基于CiteSpace的湿地枯落物分解研究现状与趋势
2025-01-12唐皓刘唯佳唐彪叶沁鑫唐小燕李堃杜磊舒向阳

枯落物分解是影响湿地生态系统物质循环和全球气候变化的关键过程之一.为了全面了解湿地枯落物分解的发展趋势和研究热点,使用Web of Science(WOS)数据库,通过文献计量学软件CiteSpace,对相关内容进行可视化分析.同时,梳理湿地枯落物分解的研究进展;归纳湿地枯落物的分解过程、影响机制和研究方法;提出相关领域的研究展望.结果显示:湿地枯落物研究分为缓慢-平稳-快速增长3个阶段,研究核心内容包括植物群落多样性、微生物驱动机制、枯落物性质、全球气候变化、碳循环等.同时,枯落物分解主要受到生物和非生物因素的影响,其中土壤微生物及相关酶活性是影响枯落物分解的初始限制性因子;研究方法以室内培养法及野外分解袋法为主.综上,现在湿地枯落物分解研究仍处于快速发展阶段,尽管从植物、土壤和微生物各因素上进行了较多探讨,但受限于以往研究手段,科学界对枯落物分解的影响机制,特别是各因素间的相互作用机制还缺乏系统了解.因此,未来研究亟需提出新的枯落物分解研究方法,重点关注植物-土壤-微生物间复杂的相互作用关系,为湿地枯落物研究乃至土壤碳循环研究提供重要理论支撑.
文献计量学; 湿地生态系统; 分解过程; 全球变化; 研究进展; 碳固定; 碳循环
P9 A 0242-11 02.009
1 前言
湿地是陆生生态系统和水生生态系统之间的过渡性地带,广泛分布于世界各地,主要包括滨海湿地、盐沼、红树林、海草床、泥炭地、高寒湿地以及河流湖泊湿地等[1].全世界现有湿地面积约1 200万km2,广泛分布在亚洲、北美洲、欧洲等沿海及河流湖泊地区,虽仅占地球陆地总面积的6%,却为全球40%的动植物提供生态栖息地,是生态服务价值最大的生态系统之一[2-5].湿地生态系统因碳储量高而备受关注,约占陆地总碳储量的20%,因其所处位置不同也被称为“蓝碳”或“青碳”生态系统[6-7].
近20多年来,已围绕湿地枯落物的养分循环、分解过程、植物群落多样性、植物根际效应、微生物驱动机制、土壤碳固定和全球气候变化等领域开展大量研究,使湿地枯落物分解成为生态学、土壤学、植物学、环境科学等学科共同关注的热点.随着研究的不断深入,湿地枯落物分解研究从最初的养分循环[8],为植物提供养分,实现生态系统内部化学元素的交换[9-11],发展到枯落物分解影响机制(包括分解过程和植物生理机制等)[12-13],到如今的关注全球变化下湿地枯落物分解与土壤碳固定的微生物驱动机制[10,12,14].因此,随着湿地枯落物分解的深入探索,逐渐形成了研究机制从宏观到微观,研究技术从基础研究到技术研究,研究范围从区域尺度到全球尺度,研究环境从单一环境行为到全球气候变化等的多维体系[15].然而,面对研究内容从广度和深度上的不断增强以及研究尺度的复杂多变,亟需从宏观视角全面了解湿地枯落物分解研究的研究现状及热点趋势.
文献计量学是通过文献数据库对发文量、发文机构、被引文献、核心关键词及突现特征等进行归纳总结,运用统计学方法,分析相关研究领域的发展过程、研究热点和未来趋势的一种重要研究方法.当前,由于科学研究的快速累积,文献计量学成为了掌握研究动态发展的重要工具之一.CiteSpace作为当前主要使用的文献计量学分析软件之一,通过知识图谱可视化功能,探寻学科领域演化的关键路径及知识转折点[16],该技术已广泛应用于各学科的研究动态分析[17-19].基于此,本文利用CiteSpace文献计量工具,对湿地枯落物分解相关文献进行计量分析和挖掘,通过可视化方法展示研究现状及热点趋势,总结湿地枯落物分解过程及影响机制,明晰最新研究成果和未来发展动态,为湿地枯落物分解及影响机制研究提供借鉴和启示.
2 研究方法
2.1 数据整理
数据采用Web of Science核心合集(WoS),设置检索时间范围为2000-01-01—2021-12-31,检索时间为2022年4月,检索表达式为TS=((litter* or residue* or debris*) and (breakdown or decomposition or decay) and (wetland or tidal wetland or tidal marsh or coastal wetland or peatland or mangrove or salt marsh or swamp or bog)),共获得检索结果1 345条,通过PRISMA protocols阅读文献题目和摘要(http://www.prisma-statement.org),筛选获得有效文献词条645条.
2.2 分析方法
通过CiteSpace(5.8.R3)进行文献计量学分析[16].将所有文献去重,以发文量、发文国家、发文机构、文献共被引及关键词等分别进行可视化分析.
3 结果与分析
3.1 发文量的时间分析
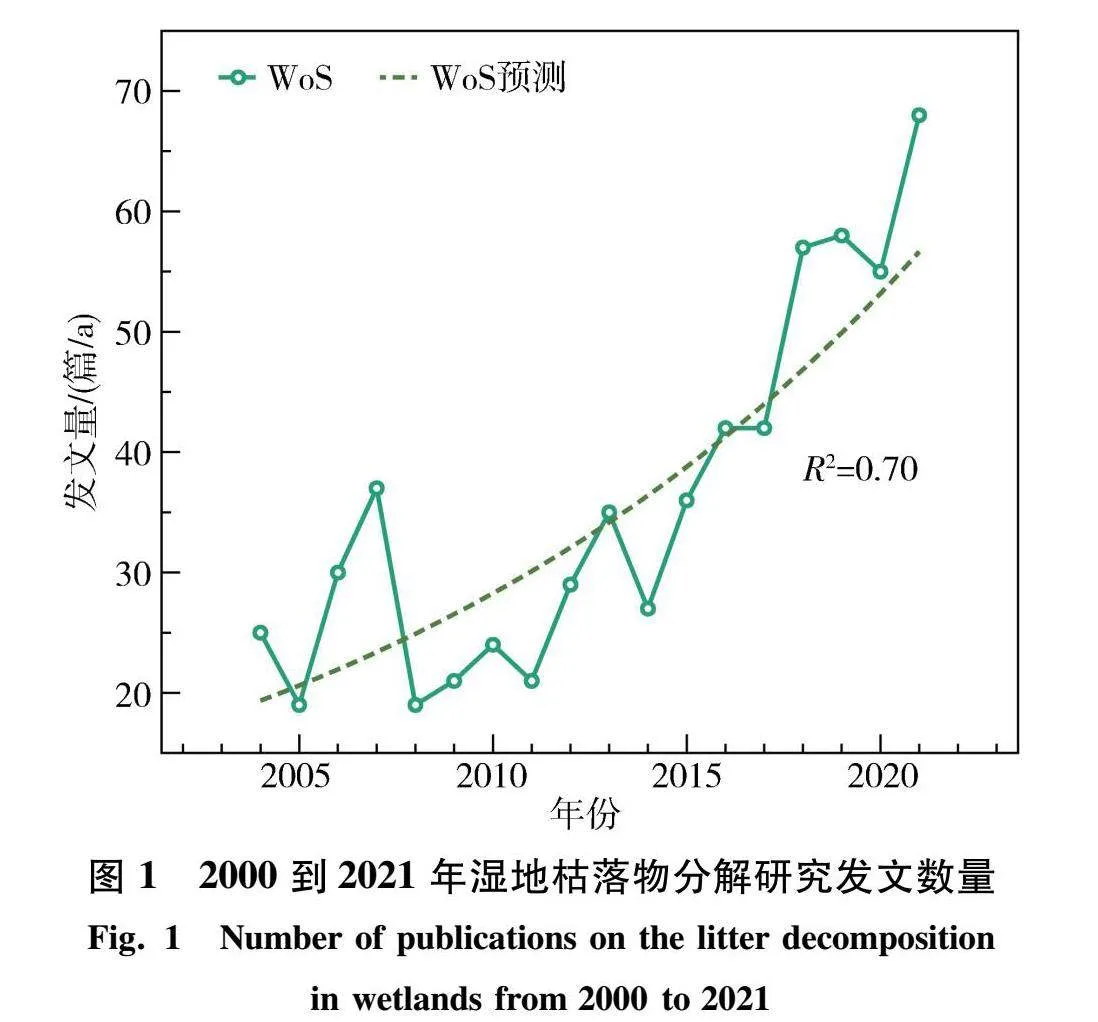
2000—2021年全球湿地枯落物分解研究呈稳定上升趋势(图1),按发文量可大致分3个阶段:1) 2004年以前为起步阶段,湿地枯落物分解研究极少,大部分研究都关注湿地木本植物叶片凋落物,仅少部分涉及湿地草本生态系统.2) 2005—2011年为平稳发展期,收录文章量逐年增加,研究区域延伸到滨海湿地、盐沼、泥炭地和河口湿地等,研究内容不仅关注湿地枯落物本身,也开始探讨枯落物分解的相关影响机制.3) 2012—2021年为快速增长期,年发文量成倍增加,其原因可能为以下2点:(a) 拉姆萨尔公约发布的《Global Wetland Outlook》明确指出湿地是一个潜在的碳汇[1],其中枯落物分解被认为是影响土壤固碳能力和有机质积累的关键过程之一[20-21].(b) 联合国政府间气候变化专门委员会(IPCC)自2014年发布的第5次和第6次评估报告指出,气候变化会对人类和生态系统造成不可逆的影响[22],全球主要经济体为积极应对全球气候变暖,均提出“碳中和”目标.自然气候解决方案(Nature Climate Solutions)[23]提供了众多自然方案来增加土壤固碳潜力,其中湿地“碳汇”备受关注[24-25],进一步推动了湿地枯落物分解研究的发展.
3.2 各国发文量分析
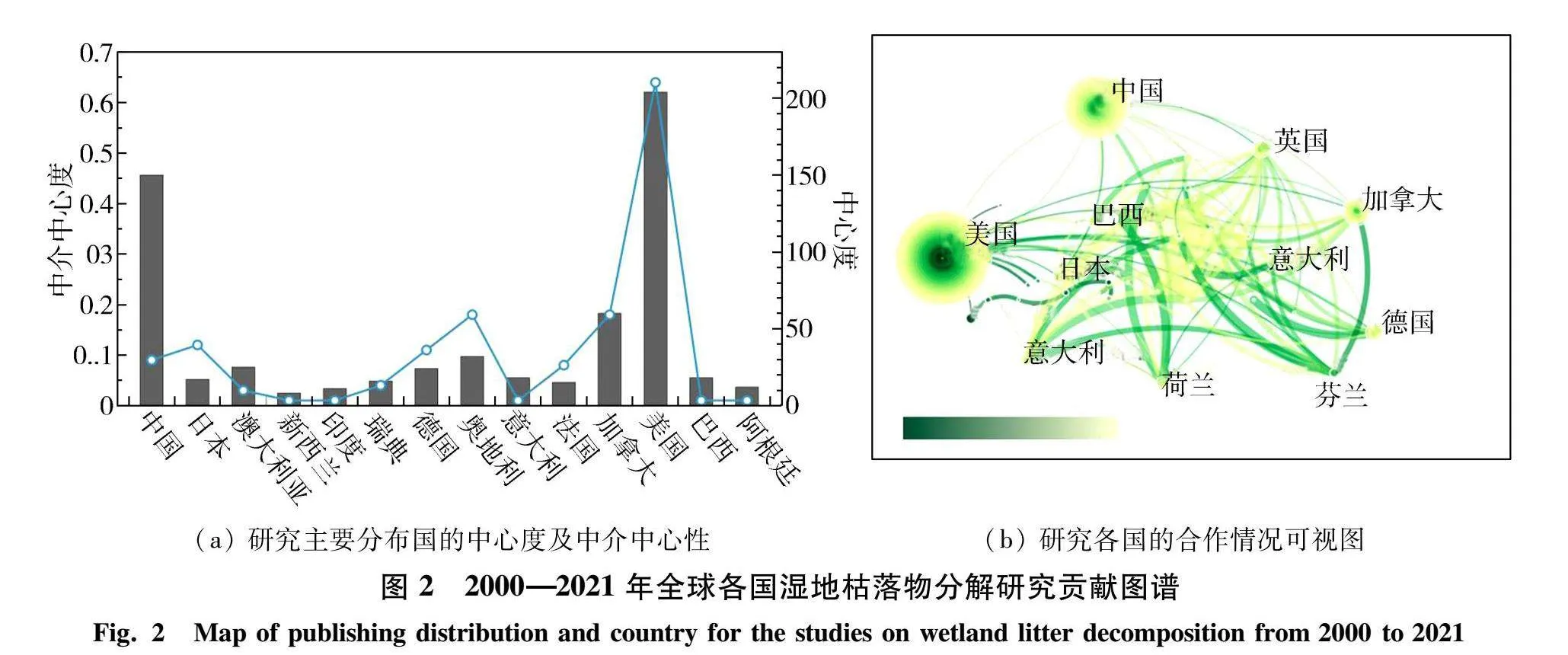
全球各国发文量能一定程度上反映该国对该领域的重视情况.当前湿地枯落物分解研究主要分布在全球发达沿海国家和地区.同时,各国发文量中介中心性分析能够发现和衡量某节点的重要程度,如数值大于0.1则为关键节点.美国、加拿大、德国、荷兰、芬兰、日本和英国的中介中心性均大于0.1(图2(a)),说明这些国家在湿地枯落物分解研究中发挥了重要作用.同时结合图2(b)可知,尽管中国发文量占比较高,但中介中心性数值仅0.09,这可能是因为中国前期基础研究成果较少,并且相较于美国而言合作国家数量较少,且合作强度相对较弱.
3.3 研究机构分析
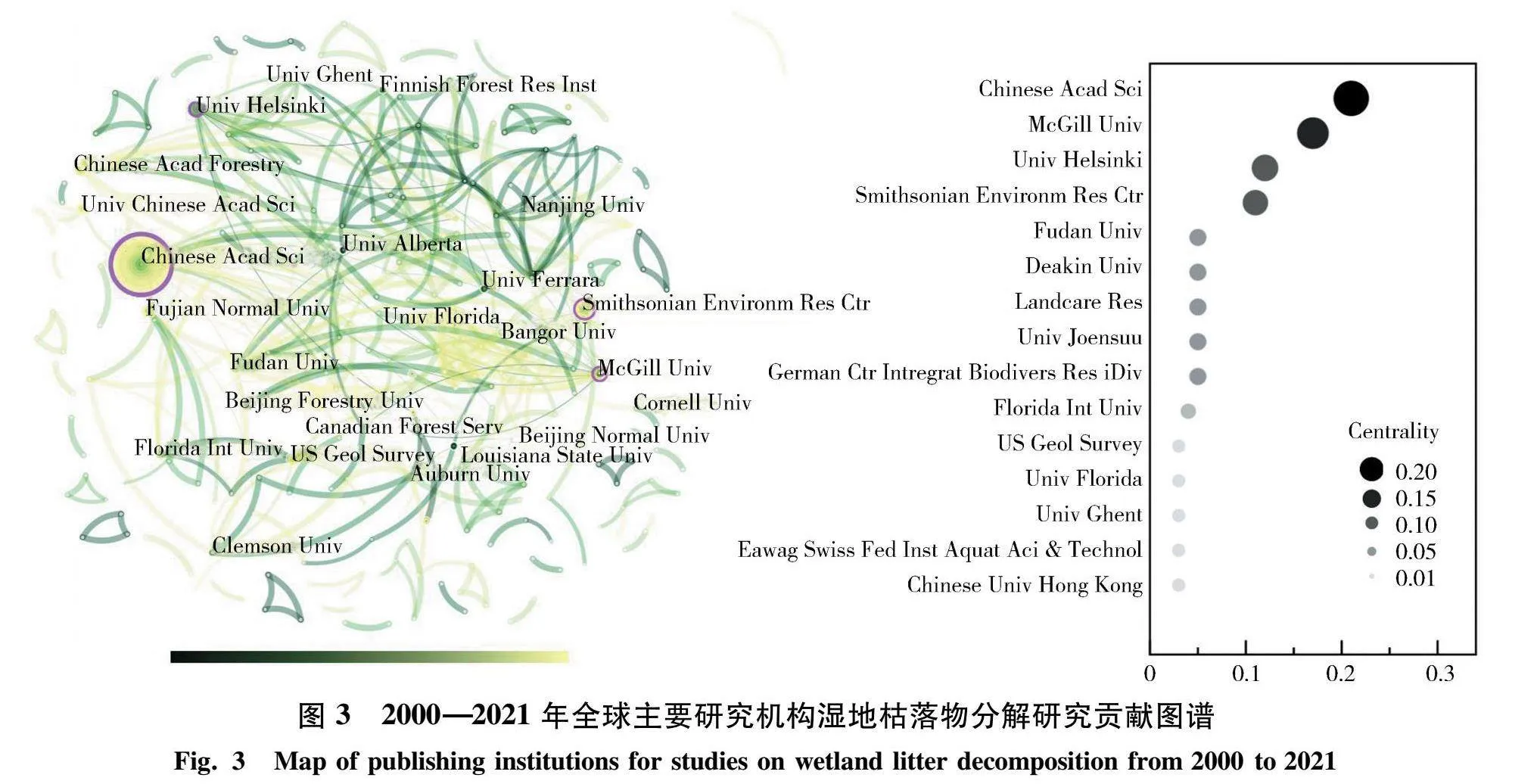
通过CiteSpace对主要发文机构进行可视化分析,可进一步了解学术界对该领域的支持和认同程度,以及哪些机构对该领域科研的贡献程度较高.由图3可知,湿地枯落物分解主要研究机构为中国科学院(Chinese Acad Sci)、加拿大麦吉尔大学(McGill Univ)、芬兰赫尔辛基大学(Univ Helsinki)、美国史密森尼环境研究中心(Smithsonian Environm Res Ctr)、中国复旦大学(Fudan Univ)和澳大利亚迪肯大学(Deakin Univ)等,并且中介中心性数值均大于0.1,这些机构为湿地枯落物分解研究贡献了关键的学术成果.
3.4 文献共被引分析
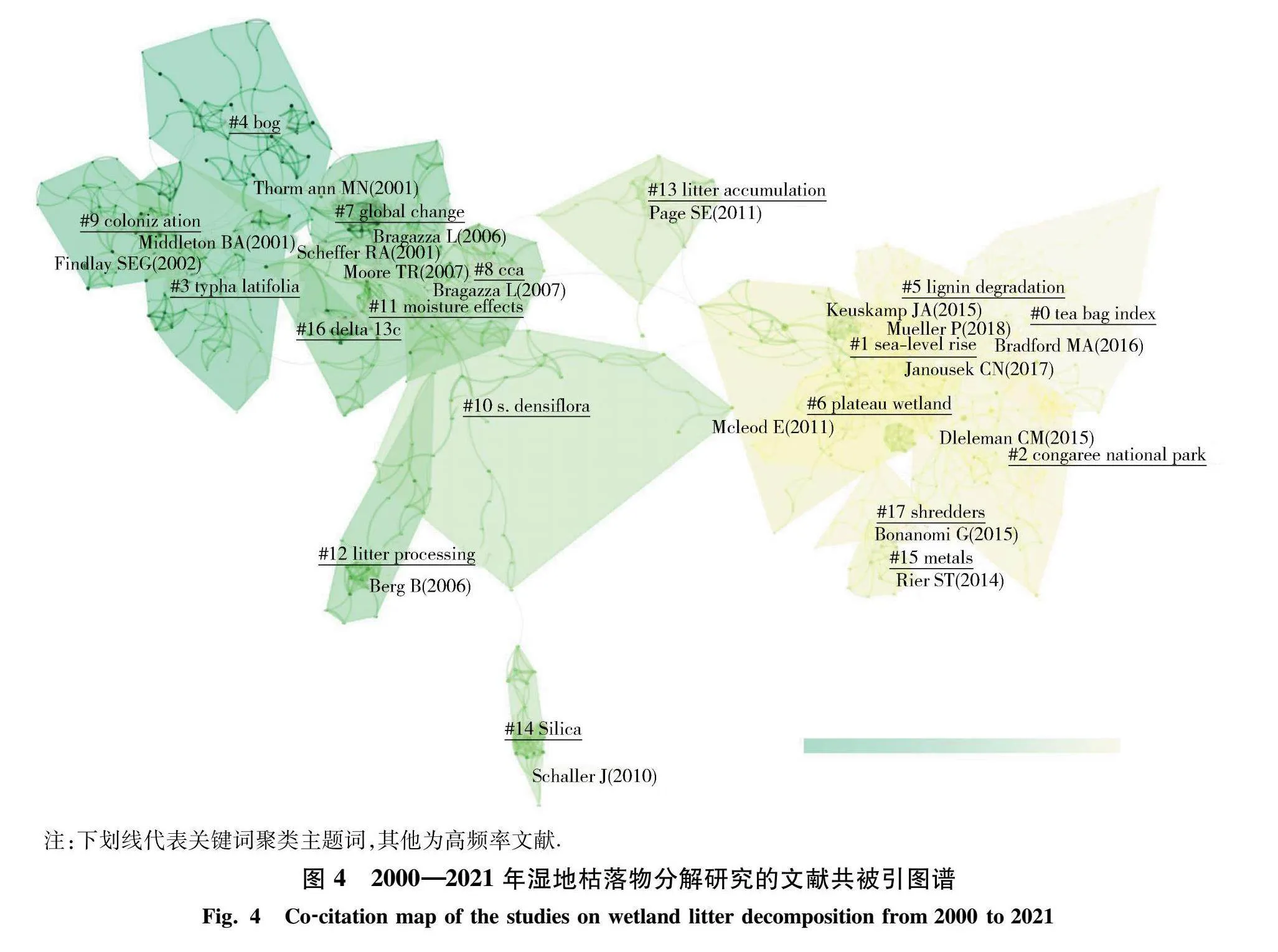
基于CiteSpace建立文献共被引关系,并通过关键词主题聚类,能够进一步详细反映各阶段关键研究和发展动态.由图4可知,通过关键词聚类共得到17个主题.基于不同时间聚类颜色大体分为3个阶段,并归纳施引文献关键词(表1).
第一阶段包括的聚类主题词有“bog”、“colonization”和“Typha latifolia”,该阶段为湿地枯落物分解的早期探索阶段,通过分析施引文献关键词(表1)可知,研究内容涉及沼泽或河口湿地的碳循环(carbon cycle)和互米花草(spartina alterniflora),这说明该阶段以湿地枯落物为代表的碳循环研究为主.首先,互米花草在北美和欧洲地区广泛用于河口、海湾等沿海滩涂地区,具有较高的生物量和耐受能力,能够保护沿海湿地[26-27].中国自20世纪70年代引入互米花草用于互堤和固滩,互米花草于2003年被中国列为外来入侵物种,这使得互米花草在中国长江河口研究备受关注[28-30],其中包括互米花草生物入侵对中国湿地碳含量的影响[31-32].
第二阶段包括的聚类主题词有“global change”“CCA”“S. densiflora”“moisture effects”“litter processing”“litter accumulation”“silica”“delta 13C”,属于湿地枯落物研究的发展阶段.该阶段开始关注全球变化对湿地枯落物分解的影响,研究内容也从枯落物分解速率深入到相关影响机制研究,诸如:1) 土壤微生物驱动机制,包括微生物呼吸作用、土壤酶活性、微生物群落结构;2) 氮沉降或季节动态变化对枯落物分解的影响;3) 不同植物群落结构对湿地枯落物分解的影响.此外,研究技术和方法也得到了极大改进和创新,其中,13C同位素标记技术和典型相关分析(canonical correlation analysis, CCA)可用于研究湿地枯落物分解的动态驱动机制.同时,针对不同气候变化研究发现,不同类型湿地生态系统枯落物的分解速率主要与土层深度和基质输入有关[15,33].
第三阶段包括的聚类主题词有“tea bag index”“sea-level rise”“congaree national park”“lignin degradation”“plateau wetland”“metals”“shredders”,为湿地枯落物分解研究的深入探索阶段.此阶段研究将湿地固碳能力与枯落物分解速率联系起来,深入探讨枯落物分解的影响机制.研究区域除滨海湿地、红树林和盐沼等典型“蓝碳”湿地生态系统外,高寒湿地因其低温和高海拔特性,逐渐成为当前研究热点[34-36].此外,Crossley等[37]在1962年提出了分解袋法,这是一种通过将植物枯落物装入尼龙网并放入土壤,从而模拟枯落物分解过程并计算枯落物分解速率,该方法极大地促进了枯落物研究的发展.然而,随着相关研究机制的不断深入,传统分解袋法受限于不同生态系统的植被类型及枯落物质量差异,导致很难系统研究枯落物分解的影响机制[12].因此,Keuskamp等[38]提出了茶包指数(Tea Bag Index),通过使用标准化物质,消除因枯落物数量和质量差异导致的机制偏差.当前,该技术已逐渐用于全球各地湿地枯落物分解的影响机制研究[39-42].
3.5 核心关键词及时序特征分析
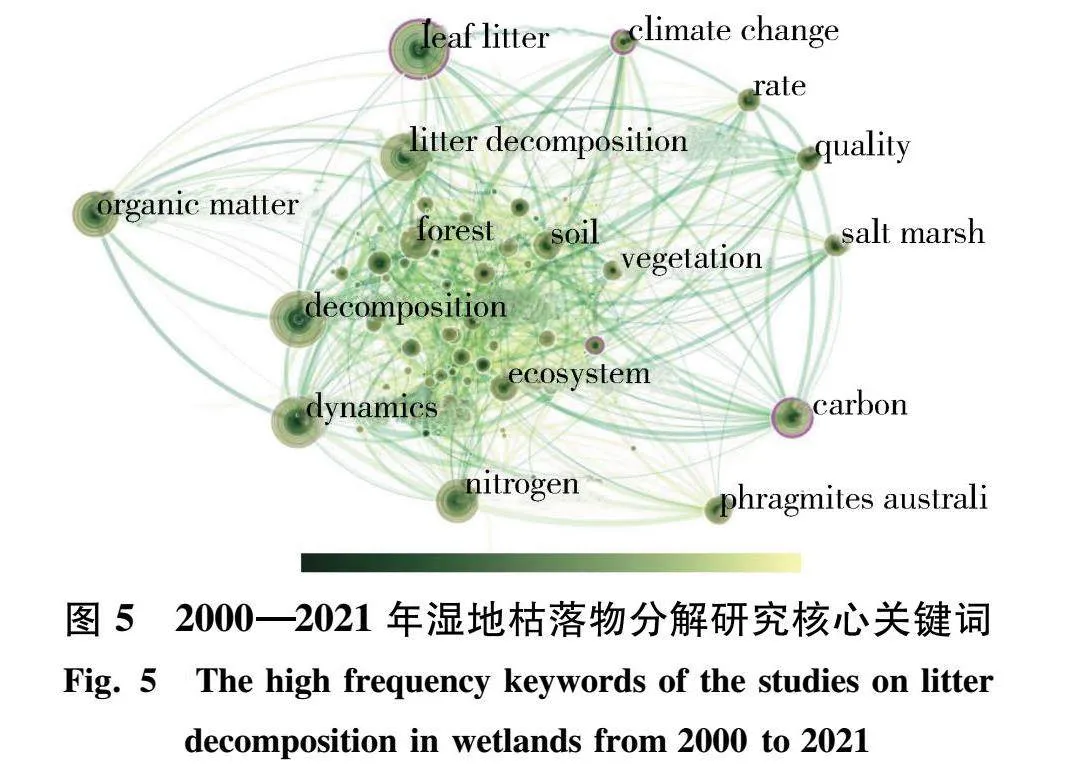
CiteSpace核心关键词能够进一步有效地分析过去、现在以及未来该领域研究的发展动态.如图5所示,剔除意思相近的关键词之后,与枯落物分解高度相关的关键词还剩下“climate change”“quality”“rate”“carbon”“nitrogen”“organic matter”“vegetation”“salt marsh”.这表明湿地枯落物分解研究大部分集中在盐沼(salt marsh)生态系统,主要关注点为枯落物分解速率、植被类型,以及与土壤碳、氮和有机质的关系.
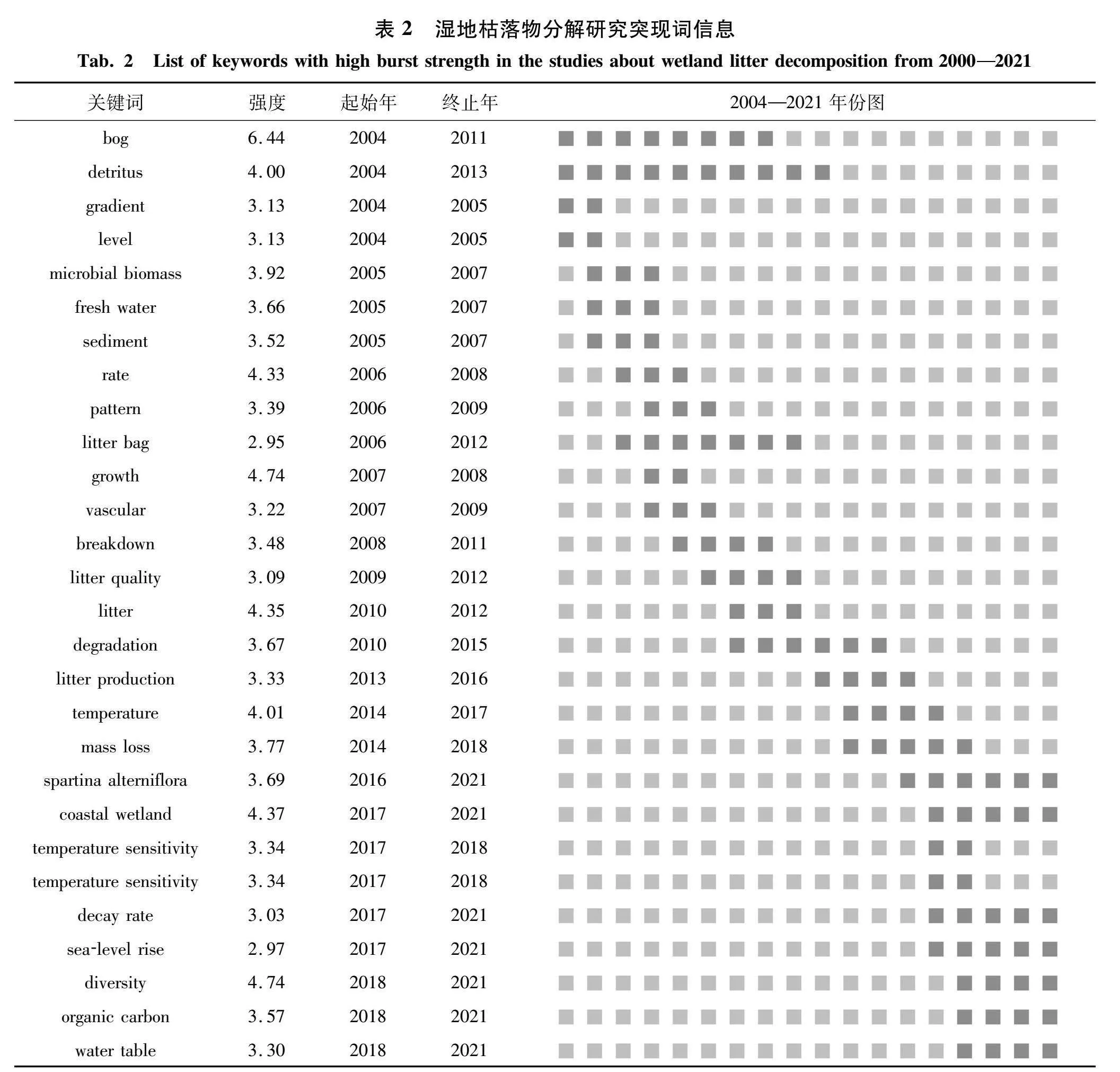
在核心关键词基础上进行突现词分析,突现强度可反映对象的连接强度,能够进一步准确把握湿地枯落物分解研究在不同时间段的前沿热点.由表2可知,前期湿地枯落物研究分布在沼泽地区,这与文献共被引主题聚类结果相符(图4和表1).在研究中期,分解袋法的运用促进了枯落物分解的发展,使更多研究开始关注枯落物自身质量和数量的影响.从2017年起,湿地枯落物分解研究则重点关注“coastal wetland”“sea-level rise”“water table”和“organic carbon”.这说明在全球气候变化下,现有研究主要关注海平面上升对湿地枯落物分解的影响,并探讨该影响下枯落物分解与土壤碳之间的关系.
4 结论
4.1 湿地枯落物分解过程
湿地枯落物分解研究已初步明晰并大致分为3个相互作用过程:1) 非生物因素(如水分和温度等)对可溶性有机化合物的淋洗,该过程主要将枯落物中的矿质离子和小的水溶性有机化合物通过淋溶作用进入土壤.2) 土壤动物的物理破碎过程,改变枯落物的组织结构.3) 微生物分解代谢.微生物群落结构、微生物活性及相关土壤酶类将枯落物中复杂有机化合物或难分解的物质降解或转化为简单有机化合物[10].通常情况下1)和2)属于物理作用过程,3)属于生物作用过程.
4.2 湿地枯落物分解影响机制
土壤胞外酶活性是影响湿地枯落物分解的重要初始限制性因子之一.土壤碳获取酶(如β-葡萄糖苷酶)、氮获取酶(如亮氨酸-氨态酶和几丁质酶等)、磷酸酶和酚氧化酶活性等与湿地枯落物分解关系密切.一方面,土壤胞外酶活性的高低与土壤养分循环有关,可用于评价土壤碳、氮和磷的生物转化方向与强度[43-45].另一方面,酚氧化酶活性与土壤氧化还原能力呈正相关关系[46].较高的酚氧化酶活性会抑制纤维素和糖类水解酶活性,间接参与枯落物分解,该现象也被称为“酶栓”理论[47].该过程与枯落物分解一样均受到众多非生物因素和生物因素的影响.
非生物因素,如温度、水分、氧化还原状况等,可直接刺激或抑制湿地枯落物分解.Kirwan等[48]通过最佳曲线关系解释土壤性质与枯落物分解的关系,在一定范围的温度或水分上升能够刺激土壤微生物活性,促进枯落物分解;反之,过高温度或水分会影响土壤氧化还原能力,抑制土壤微生物活性,降低枯落物分解.此外,在研究土壤物理保护作用中,土壤铁的络合作用或离子价态变化的作用影响大于传统土壤因素.铁形态的转化对土壤酚氧化酶活性变化起主导作用,当土壤水分发生改变时,进入土壤的氧气使大量的亚铁离子转化为三价铁离子,而高浓度的三价铁离子会使酚氧化酶活性降低,造成酚类化合物积累,抑制水解酶活性和降低枯落物分解速率.因这种机制与“酶栓”不同,也被称为“铁门(Iron gate)”机制[49-50].
生物因素,包括植物群落结构、植物功能性状和土壤微生物群落结构,均可能影响枯落物分解.首先,不同植物群落结构会导致枯落物数量和质量差异[51-52].此外,外界环境变化下植物种间变异或适应性变化也是影响枯落物分解的潜在因子[53-57].其次,植物的“激发效应”,通过影响根系泌氧和根系分泌物等,间接刺激或抑制土壤微生物活性和枯落物分解速率[58-59].然而,当前对“激发效应”的影响仍存在正或负效应的争议;正向反馈是通过植物根系生长和分泌的简单有机化合物能够提高土壤微生物活性,加速枯落物分解.负向反馈则是土壤养分含量较高,降低植物功能性状和微生物活性,从而抑制枯落物分解,这也进一步强调了植物-微生物相互作用对枯落物分解的影响[60-61].最后,研究发现土壤微生物残体对枯落物分解的影响大于微生物生理特性[62],并通过介导植物输入与土壤有机碳库的转移,来影响枯落物分解速率,但当前相关作用机制仍待进一步研究.
4.3 湿地枯落物分解研究方法
由于枯落物分解受到各种非生物因素和生物因素的影响,导致科研工作者在某一段时间内确定枯落物分解速率指标十分困难[8,12,63].因此,归纳总结湿地枯落物分解研究方法的优劣,对后续深入探讨湿地枯落物分解过程及影响机制具有重要意义.现有枯落物分解研究方法主要包括:
1) 质量平衡法.
质量平衡法是在枯落物质量保持总量动态平衡时,每年枯落物额外损失量即为枯落物分解速率(decomposition rate,k)[63].计算枯落物分解速率需要收集2个变量,即枯落物总量和碎屑枯落物质量,其中枯落物总量由研究点位随机布设的枯落物捕获网获得[64].碎屑枯落物质量则是收集地上被分解的枯落物碎屑并经烘干后获得,该方法通常应用在湿地木本植物.然而,该方法并不能用于禾本科和树龄较短的木本生态系统,并且该方法主要依赖当地原生植物凋落物,并不能反映分解速率与温度和水分的关系.
2) 分解袋法.
分解袋法被广泛用于土壤表层的枯落物分解研究,将装有植物叶片的尼龙网袋放入土壤表层,通过称重实验前后网袋内植物损失量,计算枯落物分解速率[12,37].该方法能最大程度模拟自然分解状态,但耗时较长且受到植物自身属性影响,仅能反映较小尺度的分解状况.
3) 室内分解培养法.
室内分解培养法在室内可控条件下进行,应避免自然环境下各因素间相互作用的不可控性,且可根据实验目的设计不同的枯落物分解实验,并在短期内计算出分解速率.该方法时间周期短,但研究数据均为控制性结果,不能真实反映自然环境状况[63].
4) 茶包指数.
为了消除因枯落物自身数量和质量差异导致的机制偏差,Keuskamp等[38]提出了“茶包指数”,采用2种不同分解性质的茶包(难降解红茶和易降解绿茶),通过记录单位时间内2种茶包的净损失量,构建分解曲线计算枯落物的分解速率常数(k)和稳定因子(S),进而评价枯落物的分解速率和稳定转化能力.我们也积极参与了该方法的完善和应用,并将该方法运用于欧洲滨海湿地和中国崇明岛湿地的枯落物分解研究[39,53].当前,该方法因其简便性、经济性和可重复性,已用于欧洲湿地碳循环机制研究[40,42,65-66].
5 研究展望
枯落物分解研究增强了对湿地生态系统养分和碳循环的认识,但如何进一步探讨生物和非生物因素对湿地枯落物分解的影响,还需要在研究方法和研究内容上不断更新和探索.综上,未来湿地枯落物分解还应关注以下几方面.
1) 研究方法.
当前大多湿地枯落物分解研究采用自制分解袋法,材料为研究区主要植物叶片,尽管该方法能反映湿地枯落物分解动态和部分作用机制,但大多数原生植物因“主场优势效应(home-field advantage)”[67-69],使研究结果仅限制在特定区域范围,很难系统性或跨区域比较研究湿地枯落物分解机制.因此,亟需统一枯落物分解试验研究方法,采用标准化材料,并结合本地枯落物分解袋实验比较,进行不同区域、不同气候条件、不同影响因素的比较分析试验,形成全球化枯落物分解比较研究,更有利于深入探讨枯落物内在分解机制.同时,当前研究多以野外短期试验或室内模拟培养试验为主,周期较短,时间跨度多为1~6个月,这些研究虽然反映早期植物枯落物中易分解态化合物的分解状态,但枯落物中的难分解化合物,由于分解时间较长且过程较为复杂,仍需通过长时间的动态研究来进一步探讨和完善[10,12].因此,为了阐明枯落物分解中易分解和难分解化合物的分解状态,未来应加强野外长期定位研究,同时配合室内模拟试验,探讨湿地枯落物分解的动态规律.
2) 研究机制.
当前对于植物(植物群落结构和植物功能性状)、土壤(土壤物理化学性质)和微生物(微生物群落结构和土壤酶活性)等如何影响湿地枯落物分解已取得初步进展,但随着相关机制研究的不断深入,植物-土壤(矿物)-微生物间复杂的相互作用被认为是显著影响枯落物分解的关键调控机制,例如植物-微生物共生和竞争机制[70-71]、植物根际-土壤酶活性、土壤矿物-微生物[50,72]等.因此,未来研究应重点关注各因子间相互作用对湿地枯落物分解的影响,同时加强植物-土壤-微生物过程的定量分析.
此外,多学科交叉是湿地枯落物分解研究的最基本特征之一,随着与湿地枯落物分解相关的影响因素的不断挖掘,探讨核心调控机制是当前湿地枯落物分解的关键问题之一.因此,新兴技术和分析手段,例如,新兴技术上:微生物群落结构的稳定性同位素核酸探针技术(SIP-DNA)可用于微生物作用的定量和动态研究;植物根系形态可采用CT计算机断层扫描技术,通过计算机图形学,获得可视化的根系形态特征;同位素元素示踪技术,也可用于研究枯落物-土壤-微生物的动态转化研究.此外,如偏相关分析、结构方程乃至数据模型拟合(贝叶斯建模和神经网络模型等),则需要更多地应用到湿地枯落物分解研究当中,为进一步了解和量化湿地枯落物分解的关键影响因子和生态过程的研究提供有利支撑.
3) 研究趋势.
现有研究对湿地土壤碳固定机制和稳定性有了初步认识,并且植物枯落物和微生物残体均与土壤碳稳定性关系密切.然而,近几年研究大多关注微生物残体对土壤碳稳定性的贡献,却忽视了枯落物分解对土壤碳固定的影响.同时,最新研究揭示植物枯落物与微生物残体在土壤碳稳定性的贡献上存在重叠,即植物枯落物和微生物残体在产生胞外分解产物的过程中相互影响,从而凸显了当前对枯落物定量结果研究的不足和不确定性[73].因此,未来研究应亟需加强以植物枯落物分解机制为切入点的研究,从研究方法和研究机制上,探讨湿地枯落物-微生物残体-土壤碳稳定性三者的贡献关系,从而提供植物和微生物来源的碳量化精准度,为明晰和完善湿地生态系统碳循环研究提供理论指导.
参考文献
[1] GARDNER R, FINLAYSON C. Global wetland outlook: state of the world’s wetlands and their services to people[R]. Switzerland: Secretariat of the Ramsar Convention,2018.
[2] CHMURA G L, ANISFELD S C, CAHOON D R, et al. Global carbon sequestration in tidal, saline wetland soils[J]. Global Biogeochemical Cycles,2003,17(4):1-11.
[3] DAVIDSON E A, JANSSENS I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change[J]. Nature,2006,440:165-173.
[4] MITSCH W J, BERNAL B, NAHLIK A M, et al. Wetlands, carbon, and climate change[J]. Landscape Ecology,2013,28(4):583-597.
[5] NAHLIK A M, FENNESSY M S. Carbon storage in US wetlands[J]. Nature Communications,2016,7:1-9.
[6] MACREADIE P I, ANTON A, RAVEN J A, et al. The future of blue carbon science[J]. Nature Communications,2019,10:3998.
[7] ZINKE L. The colours of carbon[J]. Nature Reviews Earth amp; Environment,2020,1(3):141.
[8] 高丽楠,张宏,陈舒慧,等. 高原2种草本植物的光合作用和叶绿素荧光参数日动态[J]. 四川师范大学学报(自然科学版),2015,38(4):550-560.
[9] 阿的鲁骥,王长庭,字洪标,等. 不同株高密花香薷光合色素含量和根际土壤酶活性的变化[J]. 四川师范大学学报(自然科学版),2016,39(5):755-759.
[10] COTRUFO M F, DEL GALDO I, PIERMATTEO D. Litter decomposition: concepts, methods and future perspectives[M]. Cambridge: Cambridge University Press,2010:76-90.
[11] 张宏,张伟,徐洪灵. 川西北高寒草甸生长季土壤氮素动态[J]. 四川师范大学学报(自然科学版),2011,34(4):583-588.
[12] PRESCOTT C E. Litter decomposition: what controls it and how can we alter it to sequester more carbon in forest soils?[J]. Biogeochemistry,2010,101(1):133-149.
[13] MUELLER P, SCHILE-BEERS L M, MOZDZER T J, et al. Global-change effects on early-stage decomposition processes in tidal wetlands-implications from a global survey using standardized litter[J]. Biogeosciences,2018,15(10):3189-3202.
[14] COTRUFO M F, SOONG J L, HORTON A J, et al. Formation of soil organic matter via biochemical and physical pathways of litter mass loss[J]. Nature Geoscience,2015,8(10):776-779.
[15] 宋飘,张乃莉,马克平,等. 全球气候变暖对凋落物分解的影响[J]. 生态学报,2014,34(6):1327-1339.
[16] CHEN C M. CiteSpace II: detecting and visualizing emerging trends and transient patterns in scientific literature[J]. Journal of the American Society for Information Science and Technology,2006,57(3):359-377.
[17] 吴胜男,王晓锋,刘婷婷,等. 基于CiteSpace的湿地恢复研究进展及热点演变分析[J]. 生态学报,2021,42(3):1224-1239.
[18] 张增可,王齐,吴雅华,等. 基于CiteSpace植物功能性状的研究进展[J]. 生态学报,2020,40(3):1101-1112.
[19] ZENG L P, LI W X, WANG X Y, et al. Bibliometric analysis of microbial sulfonamide degradation: development, hotspots and trend directions[J]. Chemosphere,2022,293:133598.
[20] KIRWAN M L, MEGONIGAL J P. Tidal wetland stability in the face of human impacts and sea-level rise[J]. Nature,2013,504(7478):53-60.
[21] WIEDER W R, BONAN G B, ALLISON S D. Global soil carbon projections are improved by modelling microbial processes[J]. Nature Climate Change,2013,3(10):909-912.
[22] TOLLEFSON J. IPCC climate report: earth is warmer than it’s been in 125 000 years[J]. Nature,2021,596(7871):171-172.
[23] LU N, TIAN H Q, FU B J, et al. Biophysical and economic constraints on China’s natural climate solutions[J]. Nature Climate Change,2022,12(9):847-853.
[24] YANG Y H, SHI Y, SUN W J, et al. Terrestrial carbon sinks in China and around the world and their contribution to carbon neutrality[J]. Science China Life Sciences,2022,65(5):861-895.
[25] 王法明,唐剑武,叶思源,等. 中国滨海湿地的蓝色碳汇功能碳中和对策[J]. 中国科学院院刊,2021,36(3):1-11.
[26] PENNINGS S C, GRANT M B, BERTNESS M D. Plant zonation in low-latitude salt marshes: disentangling the roles of flooding, salinity and competition[J]. Journal of Ecology,2005,93(1):159-167.
[27] AYRES D R, SMITH D L, ZAREMBA K, et al. Spread of exotic cordgrasses and hybrids (Spartina sp.) in the tidal marshes of San francisco bay, California, USA[J]. Biological Invasions,2004,6(2):221-231.
[28] LI B, LIAO C Z, ZHANG X D, et al. Spartina alterniflora invasions in the Yangtze River Estuary, China: an overview of current status and ecosystem effects[J]. Ecological Engineering,2009,35(4):511-520.
[29] LIAO C Z, LUO Y Q, JIANG L F, et al. Invasion of Spartina alterniflora enhanced ecosystem carbon and nitrogen stocks in the Yangtze Estuary, China[J]. Ecosystems,2007,10(8):1351-1361.
[30] WU Y, ZHANG J, LIU S M, et al. Sources and distribution of carbon within the Yangtze River system[J]. Estuarine, Coastal and Shelf Science,2007,71(1/2):13-25.
[31] LIU J E, ZHOU H X, QIN P, et al. Effects of Spartina alterniflora salt marshes on organic carbon acquisition in intertidal zones of Jiangsu Province, China[J]. Ecological Engineering,2007,30(3):240-249.
[32] CHENG X L, CHEN J Q, LUO Y Q, et al. Assessing the effects of short-term Spartina alterniflora invasion on labile and recalcitrant C and N pools by means of soil fractionation and stable C and N isotopes[J]. Geoderma,2008,145(3/4):177-184.
[33] 刘瑞鹏,毛子军,李兴欢,等. 模拟增温和不同凋落物基质质量对凋落物分解速率的影响[J]. 生态学报,2013,33(18):5661-5667.
[34] SPIVAK A C, SANDERMAN J, BOWEN J L, et al. Global-change controls on soil-carbon accumulation and loss in coastal vegetated ecosystems[J]. Nature Geoscience,2019,12(9):685-692.
[35] TREVATHAN-TACKETT S M, KEPFER-ROJAS S, ENGELEN A H, et al. Ecosystem type drives tea litter decomposition and associated prokaryotic microbiome communities in freshwater and coastal wetlands at a continental scale[J]. Science of the Total Environment,2021,782:146819.
[36] GAO J Q, FENG J, ZHANG X W, et al. Drying-rewetting cycles alter carbon and nitrogen mineralization in litter-amended alpine wetland soil[J]. Catena,2016,145:285-290.
[37] CROSSLEY D A Jr, HOGLUND M P. A litter-bag method for the study of microarthropods inhabiting leaf litter[J]. Ecology,1962,43(3):571-573.
[38] KEUSKAMP J A, DINGEMANS B J J, LEHTINEN T, et al. Tea bag index: a novel approach to collect uniform decomposition data across ecosystems[J]. Methods in Ecology and Evolution,2013,4(11):1070-1075.
[39] TANG H, NOLTE S, JENSEN K, et al. Grazing mediates soil microbial activity and litter decomposition in salt marshes[J]. Science of the Total Environment,2020,720:137559.
[40] JUDITH SARNEEL J M, CISKA VEEN G F. Legacy effects of altered flooding regimes on decomposition in a boreal floodplain[J]. Plant and Soil,2017,421(1):57-66.
[41] GRECKI K, RASTOGI A, STRECKI M, et al. Water table depth, experimental warming, and reduced precipitation impact on litter decomposition in a temperate Sphagnum-peatland[J]. Science of the Total Environment,2021,771:145452.
[42] MARLEY A R G, SMEATON C, AUSTIN W E N. An assessment of the tea bag index method as a proxy for organic matter decomposition in intertidal environments[J]. Journal of Geophysical Research: Biogeosciences,2019,124(10):2991-3004.
[43] SINSABAUGH R L, HILL B H, FOLLSTAD SHAH J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature,2009,462(7274):795-798.
[44] CARREIRO M M, SINSABAUGH R L, REPERT D A, et al. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition[J]. Ecology,2000,81(9):2359.
[45] BURNS R G, DEFOREST J L, MARXSEN J, et al. Soil enzymes in a changing environment: current knowledge and future directions[J]. Soil Biology and Biochemistry,2013,58:216-234.
[46] SINSABAUGH R L, GALLO M E, LAUBER C, et al. Extracellular enzyme activities and soil organic matter dynamics for northern hardwood forests receiving simulated nitrogen deposition[J]. Biogeochemistry,2005,75(2):201-215.
[47] FREEMAN C, OSTLE N, KANG H. An enzymic “latch” on a global carbon store: a shortage of oxygen locks up carbon in peatlands by restraining a single enzymes[J]. Nature,2001,409(6817):149.
[48] KIRWAN M L, TEMMERMAN S, SKEEHAN E E, et al. Overestimation of marsh vulnerability to sea level rise[J]. Nature Climate Change,2016,6(3):253-260.
[49] CHEN C M, HALL S J, COWARD E, et al. Iron-mediated organic matter decomposition in humid soils can counteract protection[J]. Nature Communications,2020,11:1-13.
[50] WANG Y Y, WANG H, HE J S, et al. Iron-mediated soil carbon response to water-table decline in an alpine wetland[J]. Nature Communications,2017,8:1-9.
[51] BARDGETT R D, WARDLE D A. Herbivore-mediated linkages between aboveground and below ground communities[J]. Ecology,2003,84(9):2258-2268.
[52] ORWIN K H, BUCKLAND S M, JOHNSON D, et al. Linkages of plant traits to soil properties and the functioning of temperate grassland[J]. Journal of Ecology,2010,98(5):1074-1083.
[53] TANG H, LIEBNER S, REENTS S, et al. Plant genotype controls wetland soil microbial functioning in response to sea-level rise[J]. Biogeosciences,2021,18(23):6133-6146.
[54] MADRITCH M D, DONALDSON J R, LINDROTH R L. Canopy herbivory can mediate the influence of plant genotype on soil processes through frass deposition[J]. Soil Biology and Biochemistry,2007,39(5):1192-1201.
[55] WANG X Y, MIAO Y, YU S, et al. Genotypic diversity of an invasive plant species promotes litter decomposition and associated processes[J]. Oecologia,2014,174(3):993-1005.
[56] TERHORST C P, LENNON J T, LAU J A. The relative importance of rapid evolution for plant-microbe interactions depends on ecological context[J]. Proceedings Biological Sciences,2014,281(1785):20140028.
[57] WALKER T W N, WECKWERTH W, BRAGAZZA L, et al. Plastic and genetic responses of a common sedge to warming have contrasting effects on carbon cycle processes[J]. Ecology Letters,2019,22(1):159-169.
[58] LAJTHA K, BOWDEN R D, CROW S, et al. The detrital input and removal treatment (DIRT) network: insights into soil carbon stabilization[J]. Science of the Total Environment,2018,640/641:1112-1120.
[59] LI Z, WANG F W, SU F L, et al. Climate change drivers alter root controls over litter decomposition in a semi-arid grassland[J]. Soil Biology and Biochemistry,2021,158:108278.
[60] WEN T, YU G H, HONG W D, et al. Root exudate chemistry affects soil carbon mobilization via microbial community reassembly[J]. Fundamental Research,2022,2(5):697-707.
[61] ZHAO X C, TIAN P, SUN Z L, et al. Rhizosphere effects on soil organic carbon processes in terrestrial ecosystems: a meta-analysis[J]. Geoderma,2022,412:115739.
[62] CRAIG M E, GEYER K M, BEIDLER K V, et al. Fast-decaying plant litter enhances soil carbon in temperate forests but not through microbial physiological traits[J]. Nature Communications,2022,13(1):1229.
[63] 刘增文,高文俊,潘开文,等. 枯落物分解研究方法和模型讨论[J]. 生态学报,2006,26(6):1993-2000.
[64] KARBERG N J, SCOTT N A, GIARDINA C P. Methods for estimating litter decomposition[C]//HOOVER C M. Field measurements for forest carbon monitoring. Dordrecht: Springer Netherlands,2008:103-111.
[65] ELUMEEVA T G, ONIPCHENKO V G, AKHMETZHANOVA A A, et al. Stabilization versus decomposition in alpine ecosystems of the northwestern Caucasus: the results of a tea bag burial experiment[J]. Journal of Mountain Science,2018,15(8):1633-1641.
[66] SARNEEL J M, SUNDQVIST M K, MOLAU U, et al. Decomposition rate and stabilization across six tundra vegetation types exposed to gt;20 years of warming[J]. Science of the Total Environment,2020,724:138304.
[67] SUN Y, ZHAO S Q. Leaf litter decomposition in urban forests: test of the home-field advantage hypothesis[J]. Annals of Forest Science,2016,73(4):1063-1072.
[68] AYRES E, STELTZER H, SIMMONS B L, et al. Home-field advantage accelerates leaf litter decomposition in forests[J]. Soil Biology and Biochemistry,2009,41(3):606-610.
[69] DI LONARDO D P, MANRUBIA M, DE BOER W, et al. Relationship between home-field advantage of litter decomposition and priming of soil organic matter[J]. Soil Biology and Biochemistry,2018,126:49-56.
[70] 李宜浓,周晓梅,张乃莉,等. 陆地生态系统混合凋落物分解研究进展[J]. 生态学报,2016,36(16):4977-4987.
[71] REN L J, JENSEN K, PORADA P, et al. Biota-mediated carbon cycling-a synthesis of biotic-interaction controls on blue carbon[J]. Ecology Letters,2022,25(2):521-540.
[72] LIU F T, QIN S Q, FANG K, et al. Divergent changes in particulate and mineral-associated organic carbon upon permafrost thaw[J]. Nature Communications,2022,13(1):5073.
[73] WHALEN E D, GRANDY A S, SOKOL N W, et al. Clarifying the evidence for microbial- and plant-derived soil organic matter, and the path toward a more quantitative understanding[J]. Global Change Biology,2022,28(24):7167-7185.
A Synthesis of the Litter Breakdown in Wetlands Based on CiteSpace
TANG Hao1,2, LIU Weijia3, TANG Biao4, YE Qinxin3,
TANG Xiaoyan1,2, LI Kun5, DU Lei1, SHU Xiangyang1
(1. Key Laboratory of Land Resources Evaluation and Monitoring in Southwest for Ministry of Education, Sichuan Normal University, Chengdu 610066, Sichuan;
2. Faculty of Geography Resource Sciences, Sichuan Normal University, Chengdu 610101, Sichuan;
3. Chengdu Academy of Agriculture and Forestry Sciences, Chengdu 611130, Sichuan;
4. Sichuan Provincial Farmland Quality and Fertilizer Work Station, Chengdu 610041, Sichuan;
5. Sichuan Academy of Forestry, Chengdu 610081, Sichuan)
Litter breakdown is one of the key factors that control the nutrient cycle and global climate change in wetland ecosystems. To understand the research advances and hotspots about litter breakdown in wetlands, we utilized the bibliometrics software, named as CiteSpace, to visualize the searched results and further systematically summarize the research progress (i.e. decomposition processes, mechanisms, and methods) about litter breakdown based on Web of Science. Our results showed that studies about litter breakdown had three developmental stages, slow-stable-rapid growth, and the key research included plant composition diversity, microbial mechanism, litter quality, global climate change, and the carbon cycle. More importantly, litter breakdown is affected by several biotic and abiotic factors, soil microbial community and its related soil enzyme activity is the initial limiting factor influencing litter decomposition processes. The methods to estimate the litter breakdown are usually used for laboratory incubation and litterbag technique. In conclusion, the research on litter breakdown in the wetland is still in the rapid development stage, and several factors, i.e. plant, soil, and microbes, had been discussed to affect litter breakdown. However, due to the methods through previous studies, a systematic understanding of the mechanism of litter breakdown is still not clear, especially the plant-soil-microbe interactions. Thus, future research needs to develop a standardized method to explore the interaction effects and try to provide an important theoretical basis for litter breakdown studies and carbon cycling in wetland ecosystems.
bibliometrics; wetland ecosystem; decomposition processes; global change; research advances; carbon sequestration; carbon cycle
(编辑 周 俊)
