基于NLR建立列线图模型预测肝硬化门静脉血栓形成风险
2024-12-31石绣江朱海艳梁晓萍冯娟范晓棠









摘要:目的" 分析肝硬化门静脉血栓(PVT)形成的相关危险因素,构建相关列线图模型预测肝硬化PVT形成的风险。方法" 回顾性分析2014年1月-2021年10月在我院住院诊治的1000例肝硬化患者的临床资料,将2020年12月前收治的设定为建模集(n=810),之后收治的设定为验证集(n=190)。在建模集中以是否有门静脉血栓形成分为PVT组(259例)和N-PVT组(551例);运用多因素Logistic回归分析筛出肝硬化PVT形成的独立危险因素,重点分析中性粒细胞和淋巴细胞比值(NLR)与肝硬化PVT形成的相关性,基于NLR构建用于预测肝硬化PVT形成风险的列线图模型,并对该模型进行内外部验证。结果" 建模集中PVT组的脾切除史占比、PLT、MPV、NLR、MLR、PLR、门静脉主干内径以及脾静脉直径均高于N-PVT组(P<0.05);两组年龄、性别、Child-Pugh分级、白蛋白及糖尿病病史比较,差异无统计学意义(P>0.05)。多因素Logistic回归分析显示,脾切除史、NLR、门静脉主干内径以及脾静脉直径为肝硬化患者PVT形成的独立预测因素(P<0.05),其中NLR每增加1个单位,肝硬化患者PVT形成风险增加0.527倍(OR=1.527,95%CI:1.373~1.698,P=0.000);以脾切除史、NLR、门静脉主干内径以及脾静脉直径构建预测肝硬化PVT形成的列线图模型;列线图模型校准曲线显示,建模集和验证集肝硬化患者PVT形成的预测值与实际观测值符合度良好(P>0.05),ROC曲线下面积(AUC)为0.769(95%CI:0.732~0.805),验证集联合预测的AUC为0.789(95%CI:0.712~0.866)。决策曲线分析结果显示,在大多数合理阈值概率范围内,建模集和验证集中脾切除史、NLR、门静脉主干内径以及脾静脉直径4个指标预测肝硬化PVT形成均具有良好的净收益率,并且基于NLR联合其余3项指标预测的总体净收益率高于单一指标。结论" 基于NLR构建的列线图模型可用于准确预测肝硬化PVT形成风险。
关键词:肝硬化;门静脉血栓形成;NLR;列线图
中图分类号:R575.2" " " " " " " " " " " " " " " " " " " 文献标识码:A" " " " " " " " " " " " " " DOI:10.3969/j.issn.1006-1959.2024.18.004
文章编号:1006-1959(2024)18-0019-06
Abstract:Objective" To analyze the risk factors of portal vein thrombosis (PVT) in liver cirrhosis, and to construct a relevant nomogram model to predict the risk of PVT in liver cirrhosis.Methods" The clinical data of 1000 patients with liver cirrhosis who were hospitalized in our hospital from January 2014 to October 2021 were retrospectively analyzed. The patients admitted before December 2020 were set as the modeling set (n=810), and the patients admitted after December 2020 were set as the validation set (n=190). In the modeling set, the patients were divided into PVT group (259 patients) and N-PVT group (551 patients) according to whether there was portal vein thrombosis. Multivariate logistic regression analysis was used to screen out the independent risk factors of PVT formation in liver cirrhosis, focusing on the correlation between neutrophil-to-lymphocyte ratio (NLR) and PVT formation in liver cirrhosis. Based on NLR, a nomogram model was constructed to predict the risk of PVT formation in liver cirrhosis, and the model was verified internally and externally.Results" The proportion of splenectomy history, PLT, MPV, NLR, MLR, PLR, portal vein diameter and splenic vein diameter in PVT group were higher than those in N-PVT group (Plt;0.05). There was no significant difference in age, gender, Child-Pugh classification, albumin and history of diabetes between the two groups (Pgt;0.05). Multivariate Logistic regression analysis showed that splenectomy history, NLR, main portal vein diameter and splenic vein diameter were independent predictors of PVT formation in patients with cirrhosis (Plt;0.05). For each unit increase in NLR, the risk of PVT formation in patients with cirrhosis increased by 0.527 times (OR=1.527, 95%CI:1.373-1.698, P=0.000). A nomogram model for predicting PVT formation in liver cirrhosis was constructed based on the history of splenectomy, NLR, portal vein diameter and splenic vein diameter. The calibration curve of the nomogram model showed that the predicted values of PVT formation in patients with cirrhosis in the modeling set and the validation set were in good agreement with the actual observed values (Pgt;0.05). The area under the ROC curve (AUC) was 0.769 (95%CI: 0.732-0.805), and the AUC of the combined prediction of the validation set was 0.789 (95%CI: 0.712-0.866). The results of decision curve analysis showed that within most reasonable threshold probability ranges, the four indicators of splenectomy history, NLR, main portal vein diameter and splenic vein diameter in the modeling set and validation set had good net rate of return for predicting PVT formation in cirrhosis, and the overall net rate of return based on NLR combined with the other three indicators was higher than that based on a single indicator.Conclusion" The nomogram model based on NLR can be used to accurately predict the risk of PVT in liver cirrhosis.
Key words:Liver cirrhosis;Portal vein thrombosis;NLR;Nomograph
门静脉血栓(portal vein thrombosis, PVT)[1]是指门静脉主干和(或)门静脉左、右分支发生血栓,伴或不伴脾静脉、肠系膜上静脉以及肠系膜下静脉血栓形成。随着影像学检查,如血管彩色多普勒超声、门静脉CT及MRI、血管造影等的发展,PVT的检出率呈上升趋势。有研究表明[2],在肝硬化人群中使用多普勒超声检查时PVT的患病率达17%。作为肝硬化患者疾病进展的常见并发症之一,PVT可加剧肝功能恶化、加重门静脉高压,进而导致消化道大出血、顽固性腹水、肝性脑病、肠系膜缺血性坏死以及肝肾综合征等严重并发症的出现,甚至死亡[3]。但肝硬化PVT形成早期常无明显特异性临床症状,多是在评估病情进展情况或肝恶性肿瘤筛查时被发现,故血栓形成的时间难以明确。因此尽早筛查出肝硬化PVT形成的高危人群,做到早预防、早诊断、早评估及干预治疗(抗凝、溶栓、介入和外科手术等)对于改善 PVT 转归至关重要。多项研究结果显示[4-7],对于肝硬化PVT患者越早进行抗凝治疗,门静脉系被栓塞血管再通率就越高,PVT加重病情进展的风险随之也大大降低。目前国内外关于肝硬化PVT危险因素的研究较多,尚未找到有效的血液预测指标可在影像检查发生变化前识别PVT形成高危患者。而有研究表明NLR与血栓形成关系密切,为此,本研究基于NLR建立列线图模型,拟预测肝硬化PVT形成的风险,以期为临床医生提供参考。
1资料与方法
1.1一般资料nbsp; 回顾性分析2014年1月-2021年10月在新疆医科大学第一附属医院住院诊治的1000例肝硬化患者的临床资料。将2020年12月前收治的患者设定为建模集(n=810),之后收治的患者设定为验证集(n=190)。在建模集中以是否有门静脉血栓形成分为PVT组259例和N-PVT组551例,建模集中男482例,女328例,年龄11~86岁,平均年龄(54.42±12.54)岁,脾切除史109例,糖尿病160例,肝功Child-Pugh A级321例,B级343例,C级160例。在验证集中以是否有门静脉血栓形成分为PVT组40例和N-PVT组150例,验证集中男96例,女94例,年龄32~87岁,平均年龄(56.15±11.39)岁,其中脾切除史12例,糖尿病57例,肝功Child-Pugh A级43例,B级31例,C级16例。本研究经过我院医院伦理委员会的批准,符合医学伦理学规定,所有患者均知情同意。
1.2纳入及排除标准" 纳入标准(同时符合以下2条):①肝硬化诊断:基于实验室检查、肝脏影像学及临床症状门静脉高压的症状(如脾大、腹水、食管静脉曲张等表现)或肝脏病理活检,符合《肝硬化诊治指南2019年版[8]》的标准。②首次确诊PVT形成[1]:影像学(腹部彩超、CT、MRI)证实门静脉主干和(或)门静脉左、右分支发生血栓,伴或不伴肠系膜静脉和脾静脉血栓形成。排除标准:①诊断明确的布加综合征;②合并肝癌及其他恶性肿瘤;③伴有血液系统疾病;④其他非慢性肝脏疾病导致的PVT;⑤肝移植术后;⑥治疗过程中使用过抗凝药物;⑦孕妇和哺乳期妇女。
1.3方法" 回顾性收集患者入院时的病历资料,包括性别、年龄、身高、体质量、现病史、既往史(高血压、糖尿病等疾病史、脾脏切除等手术史)、个人史(吸烟、饮酒史)、实验室检查结果及影像学相关资料。实验室检验指标为患者入院后24 h内采集的静脉血标本。血常规[白细胞计数(WBC)、中性粒细胞计数(NEUT)、淋巴细胞绝对值(LY)、单核细胞计数(MONO)、血小板计数(PLT)等]通过全自动分析仪检测;肝功(ALT、AST、白蛋白、总胆红素等)使用西门子公司的ADVIA全自动生化分析仪采用酶学方法检测。NLR=NEUT/LY。影像学资料:腹部超声结果(门静脉主干内径、脾静脉直径、脾脏体积、门静脉系血栓形成情况),腹部CT或MRI结果(肝硬化及门静脉系血栓形成情况)。
1.4统计学方法" 采用SPSS软件(Version 25.0,USA)和4.2.1R软件对数据进行分析,符合正态分布的计量资料以(x±s)表示,两组间比较采用独立样本t检验,计数资料以[n(%)]表示,两组间比较采用χ2检验。将单因素分析中有统计学意义的变量纳入多因素Logistic回归分析,采用最大似然比前进法筛选出最终变量,获得影响肝硬化PVT形成的独立危险因素,基于独立危险因素构建相关列线图模型,绘制列线图模型的校准曲线进行内外部验证,从而进一步绘制联合预测模型预测肝硬化PVT形成的ROC曲线和决策曲线,并分析联合预测模型的预测效能和净收益率,以α=0.05为检验水准,P<0.05表示差异有统计学意义。
2结果
2.1建模集两组临床资料比较" 建模集的PVT组中脾切除史占比、PLT、MPV、NLR、MLR、PLR、门静脉主干内径以及脾静脉直径均高于N-PVT组(P<0.05);两组年龄、性别、Child-Pugh分级、白蛋白及糖尿病病史比较,差异无统计学意义(P>0.05),见表1。
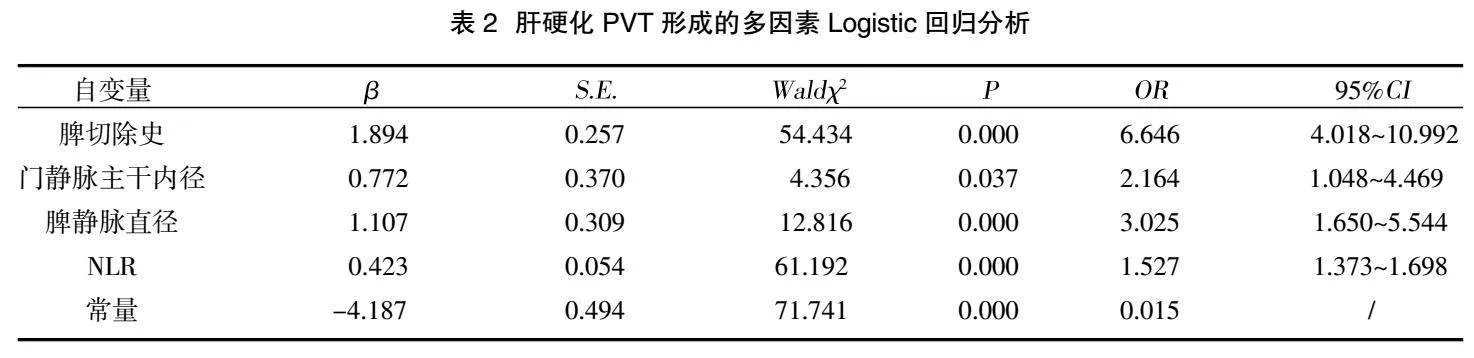
2.2肝硬化PVT形成的多因素Logistic回归分析" 以肝硬化患者是否PVT形成(否=0,是=1)作为因变量,以单因素分析中有统计学意义的指标:脾切除史(是=1,否=0)、PLT(实际值)、MPV(实际值)、NLR(实际值)、MLR(实际值)、PLR(实际值)、门静脉主干内径(实际值)以及脾静脉直径(实际值)为自变量代入多因素Logistic回归模型进行分析,结果显示:脾切除史、NLR、门静脉主干内径以及脾静脉直径为肝硬化患者PVT形成的独立预测因素(P<0.05),其中NLR每增加1个单位,肝硬化患者PVT形成风险增加0.527倍(OR:1.527,95%CI:1.373~1.698,P=0.000),见表2。
2.3列线图模型的构建" 基于多因素Logistic回归分析结果获得的4个独立预测因素:脾切除史、NLR、门静脉主干内径以及脾静脉直径构建预测肝硬化PVT形成的列线图模型,如肝硬化患者有以下特征:有脾切除史,NLR为5.06,门静脉主干内径为1.10 cm,脾静脉直径为0.80 cm,其4个特征性变量的得分分别为5.2分、9.1分、4.1分以及3.4分,该患者的列线图总评分为21.8分,该患者PVT形成风险的预测值为42.3%,见图1。
2.4列线图模型预测价值的内外部验证" 列线图模型的校准曲线显示,建模集和验证集肝硬化患者PVT形成的预测值与实际观测值符合度良好(P>0.05);ROC分析结果显示,建模集和验证集脾切除史、NLR、门静脉主干内径以及脾静脉直径4个指标预测肝硬化PVT形成均具有良好的预测效能,并且基于NLR联合其余3项指标预测的价值最高,建模集联合预测的曲线下面积(AUC)为0.769(95%CI:0.732~0.805),验证集联合预测的AUC为0.789(95%CI:0.712~0.866),见表3。决策曲线分析结果显示,在大多数合理阈值概率范围内,建模集和验证集中脾切除史、NLR、门静脉主干内径以及脾静脉直径4个指标预测肝硬化PVT形成均具有良好的净收益率,并且基于NLR联合其余3项指标预测的总体净收益率高于单一指标,见图2~图7。
3讨论
目前肝硬化PVT形成相关危险因素的研究中报道较多的是:脾静脉直径、门静脉直径、门静脉流速、脾切除史、脾静脉流速、非选择性β受体阻滞剂应用、血管内皮细胞损伤、糖尿病、遗传性及获得性易栓症等,尚缺乏有效的血液学预测指标。本研究通过单因素及多因素Logistic回归分析筛选出的独立危险因素为:脾切除史、NLR、门静脉主干内径以及脾静脉直径,基于NLR这个有效的血清学预测指标联合其余三项指标建立的列线图模型预测价值最高,且总体净收益率更高。
目前肝硬化PVT的筛查与诊断主要依据典型的影像学表现,由于选择的影像学检查方法不同或操作者的差异,少部分PVT患者可能存在不能及时确诊的问题。若能增加有效的血液学监测指标,将有助于肝硬化PVT形成患者的早期诊治。有研究表明慢性肝病疾病进展时常伴有门静脉系统炎症的激活[9]及血液高凝状态[10],机体出现炎症反应时血液中性粒细胞数会明显增加,表现为NLR增高[11]。在血栓形成前中性粒细胞是最早被聚集到内皮功能受损部位的细胞因素,且有研究已证实NLR的升高是心肌梗死和相关死亡的独立预测因素,在脑血栓患者血液中也发现有大量中性粒细胞,可见NLR与血栓性疾病的发生发展关系密切[12,13]。既往的研究也发现中性粒细胞中炎症小体的活化在血栓形成中扮演重要的角色,炎症小体复合物的活化能加速静脉血栓的形成[14],所以NLR是血栓性疾病的危险因素[15]。外周血中中性粒细胞数目的增加与炎症反应的发生发展以及严重程度关系密切,淋巴细胞属于免疫调控屏障,其数目的减少与机体的应激反应密切相关[16],上述二者的比值——NLR目前被认为是一种新型组合型炎性标志物,整合了两种白细胞亚型的信息,避免了单独白细胞亚型在感染、脱水等情况下绝对值受影响的弊端,相对不受外界因素的干扰,较其他独立的炎性指标具有更高的临床意义。同时NLR交叉了细胞免疫与体液免疫两种途径,能更好地反映机体的应激程度。本研究分析筛选出NLR为肝硬化PVT形成的独立危险因素,NLR作为血液学检测指标预测肝硬化PVT形成风险有较高的灵敏度,同时基于此指标联合其他三项预测因素建立列线图模型能更有效预测肝硬化PVT形成风险。Xing Y等[17]的研究也指出中性粒细胞与淋巴细胞比、单核细胞与淋巴细胞比是门静脉血栓形成的独立危险因素。可见,NLR可用于辅助临床筛查肝硬化PVT形成,是诊断肝硬化门静脉血栓形成的有效血液学指标。
脾切除术是临床上处理脾功能亢进、食管胃底静脉曲张破裂出血等门静脉高压所致严重并发症的常见术式之一,因其止血效果理想,术后再出血率低,临床应用相对广泛[18]。当然该术式也是肝硬化PVT形成的最常见局部血管损伤因素,故共识也指出对于胃食管静脉曲张伴脾功能亢进患者,如需行脾切除术,需充分评估病情及手术风险,术后需积极采取相应措施预防PVT发生。术后导致门静脉血流量减少流速变慢、血小板急剧增多、血液黏度增加、血管内皮细胞损伤等均是引起PVT形成的风险。本研究中PVT组与N-PVT组的门静脉主干内径、脾静脉直径存在差异。门静脉主干内径间接反映门静脉压力,随着门静脉压力增大门静脉主干内径随之增宽,血管内皮发生损伤,同时肝硬化导致自身肠道屏障功能减弱,造成肠道菌群移位,共同促进了PVT的形成。术前脾静脉直径可作为脾切除术后PVT形成的独立预测因素。术前脾静脉直径对部分脾动脉栓塞术后PVT形成的影响较大。临床需动态监测肝硬化患者影像学变化以评判其PVT的发生发展情况,本研究基于NLR联合脾切除史、门静脉主干内径、脾静脉直径构建列线图模型,并且内外部验证结果均证实,本研究构建的列线图模型用于个体化预测肝硬化患者PVT形成具有较高的准确度和价值,有助于临床医师早期识别肝硬化PVT形成高危患者以及制定个体化诊疗策略预防肝硬化患者PVT形成, 具有重要临床意义。
综上所述,本研究基于NLR构建的列线图模型可用于准确预测肝硬化PVT形成风险,该模型在建模集及验证集中都具备良好的预测效能、校准度以及净收益率,预测价值很高。但本研究采用的是回顾性分析法,为单中心研究,存在一定的局限性。有待更多大样本的前瞻性研究明确肝硬化PVT形成的危险因素。
参考文献:
[1]祁兴顺,杨玲.肝硬化门静脉血栓管理专家共识(2020年,上海)[J].临床肝胆病杂志,2020,36(12):2667-2674.
[2]Violi F,Corazza GR,Caldwell SH,et al.Portal vein thrombosis relevance on liver cirrhosis: Italian Venous Thrombotic Events Registry[J].Intern Emerg Med,2016,11(8):1059-1066.
[3]朱海艳,范晓棠.肝硬化并发门静脉血栓形成患者列线图预测模型分析及外部验证[J].实用肝脏病杂志,2022,25(6):848-852.
[4]李卿,王丽林.低分子肝素钠抗凝在肝硬化合并门静脉血栓中的应用效果[J].中国医药导报,2018,15(4):69-72.
[5]Hanafy AS,Abd-Elsalam S,Dawoud MM.Randomized controlled trial of rivaroxaban versus warfarin in the management of acute non-neoplastic portal vein thrombosis[J].Vascul Pharmacol,2019,113:86-91.
[6]Senzolo M,Garcia-Tsao G,García-Pagán JC.Current knowledge and management of portal vein thrombosis in cirrhosis[J].J Hepatol,2021,75(2):442-453.
[7]Kockerling D,Nathwani R,Forlano R,et al.Current and future pharmacol ogical therapies for managing cirrhosis and its complications[J].World J Gastroenterol,2019,25(8):888-908.
[8]徐小元,丁惠国,李文刚,等.肝硬化诊治指南[J].实用肝脏病杂志,2019,22(6):770-786.
[9]Kao JT,Yu CJ,Feng CL,et al.IL-6 significantly correlates with p-STAT3 expression and presents high variceal bleeding with mortality in cirrhotic patients:A cross-sectional study[J].J Microbiol Immunol Infect,2017,50(3):286-296.
[10]Praktiknjo M,Trebicka J,Carnevale R,et al.Von Willebrand and Factor VIII Portosystemic Circulation Gradient in Cirrhosis: Implications for Portal Vein Thrombosis[J].Clin Transl Gastroenterol,2020,11(2):e00123.
[11]Zhang JZ,Gu J.Research Progress on Inflammasome and Cancer-associated Thrombosis-Review[J].Journal of Experimental Hematology,2016,24(4):1260-1263.
[12]Kapoor S,Opneja A,Nayak L.The role of neutrophils in thrombosis[J].Thromb Res,2018,170:87-96.
[13]Manfredi AA,Ramirez GA,Rovere-Querini P,et al.The Neutrophil's Choice: Phagocytose vs Make Neutrophil Extracellular Traps[J].Front Immunol,2018,9:288.
[14]Heestermans M,Salloum-Asfar S,Salvatori D,et al.Role of platelets, neutrophils, and factor XII in spontaneous venous thrombosis in mice[J].Blood,2016,127(21):2630-2637.
[15]张爱边,张岘,刘畅,等.NLR、PLR、MPV和RDW检测在慢性骨髓增殖性肿瘤血栓形成中的临床意义[J].武汉大学学报(医学版),2023,44(10):1224-1228.
[16]Sierawska O,Makowska P,Taskin C,et al.Innate Immune System Response to Burn Damage-Focus on Cytokine Alteration[J].Int J Mol Sci,2022,23(2):716.
[17]Xing Y,Tian Z,Jiang Y,et al.A practical nomogram based on systemic inflammatory markers for predicting portal vein thrombosis in patients with liver cirrhosis[J].Ann Med,2022,54(1):302-309.
[18]Li MX,Zhang XF,Liu ZW,et al.Risk factors and clinical characteristics of portal vein thrombosis after splenectomy in patients with liver cirrhosis[J].Hepatobiliary Pancreat Dis Int,2013,12(5):512-519.
收稿日期:2023-09-26;修回日期:2023-11-05
编辑/成森
基金项目:新疆维吾尔自治区自然科学基金面上项目(编号:2022D01C234)
作者简介:石绣江(1983.10-),女,江苏邳州人,硕士,主治医师,主要从事肝硬化、脂肪肝、肝癌的诊治以及常见胃肠道疾病的诊治研究
通讯作者:范晓棠(1977.3-),女,北京人,博士,主任医师,副教授,主要从事肝硬化、肝癌、肝衰竭等终末期肝病的诊治,脂肪肝、自身免疫性肝病、酒精性肝病等非传染性肝病等的诊治研究
