红茶菌发酵香蕉醋的工艺及抗氧化活性研究
2024-12-31杨玉霞郭峰君



摘 要:采用红茶菌作为发酵混合菌种,广西北海涠洲岛香蕉作为原料,研制一款特色香蕉果醋饮品,并对香蕉果醋抗氧化活性进行研究。结果表明,红茶菌发酵香蕉醋的最佳工艺为红茶菌接种量15%、发酵温度35 ℃、初始糖度20%。此条件下发酵得到的香蕉醋总酸含量为6.06 g/100 mL,且其对DPPH自由基、羟基自由基的清除能力较强,具有较好的抗氧化活性。
关键词:红茶菌;香蕉;果醋;抗氧化活性
Study on the Process and Antioxidant Activity of Banana Vinegar Fermented by Kombucha
YANG Yuxia, GUO Fengjun
(Beihai Vocational College, Beihai 536000, China)
Abstract: Using kombucha as a fermentation mixed strain, banana from Weizhou island in Beihai, Guangxi province was used as raw material to develop a characteristic banana fruit vinegar drink, and the antioxidant activity of banana fruit vinegar was studied. The results showed that the optimal process for fermentation of banana vinegar by kombucha was 15% inoculation amount, fermentation temperature 35 ℃, and initial sugar content 20%. Under these conditions, the total acid content of banana vinegar obtained by fermentation was 6.06 g/100 mL, and its scavenging ability to DPPH free radicals and hydroxyl free radicals was strong, and it had good antioxidant activity.
Keywords: kombucha; banana; fruit vinegar; antioxidant activity
红茶菌又称海宝、胃宝,是酵母菌、醋酸菌和乳酸菌的共生物,含有酚类物质、氨基酸、多糖以及维生素等成分,具有平衡人体酸碱度、促进消化吸收,以及护胃养胃、增强人体免疫力、提高抗氧化能力等功效[1-2]。近年来,众多研究人员选用红茶菌作为醋饮的发酵菌种,使得酒精发酵和醋酸发酵同时进行,可实现一步法发酵制醋,不仅简化了发酵工艺流程,还能得到较理想的醋酸饮品。郑显义[3]用红茶菌发酵液作为发酵基质,加入水果果浆发酵制备红茶菌水果醋饮,并分析其生物活性和抗氧化性;徐清萍等[4]用粮食谷物作为发酵原料,添加红茶菌酿造粮食醋,并测定其理化指标;陈鑫等[5]利用红茶菌发酵无甜苷罗汉果醋,并优化了红茶菌菌液接种量、无甜苷罗汉果汁稀释比例、发酵液初始pH值、发酵液初始糖度、发酵温度以及摇床转速等发酵条件;孙永康等[6]用红茶菌和酿酒酵母发酵茶糖水,制备出了新型发酵型茶酒。
香蕉,芭蕉科芭蕉属植物,是热带、亚热带水果,营养组分丰富、芳香味美,富含碳水化合物、蛋白质、脂肪,以及钾、钙、镁和磷等矿物质元素,还含有酚类和黄酮等活性物质,具有抗氧化、防衰老、降脂、稳定血压、清肺利尿等作用[7-8]。广西北海涠洲岛香蕉是地理标志产品,以鲜食为主,货架期短、不耐储存,香蕉上市期相对集中,加工率低,容易造成腐坏浪费,因此提升香蕉的深加工能力迫在眉睫。目前,发酵型饮品越来越受年轻人的青睐,选用益生菌作为发酵菌种,水果作为原料加工制备的饮品,具有清凉爽口的特殊口感,较好地保留了营养物质,能够满足消费者的需求,同时也符合市场发展趋势[9-10]。
本文采用红茶菌作为发酵混合菌种制备香蕉醋饮,旨在简化加工流程,提高经济效益。通过对涠洲岛香蕉加工技术及其多元化产品开发的研究,有利于进一步提高涠洲岛香蕉的附加值,对北海经济发展具有很好的现实意义。
1 材料与方法
1.1 材料与试剂
香蕉:采摘自广西壮族自治区北海市涠洲岛;白砂糖、红茶:市售;苹果醋:市售;红茶菌菌种:实验室保存。
氢氧化钠、酚酞,西陇化工股份有限公司;邻苯二甲酸氢钾,天津市科密欧化学试剂有限公司;硫酸亚铁,成都市科龙化工试剂厂;水杨酸,西陇科学股份有限公司;过氧化氢,晶科化工化学;1,1-二苯基-2-三硝基苯肼,Sigma;铁氰化钾,汕头市光华化学厂;三氯化铁,成都市科龙化工试剂厂;三氯乙酸,天津市大茂化学试剂厂;磷酸氢二钠,天津科密欧;磷酸二氢钠,天津科密欧;无水乙醇,广东光华科技股份有限公司。
1.2 仪器与设备
打浆机:九阳;分析天平:赛多利斯;恒温培养箱:上海博迅医疗生物仪器股份有限公司;糖度计:成都泰华光学公司;紫外可见分光光度计:翱艺仪器(上海)有限公司;电热恒温水浴锅:上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 工艺流程
红茶菌发酵香蕉醋的工艺流程见图1。
1.3.2 操作要点
(1)红茶菌活化。按照红茶∶白糖∶水=1∶1∶10(质量比)的比例加热煮沸后过滤得到红茶汤,将其冷却至35 ℃以下,随后接入红茶菌种子,8层纱布封口,静置于30 ℃环境下发酵7 d,得到红茶菌菌液。
(2)香蕉浆制备。准确称取一定量香蕉,切块,按照料液比1∶3的比例加水打浆,60~70 ℃热烫杀菌,冷却,即得香蕉浆。
(3)成分调整。测量香蕉浆中的可溶性固形物含量,判断糖度的大小。为满足香蕉醋发酵所需,在发酵前用白砂糖一次性补充糖分。
(4)发酵。在香蕉浆中接入活化后的红茶菌,用8层纱布封口放入特定恒温培养箱中发酵产酸。
(5)过滤、杀菌。用8层纱布过滤后初步分离得到红茶菌香蕉醋,静置澄清后于121 ℃条件下高压灭菌15 min,冷却,即得红茶菌香蕉醋饮成品。
1.3.3 单因素实验
(1)红茶菌接种量的确定。将香蕉浆调整至初始糖度为18%,分别接入5%、10%、15%、20%和25%红茶菌,置于30 ℃恒温箱中发酵,每隔24 h测定发酵液的总酸含量,探讨不同红茶菌接种量对果醋发酵的影响。
(2)发酵温度的确定。将香蕉浆调整至初始糖度为18%,接入15%红茶菌,将调配好的原始发酵液分别放置在20 ℃、25 ℃、30 ℃和35 ℃的恒温箱中进行发酵,每隔24 h测定发酵液的总酸含量,探讨不同发酵温度对果醋发酵的影响。
(3)发酵液初始糖度的确定。将香蕉浆调整初始糖度分别调整为12%、14%、16%、18%和20%,接入15%红茶菌,置于30 ℃恒温箱中发酵,每隔24 h测定发酵液的总酸含量,探讨不同初始糖度对果醋发酵的影响。
1.3.4 正交实验
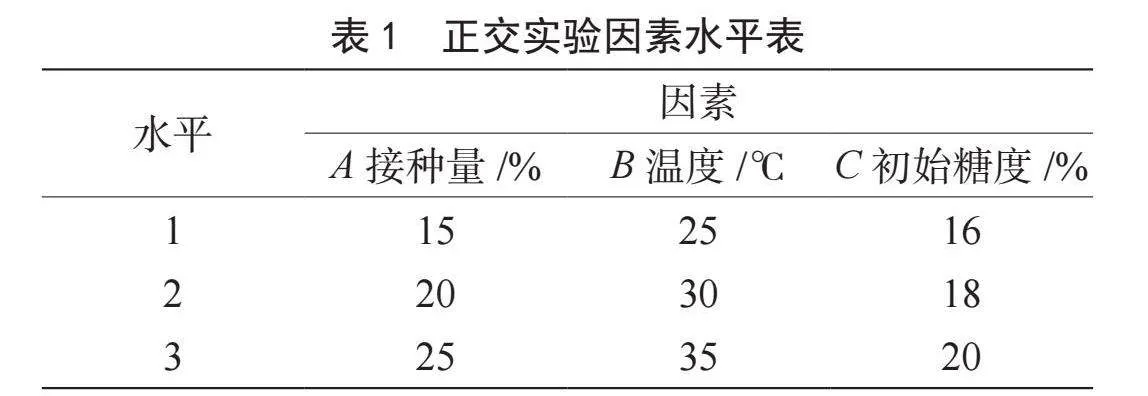
以红茶菌接种量(A)、发酵温度(B)、初始糖度(C)为考察因素,以总酸含量为考察指标,进行3因素3水平正交优化实验,确定红茶菌发酵香蕉醋的最佳工艺条件。实验因素水平设计见表1。
1.3.5 总酸测定
根据《酿造食醋》(GB/T 18187—2000)中的要求,采用酸碱滴定法测定发酵液中的总酸含量。
1.3.6 红茶菌香蕉醋的抗氧化活性研究
假定未稀释样液红茶菌香蕉醋、红茶菌液、香蕉浆、苹果醋的体积分数为100%,实验时用蒸馏水将其稀释成体积分数为5%、10%、15%、20%、25%、30%、35%、40%的样液。
(1)DPPH自由基清除能力测定。取样液0.6 mL,准确加入1 mL DPPH溶液(2.0×10-4 mol·L-1),充分混匀后在避光环境下放置30 min,于517 nm处测定吸光度Ai;对照组为样液0.6 mL再加1 mL无水乙醇避光反应30 min,在波长517 nm条件下测定吸光度Aj;并以等体积的乙醇-水溶液空白调零。DPPH自由基清除率按式(1)计算。
(1)
式中:Ai为样品组的吸光度;Aj为对照组吸光度;A0为空白组的吸光度。
(2)羟基自由基清除能力测定。向具塞试管中加入1 mL样液,0.15 mol·L-1 FeSO4溶液0.5 mL和2 mmol·L-1水杨酸溶液2.0 mL、蒸馏水2.5 mL,充分摇匀后加入1.0 mL H2O2(6 mmol·L-1),在37 ℃下恒温反应1 h,在510 nm处测定吸光值A1。羟基自由基清除率按式(2)计算。
(2)
式中:A1为含水杨酸样品液的吸光度;A2为不含水杨酸溶液时样品液的吸光度;A空为空白对照液的吸光度。
(3)还原能力测定。准确移取样液1 mL,加入0.2 mol·L-1、pH值为6.6的磷酸缓冲溶液0.2 mL和质量浓度为1%的K3Fe(CN)6溶液0.5 mL,振荡混匀,50 ℃下水浴20 min后取出,快速冷却,再加入10%三氯乙酸1 mL终止反应。取上清液1.5 mL,加入质量浓度为l%的FeCl3溶液0.2 mL和蒸馏水3.0 mL,充分摇匀,静置5 min后,于700 nm处测定吸光值。平行测定3次,取平均值。吸光值越大,说明还原能力越强。
2 结果与分析
2.1 单因素实验结果
2.1.1 红茶菌接种量对香蕉醋发酵的影响
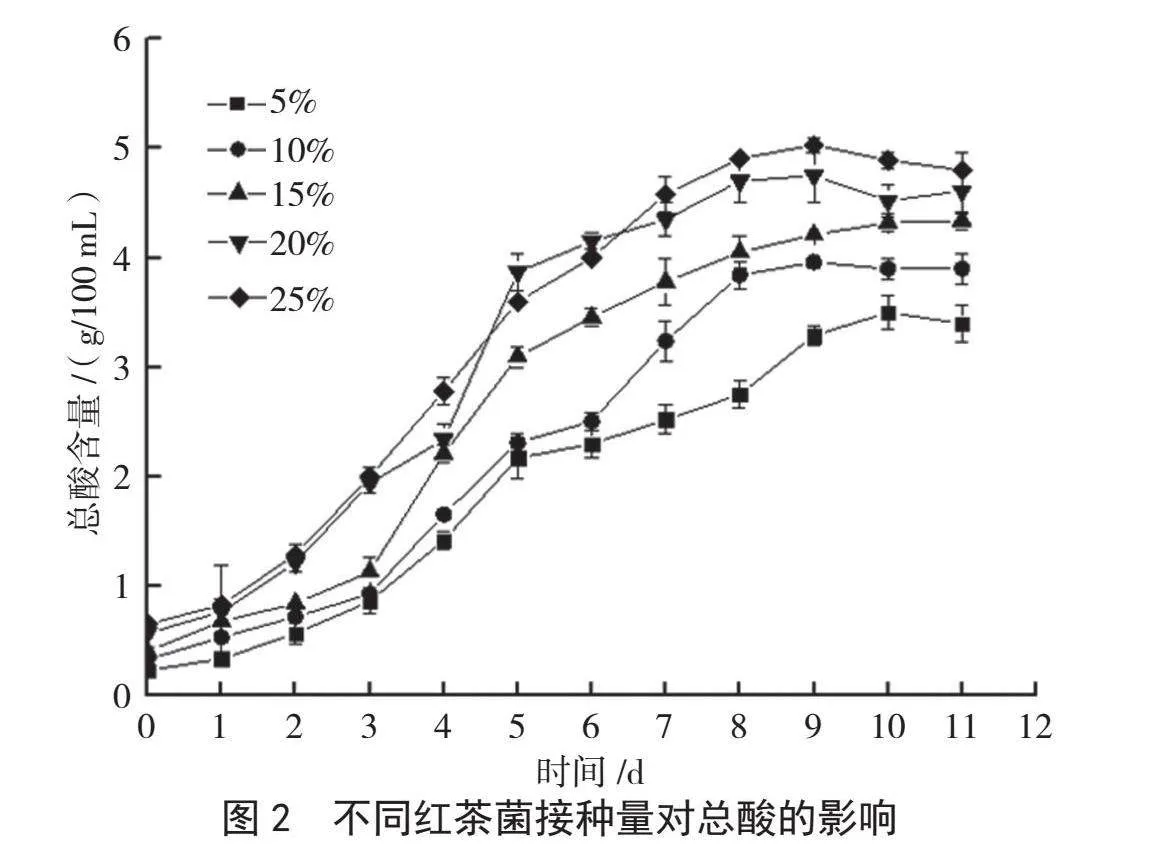
红茶菌接种量直接影响发酵的原料转化速率和周期,不同红茶菌接种量对香蕉醋中总酸含量的影响结果见图2。从图2可以看出,红茶菌接种量为10%时,发酵前3 d产酸缓慢,第4 d开始迅速产酸,在第9 d发酵液总酸含量到达峰值,后期基本保持稳定,但整体总酸含量偏低,这可能是由于发酵菌体量少,产酸能力较弱,发酵产酸结束较快。接种量为20%和25%时,发酵液从第2 d开始便能迅速产酸,发酵至第9 d时总酸含量达到峰值。整体来看,红茶菌接种量选择15%~25%较为合适。
2.1.2 发酵温度对香蕉醋发酵的影响
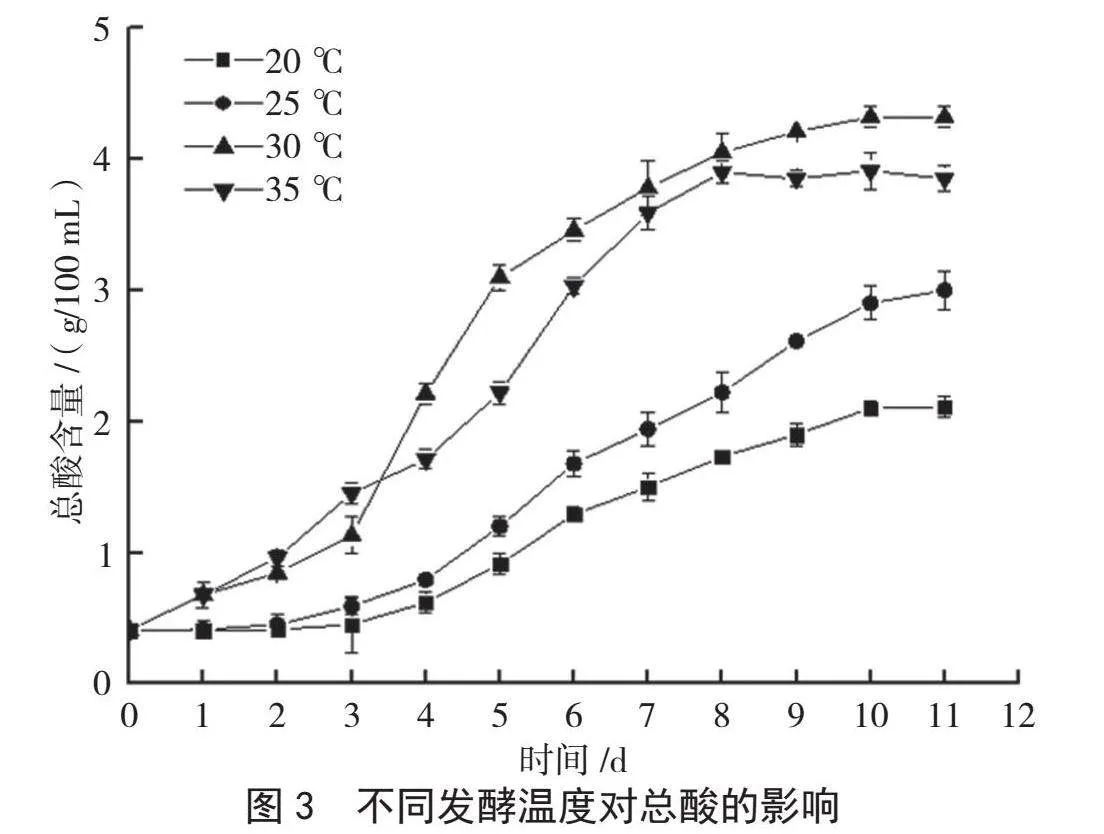
温度能影响红茶菌的活性和代谢作用,温度过高或过低都会对发酵产生不利的影响。从图3可以看出,发酵温度为20 ℃时,发酵速度较慢,发酵周期较长,产酸含量较低;发酵温度为30 ℃、35 ℃时,整体发酵过程中产酸能力较高。35 ℃发酵到第8 d时产酸基本稳定,总酸含量最高可达3.91 g/100 mL;30 ℃条件下发酵至第10 d时,总酸含量达4.30 g/100 mL。总体来看,红茶菌发酵香蕉醋更适合的温度范围为25~35 ℃。
2.1.3 初始糖度对香蕉醋发酵的影响
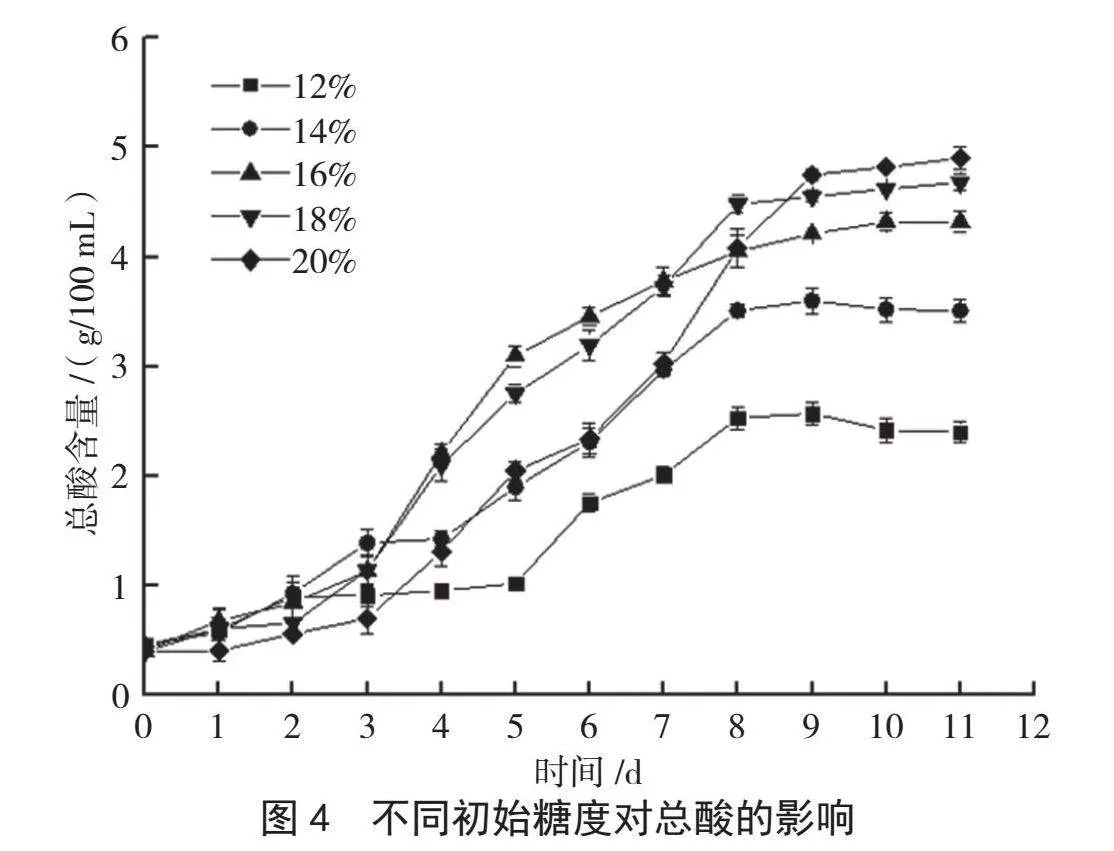
微生物利用原料中的糖分进行生长繁殖和代谢产物,不同初始糖度对香蕉醋发酵的影响结果见图4。从图4可以看出,在发酵前8 d,随着发酵时间的延长,总酸含量不断增加,但是初始糖度为12%时,发酵速率慢,最终产酸量也较低,这可能是因为初始糖度过低,发酵底物不足,发酵不充分[11]。当初始糖度为14%时,总酸含量最高为3.5 g/100 mL。初始糖度为18%时,发酵至第9 d时产酸基本稳定,总酸含量为4.53 g/100 mL。初始糖度为20%时,发酵前3 d的发酵速率较慢,这是因为前期糖度过高,渗透压加大,会抑制酵母菌的生长繁殖代谢[12],但是发酵4 d以后,总酸含量迅速上升,到第11天时可达4.90 g/100 mL。综合发酵时间、成本和效率等因素考虑,红茶菌发酵香蕉醋的最适初始糖度范围为16%~20%。
2.2 正交实验结果
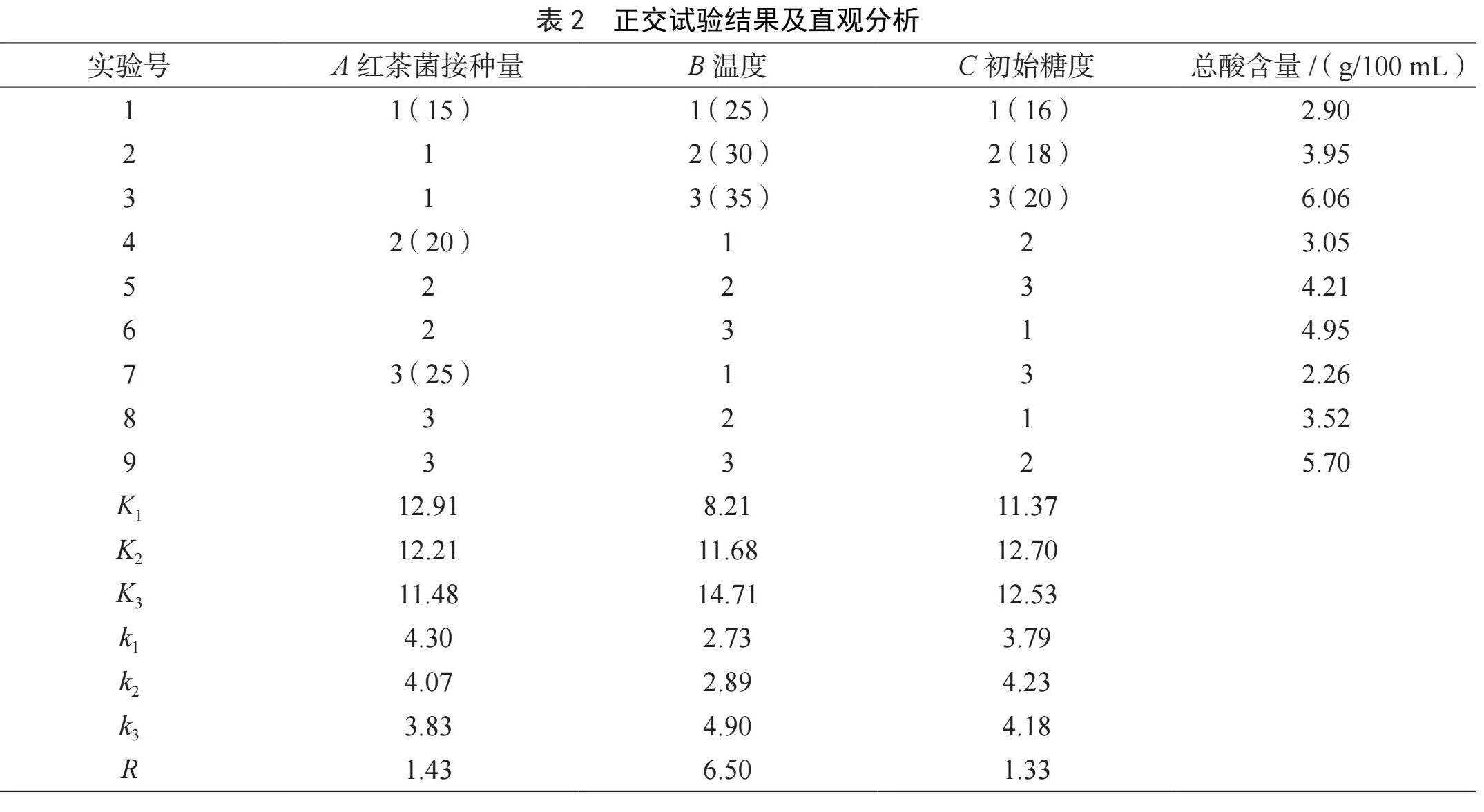
在单因素实验的基础上,进行3因素3水平正交优化实验,实验结果见表2。由表2可知,各因素对香蕉醋发酵的影响顺序为B>A>C,即发酵温度>红茶菌接种量>初始糖度。由k值大小可得香蕉醋发酵的最优条件为A1B3C2,该条件下发酵得到的红茶菌香蕉醋总酸含量为5.12 g/100 mL,小于正交表中第3组的总酸含量(6.06 g/100 mL)。因此,确定正交表中第3组,即红茶菌接种量为15%、发酵温度35 ℃、初始糖度20%为香蕉醋发酵的最佳条件。
2.3 红茶菌香蕉醋抗氧化活性研究
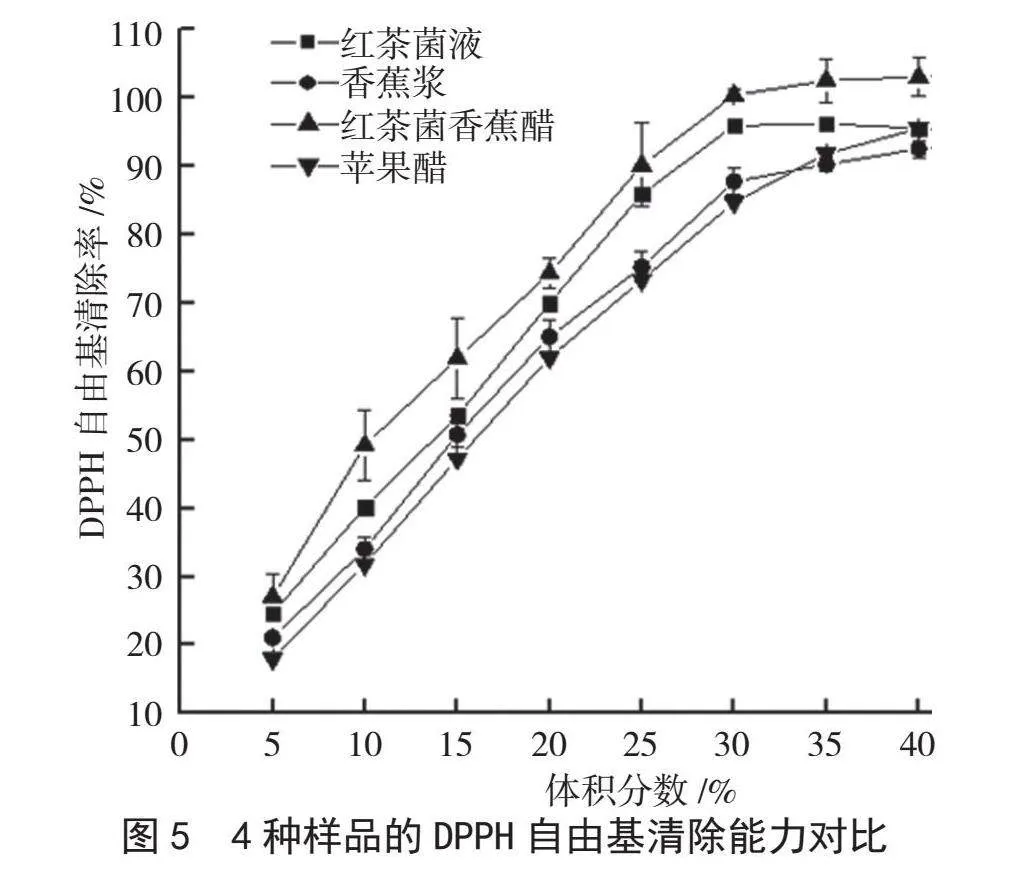
DPPH自由基是一种稳定以氮为中心的有机自由基,可以用来检测抗氧化能力,DPPH自由基清除率越大,表明该物质抗氧化的能力越强[13]。本文研究红茶菌液、香蕉浆、红茶菌香蕉醋及苹果醋4种样液对DPPH自由基的清除能力,通过测定未发酵的香蕉浆和红茶菌液的DPPH自由基清除率来比较发酵后得到的红茶菌香蕉醋的抗氧化能力,并通过苹果醋辅助验证红茶菌香蕉醋的抗氧化能力。结果如图5所示。在同一体积浓度下,红茶菌香蕉醋对DPPH自由基的清除率高于红茶菌液、香蕉浆、苹果醋。体积分数为30%时,红茶菌香蕉醋对DPPH自由基的清除率达到100%,红茶菌液、香蕉浆、苹果醋的DPPH自由基清除率分别为95%、87%、84%。未发酵的香蕉浆的抗氧化能力主要依靠酚类物质,红茶菌液的抗氧化能力主要取决于微生物发酵过程中代谢产物,红茶菌香蕉醋的DPPH自由基清除率比未发酵的香蕉浆、红茶菌液高,这是因为红茶菌发酵过程中醋酸等物质积累,导致酸度上升,提供了更多带正电的氢离子,进而提高了自由基的清除率[14]。此外,发酵将香蕉中的大分子酚类物质转化成小分子酚类物质,使其清除自由基的能力变强。红茶菌香蕉醋的DPPH自由基清除率整体均高于苹果醋,说明红茶菌香蕉醋具有较好的抗氧化能力,这可能与果醋采用不同的发酵方式、原料时其所提供的具有抗氧化能力的物质或含量有关。
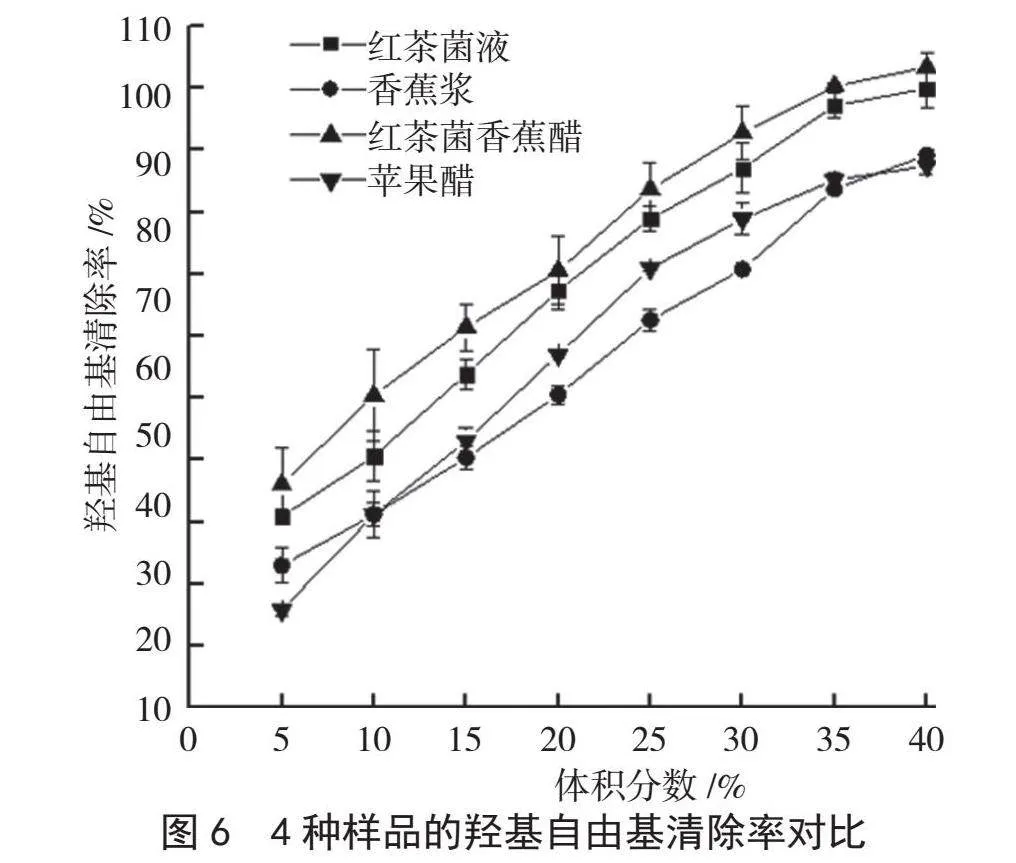
羟基自由基清除能力越高,说明样液的抗氧化能力越强。从图6可以看出,随着样液体积分数的增大,羟基自由基的清除率不断增大。其中,红茶菌香蕉醋的羟基自由基清除能力最好,当体积分数为30%时,红茶菌香蕉醋的羟基自由基清除率达到92.7%,红茶菌液、香蕉浆、苹果醋的羟基自由基清除分别为87.0%、70.8%、78.9%,说明红茶菌香蕉醋具有较好的清除羟基自由基的能力。
抗氧化能力也可用还原能力评定,还原能力越高,说明抗氧化活性越好。从图7可以看出,4种样液的还原能力表现为红茶菌香蕉醋>红茶菌液>香蕉浆>苹果醋。其中,红茶菌香蕉醋具有较强的还原能力,可能是因为微生物在发酵过程中能产生还原酮类物质,其可为自由基提供电子使其稳定,从而有利于终止自由基链式反应[5]。
3 结论
本文以香蕉为原料,采用红茶菌作为发酵菌种,制备香蕉醋,并考察红茶菌接种量、发酵温度、初始糖度对发酵过程中总酸的影响,确定最佳发酵条件为红茶菌接种量为15%、发酵温度35℃、初始糖度20%,该条件下得到的红茶菌香蕉醋总酸为6.06 g/100mL。对红茶菌香蕉醋、红茶菌液、香蕉浆、苹果醋抗氧化活性进行比较,发现红茶菌香蕉醋的DPPH自由基、羟基自由基清除能力,以及还原能力均明显高于其他3种样液,说明红茶菌香蕉醋具有较强的抗氧化活性。
参考文献
[1]邓小华,郑巧双,郭荣,等.红茶菌饮品中各成分的组成及其功能简要概述[J].现代食品,2020(11):147-148.
[2]唐思颉,涂传海,胡文秀,等.红茶菌发酵黄浆水的体外抗氧化活性[J].食品科学,2019,40(17):1-6.
[3]郑显义.几种醋酸菌混合发酵对果醋品质的影响研究[J].中国调味品,2019,44(11):127-130.
[4]徐清萍,金鑫,郭苗苗,等.红茶菌在谷物原料发酵制醋中的应用[J].中国酿造,2019,38(6):90-95.
[5]陈鑫,谢微,苏小建,等.无甜苷罗汉果汁发酵制备果醋的研究[J].食品研究与开发,2017,38(18):72-76.
[6]孙永康,卢琴琴.红茶菌酒的研制[J].中国酿造,2015,34(1):172-175.
[7]CHEN J,LI F F,LI Y X,et al.Exogenous procyanidin treatment delays senescence of harvested banana fruit by enhancing antioxidant responses and invivo procyanidin content[J].Postharvest Biol Technol,2019,158:110999.
[8]柳素洁.香蕉多酚氧化酶性质及在果酒发酵中褐变控制的研究[D].泰安:山东农业大学,2012.
[9]刘凤锦,卢兴,李玉霞,等.4种乳酸菌甜玉米乳清蛋白饮料发酵过程主要品质指标分析及感官评价[J].中国乳品工业,2019,47(9):52-56.
[10]颜建虹,张祥瑞,卢红梅,等.响应面法优化刺梨白兰地原料酒发酵工艺[J].中国酿造,2023,42(6):186-191.
[11]王丹,薛虎贵,赵康云,等.啤酒糟果醋制备及工艺条件优化[J].食品科技,2020,45(7):57-63.
[12]石庆叠.刺梨醋酿造及功能性研究[D].贵阳:贵州大学,2022.
[13]张慧霞.红茶菌微生物的分离及其代谢的初步研究[D].福州:福建师范大学,2019.
[14]丁艳如,陈爽,朱忠顺,等.红茶菌的发酵条件及抗氧化活性[J].食品科技,2016,41(3):21-26.
