不同包装方式对清蒸大黄鱼贮藏过程中品质及菌群的影响
2024-12-31邹灿敏刘梦遥钟榕斌余欣芮姚闽娜石菲菲梁鹏
摘 要:探究不同包装方式对清蒸大黄鱼贮藏过程中品质及菌群的影响。基于理化性质及高通量测序技术测定不同包装方式下清蒸大黄鱼贮藏过程中的汁液流失率、pH值、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物值、挥发性成分、菌落总数和微生物群落的变化。结果表明:相比于普通包装,真空包装和气调包装均可有效抑制清蒸大黄鱼贮藏过程中TVB-N含量的上升,真空包装可以最大程度抑制贮藏过程中清蒸大黄鱼的脂质氧化,而气调包装可以最大程度抑制微生物的生长;清蒸大黄鱼贮藏后关键挥发性成分为己醛、辛醛、壬醛、癸醛、庚醇、2-十一酮,其中气调包装的清蒸大黄鱼风味优于普通包装和真空包装;清蒸大黄鱼贮藏后的菌群多样性下降,其中革兰氏阴性菌占据优势,优势菌门为变形菌门、蓝细菌门和拟杆菌门;在属水平上,普通包装组优势菌属为嗜冷杆菌和不动杆菌,气调包装组为不动杆菌与无色杆菌,真空包装组为不动杆菌、希瓦氏菌和假单胞菌。本研究可为大黄鱼加工贮藏中包装方式的选择提供参考。
关键词:大黄鱼;清蒸;贮藏;真空包装;气调包装;菌群
Effect of Different Packaging Methods on the Quality and Microbial Community of
Steamed Large Yellow Croaker during Storage
ZOU Canmin LIU Mengyao ZHONG Rongbin YU Xinrui YAO Minna SHI Feifei LIANG Peng
(1. College of Food Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. Engineering Research Center of Fujian and Taiwan Specialty Marine Food Processing and Nutrition and Health, Ministry of Education, Fuzhou 350002, China;
3. Quanzhou Marine Biological Industry Research Institute, Quanzhou 362000, China;
4. Institute of Oceanology, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
Abstract: This study aimed to explore the effects of different packaging methods on the quality and microflora of steamed large yellow croaker during storage. Changes in the drip loss rate, pH, total volatile basic nitrogen (TVB-N) content, thiobarbituric acid reactive substances (TBARS) value, volatile components, total bacterial count (TBC) and microbial community of steamed large yellow croaker were determined during storage under different packaging conditions. It was found that compared with ordinary packaging (OP), vacuum packaging (VP) and modified atmosphere packaging (MAP) effectively inhibited the increase of TVB-N content during storage of steamed large yellow croaker. VP inhibited lipid oxidation to the greatest extent, and MAP inhibited the growth of microorganisms to the greatest extent. The key volatile components of steamed large yellow croaker after storage were hexaldehyde, octyl aldehyde, nonylaldehyde, capric aldehyde, heptanol and 2-undecone. The flavor of steamed large yellow croaker was better under MAP than under OP and VP. After storage, the bacterial diversity of steamed large yellow croaker decreased, and Gram-negative bacteria predominated in the bacterial community, with Proteobacteria, Cyanobacteria and Bacteroidetes being the dominant phyla. The dominant bacteria genera in the OP group were Psychrobacter and Acinetobacter, those in the MAP group were Acinetobacter and Achromobacter, and those in the VP group were Acinetobacter, Shewanella and Pseudomonas. The findings from this study can provide a reference for the selection of packaging methods in the processing and storage of large yellow croaker.
Keywords: large yellow croaker; steamed; storage; vacuum packaging; modified atmosphere packaging; microbial community
DOI:10.7506/rlyj1001-8123-20240522-123
中图分类号:TS254.4" " " " " " " " " " " " " " " " " " " 文献标志码:A 文章编号:1001-8123(2024)07-0038-10
大黄鱼(Larimichthys crocea)俗名黄花鱼、黄金龙等,与带鱼、小黄鱼、乌贼并列为我国传统四大海产。大黄鱼作为我国沿海特有的经济鱼类,海水养殖产量居全国第一,2022年全国养殖总产量达25.7万 t,其中福建总产量达21.5万 t[1]。随着人们生活水平不断提高,生活节奏加快,方便、营养的水产食品越来越受到青睐,市场潜力巨大[2-3]。清蒸大黄鱼可作为即食水产品进行产业化生产,其大致经过原料挑选、预处理、腌制调味、蒸制及冷却的工艺流程。然而,大黄鱼在清蒸后若未及时食用或妥善贮藏,极易因微生物活动和生理生化反应导致品质下降甚至腐败[4]。因此,探索有效的贮藏方法以保持清蒸大黄鱼的品质和安全性至关重要。
包装方式是影响鱼类贮藏品质的关键因素,不同的包装技术如真空包装、气调包装等已被广泛应用于水产品保鲜。这些技术通过调整包装内的气体成分,控制氧气、二氧化碳和其他气体的比例,旨在减缓微生物生长速率,延缓腐败过程,延长保质期。目前市面上常见的包装方式有普通包装、真空包装和气调包装等,因作用机制不同,用于不同包装对象所展现出的效果有所差异。近年来,国内外有不少学者研究比较了不同包装方式对畜肉、禽肉、生鲜水产等肉类贮藏过程中品质的影响[5-6]。另外,已有研究表明气调包装对大黄鱼鲜品贮藏品质有积极影响[7-8],但不同包装方式对清蒸大黄鱼品质及菌群的影响仍不清楚。
因此,本研究通过测定清蒸大黄鱼的汁液流失率、pH值、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值、挥发性成分、菌落总数及菌群的变化情况,探究不同包装方式下清蒸大黄鱼贮藏过程中的理化性质与菌群变化规律,为清蒸大黄鱼运输及销售过程中的贮藏条件、包装方式的科学选择提供参考依据。
1 材料与方法
1.1 材料与试剂
冰鲜大黄鱼购于永辉超市。
聚乙烯(polyethylene,PE)自封袋(食品级)"佛山市凡人包装有限公司;真空袋 福州旺客包装材料有限公司;平板计数琼脂 广东环凯微生物科技有限公司;2-硫代巴比妥酸(2-thiobarbituric acid,TBA)(纯度98%) 上海麦克林生化科技有限公司;氧化镁(纯度98%)、三氯乙酸(纯度98%)、乙二胺四乙酸(纯度≥99.5%)、氯化钠(纯度≥99.5%) 国药集团化学试剂有限公司;KG203-03快速DNA提取检测试剂盒 天根生化科技(北京)有限公司;AxyPrepDNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
SQP型电子分析天平 赛多利斯科学仪器(北京)有限公司;BS224S型手持pH计 奥豪斯仪器(常州)有限公司;T18型高速离散均质机 德国IKA公司;DQ320L-V型气调保鲜包装机 浙江达盛智能设备有限公司;Kjeltec 8420型凯氏定氮仪 丹麦福斯分析仪器有限公司;GR85DA型立式灭菌锅 美国ZEALWAY仪器有限公司;GSP-9160MBE型隔水培养箱、SPX-250B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;AW-CJ-1B型标准净化工作台 苏州安泰空气技术公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;QuantiFluor™-ST蓝色荧光定量系统"美国Promega公司;TQ8050型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪 日本岛津公司;HP-5MS柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司。
1.3 方法
1.3.1 样品制备
将冰鲜大黄鱼去头尾、去内脏,洗净沥干,鱼肉在100 ℃沸水清蒸4 min,静置冷却后,分别进行普通包装(PE自封袋)、真空包装和气调包装(N2、CO2体积比6∶4),放入4 ℃冰箱中进行贮藏实验,0~24 d贮藏期间,每隔6 d将3 种包装方式下的样品各随机取出3 个,恢复至室温后,测定样品各项指标,以未经贮藏的清蒸大黄鱼作为对照组。
1.3.2 汁液流失率测定
贮藏之初,称量包装袋的质量。贮藏期检测时,擦干恢复至室温的包装袋上的水渍后,称取包装袋、汁液和鱼肉的总质量,小心撕开包装袋,取出鱼肉,再称量包装袋和汁液的总质量,贮藏过程中的汁液流失率按
式(1)计算:
汁液流失率/%=m2-m1/m1-m0""(1)
式中:m0为包装袋质量/g;m1为包装袋、汁液和鱼肉的总质量/g;m2为包装袋与汁液的总质量/g。
1.3.3 TVB-N含量测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[9]中的自动凯氏定氮仪法测定鱼肉的TVB-N含量。
1.3.4 pH值测定
称取10 g鱼肉放入烧杯中,加入50 mL蒸馏水,用均质机以5 000 r/min均质2 min后,在室温下静置30 min,离心后取上清液,测定pH值。
1.3.5 TBARS值测定
参考胡锦鹏[10]的方法并稍加修改,将鱼肉研碎后,称取10 g样品放入锥形瓶中,再加入50 mL含0.1 g/100 mL乙二胺四乙酸的7.5 g/100 mL三氯乙酸溶液,置于加热至70 ℃的振荡器中振荡30 min,取出静置冷却后过滤,取上清液5 mL加入0.02 mol/L TBA溶液,在90 ℃的水浴锅中加热45 min,取出静置冷却至室温后,加入5 mL氯仿,充分混匀,静置至溶液分层。分别在532 nm和600 nm波长处测定上清液吸光度。TBARS值按式(2)计算:
TBARS٬ /(mg/kg)=A532 nm-A600 nm/155×1/10×72.6×100 (2)
1.3.6 挥发性成分测定
取2.0 g样品移入20 mL顶空瓶中,快速密封。将固相微萃取(solid-phase microextraction,SPME)纤维头在GC-MS进样口老化(250 ℃)至无杂峰。将样品瓶置于SPME装置,60 ℃水浴加热10 min;将SPME纤维头插入样品的顶空部分,推出纤维头,60 ℃水浴萃取30 min;抽回纤维头,从样品瓶中拔出,插入GC-MS仪进样口,进行GC-MS分析。
GC条件:HP-5MS柱(30 m×0.25 mm,0.25 μm),载气:氦气,流量1.30 mL/min;进样口温度250 ℃;升温程序:50 ℃保持2 min,以4 ℃/min升至160 ℃,以20 ℃/min升至280 ℃,保持2 min。MS条件:电子电离源,电子能量70 eV,质量扫描范围m/z 35~550,GC-MS接口温度280 ℃,离子源温度200 ℃。
定性与定量分析:与NIST 2008和Wiley质谱库中标准物质图谱比对,对挥发性成分进行定性,仅正反匹配度均大于800的物质才予以保留;根据色谱图保留峰面积计算各个挥发性成分的相对含量。
关键挥发性成分分析:采用刘登勇等[11]的相对气味活度值(relative odor activity value,ROAV)评价挥发性成分对样品总体风味的贡献。确定对样品总体风味贡献最大组分的ROAVstan=100,其他挥发性成分的ROAV按
式(3)计算:
ROAVi ≈100×Ci/Cstan×Tstan/Ti(3)
式中:Cstan为对整体风味贡献最大成分的相对含量/%;Tstan为对整体风味贡献最大成分的感觉阈值/(μg/kg);Ci为待测成分相对含量/%;Ti为待测成分的感觉阈值/(μg/kg)。
ROAV≥1,说明该成分对样品总体风味起关键性作用,ROAV值越大,对整体风味贡献越大;0.1≤ROAV<1,说明该成分对样品总体风味起重要修饰作用。
1.3.7 菌落总数计算
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》[12]方法计算菌落总数。
1.3.8 菌群的高通量测序
选择清蒸大黄鱼不同部位进行取样,混匀,采用十六烷基三甲基溴化铵法提取鱼肉样品DNA,用1%琼脂糖凝胶电泳检测抽提的基因组DNA的完整性。聚合酶链式反应(polymerase chain reaction,PCR)的引物为338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)。其中,PCR扩增体系选用ProTaq、20 μL反应体系:2×ProTaq聚合酶10 μL,前引物(5 μmol/L)和后引物(5 μmol/L)各0.8 μL,10 ng/μL模板DNA 1 μL,添加ddH2O至20 μL。PCR扩增条件为:95 ℃预变性3 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s,每个样品各循环29 次;最后在72 ℃下终延伸10 min。扩增结束后取3 μL扩增产物,用2%琼脂糖凝胶电泳检测,确保扩增产物目的条带大小正确、浓度合适。
使用凝胶回收试剂盒切胶回收PCR扩增产物,Tris-HCl缓冲液洗脱;再次用2%琼脂糖凝胶电泳检测。参照电泳初步定量结果,将PCR扩增产物用QuantiFluor™-ST蓝色荧光定量系统进行定量检测,之后按照每个样本的测序量要求,进行相应比例混合与Illumina测序。根据物种分类数据库https://www.arb-silva.de/,采用USEARCH11-uparse算法按相似度97%进行分类操作单元(operational taxonomic units,OTU)划分,分类置信度0.7。
1.4 数据处理
每组实验重复3 次,通过Excel 2019对数据进行录入,使用IBM SPSS Statistics 26对数据进行显著性分析,组间差异显著性水平设定为P<0.05,采用Origin 2021制图。
2 结果与分析
2.1 包装方式对清蒸大黄鱼贮藏过程中汁液流失率的影响
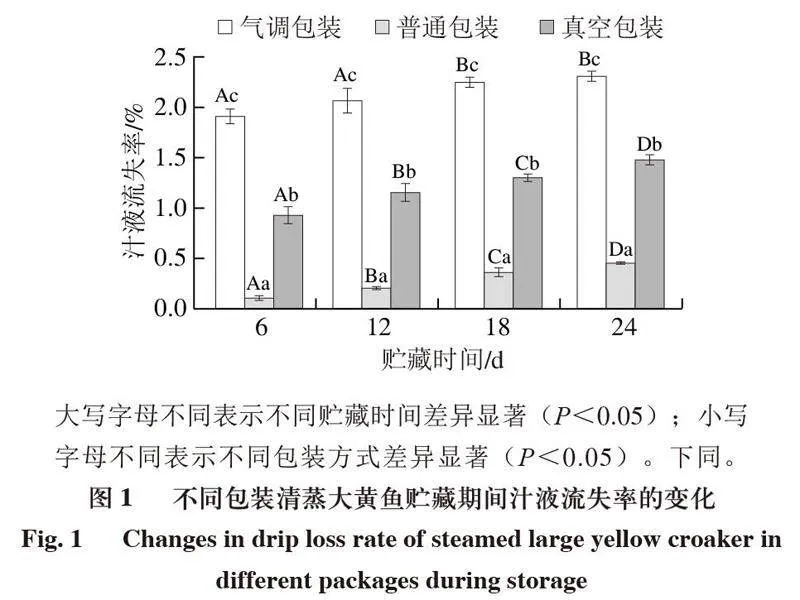
贮藏过程中清蒸大黄鱼鱼肉持水力下降使汁液流失,进而导致外观品质下降,失去的水溶性营养素和风味物质还会成为微生物良好的培养基,促进微生物生长[13-14]。如图1所示,在4 ℃贮藏条件下,不同包装清蒸大黄鱼汁液流失率均随着贮藏时间的延长而显著升高(P<0.05),这是由于随着贮藏时间的延长,鱼肉因自身酶和微生物对蛋白质、糖类的分解作用,导致细胞被破坏、蛋白质被分解,致使鱼肉的汁液流失率增加[15]。
不同贮藏时间下,清蒸大黄鱼的汁液流失程度均表现为:气调包装>真空包装>普通包装,并且在贮藏24 d汁液流失率分别达到最大值。气调包装组汁液流失率最高是因为气调包装中的CO2溶于大黄鱼鱼肉的水分中,导致蛋白质分子间距缩小,减弱了鱼肉的持水力[16]。
大写字母不同表示不同贮藏时间差异显著(P<0.05);小写字母不同表示不同包装方式差异显著(P<0.05)。下同。
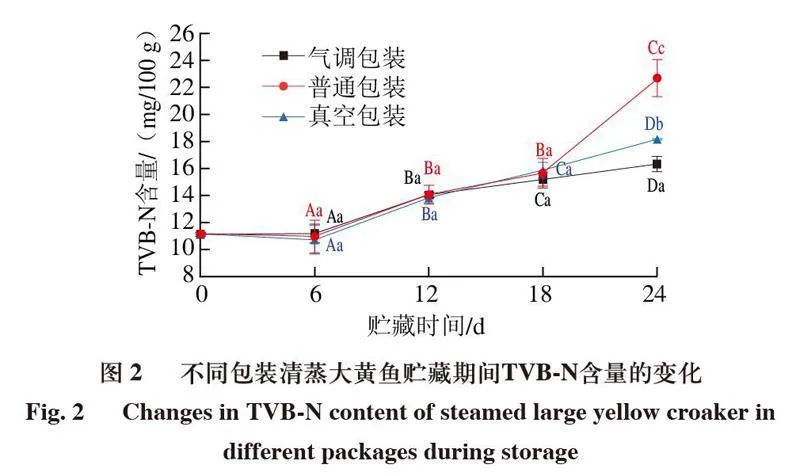
2.2 包装方式对清蒸大黄鱼贮藏过程中TVB-N含量的影响
TVB-N指动物性食品中内源酶和细菌对蛋白质降解而产生的氨和胺类等碱性含氮化合物[17],TVB-N含量是表征水产品腐败程度的重要指标之一,GB 10136—2015《食品安全国家标准 动物性水产制品》规定预制动物性水产制品(不含干制品和盐渍制品)的TVB-N含量≤30 mg/100 g,所以认为TVB-N含量的可接受范围在30 mg/100 g以内[18-19]。如图2所示,清蒸大黄鱼在4 ℃贮藏0~18 d内,普通包装、真空包装和气调包装组TVB-N含量增长趋势较为接近,当贮藏时间延长至24 d后,普通包装组TVB-N含量急速增加,显著高于真空包装、气调包装组(P<0.05)。气调包装可以有效延缓TVB-N含量增长,这可能和CO2的作用机制有关,CO2溶解于大黄鱼鱼肉的水分中,能影响微生物的生长和活性,且CO2的溶解度随着温度降低而升高[20-21]。
这表明气调包装在低温条件下能溶解更多CO2,有效抑制微生物活动,从而达到延长清蒸大黄鱼产品货架期的目的。
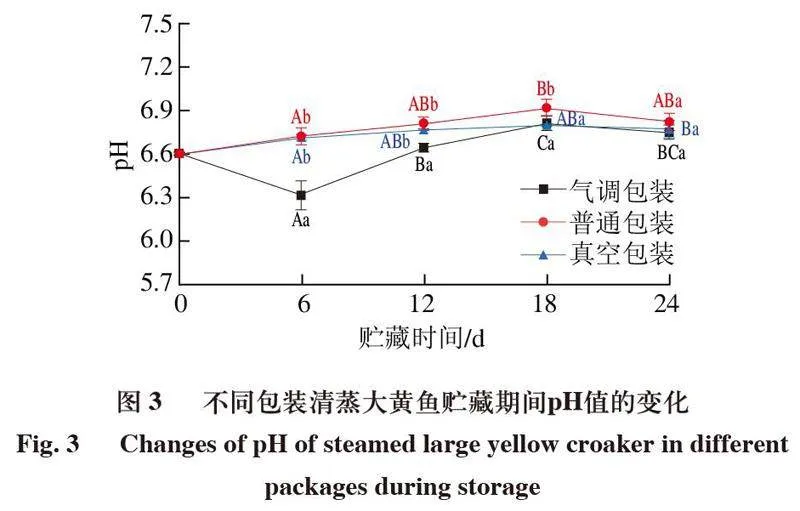
2.3 包装方式对清蒸大黄鱼贮藏过程中pH值的影响
如图3所示,清蒸大黄鱼在4 ℃贮藏过程中,pH值呈先上升后下降的变化趋势。3 种包装方式样品在贮藏6~18 d时,pH值持续上升,在18 d时分别达到最高值,这可能是由于微生物和内源酶分解蛋白质产生碱性含氮化合物,Duan Jingyun等[22]在对灵鳕鱼的研究中也得到了类似的结果。贮藏18~24 d时,pH值开始下降,这可能是脂肪酸败,微生物繁殖增多,其产生的酸性物质不断累积共同导致的[23-24]。此外,贮藏6 d时气调包装组pH值显著低于普通包装和真空包装组(P<0.05),同时也低于0 d的对照组。这是因为气调包装中的CO2溶解于鱼肉的水分中,通过形成碳酸使其酸化,故而pH值降低[25]。另外,贮藏12~24 d时,普通包装的pH值始终高于真空包装和气调包装,贮藏24 d时,pH值为:气调包装<真空包装<普通包装,普通包装pH值较高可能是因为鱼肉腐败过程中产生大量碱性含氮化合物,中和了酸性物质,这与TVB-N含量结果相一致。
2.4 包装方式对清蒸大黄鱼贮藏过程中TBARS值的影响
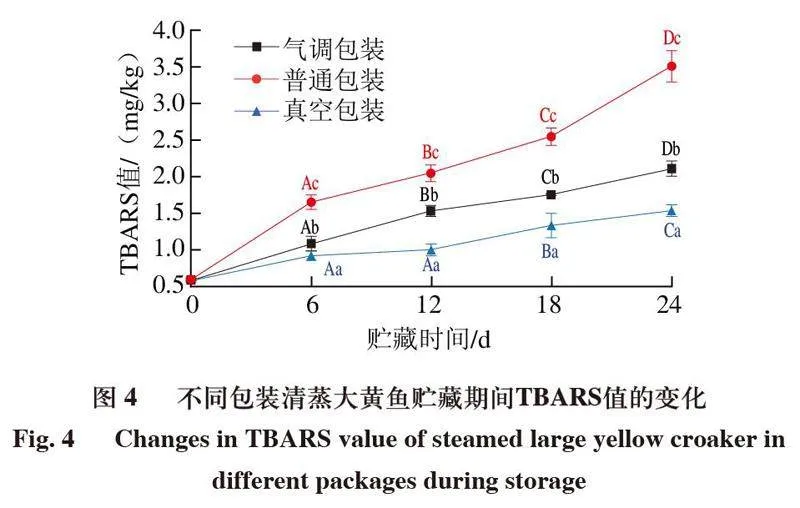
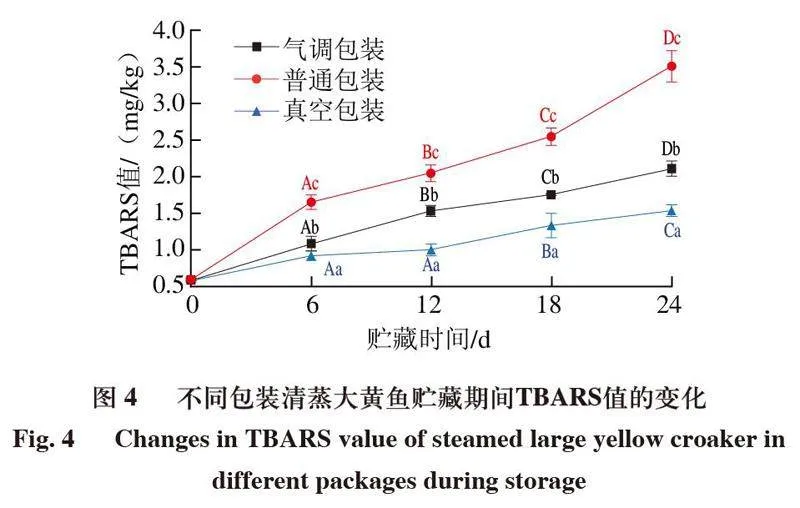
脂质氧化是造成水产品变质的关键因素之一[26],TBARS值代表脂质氧化产生次级产物的程度,可作为评价水产品中油脂氧化的指标,当水产品肌肉的TBARS值达到1.0~2.0 mg/kg时,脂质氧化后形成的酮类和酮类小分子会产生恶臭气味,使水产品失去食用价值[27]。
如图4所示,在4 ℃贮藏0~24 d,普通包装、真空包装和气调包装清蒸大黄鱼的TBARS值呈上升趋势,24 d时达到最大值,而且TBARS值始终表现为真空包装<气调包装<普通包装。此外,贮藏过程中,真空包装组TBARS值始终显著低于普通包装和气调包装组(P<0.05)。普通包装和气调包装组TBARS值分别在12 d和24 d时达到临界值,而真空包装组在贮藏24 d时仍未超出临界值。真空包装通过抽出空气隔绝氧气,气调包装通过充氮排氧,2 种方式均可以抑制脂质氧化,其中真空包装的抑制效果优于气调包装。
2.5 包装方式对清蒸大黄鱼贮藏前后挥发性成分的影响
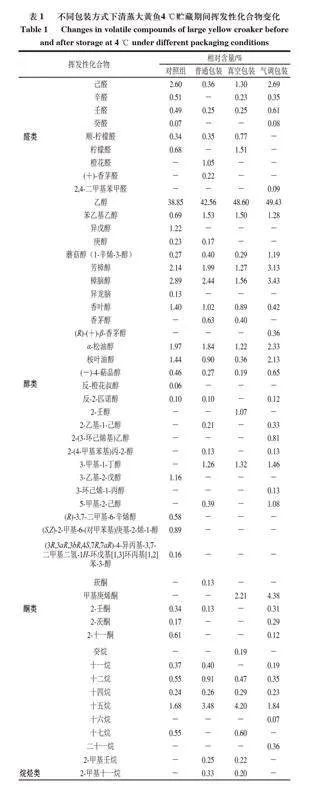
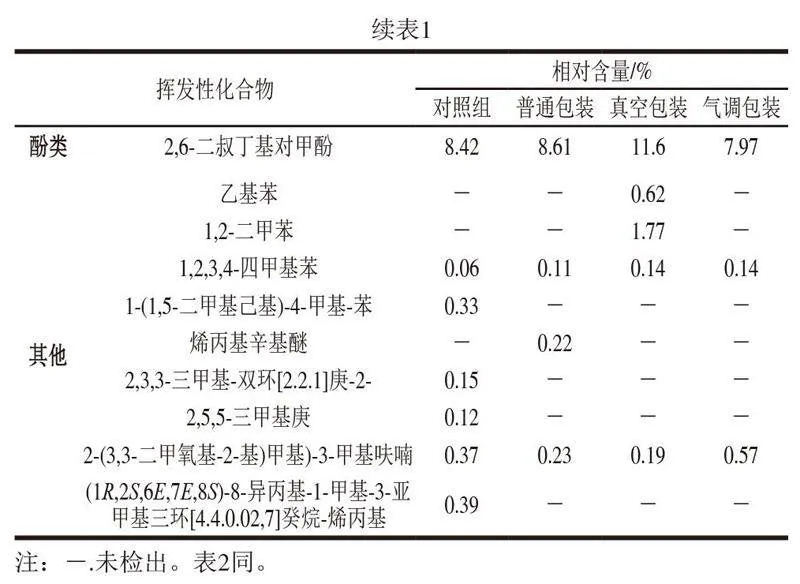
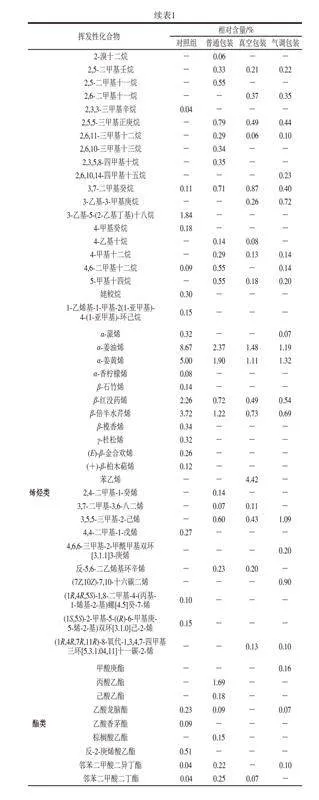
如表1所示,从清蒸大黄鱼中共检出112 种挥发性成分,其中主要有醛类(9 种)、酮类(5 种)、醇类(27 种)、烷烃类(30 种)、烯烃类(22 种)。对照组清蒸大黄鱼中共检出65 种挥发性成分,4 ℃贮藏条件下,普通包装、真空包装和气调包装清蒸大黄鱼中分别检出59、49、57 种挥发性成分。
醛类一般来源于亚油酸、油酸等不饱和脂肪酸的氧化分解,其阈值较低,是鱼类气味的主要贡献者[28]。对照组中共有6 种醛类物质(总相对含量为4.69%);4 ℃普通包装组、真空包装组和气调包装组分别共有5 种(2.23%)、5 种(4.06%)、5 种(3.82%)醛类物质。普通包装组醛类总相对含量低于气调包装和真空包装组,这可能是由于普通包装组的醛类更易分解或挥发。此外,4 ℃普通包装组橙花醛相对含量最高,气调包装组的醛类物质中,己醛相对含量最高,真空包装组的己醛相对含量也较高,己醛是亚油酸的氧化产物,呈酸腐味,是鱼类腥味的主要贡献者[29]。4 ℃下各组的己醛相对含量(普通包装组0.36%、真空包装组1.30%、气调包装组2.69%)低于对照组(2.60%),这可能是由于此时4 ℃条件下的样品处于贮藏中后期,有研究发现己醛含量在贮藏过程中呈先升高后降低的趋势[30]。
酮类能与醛类或其他物质发生相互作用,使腥味增强或减弱,酮类主要来自多不饱和脂肪酸氧化降解和氨基酸降解。对照组中共有3 种酮类物质(1.12%);4 ℃普通包装组共有2 种酮类物质(0.26%),真空包装组共有1 种(2.21%),气调包装组共有4 种(5.10%);此外,4 ℃真空包装和气调包装组的酮类物质中,甲基庚烯酮相对含量最高,甲基庚烯酮具有柑橘、果香气味[31]。
醇类的阈值高于醛类和酮类,能对鱼类的风味产生一定影响。各组醇类物质相对含量在54.64%~68.41%之间,是清蒸大黄鱼中相对含量最高的挥发性成分。醇类中相对含量最高的是乙醇,对照组为38.85%,4 ℃普通包装、真空包装、气调包装组分别为42.56%、48.60%、49.43%;对照组中的乙醇可能来自腌制过程中添加的料酒。在贮藏中乙醇可能因微生物活动而增加[32],作为酯类底物也可能在贮藏过程中减少[33],各组乙醇相对含量变化无明显规律,包装方式对乙醇在贮藏过程中的影响有待进一步研究。此外,蘑菇醇(1-辛烯-3-醇)来源于不饱和脂肪酸氧化,被认为是油脂氧化的最佳标记物之一[34],
贮藏结束后,其相对含量在气调包装中明显增加。3-甲基-1-丁醇由微生物活动产生,常作为鱼类腐败的标志[35-36],在对照组中未检出,贮藏结束后,3 种包装方式下均有检出。
烷烃类和烯烃类均属于碳氢类化合物,阈值较高,对鱼肉的风味影响有限[37]。对照组碳氢类化合物相对含量>1%的物质有α-姜油烯(8.67%)、α-姜黄烯(5.00%)、β-倍半水芹烯(3.72%)、β-红没药烯(2.26%)、3-乙基-5-(2-乙基丁基)十八烷(1.84%)、十五烷(1.68%),其中α-姜油烯、α-姜黄烯、β-倍半水芹烯、β-红没药烯是姜及其衍生物中的重要风味物质[38-39],在贮藏结束后,其相对含量明显降低。
酯类物质是醇与羧酸通过酯化产生的,4 ℃普通包装组中酯类物质相对含量明显增加,4 ℃普通包装中相对含量最高的酯类物质是丙酸乙酯。呋喃类物质由氨基酸和糖通过美拉德和Strecker降解反应产生[40],在气调包装中有所增加。
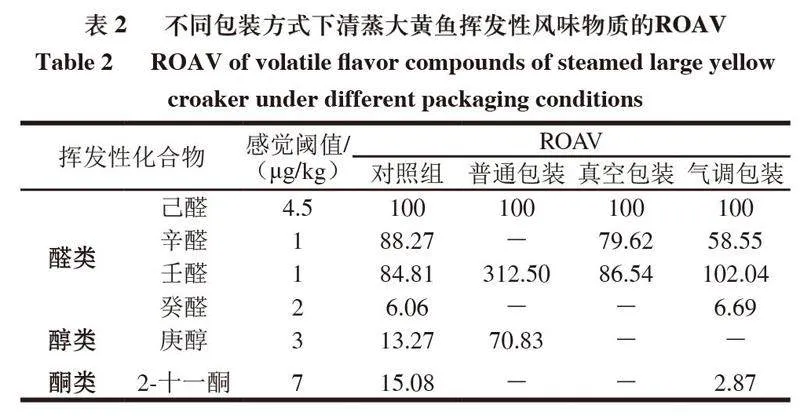
挥发性成分对鱼肉气味的贡献由其含量和感觉阈值共同决定。己醛在大黄鱼肉中的相对含量较高,对鱼肉的总体风味贡献最大。以己醛的ROAV为100,计算其他挥发性成分的ROAV,本研究仅选取ROAV≥1的挥发性风味物质进行分析。由表2可知,清蒸大黄鱼中关键挥发性成分为己醛、辛醛、壬醛、癸醛、庚醇、2-十一酮。其中,己醛具有青草味、鱼腥味;辛醛具有清香味、油脂气息;壬醛具有脂香、青草味;癸醛具有醛香、蜡香、脂肪味、青草味;庚醛具有青香、坚果香气;2-十一酮具有果香、蜡香和脂香,结合表1可知,气调包装贮藏的清蒸大黄鱼风味可能优于普通包装和真空包装,具有令人愉悦的香气。
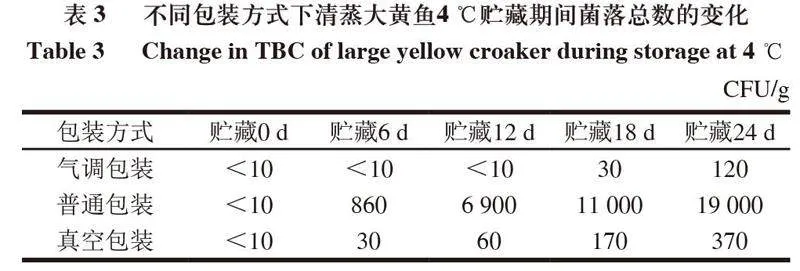
2.6 包装方式对清蒸大黄鱼贮藏过程中菌落总数的影响
在0~24 d贮藏期间,普通包装、气调包装和真空包装清蒸大黄鱼菌落总数均呈增长趋势(表3),在24 d达到最高点,但均低于规定的限值(50 000 CFU/g),此时菌落总数最高的为普通包装组(19 000 CFU/g),其次为真空包装组(370 CFU/g),最后为气调包装组(120 CFU/g),与商业无菌标准相比,普通包装和真空包装组清蒸大黄鱼在6 d时已达到不可食用状态,气调包装组则在18 d时达到不可食用状态,表明气调包装能有效抑制清蒸大黄鱼中微生物的生长。
2.7 包装方式对清蒸大黄鱼贮藏前后微生物群落的影响
2.7.1 包装方式对清蒸大黄鱼贮藏前后菌群多样性的影响
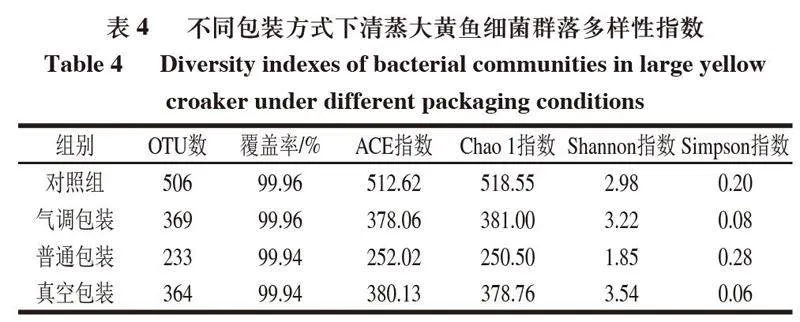
对清蒸大黄鱼进行生物信息学统计后,将种水平相似度为97%的序列划分OTU,由表4可知,贮藏后的清蒸大黄鱼OTU数有所下降。覆盖率在99.94%~99.96%之间,代表大部分样品序列被检测出,此次实验真实度较高,可以满足清蒸大黄鱼微生物多样性的分析要求。Chao 1指数和Ace指数代表清蒸大黄鱼菌群的丰富度,数值越大,所含的菌群种类越多。尽管对照组的菌落总数极低,但Ace指数与Chao 1指数的数值最高,物种最多,4 ℃气调包装和真空包装清蒸大黄鱼同样拥有较高的Ace指数和Chao 1指数。Shannon指数反映菌群的丰富度和均匀度,代表清蒸大黄鱼菌群的多样性,数值越高,多样性越高;Simpson指数则相反,数值越高,代表菌群物种越集中。对照组、4 ℃气调包装和真空包装清蒸大黄鱼的Shannon指数较高,而Simpson指数较低,说明这些样品不但维持着较高的菌群丰度,且不同物种菌群之间数量较为均衡。
2.7.2 包装方式对清蒸大黄鱼贮藏前后门水平群落结构的影响
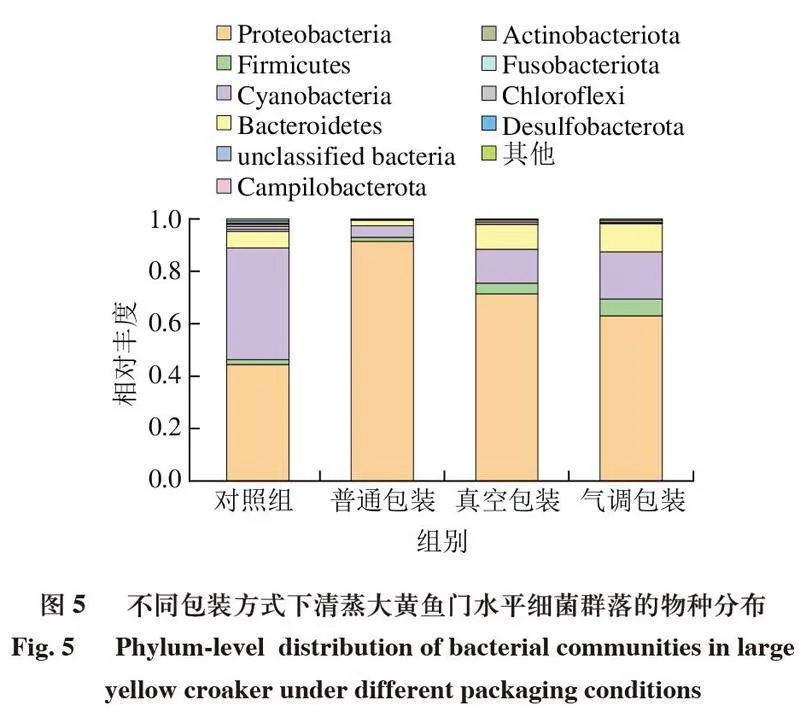
如图5所示,从各组样品中检出10 种主要菌门。对照组门水平上群落结构丰度前3的为变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)和拟杆菌门(Bacteroidetes)。4 ℃下,3 种包装方式样品门水平上群落结构相对丰度前3的门与对照组相似,但相对丰度有所不同,变形菌门相对丰度有所上升,蓝细菌门有所下降,尤其是普通包装组变形菌门相对丰度高达0.91,真空包装和气调包装组拟杆菌门相对丰度上升。值得注意的是,真空包装和气调包装组厚壁菌门(Firmicutes)相对丰度也有所上升,研究认为,变形菌门、拟杆菌门和厚壁菌门是具有致腐能力的常见菌门[21,41]。
2.7.3 包装方式对清蒸大黄鱼贮藏前后属水平群落结构的影响
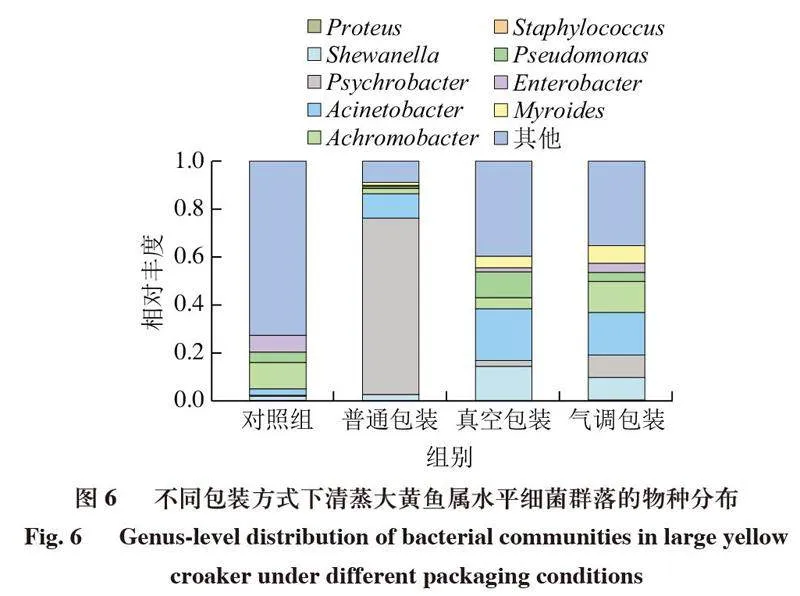
微生物的生长代谢是导致产品腐败变质的主要因素之一,但并非所有微生物都具有致腐能力,且不同物种致腐能力存在差异,腐败问题常归因于致腐能力较强的优势菌群,称为特定腐败菌(specific spoilage organism,SSO)[42]。如图6所示,由对照组属水平上的群落结构可知,热处理未能完全杀死生肉、辅料及制作过程中带来的细菌,因此热处理过后,随着贮藏时间的延长,微生物会重新污染产品。
4 ℃贮藏条件下,普通包装中最具优势的菌群为嗜冷杆菌(Psychrobacter),其次为不动杆菌(Acinetobacter);气调包装中相对丰度最高的是不动杆菌,其次是无色杆菌(Achromobacter),希瓦氏菌(Shewanella)和嗜冷杆菌的相对丰度也较高;真空包装下不动杆菌相对丰度最高,其次是希瓦氏菌和假单胞菌(Pseudomonas)。低温条件能降低微生物的生长速率,但是嗜冷菌依旧活跃,在嗜冷菌中,革兰氏阴性菌是重要的腐败微生物[43]。4 ℃下相对丰度较高的菌种均属于嗜冷的革兰氏阴性菌,可以印证这一观点。希瓦氏菌和假单胞菌是大黄鱼低温贮藏条件下常见的SSO[44-45],有较强的致腐能力,能影响大黄鱼TVB-N含量、K值和生物胺等多项指标[46]。嗜冷杆菌和不动杆菌能影响脂质的腐败进程[47],嗜冷杆菌还可以水解氨基酸产生异味,被认为是部分海产品的SSO[48-49],不动杆菌能够产生黏液和棕色色素,可能会降低产品的外观品质[50]。无色杆菌能够对生物胺产生影响,故而具有一定致腐能力[51],但通常不是主要致腐菌[52-53]。
2.7.4 属水平物种丰度聚类热图
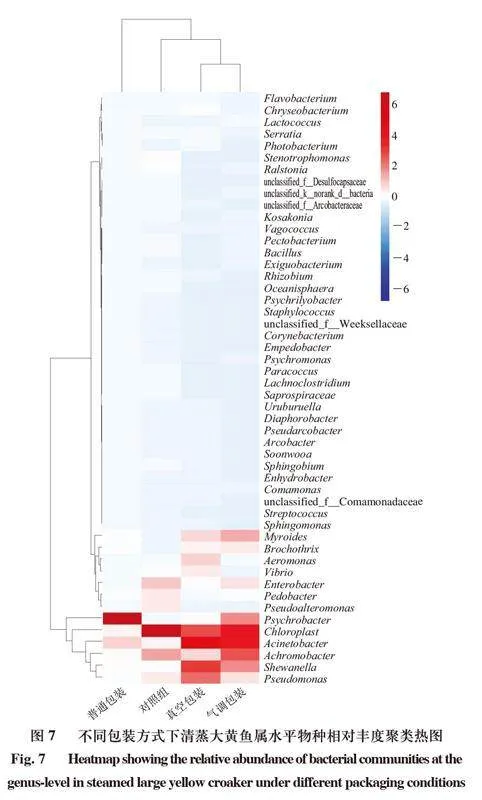
属水平上的物种丰度聚类热图可以更直观地反映细菌在属水平上的分布,也能更清晰地展现不同样品间菌群结构的差异。如图7所示,菌属颜色越接近红色,对应菌属在样品中的含量越高,菌属颜色越接近蓝色,则含量越低。经4 ℃贮藏24 d后,普通包装的清蒸大黄鱼中的优势菌属为嗜冷杆菌和不动杆菌,气调包装的清蒸大黄鱼中的优势菌属为不动杆菌与无色杆菌,而真空包装的清蒸大黄鱼中的优势菌属则为不动杆菌、希瓦氏菌和假单胞菌。结果表明,不同包装方式清蒸大黄鱼贮藏后菌群存在差异,而微生物扰动也是关键理化性质和风味物质发生变化的重要原因。
2.8 理化性质及关键挥发性成分与优势菌群相对丰度的相关性分析
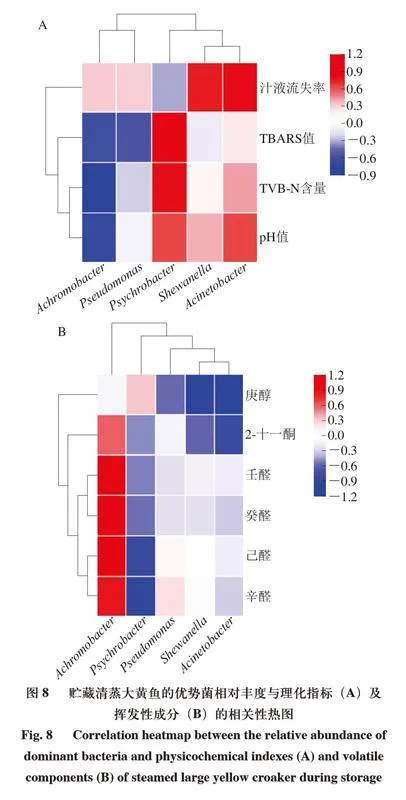
对不同包装方式下贮藏的清蒸大黄鱼中的优势菌群相对丰度与理化因子及风味物质分别进行Pearson相关性分析,并绘制相关性热图。其中,相关系数>0表示正相关,相关系数<0表示负相关。由图8A可知,优势菌相对丰度与理化指标之间具有一定相关性,其中,无色杆菌相对丰度与pH值、TVB-N含量、TBARS值呈负相关;假单胞菌相对丰度与TBARS值也呈负相关;嗜冷杆菌相对丰度与TBARS值、TVB-N含量呈正相关;希瓦氏菌和不动杆菌相对丰度与汁液流失率呈正相关。由图8B可知,无色杆菌相对丰度与辛醛、己醛、癸醛、壬醛相对含量呈正相关;嗜冷杆菌相对丰度与辛醛、己醛相对含量呈负相关;假单胞菌相对丰度与庚醇相对含量呈负相关;希瓦氏菌相对丰度与庚醇相对含量呈负相关;不动杆菌相对丰度与庚醇、2-十一酮相对含量呈负相关。
3 结 论
本研究明确了不同包装方式下清蒸大黄鱼理化性质、挥发性成分和菌群的变化规律。结果表明:4 ℃贮藏0~24 d,普通包装、气调包装、真空包装的清蒸大黄鱼TVB-N含量在可接受范围内;真空包装和气调包装均能有效抑制菌落总数和TVB-N含量的增长及脂质氧化,气调包装会使pH值降低,其中的CO2能更好地抑制微生物增殖;真空包装组TBARS值在贮藏24 d时仍未超出临界值;气调包装组菌落总数在18 d时才达到不可食用状态;清蒸大黄鱼关键挥发性成分为己醛、辛醛、壬醛、癸醛、庚醇、2-十一酮,气调包装的清蒸大黄鱼贮藏后风味优于普通包装和真空包装;贮藏后,清蒸大黄鱼的菌群多样性下降,4 ℃条件下,革兰氏阴性菌占据优势,普通包装、真空包装和气调包装组的优势菌门为变形菌门、蓝细菌门和拟杆菌门,普通包装的优势菌属为嗜冷杆菌和不动杆菌,气调包装为不动杆菌与无色杆菌,真空包装则为不动杆菌、希瓦氏菌属和假单胞菌。本研究可为清蒸大黄鱼贮藏条件、包装方式的选择提供理论依据,并为即食蒸制大黄鱼的工业化、标准化生产提供理论指导。
参考文献:
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023.
[2] 韩承义, 吴雄飞, 许斌福, 等. 2020年中国大黄鱼产业现状分析及发展建议[J]. 渔业研究, 2022, 44(4): 395-406. DOI:10.14012/j.cnki.fjsc.2022.04.011.
[3] 李旭君, 岳冬冬. 我国大黄鱼的出口贸易结构和国际竞争力[J]."海洋开发与管理, 2019, 36(4): 50-54. DOI:10.20016/j.cnki.hykfygl.2019.04.011.
[4] 陈金玉, 杨盈悦, 黄家海, 等. 4 种来源大黄鱼营养成分的比较分析[J]. 食品安全质量检测学报, 2022, 13(21): 7020-7027. DOI:10.19812/j.cnki.jfsq11-5956/ts.2022.21.048.
[5] DASZKIEWICZ T, KUBIAK D, SMIECINSKA K. Changes of meat quality from roe deer by different packing methods[J]. Fleischwirtschaft, 2020, 100(1): 87-93.
[6] 涂钰. 包装材料对冻藏鱼类及生物防腐剂对调理鱼类冷藏期间品质影响[D]. 大连: 大连工业大学, 2017.
[7] 袁赖红. 微冻条件下大黄鱼气调包装保鲜工艺及菌相研究[D]."福州: 福建农林大学, 2021. DOI:10.27018/d.cnki.gfjnu.2017.000067.
[8] 王真真, 董士远, 刘尊英, 等. 冰温下包装方式对大黄鱼的保鲜效果研究[J]. 水产科学, 2009, 28(8): 431-434. DOI:10.16378/j.cnki.1003-1111.2009.08.016.
[9] 国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016: 12.
[10] 胡锦鹏. 乳酸菌发酵半干大黄鱼制备及其品质研究[D]. 福州: 福建农林大学, 2022.
[11] 刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法: “ROAV”法[J]. 食品科学, 2008, 29(7): 370-374. DOI:10.3321/j.issn:1002-6630.2008.07.082.
[12] 国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2022[S]. 北京: 中国标准出版社, 2022: 12.
[13] KAALE L D, EIKEVIK T M. The influence of superchilling storage methods on the location/distribution of ice crystals during storage of Atlantic salmon (Salmo salar)[J]. Food Control, 2015, 52: 19-26. DOI:10.1016/j.foodcont.2014.12.022.
[14] KAALE L D, EIKEVIK T M, RUSTAD T, et al. Changes in water holding capacity and drip loss of Atlantic salmon (Salmo salar) muscle during superchilled storage[J]. LWT-Food Science and Technology, 2014, 55(2): 528-535. DOI:10.1016/j.lwt.2013.10.021.
[15] 刘欣荣. 不同贮藏方式对红鳍东方鲀品质的影响研究[D]. 保定: 河北农业大学, 2020. DOI:10.27109/d.cnki.ghbnu.2020.000086.
[16] 雷志方, 谢晶, 李彦妮, 等. 不同包装方式对金枪鱼保鲜效果的分析比较[J]. 现代食品科技, 2016, 32(8): 233-239. DOI:10.13982/j.mfst.1673-9078.2016.8.035.
[17] LI X F, XIONG Q, ZHOU H, et al. Analysis of microbial diversity and dynamics during bacon storage inoculated with potential spoilage bacteria by high-throughput sequencing[J]. Frontiers in Microbiology, 2021, 12: 713513. DOI:10.3389/fmicb.2021.713513.
[18] 国家卫生和计划生育委员会. 食品安全国家标准 动物性水产制品: GB 10136—2015[S]. 北京: 中国标准出版社, 2015: 8.
[19] KACHELE R, ZHANG M, GAO Z X, et al. Effect of vacuum packaging on the shelf-life of silver carp (Hypophthalmichthys molitrix) fillets stored at 4 ℃[J]. LWT-Food Science and Technology, 2017, 80: 163-168. DOI:10.1016/j.lwt.2017.02.012.
[20] MILNE D, POWELL S M. Limited microbial growth in Atlantic salmon packed in a modified atmosphere[J]. Food Control, 2014, 42: 29-33. DOI:10.1016/j.foodcont.2014.01.035.
[21] BASSEY A P, CHEN Y F, ZHU Z S, et al. Assessment of quality characteristics and bacterial community of modified atmosphere packaged chilled pork loins using 16S rRNA amplicon sequencing analysis[J]. Food Research International, 2021, 145: 110412. DOI:10.1016/j.foodres.2021.110412.
[22] DUAN J Y, JIANG Y, CHERIAN G, et al. Effect of combined chitosan-krill oil coating and modified atmosphere packaging on the storability of cold-stored lingcod (Ophiodon elongates) fillets[J]. Food Chemistry, 2010, 122(4): 1035-1042. DOI:10.1016/j.foodchem.2010.03.065.
[23] 党美琪, 杨眉, 安玥琦, 等. 猪肉-鱼肉复合狮子头贮藏期间的品质变化规律[J]. 肉类研究, 2023, 37(2): 26-31. DOI:10.7506/rlyj1001-8123-20221109-147.
[24] 胡梦青. 山黑猪烤肉加工及贮藏特性研究[D]. 长春: 吉林大学, 2022. DOI:10.27162/d.cnki.gjlin.2022.002347.
[25] ERKAN N, ÖZDEN Ö, INUĞUR M. The effects of modified atmosphere and vacuum packaging on quality of chub mackerel[J]. International Journal of Food Science and Technology, 2007, 42(11): 1297-1304. DOI:10.1111/j.1365-2621.2006.01325.x.
[26] ERKAN N. The effect of thyme and garlic oil on the preservation of vacuum-packaged hot smoked rainbow trout (Oncorhynchus mykiss)[J]. Food and Bioprocess Technology, 2012, 5(4): 1246-1254. DOI:10.1007/s11947-010-0412-7.
[27] FENG L F, JIANG T J, WANG Y B, et al. Effects of tea polyphenol coating combined with ozone water washing on the storage quality of black sea bream (Sparus macrocephalus)[J]. Food Chemistry, 2012, 135(4): 2915-2921. DOI:10.1016/j.foodchem.2012.07.078.
[28] 顾赛麒, 邹琳, 周振毅, 等. 包装方式对日本鳀鱼干品质特性的影响[J]. 水产学报, 2021, 45(7): 1054-1065. DOI:10.11964/jfc.20210412811.
[29] 王建辉, 杨晶, 刘永乐, 等. 不同贮藏条件下草鱼肌肉挥发性成分的变化分析[J]. 现代食品科技, 2014, 30(9): 297-303. DOI:10.13982/j.mfst.1673-9078.2014.09.049.
[30] 张晶晶, 梁萍, 施文正, 等. 不同冷藏期鲳鱼及草鱼气味变化分析[J]. 食品科学, 2016, 37(20): 31-36. DOI:10.7506/spkx1002-6630-201620006.
[31] 谢恬, 王丹, 马明娟, 等. OAV和GC-O-MS法分析五香驴肉风味活性物质[J]. 食品科学, 2018, 39(8): 123-128. DOI:10.7506/spkx1002-6630-201808020.
[32] EDIRISINGHE R K B, GRAFFHAM A J, TAYLOR S J. Characterisation of the volatiles of yellowfin tuna (Thunnus albacares) during storage by solid phase microextraction and GC-MS and their relationship to fish quality parameters[J]. International Journal of Food Science and Technology, 2010, 42(10): 1139-1147. DOI:10.1111/j.1365-2621.2006.01224.x.
[33] ZHANG Q, DING Y C, GU S Q, et al. Identification of changes in volatile compounds in dry-cured fish during storage using HS-GC-IMS[J]. Food Research International, 2020, 137: 109339. DOI:10.1016/j.foodres.2020.109339.
[34] MARTIN D, JOLY C, DUPAS-FARRUGIA C, et al. Volatilome analysis and evolution in the headspace of packed refrigerated fish[J]. Foods, 2023, 12(14): 2657. DOI:10.3390/FOODS12142657.
[35] DUFLOS G, COIN V M, CORNU M, et al. Determination of volatile compounds to characterize fish spoilage using headspace/mass spectrometry and solid-phase microextraction/gas chromatography/mass spectrometry[J]. Journal of the Science of Food and Agriculture, 2010, 86(4): 600-611. DOI:10.1002/jsfa.2386.
[36] SYROPOULOU F, PARLAPANI F F, ANAGNOSTOPOULOS D A, et al."Spoilage investigation of chill stored meagre (Argyrosomus regius) using modern microbiological and analytical techniques[J]. Foods, 2021, 10(12): 3109. DOI:10.3390/foods10123109.
[37] 李苑. Sous-vide 带鱼制品制备及贮藏中品质变化分子机制研究[D]. 杭州: 浙江大学, 2020. DOI:10.27461/d.cnki.gzjdx.2020.004110.
[38] 徐宗季, 鞠兴荣, 袁建, 等. 生姜精油挥发性物质的主成分分析[J]. 粮食与食品工业, 2016, 23(4): 5-10. DOI:10.3969/j.issn.1672-5026.2016.04.002.
[39] 周露, 谢文申, 江明. 2 种云南主要食用姜的挥发性成分研究[J]."安徽农业科学, 2016, 44(24): 95-146. DOI:10.13989/j.cnki.0517-6611.2016.24.032.
[40] ALASALVAR C, TAYLOR K D A, SHAHIDI F. Comparison of volatiles of cultured and wild sea bream (Sparus aurata) during storage in ice by dynamic headspace analysis/gas chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2616-2622. DOI:10.1021/jf0483826.
[41] WANG H, QIN X J, LI X, et al. Changes in the microbial communities of air- and water- chilled yellow-feathered broilers during storage at 2 ℃[J]. Food Microbiology, 2020, 87: 103390. DOI:10.1016/j.fm.2019.103390.
[42] LI X F, LI C, YE H, et al. Changes in the microbial communities in vacuum-packaged smoked bacon during storage[J]. Food Microbiology, 2018, 77: 26-37. DOI:10.1016/j.fm.2018.08.007.
[43] CAI L, WU X, LI X, et al. Effects of different freezing treatments on physicochemical responses and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) fillets during refrigerated storage[J]. LWT-Food Science and Technology, 2014, 59(1): 122-129. DOI:10.1016/j.lwt.2014.04.062.
[44] 郭全友, 许钟, 杨宪时. 冷藏养殖大黄鱼品质变化特征及细菌相分析[J]. 上海水产大学学报, 2006(2): 216-221. DOI:10.3969/j.issn.1004-7271.2006.02.018
[45] 张雯. 冰鲜大黄鱼腐败菌的分析与生物保鲜剂的开发[D]. 福州:"福州大学, 2014.
[46] 张楠楠. 复合生物保鲜剂结合真空包装对冰鲜大黄鱼品质及腐败菌作用机制的影响[D]. 上海: 上海海洋大学, 2019. DOI:10.27314/d.cnki.gsscu.2019.000515.
[47] ZHANG Q, CHEN X C, DING Y T, et al. Diversity and succession of the microbial community and its correlation with lipid oxidation in dry-cured black carp (Mylopharyngodon piceus) during storage[J]. Food Microbiology, 2020, 98: 103686. DOI:10.1016/j.fm.2020.103686.
[48] ANAGNOSTOPOULOS D A, PARLAPANI F F, MALLOUCHOS A, et al. Volatile organic compounds and 16S metabarcoding in ice-stored red seabream Pagrus major[J]. Foods, 2022, 11(5): 666. DOI:10.3390/foods11050666.
[49] BROEKAERT K, NOSEDA B, HEYNDRICKX M, et al. Volatile compounds associated with Psychrobacter spp. and Pseudoalteromonas spp., the dominant microbiota of brown shrimp (Crangon crangon) during aerobic storage[J]. International Journal of Food Microbiology, 2013, 166(3): 487-493. DOI:10.1016/j.ijfoodmicro.2013.08.013.
[50] LI N, ZHANG Y X, WU Q P, et al. High-throughput sequencing analysis of bacterial community composition and quality characteristics in refrigerated pork during storage[J]. Food Microbiology, 2019, 83: 86-94. DOI:10.1016/j.fm.2019.04.013.
[51] BYUN B Y, BAI X, MAH J H. Bacterial contribution to histamine and other biogenic amine content in juk (Korean traditional congee) cooked with seafood[J]. Food Science and Biotechnology, 2013, 22(6): 1675-1681. DOI:10.1007/s10068-013-0266-7.
[52] 郎冠芬. 黄尾参鱼片的充气保鲜包装[J]. 食品研究与开发, 1991(3): 39-42.
[53] LAYCOCK R A, REGIER L W. Pseudomonads and achromobacters in the spoilage of irradiated haddock of different preirradiation quality[J]. Applied Microbiology, 1970, 20(3): 333-341. DOI:10.1128/AM.20.3.333-341.1970.
