库尔勒香梨开花前后花药细菌多样性分析
2024-12-31王庆朋闫成才王喆苟长青王兰冯宏祖郝海婷


摘 要:【目的】研究库尔勒香梨花药细菌的多样性,分析库尔勒香梨开花前后花药细菌变化,为新疆南疆梨树常见病害的防治提供菌种资源。
【方法】采用平板涂布法分离和纯化香梨开花前后花药细菌,分析细菌多样性,并借助16S rDNA基因序列分析技术对其进行分子鉴定,确定其分类地位。
【结果】香梨开花前后花药所携带的细菌种类具有多样性。对开花前后花药分离的菌株分别随机挑选9株和7株进行分子鉴定,筛选的9株开花前花药细菌全部归属于芽孢杆菌属,其中包括枯草芽孢杆菌、解淀粉芽孢杆菌和贝莱斯芽孢杆菌。筛选的7株开花后花药细菌除了有芽孢杆菌属细菌,也包括鞘氨醇杆菌属细菌,开花后花药细菌多样性大于开花前。
【结论】开花前花药所携带的细菌其中有5株为枯草芽孢杆菌,2株为解淀粉芽孢杆菌,2株为贝莱斯芽孢杆菌。开花后花药所携带的细菌其中有3株为枯草芽孢杆菌,2株为解淀粉芽孢杆菌,1株为副炭疽芽孢杆菌,1株为多食鞘氨醇杆菌。
关键词:库尔勒香梨花药;细菌;多样性
中图分类号:S661.2 ""文献标志码:A ""文章编号:1001-4330(2024)08-1976-07
收稿日期(Received):2024-01-25
基金项目:新疆生产建设兵团财政科技计划项目-南疆重点产业创新发展支撑计划(2020DB006)
作者简介:王庆朋(1998-),男,新疆人,硕士研究生,研究方向为植物病理学,(E-mail)184879943@qq.com
通讯作者:郝海婷(1986-),女,陕西人,副教授,博士,硕士生导师,研究方向为植物与微生物互作,(E-mail)Haohaiting213@taru.edu.cn
0 引 言
【研究意义】库尔勒香梨( 简称香梨)是蔷薇科梨属植物,其叶子卵形,花朵白色[1]。库尔勒香梨是新疆独有的梨类品种。苹果枝枯病是新疆在香梨上普遍发生较严重的植物病害,主要危害花、叶、嫩枝及果实、树枝和树干。该病害是一种细菌性病害,可通过花期蜜腺侵染。细菌植物病害防病机制主要包括竞争、抗生作用,以及诱导植物抗性等多种方式。【前人研究进展】孙旺旺等[3]发现贝莱斯芽胞杆菌BPC6对软腐病菌的生长均具有抑制效果。Rashid等[4]发现接种枯草芽孢杆菌48 h对马铃薯软腐病具有一定的抑制作用。李磊等[5]从芹菜根际土壤分离筛选得到一株解淀粉芽胞杆菌ZF75对芹菜软腐病具有良好防治效果。【本研究切入点】有关库尔勒香梨开花前后花药细菌多样性的研究较少,需采用平板涂布法分离和纯化香梨开花前后花药细菌,分析细菌多样性,确定其分类地位。【拟解决的关键问题】设计不同时间、地点,分批次取下香梨花苞、花朵,采用平板涂布法对香梨花药细菌进行分离、纯化,通过分子扩增测序手段初步鉴定其分类地位。通过细菌多样性的鉴定,分析香梨开花前、后花药携带细菌多样性。
1 材料与方法
1.1 材 料
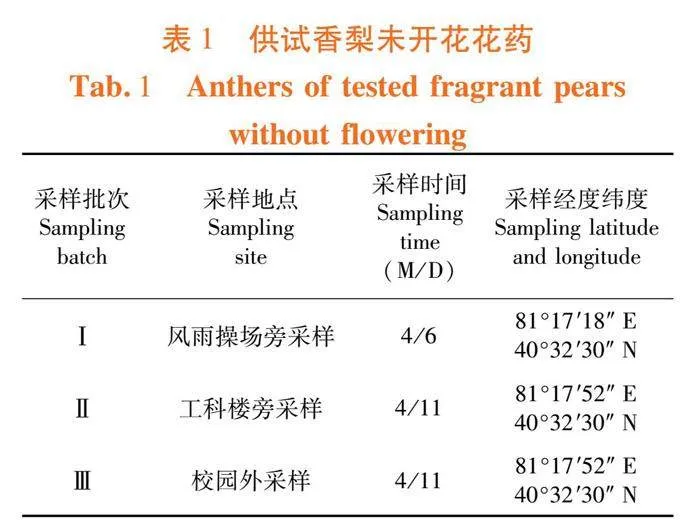
1.1.1 香梨花药
选用塔里木大学校内外梨园,2021年于香梨开花前共采集3批,开花后共采集5批。表1、表2
1.1.2 培养基
LB培养基(g/L):胰蛋白胨10 g/1 000 mL,酵母提取物5 g/1 000 mL,琼脂粉15 g/1 000 mL,氯化钠10 g/1 000 mL,水1 000 mL。
1.1.3 主要试剂和仪器
试剂:甘油、Taq Master Mix、ddH2O;16S rDNA细菌基因通用引物 27F/1492R;琼脂糖等,购于上海生工生物工程股份有限公司。
仪器:2×TSINGKE Mater Mix恒温培养振荡器;BXM-75VE立式压力蒸汽灭菌器;SPX型智能生化培养箱;PCR仪;电泳仪和凝胶成像分析仪等。
1.2 方 法
1.2.1 花药细菌的分离、保存
用牙签将新鲜香梨开花前的花药和开花后的花药挑下分别置于离心管中。采用平板涂布法分离细菌。称取0.10 g开花前花药、开花后花药放入灭菌后的超净工作台后,分别倒入灭菌后的离心管中,用无菌水冲洗1次,倒掉无菌水。加入酒精30s,倒去酒精使用无菌水冲洗2~3次,接着用灭菌的塑料研磨棒研磨。最后用移液枪向离心管中分别加入5 mL无菌水震荡摇匀,放置于试管架静置10 min,待离心管中液体澄清后,吸取上清液60 μL滴在LB培养基表面,用75%酒精浸泡后再经过酒精灯灼烧灭菌的玻璃涂布棒进行平板涂布,涂布均匀。
将涂布好的培养基置于27℃培养箱中培养,12 h观察一次,当菌落长出时,用平板划线法分离纯化,在LB培养基中培养并编号,得到纯化菌落。
用灭菌枪头挑取单菌落接种于液体LB培养基中,放入恒温振荡培养箱中,设定温度为30℃培养时间为12 h,培养好的发酵液与灭菌后的50%甘油1∶1混合各800 μL加入无菌微量离心管中,先置于-20℃冰箱5 h,之后置于-60℃冰箱保存。
1.2.2 花药携带细菌的分子鉴定
(1) 花药携带细菌基因组DNA的提取:挑取菌落,与5 μL无菌水混合,取1 μL作为DNA模板。
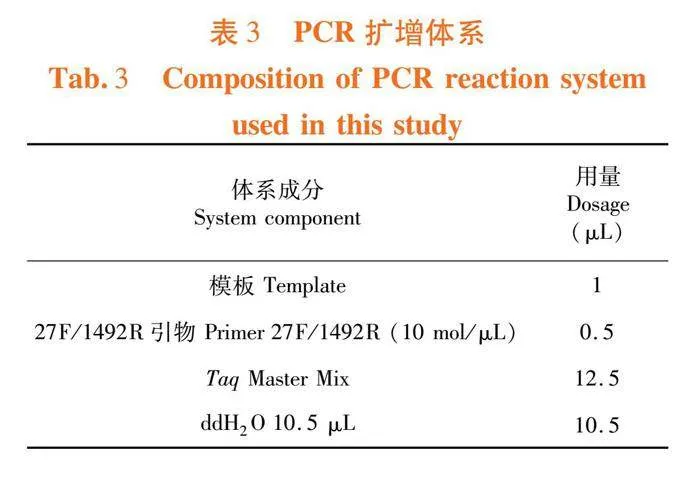
(2)以细菌基因组DNA为模板,利用细菌16S rDNA基因通用引物 27F/1492R 扩增目的片段,正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物1492R:5′-ACGGCTACCTTGTTACGACTT-3′。PCR采用25 μL 反应体系含。表3
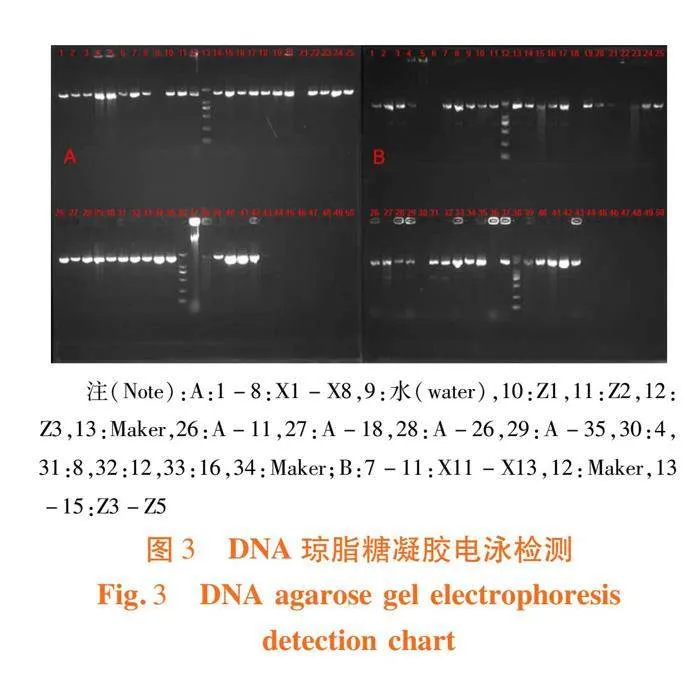
PCR反应条件:在94℃预变性3 min的基础上,将PCR反应进行30次94℃变性、51℃退火和72℃复性1 min的循环,最终在72℃延伸10 min,并使用1%琼脂糖凝胶电泳对PCR产物进行检测,确认符合要求后,将由生工生物工程(上海)股份有限公司测序。
1.3 数据处理
通过PCR技术,在NCBI网站上使用BLAST和GenBank数据库中的相似序列确定同源关系[6]。运用BioEdit,MEGA7邻接法(Neighbour-Joining,NJ)等软件对数据进行处理和分析。
2 结果与分析
2.1 香梨花药携带细菌分离情况
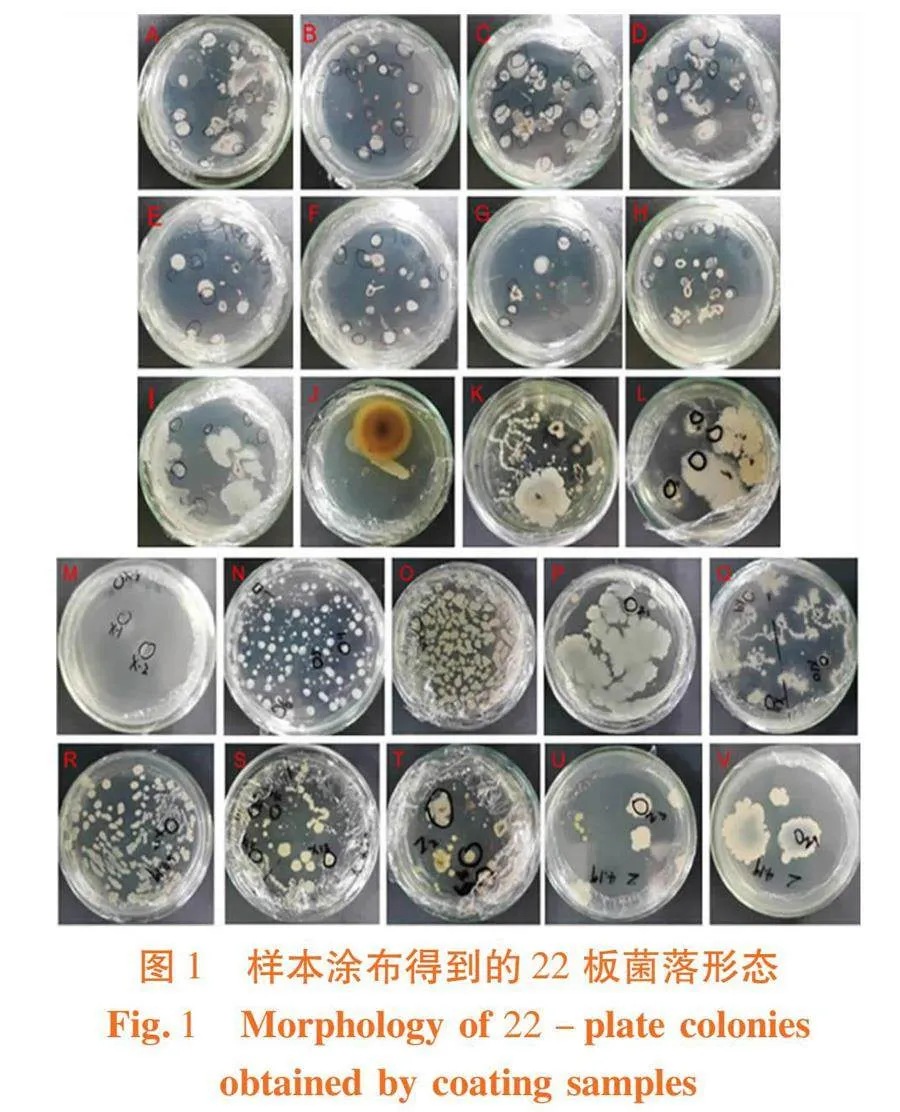
研究表明,香梨开花前后花药所携带的细菌大小、颜色、形状等各不相同。挑选出形态特点不同的菌株进行纯化。菌株的分类是基于培养基中形成的菌落的形状特点和边缘形状、菌落的粘稠度、菌落的厚度以及菌落的颜色和透明度。共分离获得80株细菌,花苞花药分离获得59株菌,花朵花药分离获得21株菌。多数菌落形态呈圆形,乳白色,表面光滑,有锯齿状边缘。图1、图2,表4
2.2 香梨花药细菌的分子鉴定
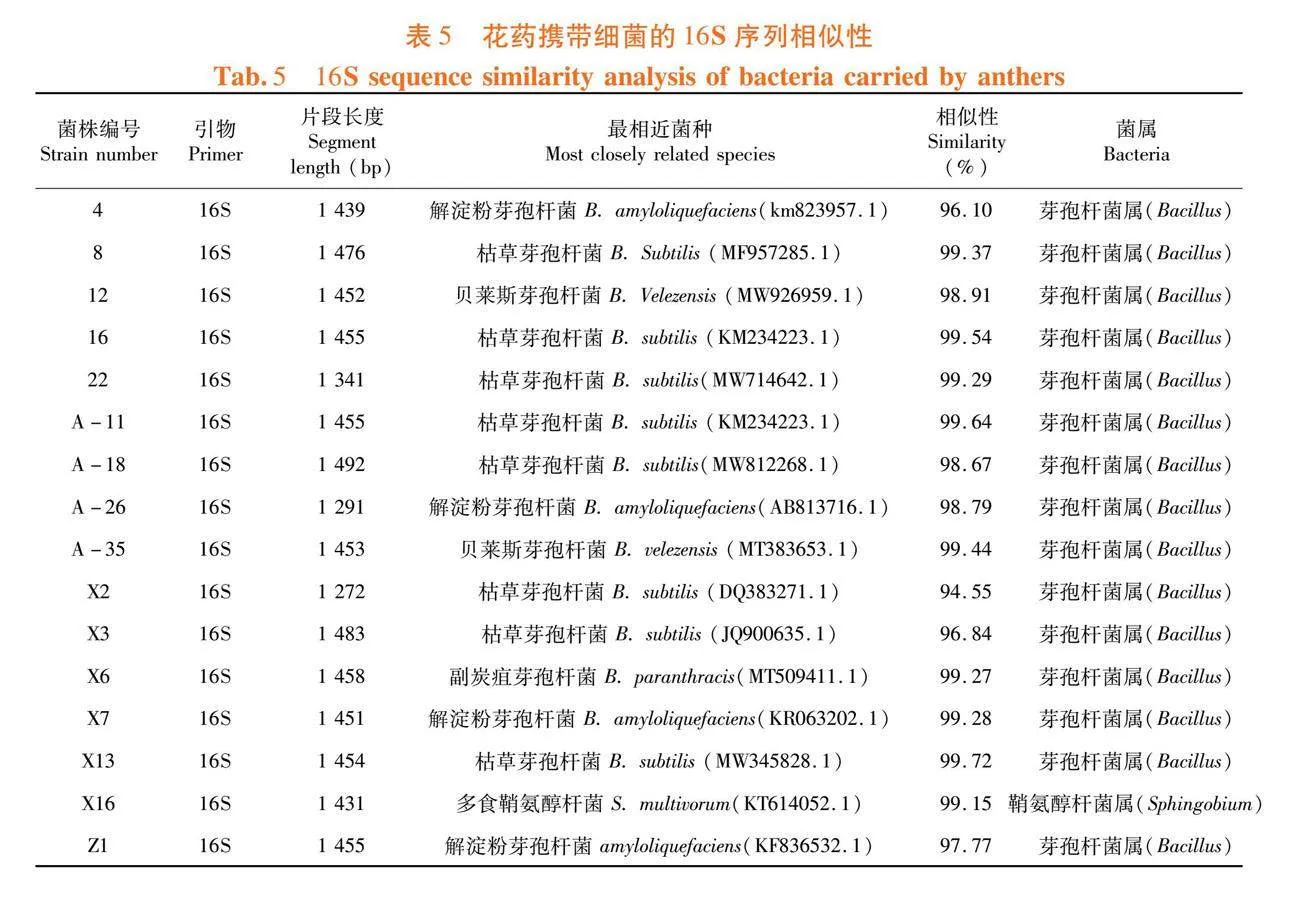
研究表明,从分离获得80株细菌中筛选16株进行分子鉴定,开花前花药分离获得59株,其中进行鉴定的有9株,其中有9株属于芽孢杆菌属,编号为4、8、12、16、22、A-11、A-18、A-26、A-35,4菌株16S序列和解淀粉芽孢杆菌Bacillus amyloliquefaciens 菌株16S序列同源性96.10%(登录号km823957.1),8菌株16S序列和枯草芽孢杆菌Bacillus subtilis序列同源性99.37%(登录号MF957285.1),12菌株16S序列和贝莱斯芽孢杆菌Bacillus velezensis 16S序列同源性98.91%(登录号MW926959.1),16菌株16S序列和枯草芽孢杆菌Bacillus subtilis 16S序列同源性99.54%(登录KM234223.1),22菌株16S序列和枯草芽孢杆菌Bacillus subtilis 16S序列同源性99.29%(登录号MW714642 .1),A-11菌株16S序列和枯草芽孢杆菌Bacillus subtilis 16S序列同源性99.64%(登录号KM234223.1),A-18菌株16S序列和杆菌 (在细菌中)菌株 Bacillus subtilis 16S序列同源性98.67%(登录号MW812268.1),A-26菌株16S序列和解淀粉芽孢杆菌Bacillus amyloliquefaciens 菌株16S序列同源性98.79%(登录AB813716.1),A-35菌株16S序列和贝莱斯芽孢杆菌Bacillus velezensis 16S序列同源性99.44%(登录号MT383653.1)。
开花后花药分离获得21株菌,鉴定的有7株,其中有6株属于芽孢杆菌属,编号为X2、X3、X6、X7、X13、X16、Z1,X2菌株16S序列和枯草芽孢杆菌Bacillus subtilis 16S序列同源性94.55%(登录号DQ383271.1),X3菌株16S序列和枯草芽孢杆菌Bacillus subtilis 16S序列同源性96.84%(登录号JQ900635.1),X6菌株16S序列和副炭疽芽孢杆菌Bacillus paranthracis 16S序列同源性99.27%(登录号MT509411.1),X7菌株16S序列和解淀粉芽孢杆菌Bacillus amyloliquefaciens 菌株16S序列同源性99.28%(登录号KR063202.1),X13菌株16S序列和解淀粉芽孢杆菌Bacillus amyloliquefaciens 菌株16S序列同源性99.28%(登录号KR063202.1),X16菌株16S序列和枯草芽孢杆菌Bacillus subtilis 菌株16S序列同源性99.72%(登录号MW345828.1),Z1菌株16S序列和解淀粉芽孢杆菌Bacillus amyloliquefaciens 菌株16S序列同源性97.77%(登录号KF836532.1),其中有1株属于鞘氨醇杆菌属,X16菌株16S序列和多食鞘氨醇杆菌Sphingobacterium multivorum 菌株16S序列同源性99.15%(登录号KT614052.1)。图3,表5
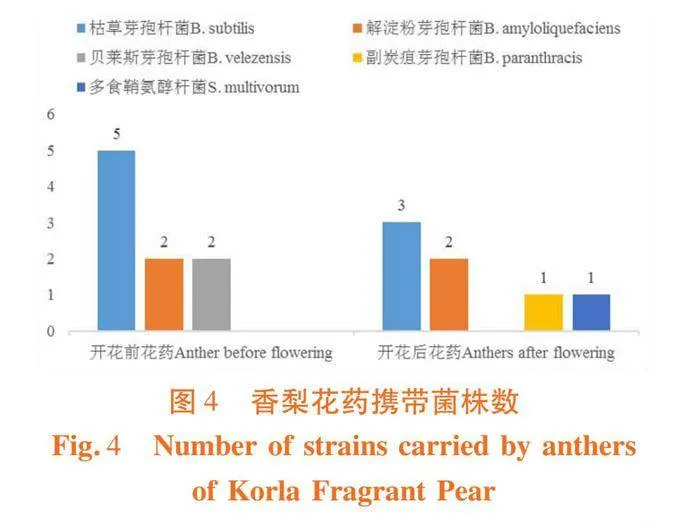
香梨开花前花药携带细菌主要为有益菌芽孢杆菌属(Bacillus),其中有枯草芽孢杆菌、解淀粉芽孢杆菌、贝莱斯芽孢杆菌等有益菌。香梨开花后花药除了有益菌芽孢杆菌属(Bacillus),还出现了其它属的细菌鞘氨醇杆菌属(Sphingobium),相对香梨开花前出现了2种新菌种副炭疽芽孢杆菌、多食鞘氨醇杆菌。图4
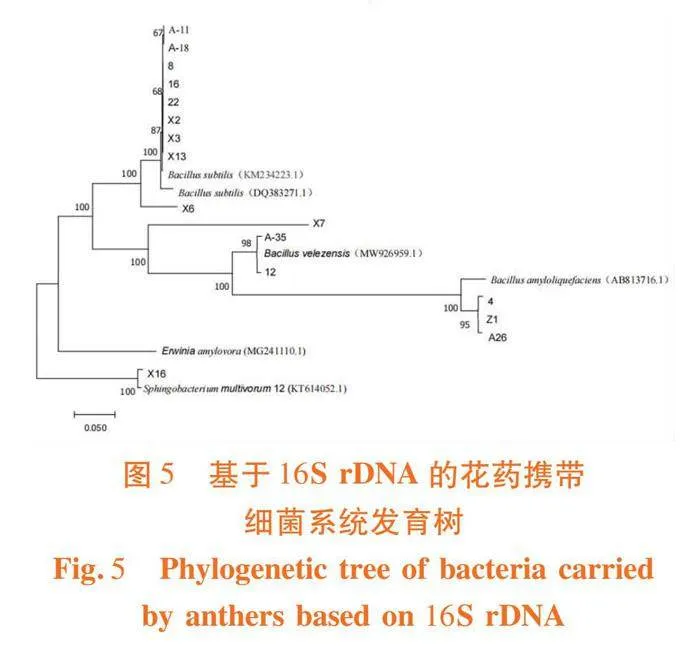
2.3 香梨花药携带细菌系统发育树的构建
研究表明,15株与芽孢杆菌属(Bacillus)亲缘关系接近,其中1株与鞘氨醇杆菌属(Sphingobium)亲缘关系接近。开花前后花药携带细菌属于2个属。图5
3 讨 论
3.1
枯草芽孢杆菌在梨花药携带的细菌中能够有效地抵抗各种病原菌,并广泛分布于土壤、湖泊、海洋以及动植物的体表[7]。枯草芽孢杆菌(B. subtilis)不仅仅是一种普通的益生菌,而且还可以应用于畜牧业。作为革兰氏阳性菌,其具备出色的氧化性和厌氧性,因此成为全球范围内应用最广泛的益生菌之一。此外,其孢子形态也受到关注[8]。
3.2
解淀粉芽孢杆菌在所占比例中位居第二。解淀粉芽孢杆菌(B. amyloliquefaciens)对植物土传病害具有抑制作用[9]。另外,枯草芽孢杆菌对小麦纹枯病菌[10]、黄瓜枯萎病致病菌[11]以及甜瓜霜霉病致病菌[12]均有抑制作用,而解淀粉芽孢杆菌对苹果叶枯病菌的抑制效果也显著[13]。
3.3
贝莱斯芽孢杆菌位居第三,贝莱斯芽孢杆菌(B. velezensis)功能包括产生植物激素、促进植物生长以及生成大量次级代谢产物[14]。
副炭疽芽孢杆菌(B. paranthracis)兼具烟碱降解和促植物生长的作用,多食鞘氨醇杆菌(S. multivorum )在活性去污方面有着卓越表现,能够有效降解水中的甾体雄激素,在环保领域具有重要作用[15]。此外,多食鞘氨醇杆菌还具备降解农药的能力[16-17],对农药残留修复也起到一定的作用[18]。
4 结 论
试验分离出了80株细菌,其中59株来自开花前花药,而21株来自开花后花药。这些细菌主要分属于芽孢杆菌属(Bacillus)和鞘氨醇杆菌属(Sphingobium)。开花前花药所携带的细菌其中有5株为枯草芽孢杆菌,2株为解淀粉芽孢杆菌,2株为贝莱斯芽孢杆菌。开花后花药所携带的细菌其中有3株为枯草芽孢杆菌,2株为解淀粉芽孢杆菌,1株为副炭疽芽孢杆菌,1株为多食鞘氨醇杆菌。其中,枯草芽孢杆菌具有抵抗病原菌的能力。
参考文献(References)
[1]陈出新. 梨品种资源的抗病性鉴定与抗病资源筛选[D]. 南京: 南京农业大学, 2016.
CHEN Chuxin. Identification of Germplasm Resources of Pear Cultivars and Screening of Resistant Resources[D]. Nanjing: Nanjing Agricultural University, 2016.
[2] 高启明, 侯江涛, 李疆. 库尔勒香梨生产现状与研究进展[J]. 中国农学通报, 2005, 21(2): 233-236.
GAO Qiming, HOU Jiangtao, LI Jiang. Progress on the research and production present situation of ‘Kuerle xiangli’[J]. Chinese Agricultural Science Bulletin, 2005, 21(2): 233-236.
[3] 孙旺旺, 闫丽, 陈昌龙, 等. 生菜软腐和菌核病拮抗菌贝莱斯芽胞杆菌BPC6鉴定与防效[J]. 中国生物防治学报, 2020, 36(2): 231-240.
SUN Wangwang, YAN Li, CHEN Changlong, et al. Identification and biocontrol effect of antagonistic bacterium Bacillus velezensis BPC6 against soft rot and Sclerotinia rot diseases on lettuce[J]. Chinese Journal of Biological Control, 2020, 36(2): 231-240.
[4] Rashid M, Chowdhury M, Sultana N. In-vitro screening of some chemicals and biocontrol agents against Erwinia carotovora subsp. carotovora, the causal agent of soft rot of potato (Solanum tuberosum)[J]. The Agriculturists, 2013, 11(2): 1-9.
[5] 李磊, 赵昱榕, 郑斐, 等. 芹菜软腐病拮抗芽胞杆菌筛选及防治效果[J]. 中国生物防治学报, 2020, 36(3): 388-395.
LI Lei, ZHAO Yurong, ZHENG Fei, et al. Screening and biocontrol of antagonistic Bacillus against celery soft rot[J]. Chinese Journal of Biological Control, 2020, 36(3): 388-395.
[6] 牟维豪, 耿毅, 欧阳萍, 等. 1株黑斑蛙源蛙病毒的分离鉴定及系统进化分析[J]. 华南农业大学学报, 2019, 40(2): 40-46.
MOU Weihao, GENG Yi, OUYANG Ping, et al. Isolation, identification and phylogenetic analysis of a ranavirus isolated from Rana nigromaculata[J]. Journal of South China Agricultural University, 2019, 40(2): 40-46.
[7] 夏飞, 张于, 旭热, 等. 生防菌哈茨木霉Trichoderma harzianum T4对西瓜根围土壤细菌群落的影响[J]. 中国生物防治学报, 2013, 29(2): 232-241.
XIA Fei, ZHANG Yu, XU Re, et al. Effect of Trichoderma harzianum T4 on bacterial community in Watermelon(Citrullus lanatus) rhizosphere soil[J]. Chinese Journal of Biological Control, 2013, 29(2): 232-241.
[8] 王宏浩, 赵素娟, 石虎, 等. 枯草芽孢杆菌的益生特性及其在动物生产中的应用[J]. 北方牧业, 2021,(16): 24-25.
WANG Honghao, ZHAO Sujuan, SHI Hu, et al. Probiotic characteristics of Bacillus subtilis and its application in animal production[J]. Northern Pastoral, 2021,(16): 24-25.
[9] 陆景倩, 郎剑锋, 杨秋侠, 等. 解淀粉芽孢杆菌对植物土传病害的作用机制[J]. 湖北农业科学, 2021, 60(12): 5-10.
LU Jingqian, LANG Jianfeng, YANG Qiuxia, et al. Mechanism of Bacillus amyloliquefaciens on plant soil-borne disease[J]. Hubei Agricultural Sciences, 2021, 60(12): 5-10.
[10] 张凯. 枯草芽孢杆菌Bs-208制剂保护剂研究[D]. 武汉: 华中农业大学, 2007.
ZHANG Kai. Studies on Protectants for Preparation and Formulation of Bacillus Subtilis Bs-208[D]. Wuhan: Huazhong Agricultural University, 2007.
[11] 李晶, 杨谦, 赵丽华, 等. 生防枯草芽孢杆菌B29菌株抗菌物质的初步研究[J]. 中国生物工程杂志, 2008, 28(2): 59-65.
LI Jing, YANG Qian, ZHAO Lihua, et al. Antifungal substance from biocontrol Bacillus subtilis B29 strain[J]. China Biotechnology, 2008, 28(2): 59-65.
[12] 贾凤安, 陈亮, 陈立, 等. 大棚甜瓜三种主要真菌病害拮抗细菌的筛选与鉴定[J]. 植物保护学报, 2010, 37(6): 505-510.
JIA Feng’an, CHEN Liang, CHEN Li, et al. Isolation and characterization of antagonistic bacteria against three major fungal pathogens of greenhouse melon[J]. Journal of Plant Protection, 2010, 37(6): 505-510.
[13] 朱娜, 张树武, 徐秉良, 等. 解淀粉芽胞杆菌TS-1203对苹果炭疽叶枯病菌的抗生作用[J]. 植物保护, 2021, 47(4): 46-51, 58.
ZHU Na, ZHANG Shuwu, XU Bingliang, et al. Inhibitory effects of Bacillus amyloliquefaciens TS-1203 on Glomerella Cingulata[J]. Plant Protection, 2021, 47(4): 46-51, 58.
[14] 陈龙, 吴兴利, 闫晓刚, 等. 贝莱斯芽孢杆菌的分类、次级代谢产物及应用[J]. 家畜生态学报, 2020, 41(1): 1-8.
CHEN Long, WU Xingli, YAN Xiaogang, et al. The classification, secondary metabolites and application of Bacillus velezensis[J]. Journal of Domestic Animal Ecology, 2020, 41(1): 1-8.
[15] Shore L S, Shemesh M. Naturally produced steroid hormones and their release into the environment[J]. Pure and Applied Chemistry, 2003, 75(11/12): 1859-1871.
[16] Abraham J, Silambarasan S. Biodegradation of chlorpyrifos and its hydrolyzing metabolite 3, 5, 6-trichloro-2-pyridinol by Sphingobacterium sp. JAS3[J]. Process Biochemistry, 2013, 48(10): 1559-1564.
[17] Cai Z Q, Zhang W J, Li S S, et al. Microbial degradation mechanism and pathway of the novel insecticide paichongding by a newly isolated Sphingobacterium sp. P1-3 from soil[J]. Journal of Agricultural and Food Chemistry, 2015, 63(15): 3823-3829.
[18] 安小康. 多食鞘氨醇杆菌和粘着剑菌对己唑醇的降解研究[D]. 北京: 中国农业科学院, 2019.
AN Xiaokang. The Degradation of Hexaconazole by Sphingobacterium Multivorum and Ensifer Adhaerens[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019.
Anther bacterial diversity of Korla Fragrant Pear before
and after flowering
WANG Qingpeng, YAN Chengcai, WANG Zhe, GOU Changqing, WANG Lan,
FENG Hongzu, HAO Haiting
(Key Laboratory of Integrated Pest Management (IPM) of Xinjiang Production and Construction Corps in Southern Xinjiang / Aral Crop Pest Science Observation and Experiment Station of the Ministry of Agriculture and Rural Affairs /College of Agronomy, Tarim University," Aral Xinjiang 843300, China)
Abstract:【Objective】 The study investigated the bacterial presence in the anthers of Korla Fragrant pear blossoms, analyzing the changes in bacterial populations before and after flowering, to provide microbial resources for the prevention and control of common diseases in Fragrant pear trees in southern Xinjiang.
【Methods】 The flat-plate coating method was employed to isolate and purify the bacteria from the anthers of Fragrant pear blossoms before and after flowering. The bacterial diversity was analyzed, and molecular identification was conducted using 16S rDNA gene sequencing to determine their taxonomic status.
【Results】 The bacterial species carried by the anthers of korla Fragrant pear blossoms before and after flowering exhibited diversity. Nine strains were randomly selected for molecular identification from the bacteria isolated from the anthers before flowering, all of which were categorized under the Bacillus genus, including Bacillus subtilis, Bacillus amyloliquefaciens, and Bacillus velezensis. Additionally, seven strains were randomly selected from the bacteria isolated after flowering; these included not only Bacillus genus but also bacteria from the Sphingobium genus, indicating greater diversity in the bacteria after flowering compared to before.
【Conclusion】 Among the bacteria carried by the anthers before flowering, five strains were identified as Bacillus subtilis, two as Bacillus amyloliquefaciens, and two as Bacillus velezensis. After flowering, the bacteria included three strains of Bacillus subtilis, two strains of Bacillus amyloliquefaciens, one strain of Bacillus paranthracis, and one strain of Sphingobacterium multivorum.
Key words:Korla Fragrant pear anther; Bacteria; Diversity
Fund projects:The Fiscal Science and Technology Program Project of Xinjiang Production and Construction Corps (2020DB006)
Correspondence author:HAO Haiting(1986-), female, from Shaanxi,Ph.D., associate professor, research direction:plant microbial interaction, (E-mail)Haohaiting213@taru.edu.cn
