突触后支架蛋白Preso 在颅脑冲击伤诱导创伤后应激障碍中的作用机制
2024-12-13曹紫萱张卓媛刘丹李田晶廖丹张敏葛俊苗罗鹏李新









摘要: 将36 只雄性C57 小鼠随机分为对照组( Sham 组) 、3.5 MPa 颅脑冲击伤( blast-related traumatic brain injury,bTBI)组、4.5 MPa bTBI 组、5.5 MPa bTBI 组、4.5 MPa bTBI+生理盐水组(bTBI+SA 组)、4.5 MPa bTBI+小分子多肽组(bTBI+TAT-FERM 组) ,每组6 只;将12 只 Preso -/-小鼠随机分为Sham 组和 4.5 MPa bTBI 组,每组6 只。对小鼠进行bTBI 造模,完成后常规饲养2 周,4.5 MPa bTBI+生理盐水组和4.5 MPa bTBI+TAT-FERM 组在bTBI 造模后每天通过尾静脉给药1 次,连续给药5 d。与对照组相比, 3.5 MPa bTBI 组小鼠焦虑抑郁行为改变不显著; 4.5 MPa bTBI 和5.5 MPa bTBI 组小鼠出现创伤后应激障碍( posttraumatic stress disorder, PTSD)样症状。与对照组相比, 4.5 MPa bTBI 组Preso/mGluR1 复合体形成增加,使用TAT-FERM 可阻断Preso 与mGluR1 的相互作用,可在不改变Preso/mGluR1 复合体组成分子蛋白表达的情况下抑制Preso/mGluR1 复合体形成,并且改善bTBI 所导致的PTSD 症状。bTBI 促进Preso/mGluR1 复合体形成是bTBI 诱致PTSD 症状的重要分子病理机制,通过阻断Preso 与mGluR1 相互作用可减轻bTBI 对PTSD 的影响,进而为治疗bTBI 相关的PTSD 提供了潜在靶点。
关键词: 颅脑冲击伤;创伤后应激障碍;突触后支架蛋白;代谢性谷氨酸受体;小分子多肽
中图分类号: O383 国标学科代码: 13035 文献标志码: A
颅脑损伤(traumatic brain injury, TBI)是现代战争中最主要的创伤类型,其中炸药、炮弹等爆炸所产生的冲击波是引起颅脑损伤的重要原因[1]。美军有关退伍军人的流行病学调查研究显示,颅脑冲击伤(blast-related traumatic brain injury, bTBI)的发生率接近10%,且有15% 的 bTBI 伤员会在退伍后产生一系列创伤后的心理应激反应,以创伤后应激障碍(posttraumatic stress disorder, PTSD)最典型[2-3]。PTSD 是一种在重大创伤事件后出现的严重精神疾病,表现出对创伤记忆的过度反应、恐惧消退受损等临床特征,对家庭和社会造成极大的负担。目前,对于bTBI 与PTSD 之间产生相关性的具体机制仍不清楚,导致缺少有效的诊断标志物和药物治疗靶点。
大量的研究表明,TBI 导致的神经元兴奋性毒性损伤是引起继发性脑损害的重要机制之一,与突触后谷氨酸能受体功能异常密切相关[4]。Preso(也称Preso1)是近期发现的一种突触后支架蛋白分子,可通过其FERM 结构域与代谢性谷氨酸受体(metabotropic glutamate receptor, mGluR)形成突触后蛋白复合体,在神经元突触可塑性的调节过程中发挥重要作用[5]。进一步的研究发现,TBI 后Preso 促进mGluR1介导的神经元兴奋性毒性损伤,其具体机制与Preso/mGluR1 复合体的形成有关[6]。但是,Preso/mGluR1复合体在bTBI 诱导PTSD 样焦虑抑郁行为中的作用尚不明确。因此,本研究在构建小鼠bTBI 模型的基础上,探讨Preso/mGluR1 复合体在bTBI 相关PTSD 中的作用机制。
1 材料与方法
1.1 实验动物
本实验采用约8 周龄的雄性C57 小鼠和Preso 基因敲除(Preso-/-)小鼠,分别由空军军医大学实验动物中心和上海南方模式生物科技公司提供。小鼠饲养在20~25 ℃ 的环境中,明暗交替时间为12 h∶12 h,通风良好,自由进食与饮水。将36 只C57 小鼠适应性喂养1 周后,随机分为对照组(Sham 组)、3.5 MPabTBI 组、4.5 MPa bTBI 组、5.5 MPa bTBI 组、4.5 MPa bTBI+生理盐水组(bTBI+SA 组)和4.5 MPabTBI+小分子多肽组(bTBI+TAT-FERM 组),每组各6 只;将12 只Preso-/-小鼠适应性喂养1 周后,随机分为Sham 组和4.5 MPa bTBI 组,每组各6 只。所有动物实验均经空军军医大学动物伦理委员会批准,许可证号为20210419。
1.2 方法
1.2.1 冲击波模型的建立
本实验采用BST-Ⅰ型生物激波管(陆军军医大学大坪医院)模拟bTBI。每组6 只小鼠麻醉后放于生物激波管末端动物固定架上,距离激波管末端挡板10 cm 处,且均位于同一垂直平面上,右侧头部朝向冲击波来源方向,同时通过激波管爆炸冲击波(驱动段压力分别为3.5、4.5 或5.5 MPa)造成单次bTBI。
1.2.2 药物干预
实验所使用的小分子干扰多肽TAT-FERM 由南京金斯瑞公司合成,通过小鼠尾静脉注射的方式将TAT-FERM 以3 nmol/g(小鼠体重)/天10 μg/g 的剂量给药,4.5 MPa bTBI 造模后连续给药5 d。
1.2.3 旷场实验
每个旷场试验箱的尺寸为40 cm × 40 cm × 35 cm,测试前首先将旷场反应箱底部、放置物以及侧壁用75% 酒精清理消毒,防止之前小鼠所残留的气味、大小便等影响测试准确性;将小鼠从饲养笼里取出,背向实验者放在旷场的中央区域,拉上帘子后实验者迅速离开,任由小鼠在旷场反应箱中自由活动;测试结束后要用75% 酒精清理消毒整个旷场箱体,等待晾干后更换小鼠继续重复以上实验(在测试下一只小鼠前需将酒精完全挥发)。利用Smart 3.0 视频分析软件进一步分析小鼠在15 min 内在中心位置的次数和运动距离百分比。如果小鼠更倾向于在旷场试验箱中间运动,被认为是抗焦虑行为,反之则是焦虑行为。
1.2.4 高架十字迷宫实验
高架十字迷宫装置通常由两段开臂和两段闭臂构成,距离地面高度51 cm,各臂长66 cm,宽5 cm,闭臂臂高15 cm,测试前要用75% 酒精清理确保整个高架十字迷宫装置的清洁,尽可能创造一个干净、无味道的理想试验环境;将小鼠从饲养笼里取出,背向实验者将小鼠轻轻放在高架十字迷宫装置的中央区域,并使其面向开臂,拉上帘子后迅速安静的离开;实验结束后将其取出放回饲养笼,做好实验完成动物的标记信息,用75% 酒精和纸巾清洁迷宫,等待晾干后更换小鼠继续重复以上实验。用Smart 3.0 视频软件进一步分析,记录小鼠进入开臂的次数(open arm entry, OE, noe)和进入开臂的时间(arm openingtime, OT, tot),进入闭臂的次数(closed arm entry, CE, nce)和进入闭臂的时间(arm closing time, CT, tct),计算小鼠进入开臂次数的百分比γnoe =(noe/noe +nce)×100%以及进入开臂时间的百分比γtot =(tot/tot +tct)×100%。
1.2.5 免疫印记杂交(Western blot)
bTBI 造模后第17 d 每组取3 只小鼠进行免疫印记杂交实验。提取蛋白时,在新鲜的小鼠皮层脑组织样品中加入RIPA 裂解液并匀浆,离心后取上清,制备好的蛋白样品于−80 ℃ 保存。使用BCA 法测定蛋白样品浓度,在10% 的聚丙烯酰胺凝胶中电泳,转膜至PVDF 膜,5% 脱脂牛奶封闭2 h。一抗Preso(1∶1 000,Abclonal)、mGluR1(1∶800,Abcam)、β-actin(1∶1 000,Proteintech)于4 ℃ 孵育过夜,在常温下二抗孵育2 h,在发光仪(ChemiDoc Touch,Bio-Rad)对条带发光。
1.2.6 苏木精-伊红(Hamp;E) 染色
bTBI 造模后第17 d 每组取3 只小鼠进行Hamp;E 染色。将石蜡包埋好的脑组织切成10 μm 薄片,然后放入甲醇中脱脂2 min,再依次浸入95% 乙醇、70% 乙醇和蒸馏水中进行脱水处理,每次均为2 min。将脱水后的切片依次浸入hematoxylin 染料、蒸馏水、酸性洗涤剂和eosin 染料中10 min,再次脱水后进行透明化处理并封片。
1.2.7 统计学分析
实验数值以x±s 表示,利用GraphPad Prism 9.0 进行统计学分析与作图。多组间比较采用单因素方差分析(one-way ANOVA),若方差齐性,则用Turkey 检验法进行两组间比较,以P<0.05 表示数据具有统计学差异。
2 结 果
2.1 bTBI 可诱导小鼠PTSD 样焦虑抑郁行为
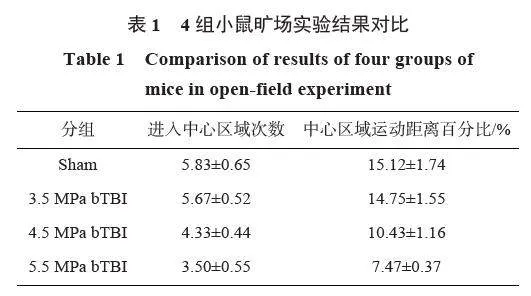
分别使用驱动段压力为3.5、4.5 和5.5 MPa 的爆炸冲击波建立小鼠bTBI 模型,波形曲线(图1)显示,小鼠头部实际受到的冲击波超压峰值分别为225、360 和410 kPa。在造模后第15 d 和第16 d 分别对各组小鼠进行旷场实验和高架十字迷宫实验的行为学检验。旷场实验结果显示(表1),与Sham 组相比,3.5 MPa bTBI 组进入中心区域次数和中心区域运动距离百分比无明显差异;4.5 和5.5 MPa bTBI 组进入中心区域次数和中心区域运动距离百分比均显著降低(P<0.05)。高架十字迷宫实验结果显示(表2),与Sham 组相比,bTBI 各组进入开臂次数百分比(γnoe)和进入开臂时间百分比(γnot)均显著降低(P<0.05)。在造模后第17 d Hamp;E 染色显示(图2),与Sham 组相比,3.5 MPa bTBI 组小鼠未见明显组织、细胞结构损伤;4.5 和5.5 MPa 组皮层组织出现部分细胞结构破坏。以上结果表明,bTBI 可诱导小鼠PTSD样焦虑抑郁行为。
2.2 Preso-/-动物bTBI 造模后未见明显焦虑抑郁样行为
Zhang 等[6] 前期已建立Preso-/-动物,实验表明Preso 基因敲除不影响健康成年小鼠的运动、焦虑和空间记忆。为了确定Preso 是否与bTBI 诱导的PTSD 样焦虑抑郁行为有关,选择驱动段压力为4.5 MPa的爆炸冲击波建立bTBI 模型,通过旷场实验和高架十字迷宫实验对Preso-/-小鼠进行行为学检验。旷场实验结果(表3)显示,与Sham 组相比,bTBI 组进入中心区域次数和中心区域运动距离百分比无明显差异。高架十字迷宫实验结果(表4)显示,与Sham 组相比,bTBI 组γnoe和γnot无明显差异。以上结果表明,Preso 可能是bTBI 诱导PTSD 样焦虑抑郁状态的关键因素。
2.3 Preso/mGluR1 复合体在bTBI 后的表达变化
bTBI 损伤后,对C57 小鼠脑组织进行Western blot 检测,结果显示bTBI 组中的Preso 和mGluR1 与Sham 组相比表达无显著性差异(图3(a))。进一步的免疫共沉淀结果显示bTBI 组中Preso 与mGluR1 之间的相互作用显著增多(P<0.05,图3(b))。以上结果提示,bTBI 并不影响Preso/mGluR1 复合体中相关分子的表达变化,而是会增加Preso 与mGluR1 之间的相互作用,进而促进Preso/mGluR1 复合体的形成。
2.4 TAT-FERM 可阻断bTBI 后Preso 与mGluR1 之间的相互作用
针对Preso 与mGluR1 之间的相互作用位点设计小分子干扰多肽TAT-FERM(GRKKRRQRRRPQKTLYNVEEE),阻断Preso 的FERM 结构与mGluR1 的结合。Western blot 结果显示,bTBI+TAT-FERM 组与bTBI+生理盐水(SA)组相比,Preso 和mGluR1 的表达未见明显改变(图4(a)),但Preso 与mGluR1 的相互作用显著减少(P<0.05,图4(b)),这表明TAT-FERM 有效阻断了Preso 与mGluR1 之间的结合。
2.5 TAT-FERM 减轻bTBI 对小鼠PTSD 样焦虑抑郁状态的影响
建立C57 小鼠bTBI 模型后连续5 d 给其尾静脉注射小分子多肽TAT-FERM 和生理盐水(SA),随后通过旷场实验和高架十字迷宫实验对其进行行为学检验。旷场实验结果(表5)显示,与SA 组相比,TAT-FERM 组进入中心区域次数无明显差异,但中心区域运动距离百分比显著升高(P<0.05)。高架十字迷宫实验结果(表6)显示,与SA 组相比,TAT-FERM 组的γnoe和γnot均显著升高(P<0.05)。以上结果表明,bTBI 造模能诱致小鼠PTSD 样焦虑抑郁状态。
3 讨 论
既往的研究发现,TBI 不但会引起急性神经系统损伤,其致伤效应还会不断累积,进而导致远期神经功能障碍,以认知障碍、情绪改变和创伤后应激等为典型症状[7]。bTBI 作为一种较特殊的TBI 类型,多见于经历战场环境的军事作业人员,主要以轻型颅脑损伤为主[8]。虽然这种冲击波引起的损伤效应并未导致明显的脑组织结构性损害,但通过对退伍军人的流行病学调查研究表明, bTBI 会显著提高PTSD 的发生率[9]。
本研究通过小鼠动物模型模拟了不同致伤强度冲击波的脑损伤效应,结果显示,3.5 MPa 冲击波所造成的脑损伤程度较轻,小鼠焦虑抑郁行为改变不显著;经历过4.5 和5.5 MPa bTBI 的实验动物PTSD 样改变更显著,且与之对应的脑组织HE 染色结果表明存在部分细胞结构破坏。然而,bTBI 诱致PTSD 的生物学机制仍需要进一步探讨。
谷氨酸受体介导的兴奋性毒性损伤是TBI 后继发性脑损害形成的重要机制,其中谷氨酸受体异常激活是其中关键的分子病理改变。mGluR1 是重要的谷氨酸受体亚型,在之前的研究中显示其异常激活在TBI 后可加重神经元损伤[10]。此外,mGluR1 相关抑制剂可以在精神和心理疾病的治疗中发挥潜在治疗作用[11]。但是,一系列临床研究表明,直接将mGluR1 作为干预靶点进行治疗,并未在TBI 后PTSD 患者中发挥预期的效果,同时还带来了许多副作用[12]。由此可见,深入探索mGluR1 在TBI 中的作用机理,对于寻找新的干预措施具有重要意义。
作为一种多结构域的突触后支架蛋白, Preso 含有1 个FERM 结构域、1 个WW 结构域和2 个PDZ 结构域,其中FERM 结构域可与mGluR1 之间发生相互作用[5, 13]。本研究进一步证实,bTBI 造模未引起Preso-/-动物明显的焦虑抑郁样行为,而bTBI 造模对C57 小鼠Preso 和mGluR1 的表达也无显著影响,但引起Preso 与mGluR1 之间的相互作用增强,从而促进Preso/mGluR1 复合体形成。Zhang 等[6] 的研究提示,调控Preso 与mGluR1 之间的相互作用能够阻断TBI 引起的急性神经元损伤。由此推测,bTBI 促进Preso/mGluR1 复合体形成极有可能是其诱致PTSD 症状的重要机制。
通过药理学手段干预复合体形成,是探索突触后蛋白复合体作用机制和发现干预靶点的重要方式。为了进一步明确Preso/mGluR1 复合体的作用,本研究针对Preso 与mGluR1 发生相互作用的FERM 结构域合成了小分子干扰多肽TAT-FERM。研究结果显示,TAT-FERM 可以阻断bTBI 后Preso 与mGluR1之间的相互作用,减少Preso/mGluR1 复合体形成。进一步的干预实验表明,TAT-FERM 可以显著改善bTBI 引起的PTSD 症状。这些结果不但证实了Preso/mGluR1 复合体在bTBI 相关PTSD 中的关键作用,同时也为开发潜在的药物治疗靶点提供了新的突破点。
4 结 论
颅脑冲击伤(bTBI)可通过促进突触后蛋白复合体Preso/mGluR1 形成,诱导bTBI 相关PTSD 样行为学改变,而小分子多肽TAT-FERM 阻断Preso/mGluR1 复合体形成可改善bTBI 诱导的PTSD 症状。
感谢陆军军医大学大坪医院张安强副教授团队和清华大学庄茁教授团队对实验的支持和帮助。
参考文献:
[1]LINDBERG M A, MOY MARTIN E M, MARION D W. Military traumatic brain injury: the history, impact, and future [J].Journal of Neurotrauma, 2022, 39(17/18): 1133–1145. DOI: 10.1089/neu.2022.0103.
[2]TROYANSKAYA M, PASTOREK N J, SCHEIBEL R S, et al. Combat exposure, PTSD symptoms, and cognition followingblast-related traumatic brain injury in OEF/OIF/OND service members and veterans [J]. Military Medicine, 2015, 180(3):285–289. DOI: 10.7205/MILMED-D-14-00256.
[3]KAPLAN G B, LEITE-MORRIS K A, WANG L, et al. Pathophysiological bases of comorbidity: traumatic brain injury andpost-traumatic stress disorder [J]. Journal of Neurotrauma, 2018, 35(2): 210–225. DOI: 10.1089/neu.2016.4953.
[4]JAMJOOM A A B, RHODES J, ANDREWS P J D, et al. The synapse in traumatic brain injury [J]. Brain, 2021, 144(1):18–31. DOI: 10.1093/brain/awaa321.
[5]HU J H, YANG L L, KAMMERMEIER P J, et al. Preso1 dynamically regulates group I metabotropic glutamate receptors [J].Nature Neuroscience, 2012, 15(6): 836–844. DOI: 10.1038/nn.3103.
[6]ZHANG Z Y, GAO X Y, TIAN Z C, et al. Preso enhances mGluR1-mediated excitotoxicity by modulating the phosphorylationof mGluR1-Homer1 complex and facilitating an ER stress after traumatic brain injury [J]. Cell Death Discovery, 2024,10(1): 153. DOI: 10.1038/s41420-024-01916-5.
[7]RACE N S, ANDREWS K D, LUNGWITZ E A, et al. Psychosocial impairment following mild blast-induced traumatic braininjury in rats [J]. Behavioural Brain Research, 2021, 412: 113405. DOI: 10.1016/j.bbr.2021.113405.
[8]KIM S Y, YEH P H, OLLINGER J M, et al. Military-related mild traumatic brain injury: clinical characteristics, advancedneuroimaging, and molecular mechanisms [J]. Translational Psychiatry, 2023, 13(1): 289. DOI: 10.1038/s41398-023-02569-1.
[9]LAI C, KOSTAS-POLSTON E A, ENGLER M B, et al. Prevalence of PTSD in active duty members with mild traumaticbrain injury: systematic review and meta-analysis [J]. Military Medicine, 2024, 189(7/8): e1454–e1461. DOI: 10.1093/milmed/usae272.
[10]CHEN T, ZHU J, WANG Y H, et al. Arc silence aggravates traumatic neuronal injury via mGluR1-mediated ER stress andnecroptosis [J]. Cell Death and Disease, 2020, 11(1): 4. DOI: 10.1038/s41419-019-2198-5.
[11]HENTER I D, PARK L T, ZARATE C A. Novel glutamatergic modulators for the treatment of mood disorders: current status [J].CNS Drugs, 2021, 35(5): 527–543. DOI: 10.1007/s40263-021-00816-x.
[12]BARACALDO-SANTAMARÍA D, ARIZA-SALAMANCA D F, CORRALES-HERNÁNDEZ M G, et al. Revisitingexcitotoxicity in traumatic brain injury: from bench to bedside [J]. Pharmaceutics, 2022, 14(1): 152. DOI: 10.3390/pharmaceutics14010152.
[13]LEE H W, CHOI J, SHIN H, et al. Preso, a novel PSD-95-interacting FERM and PDZ domain protein that regulates dendriticspine morphogenesis [J]. Journal of Neuroscience, 2008, 28(53): 14546–14556. DOI: 10.1523/JNEUROSCI.3112-08.2008.
(责任编辑 张凌云)
基金项目: 国家重点研发计划(2020-JCJQ-ZD-254-04);国家自然科学基金(82171321)
