基于自由场爆炸的小型猪内耳听觉损伤模型
2024-12-13薛松波向书毅赵杨杜智博王兴皓李羿沣张家瑞费舟田旭高志强庄茁柳占立冯国栋




摘要: 建立真实爆炸环境下的小型猪内耳听觉爆炸伤模型,研究不同爆炸冲击波压力对小型猪内耳听觉损伤的影响。选取14 头健康小型猪,在爆炸前进行听性脑干反应(auditory brainstem response, ABR)测试。搭建自由场爆炸实验平台,使用1.9 和8.0 kg TNT 炸药,爆源离地面1.8 m,身体固定于防护装置中,仅暴露头部。在不同距离布放小型猪,记录冲击波峰值压力,计算即刻死亡率。爆炸后再次进行ABR 测试,并取耳蜗组织进行扫描电镜观察,分析毛细胞损伤情况。在1.8~3.8 m 范围内,冲击波峰值压力从96.3 kPa 升至628.3 kPa,随着距离的增大,峰值压力减小。8 kg TNT爆炸在2.6 m 处(峰值压力628.3 kPa)导致小型猪即刻死亡率为50%。比较爆炸前后ABR 阈值发现,短声(click)和各频率短纯音(2、4 和8 kHz)诱发的ABR 阈值均显著升高(P<0.05),其中以4 kHz 阈值变化最显著。扫描电镜显示,随着冲击波压力的升高,内毛细胞的损伤程度高于外毛细胞。爆炸冲击波可引起小型猪听觉系统的明显损伤,表现为ABR 阈值升高和耳蜗毛细胞结构破坏。内毛细胞对爆炸冲击波更敏感。所建立的小型猪爆炸性听觉损伤模型可为研究爆炸伤机制和防护措施提供了重要的实验基础。
关键词: 爆炸伤;小型猪;内耳听觉功能;耳蜗损伤
中图分类号: O389 国标学科代码: 13035 文献标志码: A
随着现代军事科技的不断进步,爆炸性武器在战争中的广泛应用使得爆炸伤成为战争中最常见的伤害形式之一。据统计,爆炸性武器造成的伤害占战斗伤亡的50%~80%[1-2]。爆炸的特征是大气压瞬间升高,其能量的突然释放会产生一个大的压力锋或正超压,以超音速传播,也称为冲击波[3]。爆炸产生的冲击波对人体各个系统器官的影响广泛。听觉系统作为人体中最易受到爆炸冲击波影响的靶器官,常见的损伤包括鼓膜破裂、听骨链断裂、内耳损伤等,甚至可能导致永久性听力丧失[4-5]。通常认为,鼓膜对超压高度敏感,0.14~0.35 kg/cm2 的冲击波会造成鼓膜穿孔,4~7 kg/cm2 的冲击波会造成听骨链脱位或者断裂[6]。Niwa 等[7] 研究发现,冲击波可以直接导致外毛细胞静纤毛的损失。Cho 等[8] 进一步指出,高强度冲击波可能导致耳蜗基底膜的机械损伤。此外,谭君武等[9] 研究发现,爆炸可引起耳蜗微循环流速的改变,影响耳蜗内环境的稳定和毛细胞能量,引起毛细胞的损失。这些研究结果共同表明,爆炸对听觉系统的损伤是多因素、多层次的。
在爆炸伤防治研究中,直接的人类研究非常有限,动物模型成为重要的研究途径。现有的动物模型目前主要采用小鼠、大鼠、豚鼠和龙猫等啮齿动物研究听觉损伤[3, 10]。然而,这些小动物模型在模拟存在诸多局限性:小动物模型的耳蜗解剖结构与人类差异较大,不能准确反映爆炸对人类听觉系统的损伤;小动物模型无法承受较高的爆炸冲击波压力,无法模拟真实爆炸环境中产生的听觉损伤[11-12]。相比之下,猪作为一种大型哺乳动物,其耳蜗的形态、解剖结构与人类的高度相似,具有极高的实验应用价值。Dahlquist 等[13] 的研究表明,猪的耳蜗在出生时已基本发育成熟,并具备正常听力,其颞骨结构中的中耳、内耳、电生理等与人类的非常相似。此外,猪模型可以在更高强度的爆炸环境中生存,使其成为研究高强度爆炸对听觉系统影响的理想模型。
基于以上背景,设计并建立一个模拟自由场爆炸环境的小型猪爆炸致伤平台,旨在探讨不同爆炸冲击波压力对小型猪内耳听觉系统的损伤作用,进一步为爆炸伤的机制研究和防护措施开发提供实验依据。
1 实验方法
1.1 实验动物
本实验选用14 头健康小型猪,均为雄性,质量约15 kg。实验前一天送至实验场地,并禁食水12 h。小型猪在爆炸前后均接受听性脑干反应(auditory brainstem response, ABR)测试,以评估听觉功能的变化。实验获得动物实验伦理委员会批准,伦理编号为IACUC20241384。
1.2 小型猪麻醉
麻醉采用2% 戊巴比妥钠,质量为20 mg/kg,待小型猪角膜反射消失后,判定麻醉完成。在进行听力测试过程中保持深度麻醉,以避免对测试结果产生干扰。
1.3 小型猪听性脑干反应测试
在隔音室内进行ABR 测试。测试前用棉签清洁小型猪双侧外耳道,重复2~3 次。记录电极安置于小型猪双耳廓上缘连线中点与颅顶交界处,参考电极插入测试耳侧耳垂,地极置于鼻尖,测量电极之间阻抗小于3 kΩ。测试使用短声(click)及不同频率短纯音(1、2、4 和8 kHz)作为刺激声音,滤波宽度为300~3 000 Hz,刺激频率为11 s−1,扫描时程为10 ms,叠加次数为512 次,最大刺激声强度为90 dB,按20 dB递减,当出现无规律难以辨认的波形时,递增10 dB,将诱发出可重复规律波形的最低刺激强度记为ABR 阈值。通过测量其ABR 阈值的变化,评估爆炸对听觉功能的损害程度。
1.4 实验平台的设计与构建
本研究搭建了一个小型猪爆炸致伤平台,能够在自由场爆炸条件下实施爆炸实验。该平台由爆炸源、小型猪防护装置、测压系统等组成,确保实验环境能够模拟真实爆炸情景。爆炸源采用不同当量的TNT 炸药,分别为1.9 和8.0 kg,布置于离地面1.8 m 的位置,模拟高能爆炸冲击波的作用(图1(a)~(b))。动物布放位置均头朝向爆心,与爆源同高,动物均处于浅麻醉状态。在防护装置方面,采用焊制3 mm 厚的铁质框架将小型猪身体固定,并在缝隙处填充泡沫胶保证密封性,爆炸前后防护装置如图1(c)~(d) 所示,仅露出头部,确保冲击波作用集中在头部的听觉系统,同时保护其胸腹部位不受损伤。这一设计确保了听觉系统的重点损伤评估,减少其他因素干扰实验结果。在不同距离(1.8~3.8 m)处布放小型猪,高精度压力传感器分别测试在不同距离下的冲击波峰值压力及正压持续时间。高精度压力传感器(型号PCB137B22/PCB137B23)能够准确测量爆炸冲击波的压力峰值及其持续时间。爆炸后复测ABR 阈值,并统计即刻死亡率:爆炸后即刻记录每个布放距离下死亡和存活数量,计算每个布放距离即刻死亡率(死亡动物数/总动物数)。
1.5 手术取耳蜗步骤
测听后小型猪放置在解剖台上,麻醉状态下,以断颈放血的方式处死动物。沿颅顶正中线切开皮肤,线锯进行开颅,暴露双侧脑组织,去除脑组织及脑膜,可见双侧半头侧颅底区域不规则状骨块,底面积约1.0 cm×1.5 cm,使用弯头止血钳仔细撬出,迅速放入电镜固定液室温固定2 h,再转移至4 ℃ 保存。随后将固定好的样品经浓度为0.1M (0.1 mol/L) 的磷酸缓冲液PB (PH 值为7.4)漂洗3 次,每次15 min。0.1M 磷酸缓冲液PB (PH7.4)配制1% 锇酸室温避光固定1~2 h。0.1M 磷酸缓冲液PB(PH7.4)漂洗3 次,每次15 min。将组织依次放入30%、50%、70%、80%、90%、95%、100% 和100% 的酒精每次15 min,乙酸异戊酯15 min。将样本放入临界点干燥仪内进行干燥。样本紧贴于导电碳膜双面胶上放入离子溅射仪样品台上进行喷金30 s 左右,利用扫描电子显微镜观察采图。通过电镜观察耳蜗毛细胞的损伤情况,特别是外毛细胞和内毛细胞的损伤程度,并分析耳蜗基底膜的裂痕和细胞排列结构变化。
1.6 统计分析
采用SPSS 24.0 软件对实验数据进行统计分析,采用配对样本t 检验分析爆炸前后小型猪各频率的ABR 阈值变化。对比爆炸前后的听力阈值,分析不同的TNT 载荷和爆炸距离对小型猪听觉功能的影响。
2 实验结果
2.1 不同距离爆炸物理参数特征及趋势
在爆炸冲击波作用范围内1.8~3.8 m 处,实验测得峰值压力为96.3~628.3 kPa,冲击波持续时间为1.30~4.26 ms。实验数据表明,随着到爆心的距离增大,冲击波的峰值压力逐渐减小,同时正压持续时间有所延长,这一现象符合爆炸冲击波的衰减规律(表1)。
2.2 即刻死亡率统计
在第1 发爆炸实验中,所有小型猪均存活。在第2 发实验中,8.0 kg TNT 爆炸后,距离爆心2.6 m 处的峰值压力为628.3 kPa,导致1 头小型猪死亡,死亡率为50%。而距离爆心2.9 m 处的峰值压力为528.7 kPa,小型猪均存活。这提示峰值压力超过600 kPa 可能会导致小型猪死亡。
2.3 爆炸前后听性脑干反应
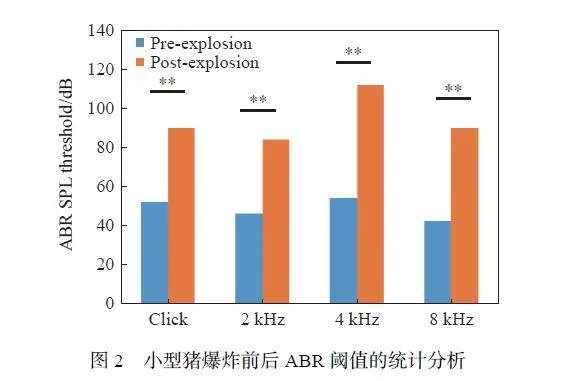
在短声(click)和短纯音(2、4 和8 kHz)诱发条件下,爆炸前后的ABR 声压级阈值均具有显著性差异,如表2 所示。结果显示在4 kHz 时阈值变化最显著,证实爆炸冲击波对小型猪听觉系统的损伤在4 kHz 时表现最明显(图2)。
2.4 耳蜗损伤情况
在不同爆炸条件下,耳蜗的损伤程度呈现显著变化(图3)。随着自由场压力的增大,耳蜗螺旋器受损加重。内毛细胞(inner hair cells, IHCs)的纤毛数量逐渐减少,出现退化,甚至完全消失,损伤程度明显高于外毛细胞(outer hair cells, OHCs)。外毛细胞的纤毛V 形结构部分消失分布不均匀,且基底膜出现裂痕。总体而言,内毛细胞对爆炸冲击更敏感,其损伤随着自由场压力的提高而显著加重,这可能是引起听力损伤的主要原因。
3 讨 论
成功建立了小型猪爆炸内耳听觉损伤模型,从听觉功能和形态学两个方面评估了爆炸冲击波对内耳听觉系统的影响。研究结果显示,爆炸冲击波显著提高小型猪的ABR 阈值,尤其在4 kHz 频率时变化最明显;扫描电镜观察显示,内毛细胞损伤程度高于外毛细胞,且损伤随冲击波压力的升高而加重。这些发现为深入理解爆炸性听觉损伤的机制提供了重要依据。
小型猪作为爆炸引起内耳听觉损伤的动物模型,主要基于其在解剖和生理特性上与人类的高度相似性[14]。首先,小型猪的耳蜗形态和大小与人类几乎一致,这使得研究结果更具临床相关性。相比之下,其他啮齿类动物的耳蜗结构与人类存在显著差异,限制了结果的外推应用。其次,小型猪的内耳在出生时已基本发育成熟,具备正常的听觉功能,这与人类的听觉发育过程相似。此外,小型猪作为大型哺乳动物,能够耐受真实爆炸条件下产生的高强度冲击波,而不至于立即死亡,这为评估爆炸对听觉系统的直接影响提供了可能[15]。虽然小型猪的外耳道比人类更弯曲,可能对冲击波有一定的缓冲作用,但本研究结果显示,其听觉系统仍然受到明显损伤,证明了该模型的适用性。因此,选择小型猪作为爆炸伤动物模型,不仅提高了研究结果的可靠性和可转化性,还为深入探索爆炸冲击波对听觉系统的损伤机制提供了理想的平台。
爆炸性武器所产生的冲击波是产生生物损毁的重要因素,其毁伤效果主要取决于两个物理参数:冲击波峰值压力和正压作用时间[16]。本研究设计了2 次不同载荷真实环境爆炸伤和不同距离的爆炸伤,随着距离增加,冲击波峰值压力减小,符合冲击波衰减规律[17]。当峰值压力超过600 kPa 时,小型猪出现即刻死亡,提示高压冲击波对生物体具有致命性。内耳听觉系统损伤程度与冲击波压力呈正相关关系,提示在爆炸伤防护中,应重点关注高压冲击波对听觉系统的保护。
爆炸冲击波导致小型猪的ABR 阈值显著升高,尤其在4 kHz 频率下变化最明显。这一结果与人类和其他动物模型的研究一致,表明爆炸冲击波对听觉系统的损伤具有普遍性。人类暴露于爆炸冲击波后,患者常出现高频听力下降和ABR 阈值升高[18]。在动物模型中,龙猫和小鼠在暴露于高强度噪声后,导致ABR 阈值持久升高,且在4~8 kHz 较明显,常伴随耳蜗毛细胞的丢失和突触连接的破坏[19-20]。爆炸冲击波对4 kHz 频率的损伤尤为显著,因为耳蜗在该频段具有较高敏感性[21]。此外,可能由于4 kHz位于耳蜗基底转,声波在耳蜗内传播时易产生共振,导致局部能量集中,造成细胞损伤。
爆炸冲击波对耳蜗的内毛细胞和外毛细胞均可造成损伤,然而广泛的外毛细胞丢失是爆炸诱发的声损伤的特征性发现[22-23]。而本研究发现,爆炸冲击波的高压峰值直接损伤内毛细胞的纤毛结构,导致纤毛断裂、融合或消失。而爆炸冲击波导致外毛细胞的纤毛排列紊乱,V 形结构消失,外毛细胞最外结构较内排更易缺失。相比内毛细胞,外毛细胞对爆炸冲击波的抵抗力稍强。爆炸冲击波可导致小型猪内毛细胞和外毛细胞均损伤,但内毛细胞更易受损。损伤机制涉及机械性损伤[24]、氧化应激[25]、兴奋性毒性、炎症反应和血流障碍等多种因素。深入研究这些机制,将有助于开发新的防护和治疗方法,减轻爆炸伤对听觉系统的影响。
本研究存在以下局限:首先,ABR 测试耗时较长,未进行全频率的听觉功能评估,未来将结合其他检测方法进行测试。其次,爆炸参数仅限于1.9 和8 kg TNT 当量,样本数量较少,未涵盖其他类型和当量的爆炸物,结果的适用性有限。此外,未考虑长期效应,缺乏对长期暴露于爆炸环境中的累积影响研究,未来应进行长期观察。
该小型猪爆炸损伤模型具有广泛的应用前景。首先,它为深入研究爆炸冲击波对听觉系统的损伤机制提供了理想平台,可用于探讨不同爆炸条件下听觉损伤的累积效应,有助于揭示听觉系统对爆炸冲击波的长期适应和损伤机制[26]。其次,该模型可用于听力保护装置的开发与评估,尤其是在高强度爆炸环境中[27]。利用本研究的实验平台,可测试和优化各种听力保护设备的设计,为军事和工业领域提供有效的防护措施。此外,该模型还可支持爆炸性听觉损伤的医学干预和康复治疗研究,如药物治疗和听力植入设备等,为改善爆炸伤患者的生活质量提供新的科学依据和治疗策略。
4 结 论
通过构建小型猪爆炸致伤平台,采用不同当量的TNT 炸药,在自由场条件下对小型猪进行了爆炸冲击波损伤实验,多维度评估了爆炸对听觉系统的影响,得到的结论如下。
(1) 爆炸冲击波显著损伤小型猪的听觉功能。爆炸后,所有频率下的听性脑干反应阈值均显著升高,尤其在4 kHz 频率时,阈值变化最明显。这表明爆炸对听觉系统的损伤具有频率依赖性,4 kHz 可能是受损最敏感的频率。
(2) 耳蜗损伤程度与爆炸压力密切相关。随着爆炸峰值压力的增大,耳蜗受损加重,基底膜出现裂痕,细胞排列结构发生变化。
(3) 内毛细胞对爆炸冲击波可能更为敏感。扫描电子显微镜观察显示,内毛细胞的纤毛数量减少,排列紊乱甚至消失,损伤程度明显高于外毛细胞。内毛细胞的严重损伤可能是引起听力损伤的主要原因,这强调了其在听觉系统中的关键作用。
(4) 小型猪内耳听觉爆炸伤模型模实用性和推广性。在不同实验中,使用相同的爆炸参数对小型猪进行测试,观察到一致的听力损伤结果,表明建立的小型猪听觉爆炸伤模型具有较好的重复性和稳定性,可以作为评估听力损伤和防护措施效果的有效工具,适用于更广泛的爆炸伤害研究。
参考文献:
[1]SULLIVAN E V. War-related PTSD, blast injury, and anosognosia [J]. Neuropsychology Review, 2012, 22(1): 1–2. DOI:10.1007/s11065-012-9188-z.
[2]MCEVOY C B, CRABTREE A, POWELL J R, et al. Cumulative blast exposure estimate model for special operations forcescombat soldiers [J]. Journal of Neurotrauma, 2023, 40(3/4): 318–325. DOI: 10.1089/neu.2022.0075.
[3]PAIK C B, PEI M, OGHALAI J S. Review of blast noise and the auditory system [J]. Hearing Research, 2022, 425: 108459.DOI: 10.1016/j.heares.2022.108459.
[4]MIZUTARI K. Blast-induced hearing loss [J]. Journal of Zhejiang University: Science B, 2019, 20(2): 111–115. DOI: 10.1631/jzus.B1700051.
[5]刁明芳. 爆震伤对听觉系统的损害与影响 [J]. 中国耳鼻咽喉颅底外科杂志, 2016, 22(3): 254–256. DOI: 10.11798/j.issn.1007-1520.201603022.
[6]PARK W J, MOON J D. Changes in the mean hearing threshold levels in military aircraft maintenance conscripts [J].Archives of Environmental and Occupational Health, 2016, 71(6): 347–352. DOI: 10.1080/19338244.2015.1136588.
[7]NIWA K, MIZUTARI K, MATSUI T, et al. Pathophysiology of the inner ear after blast injury caused by laser-induced shockwave [J]. Scientific Reports, 2016, 6: 31754. DOI: 10.1038/srep31754.
[8]CHO S I, GAO S S, XIA A P, et al. Mechanisms of hearing loss after blast injury to the ear [J]. PLoS One, 2013, 8(7): e67618.DOI: 10.1371/journal.pone.0067618.
[9]谭君武, 彭洪. 传统方法联合银杏叶注射液治疗爆震性聋的临床分析 [J]. 中华劳动卫生职业病杂志, 2015, 33(4):279–281. DOI: 10.3760/cma.j.issn.1001-9391.2015.04.013.
TAN J W, PENG H. Clinical analysis of Ginkgo biloba injection combined with traditional therapy in treatment of explosivedeafness [J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2015, 33(4): 279–281. DOI: 10.3760/cma.j.issn.1001-9391.2015.04.013.
[10]NAERT G, PASDELOU M P, LE PRELL C G. Use of the guinea pig in studies on the development and prevention ofacquired sensorineural hearing loss, with an emphasis on noise [J]. The Journal of the Acoustical Society of America, 2019,146(5): 3743–3769. DOI: 10.1121/1.5132711.
[11]ARUN P, WILDER D M, EKEN O, et al. Long-term effects of blast exposure: a functional study in rats using an advancedblast simulator [J]. Journal of Neurotrauma, 2020, 37(4): 647–655. DOI: 10.1089/neu.2019.6591.
[12]JIANG S Y, WELCH P, SANDERS S, et al. Mitigation of hearing damage after repeated blast exposures in animal model ofchinchilla [J]. Journal of the Association for Research in Otolaryngology, 2022, 23(5): 603–616. DOI: 10.1007/s10162-022-00862-2.
[13]DAHLQUIST A, ELANDER DEGERSTEDT L, VON OELREICH E, et al. Blast polytrauma with hemodynamic shock,hypothermia, hypoventilation and systemic inflammatory response: description of a new porcine model [J]. European Journalof Trauma and Emergency Surgery, 2022, 48(1): 401–409. DOI: 10.1007/s00068-020-01476-0.
[14]GURR A, STARK T, PROBST G, [14] et al. The temporal bone of lamb and pig as an alternative in ENT-education [J].Laryngorhinootologie, 2010, 89(1): 17–24. DOI: 10.1055/s-0029-1224158.
[15]JIANG S Y, SANDERS S, GAN R Z. Hearing protection and damage mitigation in Chinchillas exposed to repeated lowintensityblasts [J]. Hearing Research, 2023, 429: 108703. DOI: 10.1016/j.heares.2023.108703.
[16]ARTERO-GUERRERO J, PERNAS-SÁNCHEZ J, TEIXEIRA-DIAS F. Blast wave dynamics: the influence of the shape ofthe explosive [J]. Journal of Hazardous Materials, 2017, 331: 189–199. DOI: 10.1016/j.jhazmat.2017.02.035.
[17]DEWEY J M. An interface to provide the physical properties of the blast wave from a free-field TNT explosion [J]. ShockWaves, 2022, 32(4): 383–390. DOI: 10.1007/s00193-022-01076-4.
[18]DION G R, MILLER C L, O’CONNOR P D, et al. Correlation of otologic complaints in soldiers with speech disorders aftertraumatic brain injury [J]. Journal of Voice, 2014, 28(1): 88–91. DOI: 10.1016/j.jvoice.2013.08.005.
[19]CAMPBELL K, CLAUSSEN A, MEECH R, et al. D-methionine (D-met) significantly rescues noise-induced earing loss:timing studies [J]. Hearing Research, 2011, 282(1/2): 138–144. DOI: 10.1016/j.heares.2011.08.003.
[20]SHAO N N, JIANG S Y, YOUNGER D, et al. Central and peripheral auditory abnormalities in chinchilla animal model ofblast-injury [J]. Hearing Research, 2021, 407: 108273. DOI: 10.1016/j.heares.2021.108273.
[21]CAMPBELL K C M, MEECH R P, KLEMENS J J, et al. Prevention of noise- and drug-induced hearing loss with Dmethionine[J]. Hearing Research, 2007, 226(1/2): 92–103. DOI: 10.1016/j.heares.2006.11.012.
[22]EWERT D L, LU J Z, LI W, et al. Antioxidant treatment reduces blast-induced cochlear damage and hearing loss [J]. HearingResearch, 2012, 285(1/2): 29–39. DOI: 10.1016/j.heares.2012.01.013.
[23]KIM J, XIA A P, GRILLET N, et al. Osmotic stabilization prevents cochlear synaptopathy after blast trauma [J]. Proceedingsof the National Academy of Sciences of the United States of America, 2018, 115(21): E4853–E4860. DOI: 10.1073/pnas.1720121115.
[24]LIU C C, GAO S S, YUAN T, et al. Biophysical mechanisms underlying outer hair cell loss associated with a shortenedtectorial membrane [J]. Journal of the Association for Research in Otolaryngology, 2011, 12(5): 577–594. DOI: 10.1007/s10162-011-0269-0.
[25]CHEN T, SMITH K, JIANG S Y, et al. Progressive hearing damage after exposure to repeated low-intensity blasts inchinchillas [J]. Hearing Research, 2019, 378: 33–42. DOI: 10.1016/j.heares.2019.01.010.
[26]HUANG X Y, XIA B C, CHANG L J, et al. Experimental study on intracranial pressure and biomechanical response in ratsunder the blast wave [J]. Journal of Neurotrauma, 2024, 41(5/6): 671–684. DOI: 10.1089/neu.2022.0229.
[27]ANDERSON D A, ARGO T F, GREENE N T. Occluded insertion loss from intracochlear pressure measurements duringacoustic shock wave exposure [J]. Hearing Research, 2023, 428: 108669. DOI: 10.1016/j.heares.2022.108669.
(责任编辑 张凌云)
基金项目: 国家重点研发计划(2022YFC2402701)
