D-海藻糖增强氨基糖苷类抗生素杀灭大肠杆菌的机制探究
2024-12-11黄炜雅钟洁亚赖泽迎陈慧君赵航宇陈雅娟




摘要:寻找高效的抗生素佐剂并研究其增效杀菌机制是目前应对细菌耐药问题的有效策略之一。为探究D-海藻糖(D-trehalose)增强氨基糖苷类抗生素杀灭大肠杆菌的机制,以大肠杆菌BW25113为研究对象,测定D-trehalose联合氨基糖苷类抗生素作用前后的ATP、NADH含量以及质子动力势(PMF),分析菌体内能量代谢和膜电位水平的变化,并通过抑菌圈实验检测对抗生素摄取的影响。结果提示:D-trehalose联合妥布霉素或庆大霉素双处理后,D-trehalose能够通过升高大肠杆菌PMF水平增加ATP合成,提高NADH水平,促进抗生素摄取,由此显著增强抗生素的杀菌效果。研究结果为开发D-海藻糖作为新型氨基糖苷类抗生素佐剂提供依据。
关键词:大肠杆菌;D-海藻糖;妥布霉素;庆大霉素;质子动力势
中图分类号:S859.796文献标志码:A文章编号:0253-2301(2024)09-0036-08
DOI:10.13651/j.cnki.fjnykj.2024.09.007
Study on the Mechanism ofD-trehalose Enhancing the Killing of Escherichia coli by Aminoglycoside Antibiotics
HUANG Wei-ya,ZHONG Jie-ya,LAI Ze-ying,CHEN Hui-jun,ZHAO Hang-yu,CHEN Ya-juan*
(Fujian University Key Laboratory of Cellular Stress Response and Metabolic Regulation/College of Life Science,Fujian Normal University,Fuzhou,Fujian 350108,China)
Abstract:Finding the efficient antibiotic adjuvants and studying their synergistic bactericidal mechanism is one of the effective strategies to deal with the problem of bacterial resistance.In order to explore the mechanism of D-trehalose enhancing the killing effect of Escherichia coli by the aminoglycoside antibiotics,by taking Escherichia coli BW25113 as the research object,the contents of ATP,NADH and proton motive force(PMF)were measured before and after the treatment of D-trehalose combined with the aminoglycoside antibiotics.The changes of energy metabolism and membrane potential in bacteria were analyzed,and the effect on the uptake of antibiotics was detected by using the inhibition zone experiment.The results showed that:after the double treatment with D-trehalose combined with tobramycin or gentamycin,D-trehalose could increase the synthesis of ATP,increase the level of NADH,and promote the uptake of antibiotics by increasing the PMF level of Escherichia coli,thus significantly enhancing the bactericidal effect of antibiotics.The results of this study provided a basis for the development of D-trehalose as a new-type aminoglycoside antibiotic adjuvant.
Key words:Escherichiacoli;D-trehalose;Tobramycin;Gentamycin;Proton motive force
自20世纪中叶首次发现抗生素可以作为饲料添加剂促进动物生长,畜牧养殖业开启了使用抗生素的时代。随着抗生素在饲料及兽药领域等方面的不当使用以及滥用,抗生素耐药性的产业减弱了原有抗生素的功效,耐药细菌的出现使得感染性疾病的治疗变得困难2]。研究人员便提出寻找一些抗生素佐剂以提高传统抗生素疗效,如通过增加细菌对药物摄取的方法来应对细菌耐药性3]。本课题组前期通过外源添加D-海藻糖(D-trehalose)与三大类杀菌抗生素(氨基糖苷类抗生素、氟喹诺酮类抗生素及β-内酰胺类抗生素)对大肠杆菌BW25113和金黄色葡萄球菌ATCC25923进行杀灭测试4结果发现其协同氨基糖苷类抗生素具有较好的杀菌效果,并且在不同的培养条件杀菌效果均显著,是一种潜在的有效抗生素佐剂5。因此,本研究进一步测试D-trehalose协同氨基糖苷类抗生素杀灭临床分离的耐药大肠杆菌的杀菌效果,评估其作为有效抗生素佐剂在临床治疗中的潜在应用价值。并且,为解析D-trehalose增效氨基糖苷类抗生素的杀菌机制,对菌体内能量代谢和膜电位变化情况,包括质子动力势(PMF)变化水平以及ATP、NADH含量进行测定,同时探究D-trehalose是否通过促进细菌胞内抗生素摄取增强杀菌效果。
1材料与方法
1.1试验材料
8株临床耐药大肠杆菌株来自福建医科大学附属第一医院,试验菌株为大肠杆菌BW25113。
1.2仪器与试剂
1.2.1主要仪器37℃恒温培养箱、光吸收全波长酶标仪、流式细胞仪、37℃恒温震荡培养器。
1.2.2主要试剂ATP检测试剂盒S0026、增强NAD/NADH检测试剂盒(WST-8法),3,3'-二乙基氧杂羰花青碘(DiOC₂(3))、妥布霉素(Tobramycin,Tob)、庆大霉素(Gentamycin,Genta)、羰基氰化物间氯苯腙(CCCP)。
1.3试验方法
1.3.1 D-trehalose协同Tob杀灭临床耐药大肠杆菌的处理方法使用LB液体培养基过夜活化8株临床耐药大肠杆菌,1:500转接至新鲜LB中培养24 h。取9支试管,各加入500μL菌液,编号1~9,1~3号试管为空白对照组(未处理);4~6号试管加入终浓度为50μg mL¹Tob(Tob单处理),7~9号试管加入终浓度为50μgmL¹Tob以及30 mmol-L-¹的D-trehalose(Tob+D-trehalose双处理),处理3h后,取经不同试验条件处理的50μL平台期的菌液用PBS洗涤2遍后重悬。随后将菌悬液用PBS缓冲液依次进行10倍稀释,取4μL稀释完的菌液滴于固体LB平板上。自然风干后于37℃培养箱中培养12 h,计算菌落数。8株临床耐药大肠杆菌具体耐药信息列于表1。
1.3.2菌株活化、处理及洗涤方法将存于-80℃的菌株大肠杆菌BW25113于37℃摇床培养过夜活化。以1:500的比例接种于20 mL新鲜的液体培养基培养24 h达到平台期,所选用的氨基糖苷类抗生素为Tob、Genta。
取6根试管分别加入500μL平台期大肠杆菌,1号管为空白对照组(未处理),2号管加入终浓度为30 mmol-L¹的D-trehalose(D-trehalose单处理),3号管加入终浓度为50μg·mL¹Tob(Tob单处理),4号管加入终浓度为50μg·mL¹Tob和30 mmol-L⁻¹的D-trehalose(Tob+D-trehalose双处理),5号管加入终浓度为30μg·mL¹Genta(Genta单处理),6号管加入30μg mL-¹Genta和30mmol-L¹的D-trehalose(Genta+D-trehalose双处理)。分别处理1.5 h后,用PBS洗涤2遍离心去上清后重悬。
(1)大肠杆菌胞内质子动力势水平测定按照1.3.2的方法制作平台期大肠杆菌不同处理下的菌液,取100μL处理后的菌液加1 mL PBS,加入终浓度为30μmol-L¹的荧光染料DiOC₂(3),37℃下孵育30min后,流式细胞仪进行分析。DiOC₂(3)探针会在细菌体内发生绿色荧光,膜电位的升高使得探针分子发生自聚,其荧光便往红色波段迁移,Ex/Em:482/497nmol-L¹。若Red/Green(R/G)比值升高,则说明质子动力势水平增加。
(2)大肠杆菌胞内ATP水平测定按照1.3.2的方法制作平台期大肠杆菌不同处理下的菌液,各加入100μL裂解液吹打混匀,于10000 r·min-¹、4℃离心5min,取上清与检测试剂混合后使用酶标仪化学发光Luminescence(RLU)检测其荧光值,荧光值越大,则ATP含量越多。同时按照0、0.1、1、5、10μmoL·L¹ATP浓度梯度制备ATP标准品作标准曲线,将样品得出的荧光值代入标准曲线中得出ATP含量。
(3)大肠杆菌胞内NADH含量测定按照1.3.2的方法制作平台期大肠杆菌不同处理下的菌液,加入200μL预冷的增强型NAD'/NADH提取液。于12 000 r·min-¹,4℃离心8 min,取上清与乙醇脱氢酶工作液混合在酶标仪450 nm处测试其吸光度,同时制备不同浓度的NADH标准品用于制备标准曲线,将样品测得的吸光度代入标准曲线后得出NAD*、NADH的含量。
1.3.3细菌对妥布霉素的摄取试验将培养至平台期的大肠杆菌经过不同Tob浓度(50、100、200μg mL¹)与D-trehalose(30 mmol-L¹)共同处理3h后离心去上清,用PBS洗涤2遍后加入2mg mL¹溶菌酶充分裂解4 h,液氮冻融两次,90℃加热10 min,使细菌细胞完全裂解释放摄入的抗生素,离心得到上清作为样品备用。同时制备标准品,将未处理的菌液经溶菌酶吹打混匀后加入终浓度为0、20、40、60、80、100μgmL-¹的Tob,于37℃下充分裂解4 h后,液氮反复冻融两次,90℃加热10 min,离心得到上清作为对照标准品。
制备含有BW25113菌株的方型培养皿,按照顺序将上清点涂到方板上,与对照标准品相比,若摄入抗生素浓度越多,则点涂的位置抑菌圈越大,细菌不生长的区域则越大。测量标准品的抑菌圈直径为横坐标,Tob浓度为纵坐标作标准曲线。代入样品的抑菌圈直径,最后计算得出样品中摄取的抗生素含量。
2结果与分析
2.1 D-trehalose协同Tob杀灭临床耐药大肠杆菌的效果分析
由图1可知,Tob单处理组在杀灭8株耐药大肠杆菌的效果上与未处理组相比无显著差异。而Tob+D-trehalose双处理组的杀菌效果与Tob单处理组相比显著增强。其中,与Tob单处理相比,210215789、210305622、210117294、210117528这4株临床大肠杆菌在D-trehalose+Tob双处理下增强了4个数量级的杀菌效果,而210215749、210829790、210305607、210829776这4株增强了约3个数量级的杀菌效果。结果表明,D-trehalose能够显著增强Tob杀灭临床耐药大肠杆菌。
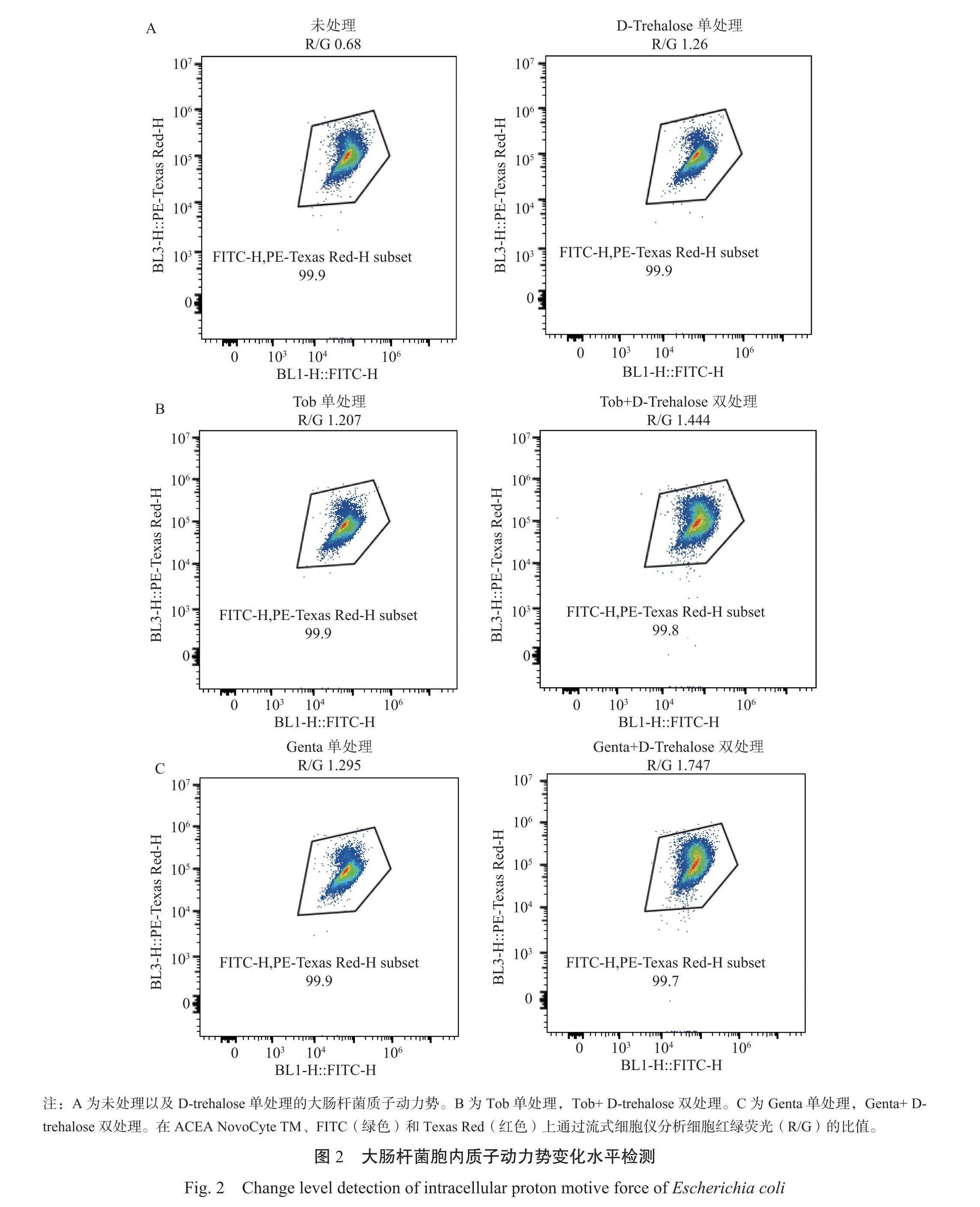
2.2大肠杆菌胞内质子动力势变化情况
由图2A可知,未处理组其R/G比值为0.68,在加入了D-trehalose后其R/G比值增加为1.26,说明D-trehalose单处理下的大肠杆菌PMF显著高于未处理组。
由图2B和图2C可知,Tob单处理下R/G比值为1.207,而Tob+D-trehalose双处理后R/G值为1.444。Genta单处理时R/G值为1.295,加入了D-trehalose后其R/G值为1.747。
以上结果证实,外源添加D-trehalose促进了大肠杆菌PMF的升高,从而提高了大肠杆菌对抗生素的摄取,增强了抗生素的杀菌效果。
2.3大肠杆菌胞内ATP含量测定结果
由图3B可知,与未处理组相比,外源添加D-trehalose后大肠杆菌产生ATP的含量显著增加。而与Tob与Genta单处理组相比,D-trehalose联合抗生素的双处理组中大肠杆菌产生的ATP含量显著升高,说明外源添加D-trehalose可以显著提高细菌的新陈代谢水平,从而提高抗生素的杀菌效率。
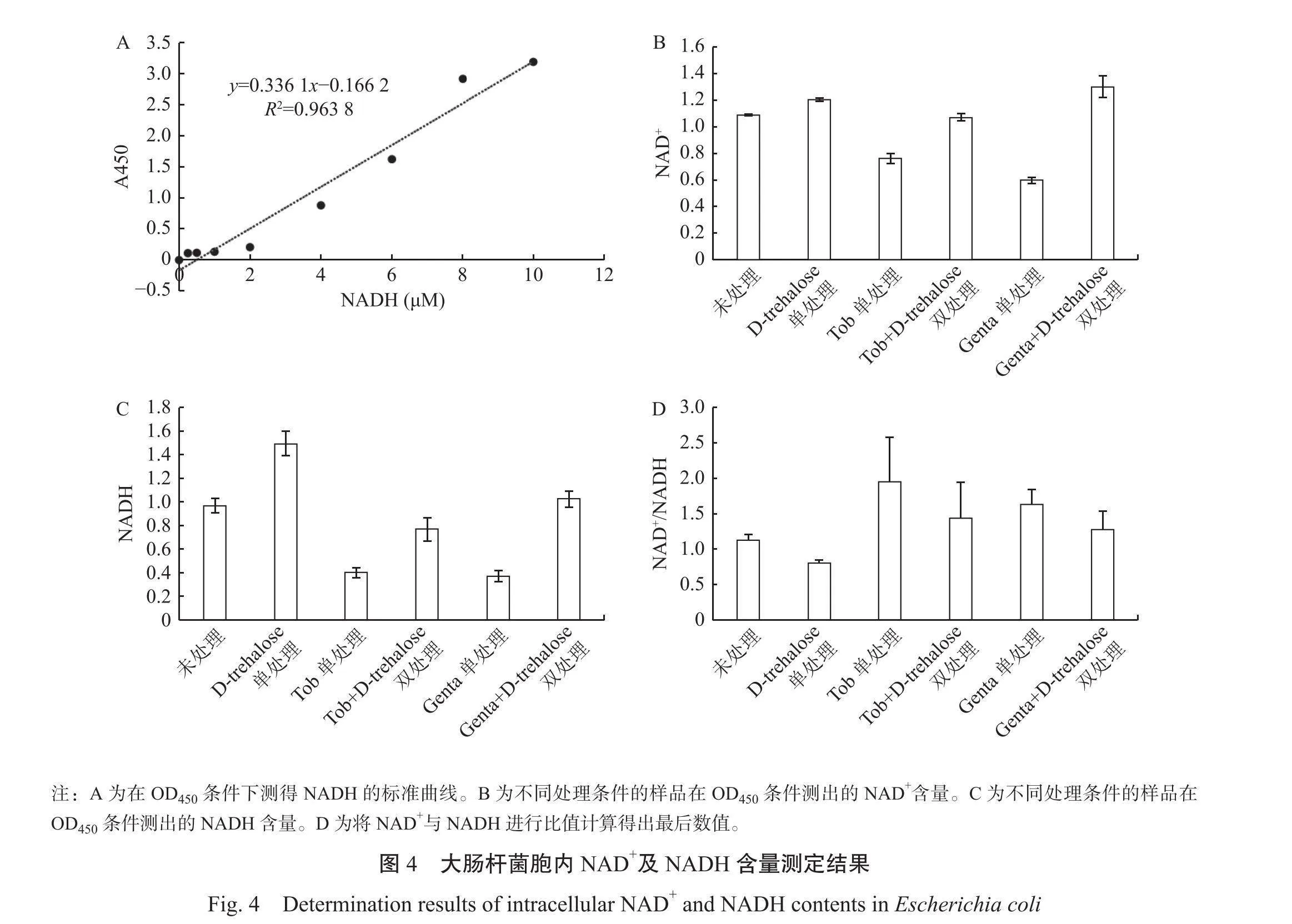
2.4大肠杆菌胞内NADH含量测定结果
由图4B可知,D-trehalose处理的细菌中NAD的浓度高于未处理组,Tob/Genta单处理组的NAD+含量低于未处理组,并且在添加了D-Trehalose后显著上升。
由图4C可知,D-trehalose处理的细菌中NADH的浓度高于未处理组,Tob/Genta单处理组的NADH含量低于未处理组,同样在添加了D-trehalose后显著上升。
由图4D可知,D-trehalose处理组的NAD/NADH比值低于未处理组,Tob/Genta+D-trehalose双处理组NAD/NADH含量低于Tob/Genta单处理组,说明在D-trehalose作用下大肠杆菌产生NADH的浓度显著大于NAD*,增强了细菌代谢活性,激活电子传递链,从而提高了抗生素杀菌效率。
2.5细菌对妥布霉素的摄取
由图5A可知,D-trehalose协同Tob处理下的杀菌效果显著高于Tob单处理组。由图5B可知,在D-trehalose浓度不变的情况下,随着Tob浓度增大,Tob+D-trehalose处理后的大肠杆菌体内抗生素含量高于Tob单处理组,证明D-trehalose增加了大肠杆菌对Tob的摄取,并且效果显著。由图5C可知,较为显著的抑菌圈200μg·mL¹Tob处理下,抗生素进入胞内含量为20 ug mL¹,而加入D-trehalose后Tob摄取量为40μg mL-¹。由此可见,外源添加D-trehalose确实可以增强大肠杆菌对抗生素的摄取,导致细菌死亡。
3讨论
细菌耐药性正成为全球公共卫生和人类健康面临的严峻挑战,其影响波及农业、水产养殖业和畜牧业等多个关键领域。深入理解细菌对抗生素的应对机制⁶-101,对于开发有效策略以杀灭耐药菌株至关重要,而人体所需的代谢物作为抗生素佐剂在中枢代谢中发挥了重要作用。某些代谢物如葡萄糖、果糖¹²]、甘露醇1³或丙酮酸¹4等,能够促进细菌糖酵解、增加NADH生成、激活电子传递链(electron transport chain,ETC)并提高细胞膜的质子动力势,从而促进氨基糖苷类抗生素如庆大霉素的摄取,增强其杀菌效果15。物理手段如热休克16以及低离子休克¹7,通过依赖PMF的变化和细胞内蛋白质的聚集,也能增强氨基糖苷类抗生素的摄取,进而杀灭细菌。这些抗生素佐剂的发现及代谢机理研究,大大增加了抗生素的作用,减少耐药性的产生,为新的抗生素的发现提供了一种替代和补充的策略。
本研究通过外源添加代谢物D-trehalose,发现其显著增加了Tob对临床分离耐药大肠杆菌的杀伤效果。此外,D-trehalose促进大肠杆菌PMF水平升高,增加ATP及NADH的产生并增强细菌代谢活性,激活电子传递链,从而提高细胞内抗生素浓度并有效杀死细菌。这些结果不仅为D-trehalose作为一种安全高效的抗生素佐剂的应用提供了科学依据,也为临床应对氨基糖苷类抗生素耐药性问题提供了新的视角。尽管如此,D-trehalose在体内的实际效果,特别是在小鼠模型中的联合作用,仍需进一步的研究来验证[18]。未来的工作将集中于评估D-trehalose在不同生物体内的效果,以及其与其他抗生素联合使用的潜力,为抵抗耐药细菌提供新思路。
参考文献:
[1]姬书会,邱孜博.我国畜牧业中滥用抗生素的危害和对策[J].中国畜禽种业,2022,18(12):59-62.
[2]CIORBA V,ODONE A,VERONESI L,etal.Antibiotic resistance as a major public health concern:epidemiology and economic impact[J].Ann Ig,2015,27(3):562-579.
[3]ALLISON K R,BRYNILDSEN M P,COLLINS J.Metabolite-enabled eradication of bacterial persister by aminoglycosides[J].Nature,2011,473(7346):216-220.
[4]冯荆城,庄彬彬,李中燕,等.1,2-丁二醇辅助氨基糖苷类抗生素杀灭大肠杆菌效果分析[J].福建农业科技,2022,53(7):27-34.
[5]赖泽迎,吴泽源,杨晓乐,等.D-海藻糖联合氨基糖苷类抗生素杀菌效果分析[J].福建农业科技,2023,54(11):36-43.
[6]LIUY,LIR,XIAOX,etal.Antibioticadjuvants:an alternative approach to overcome multi-drug resistant Gram-negative bacteria[J].Crit RevMicrobiol,2019,45(3):301-314.
[7]BARON SA,ROLAIN JM.Effux pump inhibitor CCCP to rescue colistin susceptibility in mcr-1 plasmid-mediated colistin-resistant strains and Gram-negative bacteria[J].J Antimicrob Chemother,2018,73(7):1862-1871.
[8]KUANG SF,XIANG J,CHEN YT,etal.Exogenous pyruvate promotes gentamicin uptake to kill antibiotic-resistant Vibrio alginolyticus[J].Int J Antimicrob Agents,2024,63(1):107036.
[9]LIZ,WUL,HUANG Z,etal.CCCP Facilitates Aminoglycoside to Kill Late Stationary-Phase Escherichia coli by Elevating Hydroxyl Radical[J].ACS InfectDis,2023,9(4):801-814.
[10]ZHU C,ZHOU Y,KANG J,etal.Alkaline arginine promotes the gentamicin-mediated killing of drug-resistant Salmonella byincreasing NADH concentration and proton motive force[J].Front Microbiol,2023,14:1237825.
[11]SHE P,WANG Y,LIU Y,etal.Effects of exogenous glucose onPseudomonas aeruginosa biofilm formation and antibioticresistance[J].Microbiology open,2019,8(12):933.
[12]SU YB,PENG B,HAN Y,etal.Fructose restores susceptibility of multidrug-resistant Edwardsiellatarda to kanamycin[J].J Proteome Res,2015,14(3):1612-1620.
[13]BARRAUD N,BUSON A,JAROLIMEK W,etal.Mannitolenhancesantibiotic sensitivity of persister bacteria in Pseudomonas aeruginosa biofilms[J].PLoS One,2013,8(12):84220.
[14]SU Y B,PENG B,LI H,etal.Pyruvate cycle increases aminoglycoside efficacy and provides respiratory energy in bacteria[J].Proc Nall Acad Sci U S A,2018,115(7):1578-1587.
[15]ZHAO XL,CHEN ZG,YANG T C,etal.Gutamine promotes antibiotic uptake to kill multidrug-resistant uropathogenic bacteria[J].Sci Transl Med,2021,13(625):0716.
[16]LV B,HUANG X,LIJIA C,etal.Heat shock potentiates aminoglycosides against gram-negative bacteria by enhancing antibiotic uptake,proteinaggregation,and ROS[J].Proc Natl AcadSciUSA,2023,120(12):2217254120.
[17]CHEN Z,GAO Y,LV B,etal.Hypoionic Shock Facilitates Aminoglycoside Killing of Both Nutrient Shift and Starvation-Induced Bacterial Persister Cells by Rapidly Enhancing Aminoglycoside Uptake[J].Front Microbiol,2019,10:2028.
[18]PENG B,SU YB,LIH,etal.Exogenous alanine and/or glucose plus kanamycin kills antibiotic-resistant bacteria[J].Cell Metab,2015,21(2):249-262.
(责任编辑:柯文辉)
