可见光介导下有机光敏剂诱导三氮唑化合物的合成
2024-12-09吴亚男吴新星*




摘要:光诱导反应与有机金属催化、小分子催化和不对称催化等反应实现了许多结构复杂的杂环化合物和天然有机化合物的合成,丰富和发展了有机反应方法学的研究内容。在众多的杂环化合物中,三氮唑是一类重要的具有生物和药理活性的五元杂环化合物,被广泛应用于医药、农药以及其他精细化工领域。基于此,该研究以取代的叠氮和苯甲酰乙腈作为原料、芘作为有机光催化剂,在可见光介导下,通过[3 + 2]环加成合成一系列1,4,5-取代的1,2,3-三氮唑化合物,并以核磁氢谱、碳谱、高分辨质谱和熔点等数据对相应目标化合物进行了表征。实验结果表明:该反应条件温和、区域选择性高、官能团兼容性好,反应操作简单,产率高达99%。反应机理揭示了该光照转化的可能反应历程。该研究为1,2,3-三氮唑衍生物的合成提供了一种简单、高效、绿色的方法,同时,丰富了三氮唑杂环化合物的分子库。
关键词:可见光催化;有机光敏剂;1,2,3-三氮唑;[3 + 2]环加成;叠氮
中图分类号: TQ463+.53" " " " " " " " " " "文献标志码: A文章编号: 1673-2340(2024)01-0080-07
Abstract: Photoinduced reactions, combined with organometallic catalysis, small molecule catalysis, and asymmetric catalysis, have achieved many structurally complex heterocyclic compounds and natural organic compounds, enriching, and developing the research content of organic reaction methodology. Among numerous heterocyclic compounds, triazole is an important class of five membered heterocyclic compounds with biological and pharmacological activities, widely used in pharmaceuticals, pesticides, and other fine chemical fields. Based on this, this study synthesized a series of 1,4,5-substituted 1,2,3-triazole compounds by [3+2] cycloaddition under visible light mediation, using azide and benzoylacetonitrile as raw materials and pyrene as organic photocatalysts, and the corresponding target compounds were characterized using data such as nuclear magnetic resonance H-spectroscopy, C-spectroscopy, high-resolution mass spectrometry and melting point. The experimental results show that the reaction conditions are mild, the regioselectivity is high and the functional group compatibility is good. In addition, the reaction operation is simple, the yield is as high as 99%, and the reaction mechanism reveals the potential reaction course of this photoconversion. This study provides a simple, efficient, and green method for the synthesis of 1,2,3-triazole derivatives, simultaneously enriching the molecular library of triazole heterocyclic compounds.
Key words: visible light catalysis; organic photosensitizer; 1,2,3-triazole; [3+2] cycloaddition; azides
1,2,3-三氮唑是一类重要的五元含氮杂环骨架,其衍生物具有广泛的生物活性,如具有抗菌、抗真菌、抗吞噬、抗结核、抗病毒、抗血小板、抗炎、抗惊厥及抗肿瘤和增殖活性等功能[1-3]。到目前为止,尚未有从自然界中提取1,2,3-三氮唑结构单元的相关报道。经查阅文献发现,在过去几十年里,人们为发展有效的制备方法作出了重大努力[4-6]。最早报道的是通过加热经1,3-偶极环加成合成1,2,3-三氮唑化合物[7]。然而,由于高活化能(24~26 kcal/mol),这些环加成反应在高温下进行得非常缓慢,并且可能产生区域异构体的混合物。同时,铜(I)催化的1,3-偶极环加成反应也被报道。另一方面,三氮唑化合物的广泛应用,吸引了众多化学工作者的研究兴趣[8-13],如利用邻叠氮芳基异腈通过铜催化的串联反应合成1,2,3-三氮唑[1,5-a]喹喔啉骨架衍生物。将磺基叠氮应用于Huisgen环加成反应中,以噻吩甲酸铜(CuTC)为催化剂在室温下合成含磺酰基的1,2,3-三氮唑化合物。该反应中间体很不稳定,容易分解出氮气得到磺酰胺类副产物。值得注意的是,过渡金属铜的存在会诱导病毒或生物系统中寡核苷酸链的降解;此外,铜离子对生物体具有潜在的毒性。因此,这一局限性在很大程度上限制了该策略在1,2,3-三氮唑化合物制备中的应用。因此,发展新的方法合成多取代的1,2,3-三氮唑化合物具有重要意义。
光化学反应是指通过光引发的有机合成反应。光敏剂、反应中间体或底物通过吸收光子产生的激发态分子不同于基态,其通常会发生基态分子无法参与的化学反应。其中光催化剂对反应起关键性作用,可实现单电子转移(single electrontransfer,SET)[14]、氢原子转移(hydrogen atom transfer,HAT)[15]及能量转移(energy transfer,EnT)[16-18]。基于这些转化过程,光催化反应合成杂环化合物的研究取得了显著进展,如实现了酰胺、吡啶、噻吩等化合物的合成。然而,经查阅相关文献发现,基于光催化合成1,4,5-取代的1,2,3-三氮唑化合物的研究还没有报道。
基于之前的光催化反应相关工作[19-20],拟在可见光介导的有机光敏剂催化下,以叠氮类化合物与苯甲酰乙腈类衍生物作为反应底物,实现1,4,5-取代的1,2,3-三氮唑化合物的合成。
1" "实验部分
1.1" "试剂与仪器
所有市售的药品和溶剂在使用前都没有经过特殊的纯化处理。芳甲酰乙腈(纯度gt;97%), 安耐吉化学技术(上海)有限公司;乙腈,北京百灵威科技有限公司;碳酸钾、芘、石油醚及乙酸乙酯,上海泰坦科技股份有限公司。光源,2 m,12 W。利用薄层层析色谱法(TLC)监测反应。反应在紫外灯(254 nm或365 nm)下显色。反应使用合适极性的洗脱液在硅胶(300~400目)柱上进行柱层析。核磁共振波谱均使用德国布鲁克400兆核磁共振仪于室温下测定,内标为三甲基硅烷,溶剂为氘代氯仿(峰的裂分模式用如下缩写进行描述:s = 单峰,d = 双重峰,t = 三重峰,q = 四重峰,dd = 两个双重峰,m = 多重峰;耦合常数J以赫兹(Hz)表示)。所用底物按文献[21]合成。
1.2" "实验方法
在反应管中分别加入苯甲酰乙腈(0.10 mmol)、 K2CO3(0.10 mmol)、芘(摩尔分数为10.0%);再用注射器分别注入有机叠氮化物(0.15 mmol)和乙腈(1.0 mL);然后在室温下通过蓝光照射反应24 h。反应完成后萃取出有机相,再用柱层析分离纯化,最终得到目标产物。
1.3" "化合物表征数据
1-对甲苯基-4-氰基-5-苯基-1,2,3-三氮唑(3a):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点105~107 ℃,产率97%。1H NMR(400 MHz,CDCl3) δ 7.50-7.41(m,3H),7.36-7.33(m,2H), 7.27-7.20(m,4H),2.42(s,3H)。13C NMR(101 MHz,CDCl3) δ 143.0,140.7,132.8,131.0,130.3,129.4,129.0, 125.0,123.5,120.5,112.2,21.3。C16H13N4 HRMS(ESI)([M+H]+)计算值261.113 5,测试值261.113 7。
1-对甲氧基苯基-4-氰基-5-苯基-1,2,3-三氮唑(3b):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点128~130 ℃,产率99%。1H NMR(400 MHz,CDCl3) δ 7.51-7.42(m,3H),7.38-7.33(m,2H),7.28-7.22(m,2H),6.97-6.93(m,2H),3.86(s,3H)。13C NMR(101 MHz,CDCl3) δ 160.8,143.0,131.0,129.4, 128.9,128.1,126.6,123.5,120.3,114.8,112.2,55.7。C16H13N4O HRMS(ESI)([M+H]+)计算值277.108 4, 测试值277.108 5。
1-苯基-4-氰基-5-苯基-1,2,3-三氮唑(3c):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点119~121 ℃,产率94%。1H NMR(400 MHz, CDCl3) δ 7.56-7.27(m,10H)。13C NMR(101 MHz, CDCl3) δ 143.1,135.3,131.1,130.3,129.8,129.4, 129.4,129.0,125.2,125.0,123.4,120.6,112.1。C15H11N4 HRMS(ESI)([M+H]+)计算值247.097 8,测试值247.097 7。
1-对氟苯基-4-氰基-5-苯基-1,2,3-三氮唑(3d):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点99~101 ℃,产率70%。1H NMR(400 MHz,CDCl3) δ 7.54-7.43(m,3H),7.39-7.30(m,4H),7.21-7.13(m,2H)。13C NMR(101 MHz,CDCl3) δ 163.2(d,J = 253.5 Hz),143.1,131.4(d,J = 3.0 Hz),131.4,131.2,129.5(d, J = 62.6 Hz),128.9,127.2 (d,J = 9.1 Hz),127.1,123.1,120.7,117.1(d,J = 23.2 Hz),116.8,111.9。C15H10FN4 HRMS(ESI)([M+H]+)计算值265.088 4,测试值265.088 5。
1-对氯苯基-4-氰基-5-苯基-1,2,3-三氮唑(3e):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点121~123 ℃,产率96%。1H NMR (400 MHz,CDCl3) δ 7.48-7.35(m,5H),7.28-7.19(m,4H)。13C NMR(101 MHz,CDCl3) δ 142.0,135.4,132.7,130.3, 129.0,128.6,127.9,125.3,122.0,119.8,110.8。C15H10ClN4 HRMS(ESI)([M+H]+)计算值281.058 9,测试值281.059 6。
1-对溴苯基-4-氰基-5-苯基-1,2,3-三氮唑(3f):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点107~109 °C,产率98%。1H NMR(400 MHz,CDCl3) δ 7.63-7.45(m,5H),7.36-7.33(m,2H),7.27-7.22(m,2H)。13C NMR(101 MHz,CDCl3) δ 143.0,134.3,133.0,131.4,129.6,128.9,126.5,124.5, 123.0,120.8,111.9。C15H10BrN4 HRMS(ESI)([M+H]+)计算值325.008 4,测试值325.008 7。
1-间甲苯基-4-氰基-5-苯基-1,2,3-三氮唑(3g):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点91~93 ℃,产率93%。1H NMR(400 MHz,CDCl3) δ 7.52-7.42(m,3H),7.37-7.29(m,4H),7.26-7.21(m,1H),7.05-7.04(m,1H),2.38(s,3H)。13C NMR(101 MHz,CDCl3) δ 143.0,140.2,135.2, 131.1,129.4,129.4,128.9,125.7,123.4,122.2,120.5, 112.2,21.3。C16H13N4 HRMS(ESI)([M+H]+)计算值261.113 5,测试值261.113 7。
1-间溴苯基-4-氰基-5-苯基-1,2,3-三氮唑(3h):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点122~124 ℃,产率86%。1H NMR(400 MHz,CDCl3) δ 7.70-7.46(m,5H),7.41-7.29(m,3H),7.25-7.20(m,1H)。13C NMR(101 MHz,CDCl3) δ 143.2,136.3,133.5,131.4,130.9,129.6,129.0,128.2, 123.6,123.2,122.9,120.8,111.8。C15H10BrN HRMS(ESI)([M+H]+)计算值325.008 4,测试值325.008 4。
1-(3,5-二氯)苯基-4-氰基-5-苯基-1,2,3-三氮唑(3i):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点133~135 ℃,产率91%。1H NMR(400 MHz,CDCl3) δ 7.49(m,1H),7.48-7.40(m,3H),7.35-7.25(m,2H),7.21-7.15(m,2H)。13C NMR(101 MHz,CDCl3) δ 142.2,135.6,135.2,130.7,129.5, 128.8,127.9,122.6,121.5,120.0,110.5。C15H9Cl2N4 HRMS(ESI)([M+H]+)计算值315.019 9,测试值315.020 1。
1-邻甲苯基-4-氰基-5-苯基-1,2,3-三氮唑(3j):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点126~128 ℃,产率49%。1H NMR (400 MHz,CDCl3) δ 7.49-7.40(m,3H),7.40-7.29(m,6H),1.97(s,3H)。13C NMR(101 MHz,CDCl3) δ 143.9,135.0, 134.5,131.7,131.0,129.4,128.9,128.3,127.4,127.3, 123.3,119.6,112.3,77.2,17.5。C16H13N4 HRMS(ESI)([M+H]+)计算值261.113 5,测试值261.113 8。
1-对甲苯基-4-氰基-5-对甲苯基-1,2,3-三氮唑(3k):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点87~89 ℃,产率99%。1H NMR(400 MHz,CDCl3) δ 7.27(s,1H),7.25(s,1H),7.23(s,6H),2.42 (s,3H),2.39(s,3H)。13C NMR(101 MHz,CDCl3) δ 143.1,141.5,140.6,133.0,130.3,130.1,128.8,125.0, 120.4,120.2,112.3,77.2,21.5,21.3。C17H15N4 HRMS (ESI)([M+H]+)计算值275.129 1,测试值275.129 0。
1-对甲苯基-4-氰基-5-对甲氧苯基-1,2,3-三氮唑(3l):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点114~116 ℃,产率97%。1H NMR (400 MHz,CDCl3) δ 7.30-7.27(m,2H),7.24(m,4H),6.95-6.90(m,2H),3.84(s,3H),2.43(s,3H)。13C NMR(101 MHz,CDCl3) δ 161.5,143.0,140.5, 133.0,130.4,130.3,125.0,119.9,115.4,114.9,112.5, 55.4,21.3。C17H15N4O HRMS(ESI)([M+H]+)计算值291.124 1,测试值291.124 0。
1-对甲苯基-4-氰基-5-对氟苯基-1,2,3-三氮唑(3m):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点101~103 ℃,产率78%。1H NMR(400 MHz,CDCl3) δ 7.39-7.32(m,2H),7.31-7.27(m,2H),δ 7.24-7.11(m,4H),2.43(s,3H)。13C NMR(101 MHz,CDCl3) δ 165.3,162.8,142.1,140.9,132.6,131.2(d,J = 9.1 Hz),131.1,130.4,125.0,120.4,119.6(d,J = 4.0 Hz),119.6,117.0(d,J = 22.2 Hz),116.8,112.1, 21.3。C16H12FN4 HRMS(ESI)([M+Na]+)计算值279.104 1,测试值279.104 2。
1-对甲苯基-4-氰基-5-对氯苯基-1,2,3-三氮唑(3n):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点117~119 ℃,产率55%。1H NMR(400 MHz,CDCl3) δ 7.36-7.33(m,2H),δ 7.22-7.19(m,4H), δ 7.14-7.12(m,2H),2.36(s,3H)。13C NMR(101 MHz,CDCl3) δ 140.9,139.9,136.5,131.6,129.43,129.2, 128.8,123.9,120.9,119.5,110.9,20.3。C16H12ClN4 HRMS(ESI)([M+H]+)计算值295.074 5,测试值295.077 4。
1-对甲苯基-4-氰基-5-对溴苯基-1,2,3-三氮唑(3o):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点131~133 ℃,产率50%。1H NMR(400 MHz,CDCl3) δ 7.45-7.40(m,2H),7.31-7.27(m,4H),7.21(m,2H),2.43(s,3H)。13C NMR(101 MHz,CDCl3) δ 141.9,141.0,137.5,132.6,130.5,130.2,129.8,125.0, 121.9,120.5,111.9,77.2,21.3。C16H12N4Br HRMS(ESI)([M+H]+)计算值339.024 0,测试值339.024 1。
1-对甲苯基-4-氰基-5-对甲酸甲酯苯基-1,2,3-三氮唑(3p):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点140~142 ℃,产率33%。1H NMR(400 MHz,CDCl3) δ 8.12-8.07(m,2H),7.45-7.40(m,2H),7.27(m,2H),7.22-7.18(m,2H),3.94(s,3H),2.43(s,3H)。13C NMR(101 MHz,CDCl3)δ 165.8,141.9,141.0,132.6,132.4,130.5,130.4,129.0, 127.7,124.9,120.8,111.8,52.6,21.3。C18H15N4O2 HRMS (ESI)([M+H]+)计算值319.119 0,测试值319.118 7。
1-对甲苯基-4-氰基-5-间甲氧苯基-1,2,3-三氮唑(3q):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点128~130 ℃,产率99%。1H NMR (400 MHz,CDCl3) δ 7.33(m,1H),7.27(m,2H),7.25-7.21(m,2H),7.01(m,1H),6.91-6.84(m,2H), 3.73(s,3H),2.42(s,3H)。13C NMR(101 MHz,CDCl3) δ 159.9,142.9,140.7,132.9,130.5,130.3,124.9, 124.5, 121.2,120.5,116.9,114.1,112.2,55.4,21.3。C17H15N4O HRMS(ESI)([M+H]+)计算值291.124 1,测试值291.124 4。
1-对甲苯基-4-氰基-5-间氯苯基-1,2,3-三氮唑(3r):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点137~139 ℃,产率86%。1H NMR(400 MHz,CDCl3) δ 7.47 (m,1H), 7.39 (m,1H), 7.33(m,1H),7.30-7.28(m,2H),7.25-7.19(m,3H),2.44(s,3H)。13C NMR(101 MHz,CDCl3) δ 159.9,142.9,140.7, 132.9,130.5,130.3,125.0,124.5,121.2,120.5,116.9, 114.1,112.2,55.4,21.3。C16H12ClN4 HRMS(ESI)([M+H]+)计算值294.074 5,测试值295.074 8。
1-对甲苯基-4-氰基-5-噻吩基-1,2,3-三氮唑(3s):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点104~106 ℃,产率45%。1H NMR(400 MHz,CDCl3) δ 7.50(m,2H),7.37(m,2H),7.31(m,2H),7.13-7.10(m,1H),2.49(s,3H)。13C NMR(101 MHz,CDCl3) δ 141.8,138.3,132.4,130.9,130.5,130.5,128.1, 126.3,123.5,118.9,112.4,21.5。C14H11N4S HRMS(ESI)([M+H]+)计算值267.069 9,测试值267.070 3。
1-对甲苯基-4-氰基-5-呋喃基-1,2,3-三氮唑(3t):洗脱剂V(石油醚)/V(乙酸乙酯) = 5/1,白色固体,熔点137~139 ℃,产率64%。1H NMR(400 MHz,CDCl3) δ 7.57(s,1H),7.41-7.32(m,4H),6.53-6.46(m,2H),2.50(s,3H)。13C NMR(101 MHz,CDCl3) δ 145.5,141.5,138.7,134.6,133.0,130.4,125.7,117.9,114.1,112.2,112.0,21.4。C14H11N4O HRMS(ESI) ([M+H]+)计算值251.092 7,测试值251.093 3。
2" "结果与讨论
2.1" "反应条件优化
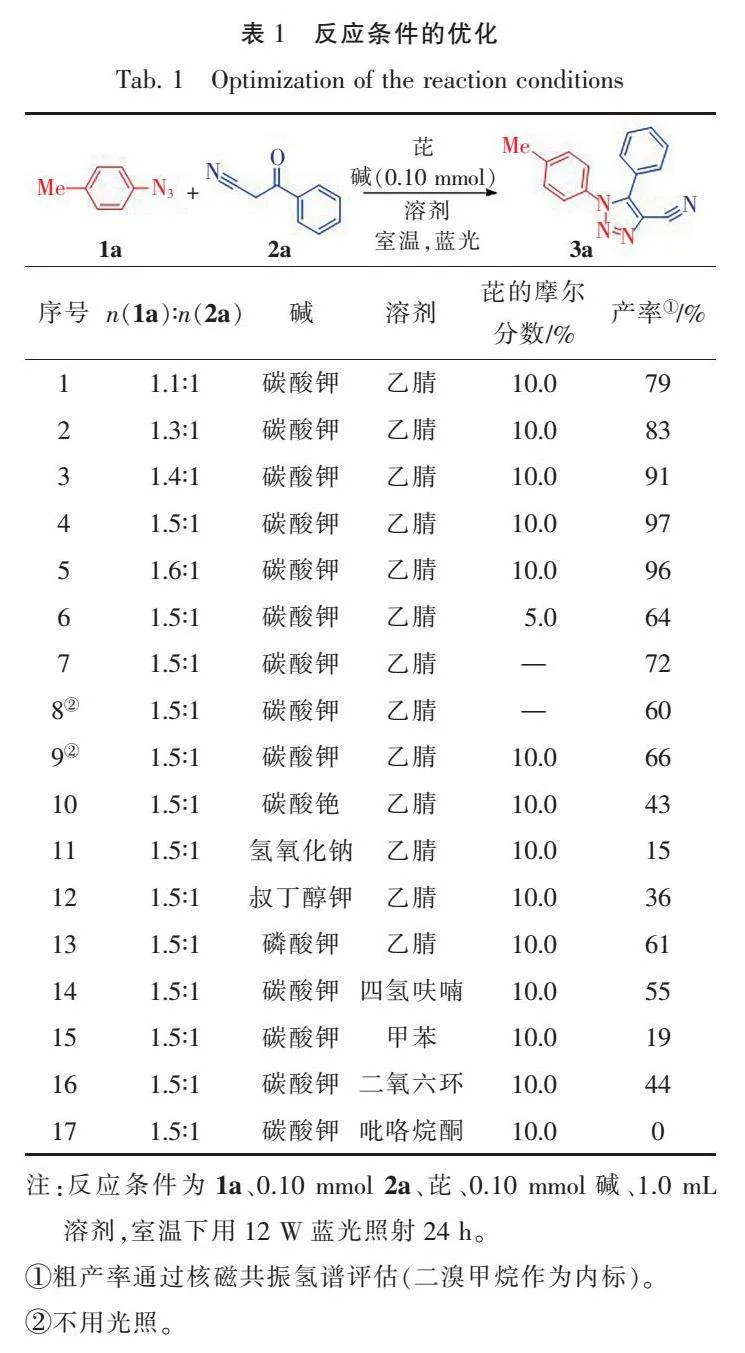
首先测试了对甲苯基叠氮化物1a与苯甲酰乙腈2a在可见光介导的有机光敏剂芘催化下进行反应的产率(表1)。该反应仅以79%的产率提供了预期的产物3a(序号1)。随后,尝试调控1a与2a的摩尔比例,发现当n(1a)∶n(2a)为1.5∶1时,收率达到最高,为97%(序号2—5)。当降低光敏剂芘的参与量时,产率明显下降为64%(序号6)。在无芘参与的可见光介导下,反应收率仅有72%(序号7),而在无可见光的介导下,收率更低,仅60%(序号8)。同时,尝试了芘参与的无可见光介导下,反应体系以66%的收率获得目标产物(序号9)。随后,分别尝试了将碳酸铯、氢氧化钠、叔丁醇钾和磷酸钾作为碱应用于该反应,遗憾的是,没有得到更好的反应收率(序号10—13)。最后,我们尝试了不同类型的溶剂,实验结果表明,四氢呋喃、甲苯和二氧六环能够促进反应的发生,而强极性的吡咯烷酮对该反应是无效的(序号14—17)。最终确定n(1a)∶n(2a)为1.5∶1、碱为碳酸钾、溶剂为乙腈、芘为光敏剂在12 W蓝光下为最优的反应条件。
2.2" "反应底物拓展
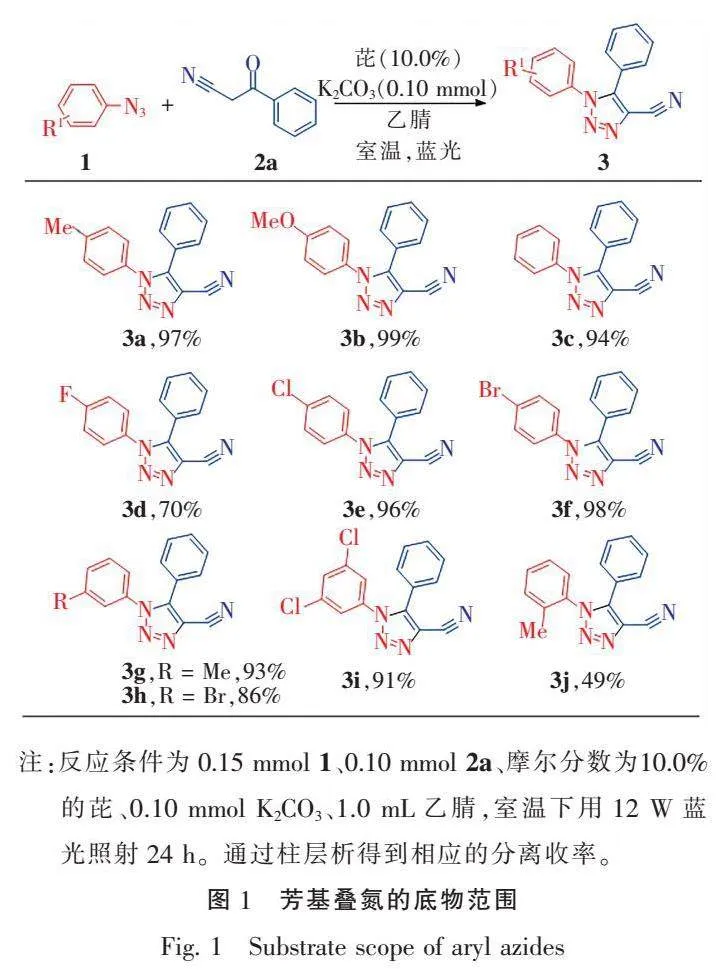
在最优条件下,进行了底物拓展。首先,对芳基叠氮的底物范围进行了探索(图1)。实验结果表明,当芳基叠氮对位含取代基时,无论是吸电子还是给电子基(如对甲基、对甲氧基、对氟、对氯、对溴)均能顺利参与反应,收率最高达99%(3a—3f)。对于间位取代的芳基叠氮(如间甲基、间溴和3,5-二氯),电子效应对反应也几乎无影响,收率在86%~93%之间(3g—3i)。当芳基叠氮的取代基在邻位时(如邻甲基),反应收率仅为49%(3j),说明位阻对反应影响较大。
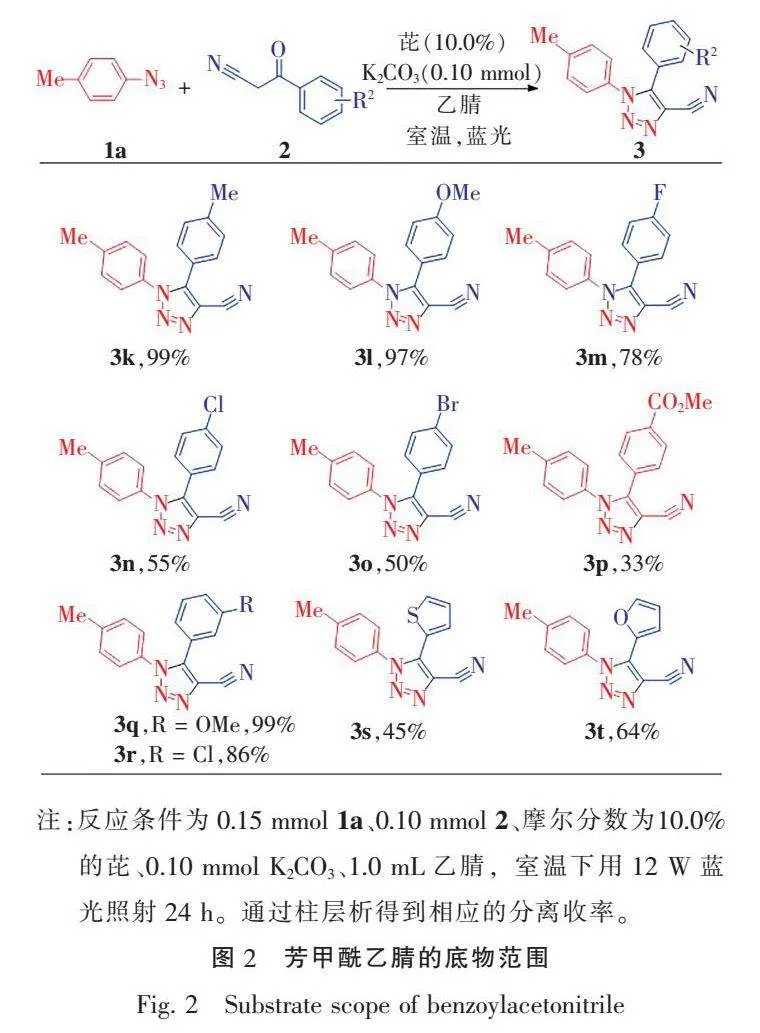
随后,在最优的条件下,对芳甲酰乙腈的底物范围进行了探索(图2)。由实验数据可知,电子效应对反应具有一定影响,即芳甲酰乙腈对位为给电子基(如对甲基和对甲氧基)反应效果明显优于吸电子基(如对氟、对氯、对溴及对甲酸甲酯),收率在33%~99%之间(3k—3p)。但对于间位取代的芳甲酰乙腈,电子效应对反应影响不大,如间甲氧基和间氯取代的芳甲酰乙腈参与反应的收率分别为99% (3q)和86%(3r)。令人欣慰的是,杂芳甲酰乙腈也能顺利参与反应,且收率中等(3s和3t)。
基于前期的研究工作及相关文献报道,我们提出了可能的反应机理(图3)。首先可见光引发芘,得到激发态的芘,随后激发态的芘通过能量传递,将光能转化为内能。芳甲酰乙腈在无机碱作用下首先去质子化,脱去一分子H+,然后再经互变异构,得到中间体A。随后A与芳基叠氮进行[3 + 2]环加成,得到中间体B,B与形成的KHCO3经质子交换,得到中间体B′,最后B′在碱性条件下脱去一分子水得到目标产物3。
3" "结束语
综上所述,本研究发展了一种基于可见光介导的有机光敏剂催化下,叠氮与苯甲酰乙腈作为底物参与[3 + 2]环加成反应的新方法。该策略以中等至较好的收率得到了一系列1,4,5-取代的1,2,3-三氮唑化合物。该反应体系具有条件温和、区域选择性高、官能团兼容性好等优点,为实现1,2,3-三氮唑衍生物的合成提供了一种有效的反应途径。
参考文献:
[ 1 ] NELSON R, KESTERNICH V, P?魪REZ-FEHRMANN M, et al. Regiospecific synthesis of 1,4,5-trisubstituted 1,2,3-triazoles via enolate-azide cycloaddition between 1,3-dicarbonyl compounds and aryl azides[J]. Journal of Chemical Research, 2016, 40(8):453-457.
[ 2 ] AGALAVE S G, MAUJAN S R, PORE V S. Click chemistry:1,2,3-triazoles as pharmacophores[J]. Chemistry-An Asian Journal, 2011, 6(10):2696-2718.
[ 3 ] CAMPOS V R, ABREU P A, CASTRO H C, et al. Synthesis, biological, and theoretical evaluations of new 1,2,3-triazoles against the hemolytic profile of the Lachesis muta snake venom[J]. Bioorganic amp; Medicinal Chemistry, 2009, 17(21):7429-7434.
[ 4 ] DANENCE L J T, GAO Y J, LI M G, et al. Organocatalytic enamide-azide cycloaddition reactions:regiospecific synthesis of 1,4,5-trisubstituted-1,2,3-triazoles[J]. Chemistry-A European Journal, 2011, 17(13):3584-3587.
[ 5 ] WANG L, PENG S Y, DANENCE L J T, et al. Amine-catalyzed[3+2] huisgen cycloaddition strategy for the efficient assembly of highly substituted 1,2,3-triazoles[J]. Chemistry-A European Journal, 2012, 18(19):6088-6093.
[ 6 ] LI W J, WANG J. Lewis base catalyzed aerobic oxidative intermolecular azide-zwitterion cycloaddition[J]. Angewandte Chemie International Edition, 2014, 53(51):14186-14190.
[ 7 ] SEUS N, GON■ALVES L C, DEOBALD A M, et al. Synthesis of arylselanyl-1H-1,2,3-triazole-4-carboxylates by organocatalytic cycloaddition of azidophenyl arylselenides with β-keto-esters[J]. Tetrahedron, 2012, 68(51):10456-10463.
[ 8 ] COSTA G P, SEUS N, ROEHRS J A, et al. Ultrasound-promoted organocatalytic enamine-azide[3 + 2] cycloaddition reactions for the synthesis of ((arylselanyl)phenyl-1 H-1,2,3-triazol-4-yl)ketones[J]. Beilstein Journal of Organic Chemistry, 2017, 13:694-702.
[ 9 ] ALIMI I, REMY R, BOCHET C G. Photochemical C-H activation:generation of indole and carbazole libraries, and first total synthesis of clausenawalline D[J]. European Journal of Organic Chemistry, 2017, 2017(22):3197-3210.
[10] KUMAR A S, GHULE V D, SUBRAHMANYAM S, et al. Synthesis of thermally stable energetic 1,2,3-triazole derivatives[J]. Chemistry-A European Journal, 2013, 19(2):509-518.
[11] DE SOUZA R O M A, DE MARIZ E MIRANDA L S. Strategies towards the synthesis of N2-substituted 1,2,3-triazoles[J]. Anais Da Academia Brasileira De Ciencias, 2019, 91(Sup 1):e20180751.
[12] KUMARI D, BANERJEE S. 1,2,3-Triazoles by click chemistry using azido esters as a precursor[J]. Propellants, Explosives, Pyrotechnics, 2020, 45(12):1845-1852.
[13] GARC?魱A-MORENO M I, RODR?魱GUEZ-LUCENA D, MELLET C O, et al. Pseudoamide-type pyrrolidine and pyrrolizidine glycomimetics and their inhibitory activities against glycosidases[J]. The Journal of Organic Chemistry, 2004, 69(10):3578-3581.
[14] ALLEN L J, CABRERA P J, LEE M, et al. N-Acyloxyphthalimides as nitrogen radical precursors in the visible light photocatalyzed room temperature C-H amination of arenes and heteroarenes[J]. Journal of the American Chemical Society, 2014, 136(15):5607-5610.
[15] JONES G H, EDWARDS D W, PARR D. A room temperature photochemical dehydrogenation catalyst[J]. Journal of the Chemical Society, Chemical Communications, 1976(23):969.
[16] JAMES M J, SCHWARZ J L, STRIETH-KALTHOFF F, et al. Dearomative cascade photocatalysis:divergent synthesis through catalyst selective energy transfer[J]. Journal of the American Chemical Society, 2018, 140(28):8624-8628.
[17] SKUBI K L, BLUM T R, YOON T P. Dual catalysis strategies in photochemical synthesis[J]. Chemical Reviews, 2016, 116(17):10035-10074.
[18] UOYAMA H, GOUSHI K, SHIZU K, et al. Highly efficient organic light-emitting diodes from delayed fluorescence[J]. Nature, 2012, 492:234-238.
[19] WU Y N, CHEN K, GE X, et al. Redox-neutral P(O)-N coupling between P(O)-H compounds and azides via dual copper and photoredox catalysis[J]. Organic Letters, 2020, 22(15):6143-6149.
[20] WU Y N, ZHANG Y P, JIANG M J, et al. Synergistic combination of visible-light photo-catalytic electron and energy transfer facilitating multicomponent synthesis of β-functionalized α, α-diarylethylamines[J]. Chemical Communications, 2019, 55(45):6405-6408.
[21] ALT I T, GUTTROFF C, PLIETKER B. Iron-catalyzed intramolecular aminations of C(sp3)-H bonds in alkylaryl azides[J]. Angewandte Chemie International Edition, 2017, 56(35):10582-10586.
(责任编辑:张燕)
收稿日期: 2023-11-28 接受日期: 2024-01-02
基金项目: 南通市科技基础科学研究青年科技人才创新专项项目(JC12022052)
第一作者简介: 吴亚男(1991— ), 女, 讲师, 博士。
* 通信联系人: 吴新星(1987— ), 男, 副教授, 博士, 主要研究方向为有机合成方法学。E-mail:wuxinxng@163.com
