基于显微共聚焦拉曼光谱与多靶标适配体微流控技术鉴定鼻咽癌循环肿瘤细胞的方法
2024-11-20吴紫曼郭非凡武薇豆小李健张秀明熊丹

摘要:目的 "建立一种基于显微共聚焦拉曼光谱技术的鼻咽癌循环肿瘤细胞鉴定方法,实现对鼻咽癌循环肿瘤细胞的无接触、无标记检测。方法 "体外培养人T淋巴细胞白血病细胞株Jurkat和鼻咽癌细胞株Sune1,利用EpCAM、CD44、EGFR和波形蛋白适配体组装的纳米微流控芯片技术识别和亲和捕获单细胞,并使用显微共聚焦拉曼光谱技术对单细胞进行鉴定,得到单细胞拉曼光谱。以两种机器学习算法:支持向量机和线性判别分析构建分类器,对单细胞拉曼光谱进行建模分析。结果 "共采集得到474个Jurkat细胞与Sune1细胞的单细胞拉曼光谱,其峰位分析结果显示:与Jurkat细胞相比,Sune1细胞中的腺嘌呤、胸腺嘧啶和鸟嘌呤含量显著下降(Plt;0.0001);羟脯氨酸、蛋白质和脂类的含量显著上升(Plt;0.0001),差异有统计学意义。线性判别分析的预测准确率较高,能够有效区分两种细胞,预测准确率高达98.31%。结论 "本研究基于显微共聚焦拉曼光谱技术和机器学习算法,建立了一种可能适用于鉴定鼻咽癌循环肿瘤细胞的方法,可对鼻咽癌的临床微创诊断产生积极作用。
关键词:鼻咽癌;循环肿瘤细胞;显微共聚焦拉曼光谱技术;微流控芯片;机器学习;分离鉴定
Identification of circulating tumour cells in nasopharyngeal carcinoma based on microconfocal Raman spectroscopy with multi-target aptamer microfluidics
WU Ziman1, 2, GUO Feifan2, WU Wei2, DOU Xiaowen2, LI Jian3, ZHANG Xiuming1, 2, XIONG Dan1, 2
1School of Medical Technology, Xinxiang Medical University, Xinxiang 453000, China; 2Department of Clinical Laboratory Medicine, the Third Affiliated Hospital of Shenzhen University, Shenzhen 518001, China; 3Department of Otolaryngology, the First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510000, China
Abstract: Objective To establish a method for the identification of nasopharyngeal carcinoma circulating tumor cells based on microconfocal Raman spectroscopy, in order to realize the non-contact and marker-free detection of nasopharyngeal carcinoma circulating tumor cells. Methods Human T lymphocytic leukemia cell line Jurkat and nasopharyngeal carcinoma cell line Sune1 were cultured in vitro, and single cells were identified and affinity captured by nanomicronic chip technology assembled by EpCAM, CD44, EGFR and vimentin aptamer. The single cells were identified by microconfocal Raman spectroscopy to obtain single cell Raman spectroscopy. Two machine learning algorithms, support vector machine and linear discriminant analysis, were used to construct a classifier to model and analyze single-cell Raman spectra. Results Single-cell Raman spectra of 474 Jurkat cells and Sune1 cells were collected. Peak location analysis results showed that the contents of adenine, thymine and guanine in Sune1 cells decreased significantly compared with Jurkat cells. The contents of hydroxyproline, protein and lipids increased significantly, and the differences were statistically significant. Linear discriminant analysis had a high prediction accuracy, which could effectively distinguish the two types of cells, and the prediction accuracy was as high as 98.31%. Conclusion Based on microconfocal Raman spectroscopy and machine learning algorithms, this study established a method that may be suitable for the identification of nasopharyngeal carcinoma circulating tumor cells, which has a positive effect on the clinical minimally invasive diagnosis of nasopharyngeal carcinoma.
Keywords: nasopharyngeal carcinoma; circulating tumor cells; microconfocal raman spectroscopy; microfluidic chip; machine learning; separation and identification
鼻咽癌作为一种具有高度侵袭性和转移性的头颈部癌,其早期诊断对于改善患者预后至关重要[1]。鼻咽癌的发病是一个复杂的过程,EB病毒感染是其最重要的诱因。EB病毒可通过其编码的蛋白,如LMP1等,干扰人鼻咽黏膜上皮细胞的正常功能,导致细胞无限制增殖和凋亡抑制[2]。此外,遗传因素、环境因素、表观遗传学改变以及免疫微环境的失调等也共同参与了鼻咽癌的发生发展[3]。鼻咽癌的早期诊断一直是临床难题。目前常用的诊断方法包括以鼻咽镜为主的内镜检查,以CT、MRI为主的影像学检查以及病理学检查。然而,这些方法在早期鼻咽癌的诊断上存在一定的局限性。鼻咽镜检查虽然能直接观察鼻咽部病变,但具有一定的侵入性,且对隐匿性病变的检出能力有限。影像学检查虽无侵入性,但对早期微小病变的敏感性不足。病理学检查是确诊的金标准,但穿刺活检等操作具有一定侵入性[4, 5]。其他的辅助检查如EB病毒相关抗体检测又存在特异性不足的问题[6]。因此,开发新的、更灵敏和更具特异性的鼻咽癌早期诊断技术具有很高的临床价值。循环肿瘤细胞(CTCs)作为一种新型的液体活检标志物,目前已广泛应用于肺癌、乳腺癌、结直肠癌、前列腺癌等多种肿瘤的早期诊断、治疗监测、预后评估和耐药性监测,在鼻咽癌早期诊断中也具有广阔前景。相较于传统组织活检,CTCs检测具有敏感度高、特异度强、可重复性好等优势,其携带肿瘤的遗传信息,可以通过无创的方式实现肿瘤的早期检测和动态监测,有望成为鼻咽癌个体化治疗的重要辅助手段[7]。显微共聚焦拉曼光谱技术(MCRS)作为一种新型分析技术,具有非破坏性、非侵入性、空间分辨率高和准确率高等优点,能够在无接触、无标记的情况下对细胞进行近乎实时的检测[7, 8]。MCRS技术已被成功应用于各种肿瘤的诊断和监测,包括乳腺癌、肺癌、结直肠癌等[9-11]。然而,目前关于MCRS技术在鼻咽癌CTCs鉴定中的应用研究尚不充分。本研究旨在解决鼻咽癌早期诊断的难题,建立一种结合显微共聚焦拉曼光谱和多靶标适配体微流控技术的循环肿瘤细胞鉴定新方法。利用显微共聚焦拉曼光谱,初步探索了鼻咽癌细胞系与人T淋巴细胞白血病细胞系在分子振动水平的差异,结果表明两类细胞的拉曼光谱存在显著差异,提示拉曼光谱技术在肿瘤细胞的非侵入性、无标记检测方面具有潜在应用价值,现报道如下。
1 "材料与方法
1.1 "材料与试剂
生物材料:生物素修饰的核酸适配体序列如下:
EPCAM(5ʹ to 3ʹ, Biotin-C6 spacer
CACTACAGAGGTTGCGTCTGTCCCACGTTGTCA
TGGGGGGTTGGCCTG)
Vimentin (5' to 3', Biotin‑C6 spacer
CACGCATAGCCTTTGCTCCTCGTCTGGAACGTCGCAGCTTTAGTTCTGGGCCTATGCGT)
EGFR (5' to 3', Biotin-C6 spacer
TACCAGTGCGATGCTCAGTGCCGTTTCTTCTCTTTCGCTTTTTTTGCTTTTGAGCATGCTGACGCATT
CGGTTGAC)
CD44 (5ʹ to 3ʹ, Biotin-C6 spacer
GGGATGGATCCAAGCTTACTGGCATCTGGATTTGCGCGTGCCAGAATAAAGAGTATAACGTGTGAA
TGGGAAGCTTCGATAGGAATTCGG)。
由生工生物工程(上海)股份有限公司合成并经HPLC纯化。
1.2 " 实验方法
1.2.1 "样本制备 " 人类T淋巴细胞白血病细胞系Jurkat在含有10% FBS(GIBCO)的RPMI1640(GIBCO)培养基中培养。鼻咽癌细胞系Sune1培养于含有5% FBS(GIBCO)的RPMI1640(GIBCO)培养基。所有细胞均在37 ℃,5%(vol/vol)CO2培养箱中生长。
3例鼻咽癌患者外周血样本来自中山大学附属第一医院,获得知情同意后,取2 mL外周血入BD真空容器EDTA-2K中。然后采用Ficoll密度梯度离心法获得外周血的PBMC。样品在6 h内进行处理。患者的采血点均于诊断后通过抽吸活检采集。本研究经中山大学医院附属第一医院临床科研和实验动物伦理委员会批准(审批号:伦审[2020]483号)。
1.2.2 "微流控技术分离与免疫荧光技术鉴定 " 用PBS将链霉亲和素配置成1 mg/mL的溶液储备。使用时将储备液用PBS稀释成10 μg/mL,滴加100 μL至五通道微流控芯片基底,37 ℃孵育1 h,PBS清洗3次, 37 ℃干燥。将Sune1细胞与Jurkat细胞按一定比例混合制备成模拟外周血样本。向模拟样本与临床患者的PBMC细胞悬液中分别加入4 μL含10 μmol/L生物素修饰的 EPCAM、CD44、Vimentin、EGFR 溶液;37 ℃缓慢振荡孵育1 h,800 r/min离心5 min;PBS清洗3次,加入RPMI 1640或DMEM培养基重悬至200 μL,上机检测。基于既往研究[12]的方法,本实验前期使用压印技术制备了一种微通道和微室集成的可用于细胞捕获和分选的功能化纳米基底微流控芯片装置。该芯片装置以涡流区域结合纳米结构基底,利用梯度剪切力对CTCs选择性富集。使用链霉亲和素修饰芯片表面,将悬浮PBMC溶液以0.5 mL/h的流速注入组装芯片的微流控系统中;使用RPMI 1640清洗芯片,90%的甲醇固定细胞;分选后,用PBS清洗芯片,进行免疫荧光染色。荧光抗体CD45(555 nm)、EpCAM(651 nm)、PCK(488 nm)、Vimentin(647 nm)染色标记,DAPI染色鉴定细胞核。CD45(-)EpCAM(+)DAPI(+)可以鉴定为 CTCs阳性。
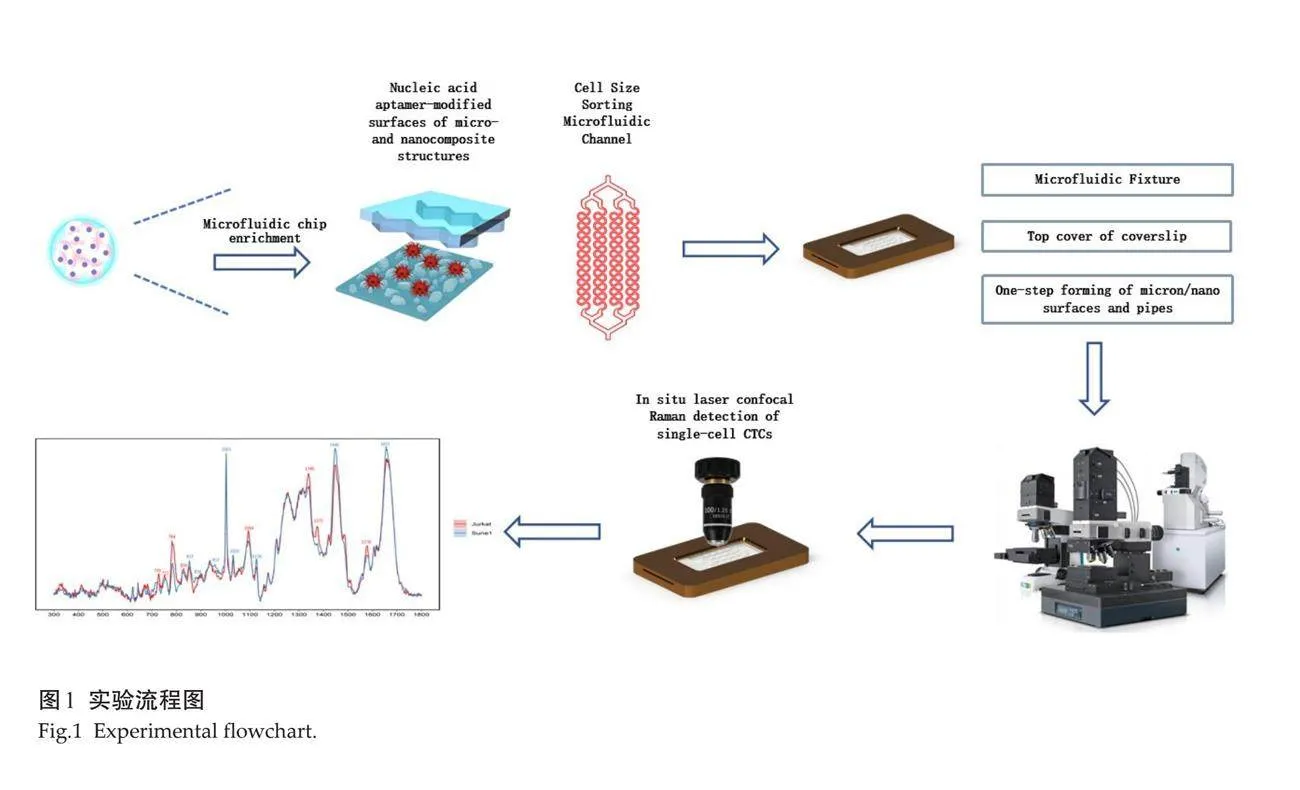
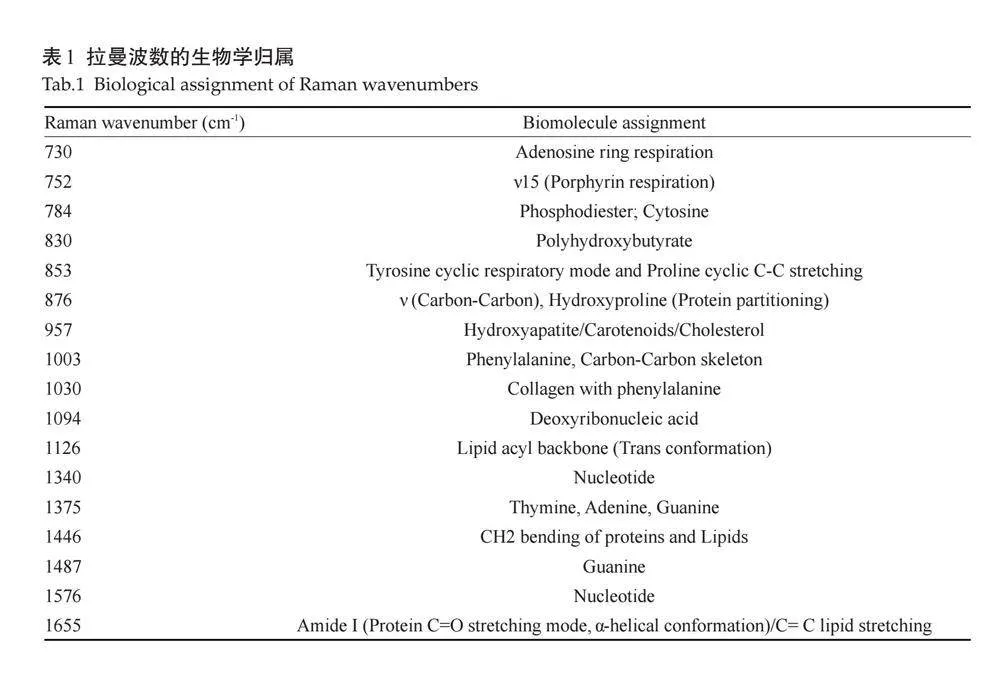
1.2.3 "显微共聚焦拉曼光谱技术检测 " 经过多靶标适配体纳米芯片微流控技术分选后,对Jurkat和Sune1细胞系进行了单细胞拉曼光谱分析。将Jurkat和Sune1细胞系消化成单细胞,PBS洗涤1次,4%(vol/vol)多聚甲醛固定15 min,PBS洗涤3次。采用显微共聚焦拉曼光谱仪(WitecA300)获得样品的单细胞拉曼光谱(100×物镜,激光功率:20~21 mW)。测量前,用硅片对光谱仪进行校准,使其拉曼峰位于520.73 cm-1处。将Jurkat细胞株和Sune1细胞株置于60倍水镜进行检测。光谱范围280~2187 cm-1,用1200个凹槽/mm的衍射光栅在10 s积分时间内记录光谱。利用显微共聚焦拉曼光谱仪,从每个细胞的顶部、底部、左侧、右侧和中间等5个位置采集了至少5个光谱点。Jurkat细胞采集71个细胞,采集285个光谱;Sune1采集48个细胞,采集189个光谱,共采集474个光谱。差异波数及对应的生物分子结构类型(表1),实验流程(图1)。
1.3 "统计学分析
本研究使用labspec-6软件对Jurkat细胞系和Sune1细胞系的单细胞拉曼光谱进行去背景和矢量归一化处理。根据拉曼光谱分离不同的组别,采用线性判别分析(LDA),对三维或二维拉曼光谱进行可视化处理。通过计算相应的拉曼带的强度,对细胞内的生物分子进行半定量,两组间差异的比较采用t检验。为了建立能够区分Jurkat细胞和Sune1细胞的预测模型,首先对两种细胞的单细胞拉曼光谱数据进行分类。随后,分别随机抽取75%的数据作为训练集,剩余的25%作为测试集。基于训练集,构建预测模型,并利用测试集对模型的性能进行评估。首先,采用主成分分析(PCA)对高维数据进行降维。通过PCA,将每个单细胞的拉曼光谱特征转化为不相关的、能够最大程度解释数据方差的前100个主成分。随后,分别利用LDA和支持向量机(SVM)两种分类算法,对降维后的数据进行分类。为找到最适合区分Jurkat细胞和Sune1细胞的分类器,比较两种模型在测试集上的分类性能。采用二进制分类的混淆矩阵,计算敏感度、特异度和总体准确性,计算公式:敏感度=真阳性数量/(真阳性数量+假阴性数量),特异度=真阴性数量/(真阴性数量+假阳性数量),总体准确性=(真阴性数量+真阳性数量)/(假阴性数量+真阳性数量+真阴性数量+假阳性数量)。
2 "结果
2.1 "微流控技术与免疫荧光技术分离鉴定
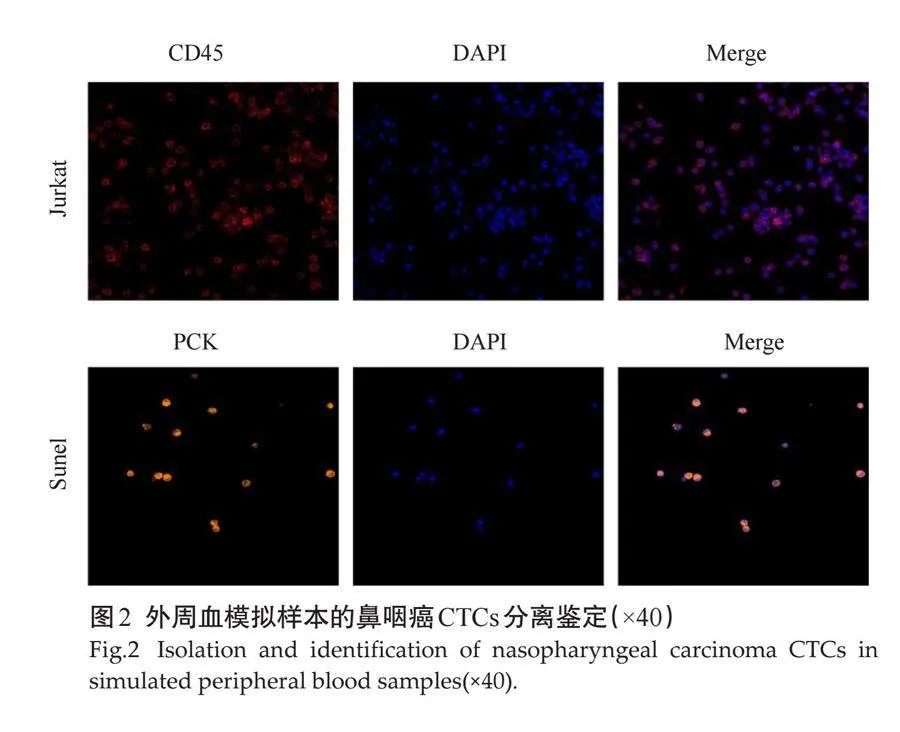
Jurkat细胞和Sunel细胞混合样本经多靶标适配体纳米芯片微流控技术分离后,免疫荧光染色(采用CD45和PCK抗体)结果显示:分离后的Jurkat细胞核周出现CD45强阳性荧光,而Sune1细胞胞浆出现PCK强阳性荧光,该装置能高效、准确地分离两种细胞(图2)。
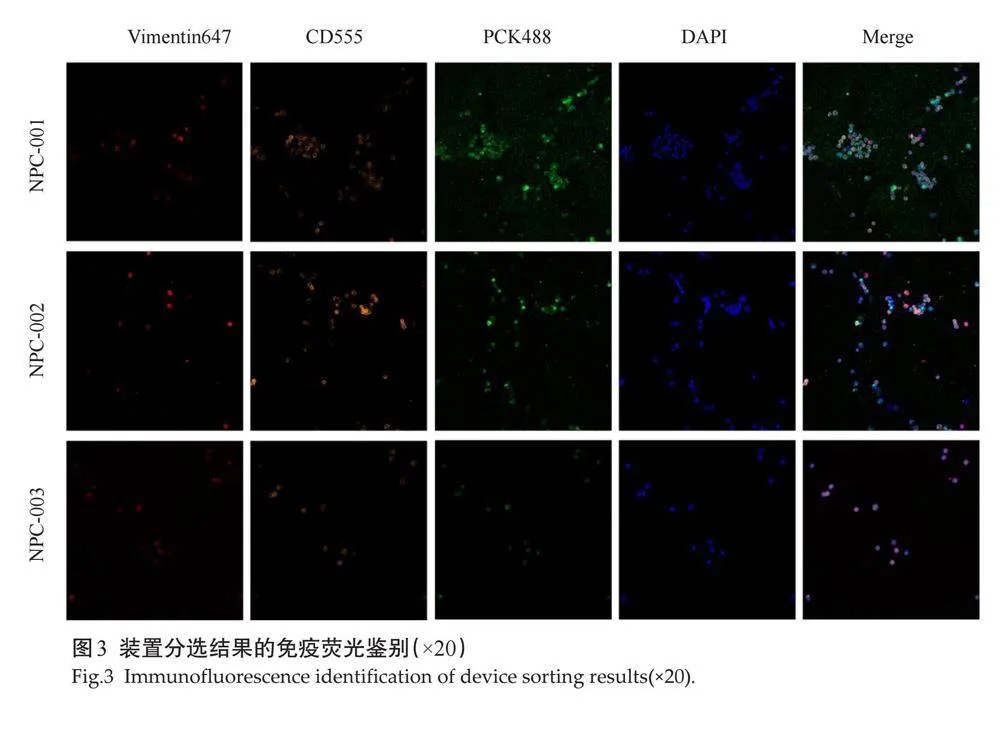
使用上述装置对3例鼻咽癌患者的外周血样本进行了处理,成功分离并富集到了鼻咽癌CTCs。免疫荧光染色结果显示:NPC-001样本中检测到5个上皮型CTCs;NPC-002样本中检测到3个上皮型和1个间质型CTCs;NPC-003样本中检测到1个混合型CTCs(图3)。
2.2 "机器学习对两种细胞系的光谱数据结构分析
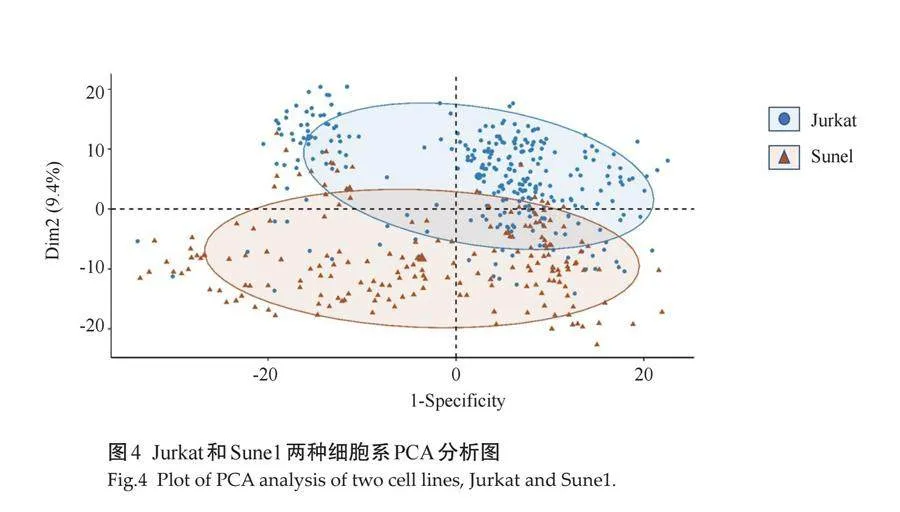
对474个单细胞拉曼光谱数据进行PCA降维分析的结果表明,Jurkat组和Sune1组在降维后的特征空间中呈现出明显的聚类趋势,两种细胞类型在拉曼光谱特征上存在显著差异,具有较好的区分度(图4)。利用SVM和LDA机器学习算法构建的分类模型结果显示,LDA模型在分类Jurkat细胞和Sune1细胞时表现卓越,预测准确率达到98.31%。混淆矩阵显示,仅有1个Jurkat细胞被误分类为Sune1细胞,而所有Sune1细胞均被正确分类(表2)。SVM模型虽然也取得了较高的准确率,但LDA模型在对两类细胞的分类上表现更为出色,基于拉曼光谱的LDA模型能够对Jurkat细胞和Sune1细胞进行高度准确、特异性的分类。
2.3 "Jurkat细胞系和Sune1细胞系的拉曼光谱及潜在光谱生物标志物差异分析
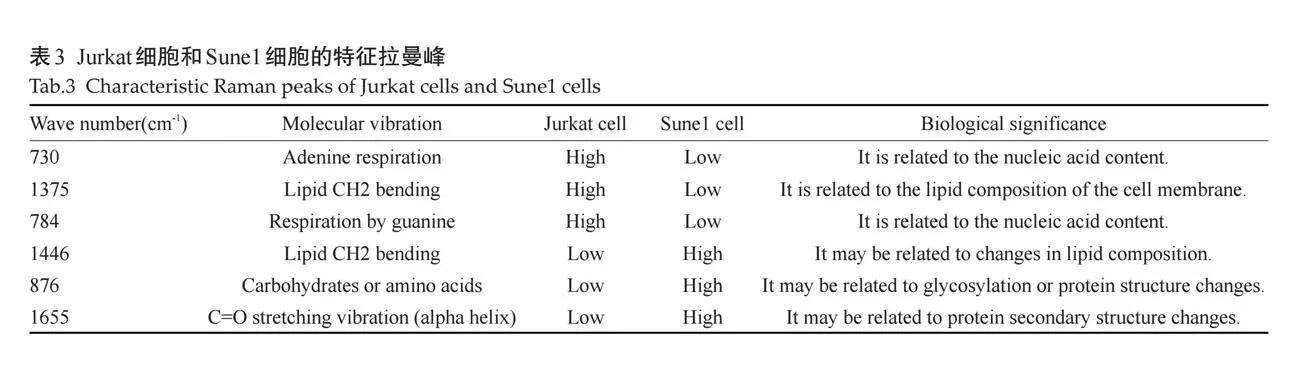
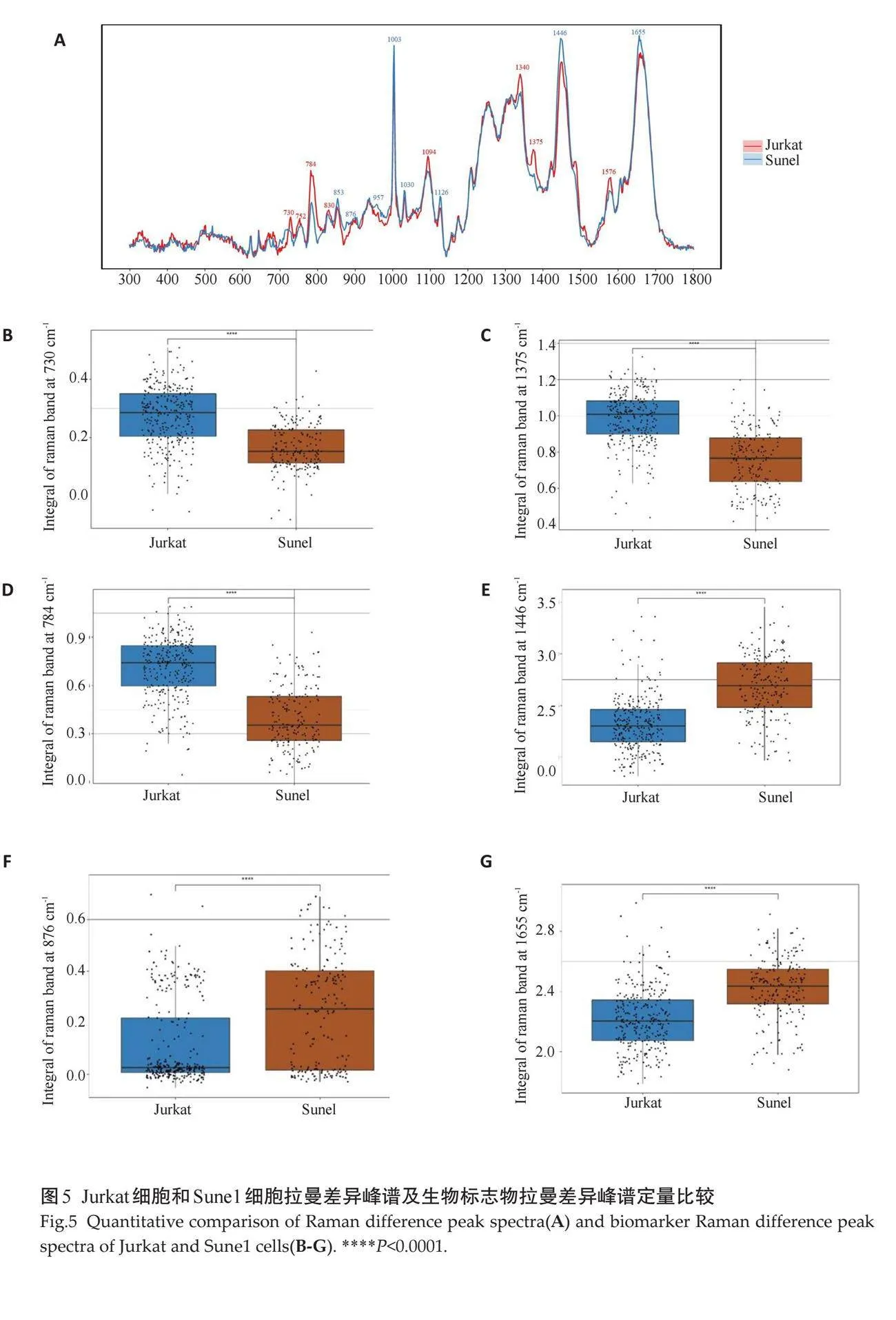
对Jurkat细胞和Sune1细胞的单细胞拉曼光谱采集的光谱信号进行去背景及归一化处理后,对两种细胞系进行分析,两种细胞系其生物振动分布于300~1800 cm-1(图5A)。与Jurkat细胞相比,差异显著的波数为730、752、784、830、853、876、957、1003、1030、1094、1126、1340、1375、1446、1487、1576、1655 cm-1。通过半定量的方式来评估Sune1细胞的差异,与Jurkat细胞相比,Sune1细胞在730、752、784、830、1094、1340、1375、1487和1576 cm-1的光谱强度相对降低,其最显著差异在于730、1375和784 cm-1光谱峰(图5B~D)。同样,与Jurkat细胞相比,Sune1细胞在853、876、957、1003、1030、1126、1446、1655 cm-1光谱峰强度相对增高,其中最显著差异在1446、876和1655 cm-1 光谱峰(图5E~G)。Jurkat细胞和Sune1细胞差异有统计学意义的拉曼光谱特征峰所对应的生物分子结构及其生物学意义(表3)。
3 "讨论
鼻咽癌是一种好发于鼻咽部上皮组织的恶性肿瘤,早期症状不典型,多数患者确诊时已处于中晚期。CTCs作为肿瘤早期诊断和预后评估的重要生物标物,在多种肿瘤中受到广泛关注[13-14]。相较于传统的影像学检查,CTCs检测具有更早诊断的潜力。鼻咽癌患者的循环肿瘤细胞中通常表达EpCAM和CD44等标志物,其中,EpCAM是目前临床鼻咽癌CTCs捕获常用的靶标之一[15-16]。本研究初步建立了一种基于多靶标适配体微流控芯片和显微共聚焦拉曼光谱的鼻咽癌CTCs检测方法。利用EpCAM和CD44以及EGFR和波形蛋白4种核酸适配体构建的微流控芯片,实现了对鼻咽癌CTCs的高效捕获。随后,通过共聚焦拉曼光谱技术结合LDA,对捕获的鼻咽癌CTCs进行高特异性鉴定。本研究的无损检测技术,为后续的细胞培养、基因组学、蛋白质组学等下游分析提供了高质量的样本,有助于深入研究肿瘤的发生发展机制,为肿瘤的精准治疗提供新的思路。
本研究通过单细胞拉曼光谱强度半定量地显示细胞内蛋白质、核酸、脂质等的差异来区分模拟外周血中的鼻咽癌细胞和人T淋巴细胞白血病细胞。单细胞拉曼光谱不仅可以区分癌细胞和人T淋巴细胞白血病细胞,还可以用于识别不同的癌细胞系[17]。核酸、蛋白质和脂质是真核细胞的重要组成物,真核细胞含有共同光谱特征,例如大约1256 cm-1和1600 cm-1的峰表示酰胺 I 波段。芳香族氨基酸出现在1002 cm-1(苯丙氨酸)和656 cm-1(酪氨酸)附近。核酸的振动模式存在于789 cm-1和1090 cm-1[18]。与此同时,各组分条带的相对强度也可以分类出两类细胞的不同。本研究结果显示,Jurkat细胞系在730、1375、784 cm-1处的拉曼光谱峰值高于Sune1细胞系,这三处峰值分别来自细胞的腺嘌呤的对称呼吸模式、脂质中的 CH2 弯曲振动和鸟嘌呤的呼吸模式[19-21]。据报道,Jurkat细胞是一种常用于癌症研究的人T淋巴细胞,730 cm-1、1375 cm-1和784 cm-1 处的拉曼峰是 Jurkat 细胞拉曼光谱中的突出特征[22]。当Jurkat细胞经历活化和凋亡时这些峰值的强度能够反映其生化组成和代谢状态的改变。本研究发现,Sune1细胞系在1446 cm-1、876 cm-1和1655 cm-1处的拉曼光谱峰值高于Jurkat细胞系。与Jurkat细胞相比鼻咽癌的脂质成分可能发生变化,例如饱和脂肪酸水平升高,多不饱和脂肪酸水平降低,因此1446 cm-1峰的强度增加,通常与细胞膜中的脂质 CH2 弯曲振动有关[23]。癌细胞通常表现出与正常细胞不同的糖基化模式,碳水化合物骨架振动或特定氨基酸的环振动,可能会导致Sune1 细胞中876 cm-1峰的强度增加[24]。据报道,鼻咽癌细胞可能具有与正常细胞不同的蛋白质表达谱,导致α螺旋蛋白含量增加[25]。由于1655 cm-1峰值与蛋白质肽骨架中的 C=O 伸展振动有关,特别是α螺旋结构,这就可能导致Sune1细胞在该峰的强度增加。因此,显微共聚焦拉曼光谱技术在鼻咽癌细胞鉴定方面展现出广阔的应用前景。通过建立更完善的谱库和分析模型,并结合其他组学数据,有望实现对鼻咽癌细胞的精准分类和早期诊断。本研究发现,鼻咽癌细胞与人T淋巴细胞白血病细胞在核酸、蛋白质和脂质等生物分子组成上存在显著差异,这些差异反映了肿瘤细胞独特的生物学特征,如DNA损伤修复机制异常、蛋白质折叠异常和细胞代谢改变。通过分析拉曼光谱特征峰,可以深入了解鼻咽癌细胞的代谢通路,为鼻咽癌的早期诊断、肿瘤分型、药物筛选和耐药机制研究提供新的思路[26]。
本研究测试了SVM和LDA两种常用的机器学习的方法构建分类器。实验结果表明,在我们的数据集上,LDA算法的分类准确率达到了98.31%,显著优于SVM算法。由于本研究的数据呈现出较强的线性可分性,LDA能够有效地找到数据的最佳投影方向,从而实现准确分类。LDA算法的计算效率高,适用于大规模数据集的分析。相比之下,SVM算法在处理非线性数据方面具有优势,但在我们的线性可分数据集上,其性能受到了限制。 此外,SVM算法对参数的敏感性较高,需要进行细致的调优。综上所述,在本实验中,LDA算法展现出了更好的性能。
本研究初步验证了显微共聚焦拉曼光谱技术能够根据鼻咽癌CTCs独特的拉曼光谱特征,高灵敏性和特异性地将鼻咽癌细胞株Sune1与Jurkat细胞。显微共聚焦拉曼光谱技术结合多靶标适配体微流控芯片,为CTCs的检测提供了一种高效、特异且无损的新方法。本研究通过比较鼻咽癌CTCs与Jurkat细胞的拉曼光谱,发现两者在核酸、蛋白质和脂质等生物分子组成上存在显著差异。揭示其独特的分子特征和代谢状态等信息,从而实现对鼻咽癌CTCs的高灵敏度和高特异度检测。与传统的CTCs检测方法相比,本方法具有无标记、无损、高通量、多参数分析等优势[27]。此外,结合机器学习算法,如LDA,可以进一步提高检测的准确性。本研究不仅为鼻咽癌的早期诊断提供了新的技术手段。本研究分别捕获了Jurkat细胞和Sune1细胞的单个光谱峰,下一步将模拟人体血细胞的形式进行比例混合检测,寻找上皮细胞和淋巴细胞的拉曼差异光谱峰,实现CTCs的鉴定;进一步收集临床患者的标本,结合显微共聚焦拉曼光谱技术和算法实现单细胞拉曼光谱鉴定循环肿瘤细胞的目的,以期建立基于多靶标适配体微流控技术与显微共聚焦拉曼光谱技术一体化的分离及鉴定CTCs的平台,从而实现对临床患者CTCs的检测,为患者的早期诊断、伴随诊断等提供平台支撑。非破坏性、非侵入性的CTCs识别鉴定技术则能够使CTCs保持较高的细胞活力、真实样本的检出率以及捕获的CTCs的数量等,有利于对CTCs进行下游的实验。CTCs的下游分析有助于识别与治疗相关的特定分子靶点,扩展对侵袭、迁移和免疫监视相关基本分子通路的理解,识别更具侵袭性的肿瘤细胞,促进个体化治疗的发展。
参考文献:
[1] " "薛 "飞, 张 "婷, 王 "锐, 等. 鼻咽癌的临床特征及诊断治疗进展[J]. "医学研究生学报, 2022, 35(11): 1213-8.
[2] " Bruce JP, To KF, Lui VWY, et al. Whole‑genome profiling of nasopharyngeal carcinoma reveals viral‑host co‑operation in inflammatory NF‑κB activation and immune escape[J]. "Nat Commun, 2021, 12(1): 4193.
[3] " Chen YP, Chan ATC, Le QT, et al. Nasopharyngeal carcinoma[J]. "Lancet, 2019, 394(10192): 64-80.
[4] " Juarez‑Vignon Whaley JJ, Afkhami M, Onyshchenko M, et al. Recurrent/metastatic nasopharyngeal carcinoma treatment from present to future: where are we and where are we heading?[J]. "Curr Treat Options Oncol, 2023, 24(9): 1138-66.
[5] " Zhang YM, Gong GZ, Qiu QT, et al. Radiomics for diagnosis and radiotherapy of nasopharyngeal carcinoma[J]. "Front Oncol, 2021, 11: 767134.
[6] " Liu WX, Chen G, Gong X, et al. The diagnostic value of EBV-DNA and EBV‑related antibodies detection for nasopharyngeal carcinoma: a meta-analysis[J]. "Cancer Cell Int, 2021, 21(1): 164.
[7] "Wang HP, Ma HZ, Fang PP, et al. Dynamic confocal Raman spectroscopy of flowing blood in bionic blood vessel[J]. "Spectrochim Acta A Mol Biomol Spectrosc, 2021, 259: 119890.
[8] "Gomes da Costa S, Richter A, Schmidt U, et al. Confocal Raman microscopy in life sciences[J]. "Morphologie, 2019, 103(341): 11-6.
[9] "Hanna K, Krzoska E, Shaaban AM, et al. Raman spectroscopy: current applications in breast cancer diagnosis, challenges and future prospects[J]. "Br J Cancer, 2022, 126: 1125-39.
[10]Kanmalar M, Abdul Sani SF, Kamri NINB, et al. Raman spectroscopy biochemical characterisation of bladder cancer cisplatin resistance regulated by FDFT1: a review[J]. "Cell Mol Biol Lett, 2022, 27(1): 9.
[11] Auner GW, Koya SK, Huang CH, et al. Applications of Raman spectroscopy in cancer diagnosis[J]. "Cancer Metastasis Rev, 2018, 37(4): 691-717.
[12] Li M, Liu D, Zhang J, et al. Aptamer-cocktail functionalized nano-microfluidic chip for enhancing isolation and characterization of circulating cancer cells[J]. "Anticancer Res, 2022, 42(9): 4345-58.
[13] Alix-Panabières C, Pantel K. Challenges in circulating tumour cell research[J]. "Nat Rev Cancer, 2014, 14(9): 623-31.
[14] Lin DF, Shen LS, Luo M, et al. Circulating tumor cells: biology and clinical significance[J]. "Signal Transduct Target Ther, 2021, 6(1): 404.
[15] Fagotto F, Aslemarz A. EpCAM cellular functions in adhesion and migration, and potential impact on invasion: a critical review[J]. "Biochim Biophys Acta Rev Cancer, 2020, 1874(2): 188436.
[16] Chen C, Zhao SJ, Karnad A, et al. The biology and role of CD44 in cancer progression: therapeutic implications[J]. "J Hematol Oncol, 2018, 11(1): 64.
[17] Lin J, Zheng JP, Wu AG. An efficient strategy for circulating tumor cell detection: surface-enhanced Raman spectroscopy[J]. "J Mater Chem B, 2020, 8(16): 3316-26.
[18]Noorani L, Stenzel M, Liang R, et al. Albumin nanoparticles increase the anticancer efficacy of albendazole in ovarian cancer xenograft model[J]. "J Nanobiotechnology, 2015, 13: 25.
[19] Huang HM, Li SS, Tang QL, et al. Metabolic reprogramming and immune evasion in nasopharyngeal carcinoma[J]. "Front Immunol, 2021, 12: 680955.
[20] Sobanski T, Rose M, Suraweera A, et al. Cell metabolism and DNA repair pathways: implications for cancer therapy[J]. "Front Cell Dev Biol, 2021, 9: 633305.
[21] Lieu EL, Nguyen T, Rhyne S, et al. Amino acids in cancer[J]. "Exp Mol Med, 2020, 52: 15-30.
[22]Tang P, Cheng WD, He XM, et al. Raman spectrum spectral imaging revealing the molecular mechanism of Berberine-induced Jurkat cell apoptosis and the receptor-mediated Berberine delivery system[J]. "Biomed Opt Express, 2019, 10(4): 1581-600.
[23] Zheng SX, Matskova L, Zhou XY, et al. Downregulation of adipose triglyceride lipase by EB viral‑encoded LMP2A links lipid accumulation to increased migration in nasopharyngeal carcinoma[J]. "Mol Oncol, 2020, 14(12): 3234-52.
[24]Kopec M, Imiela A, Abramczyk H. Monitoring glycosylation metabolism in brain and breast cancer by Raman imaging[J]. "Sci Rep, 2019, 9(1): 166.
[25] Li SX, Chen QY, Zhang YJ, et al. Detection of nasopharyngeal cancer using confocal Raman spectroscopy and genetic algorithm technique[J]. "J Biomed Opt, 2012, 17(12): 125003.
[26]Xu JB, Chen DY, Wu W, et al. A metabolic map and artificial intelligence-aided identification of nasopharyngeal carcinoma via a single-cell Raman platform[J]. "Br J Cancer, 2024, 130(10): 1635-46.
[27] Smit DJ, Pantel K. Circulating tumor cells as liquid biopsy markers in cancer patients[J]. "Mol Aspects Med, 2024, 96: 101258.
(编辑:郎 "朗)
