胃癌病人化疗致周围神经病变轨迹变化及预测因素研究
2024-11-08聂凤梅林琴张丽娟朱虹玉黄凤


Study on the trajectory changes and predictive factors of chemotherapy-induced peripheral neuropathy in gastric cancer patients
NIE Fengmei,LIN Qin,ZHANG Lijuan,ZHU Hongyu,HUANG Feng*Clinical Oncology School of Fujian Medical University/Fujian Cancer Hospital,Fujian 350014 China*Corresponding Author HUANG Feng,E-mail:378872169@qq.com
Keywords gastric cancer;chemotherapy;peripheral neuropathy;trajectory;latent class growth;nursing
摘要 目的:采用潜类别增长分析法对胃癌病人化疗所致周围神经病变(CIPN)的轨迹变化及预测因素进行分析。方法:2021年12月—2022年12月,采用一般资料调查表、化疗致周围神经病变评估工具、阿森斯失眠量表、广泛性焦虑障碍量表和癌因性疲乏问卷对福建某三级甲等肿瘤专科医院收治的150例初次化疗的胃癌病人进行调查,并于首次调查后的第3次化疗(T1)、第5次化疗(T2)、第7次化疗(T3)时随访病人的CIPN情况。采用潜类别增长分析拟合CIPN的异质性轨迹变化。结果:124例胃癌病人完成至少2次调查,拟合了3条CIPN的轨迹变化,分别是CIPN持续快速加重组(8.07%)、CIPN快速-缓慢加重组(37.90%)和CIPN稳定组(54.03%);Logistic回归分析显示,焦虑、无规律运动、吸烟史和三药联合化疗是CIPN持续快速加重组的影响因素(P<0.05),焦虑、疲乏、无规律运动、吸烟史、不良饮酒史和三药联合化疗是CIPN快速-缓慢加重组的影响因素(P<0.05)。结论:胃癌病人CIPN呈现不同的异质性轨迹变化,护理人员需要重视存在焦虑、无规律运动、疲乏、有吸烟史、饮酒史以及三药联合化疗的病人,并给予有效的护理。
关键词 胃癌;化疗;周围神经病变;轨迹;潜类别增长;护理
doi:10.12102/j.issn.2095-8668.2024.21.018
胃癌是消化道发病率较高的肿瘤之一,化疗是其主要治疗方法之一,可延长病人的生存时间。化疗方案包括奥沙利铂+5-氟尿嘧啶+左亚叶酸钙(FOLFOX)、紫杉醇+奥沙利铂+5-氟尿嘧啶+左亚叶酸钙(POF)和奥沙利铂+卡培他滨(XELXO)等[1]。研究发现,化疗导致周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)的常见药物有铂类和紫杉烷类等,其中报道最多的为奥沙利铂和紫杉醇[2]。胃癌化疗病人中,CIPN发生率高达70%以上[3]。CIPN是个体体验的一系列与化疗相关的不良症状群,常表现为感觉和运动神经受损,感觉神经受损症状包括手足麻木、刺痛、烧灼感等,运动神经受损症状包括肌无力、平衡失调等,严重影响癌症病人的生活质量[4]。有研究显示,癌症病人的CIPN具有群体异质性,呈现轨迹变化[5],不同群体病人的CIPN可能会表现出不同的变化形态[6]。既往的观察性研究显示,焦虑、抑郁等不良情绪是CIPN发生的影响因素[7],年龄越大、联合化疗、化疗次数越多、有吸烟史、饮酒量较大的人群更易引发CIPN,且CIPN在糖尿病人群中症状最为突出[8]。目前,国内外学者对CIPN的研究大多数局限于横断面调查,较少探讨CIPN的变化轨迹。因此,本研究旨在采用潜类别增长分析方法探讨胃癌病人CIPN的异质性轨迹变化,并分析其预测因素,为针对性地实施护理干预提供参考依据。
1 对象与方法
1.1 研究对象
采用方便抽样方法,选取2021年12月—2022年12月在福建省某三级甲等肿瘤专科医院化疗的124例胃癌病人作为研究对象。纳入标准:1)经病理学检查,确诊为胃癌的病人[9];2)年龄≥18岁;3)首次化疗且预计化疗时间达6个月以上;4)卡氏功能状态评分(Karnofsky Performance Score,KPS )≥60分;5)自愿参与本调查;6)能独立完成问卷或在他人帮助下完成。排除标准:1)语言交流障碍、昏迷病人;2)患有其他恶性肿瘤。本研究已获得医院医学伦理委员会审批,批号:K2023-271-01。
1.2 方法
1.2.1 研究工具
1.2.1.1 一般资料调查表
研究者查阅文献后自行设计,包括人口学资料和疾病相关资料,如年龄、性别、婚姻状况、慢性病史、吸烟史、疾病分期等。
1.2.1.2 化疗致周围神经病变评估工具(Chemotherapy-Induced Peripheral Neuropathy Assessment Tool,CIPNAT)
CIPNAT用于评估病人发生化疗致 CIPN的严重程度,属于病人自我报告型问卷[10]。 包括两个分量表,第1个分量表包括9项症状体验,由感觉神经受损和运动神经受损2个维度组成,每项症状体验从困扰程度、严重情况、发生频率及是否发生4个方面进行评估,共36个子条目,除是否发生采用0~1分计分外,其余条目均采用0~10分计分法,总分为0~279分,得分与症状严重程度呈正比。第2个分量表为 CIPN 对日常生活的影响,14 个条目,采用 0~10 分评分法,总分为 0~140 分。CIPNAT的Cronbach′s α系数为0.94,条目水平的内容效度指数(I-CVI)为0.92,可全面精准评估中国病人的CIPN。由于本研究的重点是探讨CIPN程度的轨迹变化情况,因此,本研究只使用第1个分量表的数据分析CIPN的症状严重程度。
1.2.1.3 阿森斯失眠量表(Athens Insomnia Scale,AIS)
AIS量表由Dan Sedmark等编制,通过入睡障碍、夜间苏醒障碍、早醒、睡眠质量、总睡眠时间、白天情绪、思睡和身体功能8个条目评定病人近1个月内的睡眠质量[11]。每个条目按症状从无到严重依次计0~3分,总分为24分,得分越高,表示失眠情况越严重。AIS量表的Cronbach′s α系数为0.900,具有较好的信度,可快速评估病人的失眠情况。
1.2.1.4 广泛性焦虑障碍量表(the Generalized Anxiety Disorder 7-Item Scale,GAD-7)
GAD-7是由Spitzer 等[12]根据美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)编制的简明焦虑症状自评量表。该量表由7个条目组成,每个条目由完全不会、好几天、一半以上的日子、几乎每天4个选项构成,分别对应0、1、2、3分,最高分为21分,≥5分说明可能存在焦虑情绪,5~9分为轻度焦虑,10~14分为中度焦虑,15~21分为重度焦虑。研究显示,GAD-7具有较高的信度和效度[13]。
1.2.1.5 癌因性疲乏问卷(Revised Piper Fatigue Scale,RPFS)
修订后的中文版RPFS包括感觉、情绪、认知、行为4个维度,共22个条目。采用0~10分计分法,以4个维度的均分表示总分,轻度疲乏为0~3.3分,中度疲乏为>3.3~6.7分,重度疲乏为>6.7~10.0 分。RPFS的Cronbach′s α系数为 0.91,重测信度为0.98[14]。
1.2.2 资料收集方法
对参与本次调查的成员进行统一培训,征得病人同意后,调查员对符合标准的研究对象采用面对面的方式进行问卷调查,研究者说明调查目的、问卷内容、所需时间和注意事项后,发放问卷由病人填写。无法自行填写问卷的病人,由研究者按照统一的方式进行逐句询问后代为填写,填写完成后研究人员再次检查问卷内容,避免漏选或者无效问卷。本研究在病人化疗开始前进行基线调查(T0),收集病人的一般人口学资料和疾病资料及CIPNAT、ASI、GAD-7、RPFS得分情况,并于首次调查后的第3次化疗(T1)、第5次化疗(T2)、第7次化疗(T3)时随访病人的CIPN情况。由于化疗周期延长,毒副作用加剧,国内已有学者对胃癌化疗病人副作用的随访时间进行界定[15]。因此,本研究的随访时间确定在第3次、第5次和第7次化疗时。基线调查纳入符合标准的150例病人,因中途拒绝调查、放弃治疗和转院等其他原因失访26例,最终完成至少2次调查的病人有124例。
1.2.3 统计学方法
本研究采用Mplus 7.4 和SPSS 24.0软件进行统计分析,符合正态分布的定量资料采用均数±标准差(x±s)描述,不符合正态分布时采用中位数(四分位数)[M(P25,P75)]描述,定性资料采用例数、构成比(%)描述。采用一般线性模型分析总体CIPN的变化情况;潜类别增长分析(latent class growth analysis,LCGA)拟合CIPN的异质性,采用多元Logistic回归分析一般人口学资料、疾病相关资料、AIS、GAD-7、RPFS得分对胃癌病人CIPN异质性变化的预测作用,检验水准α=0.05。
2 结果
2.1 胃癌病人的一般资料
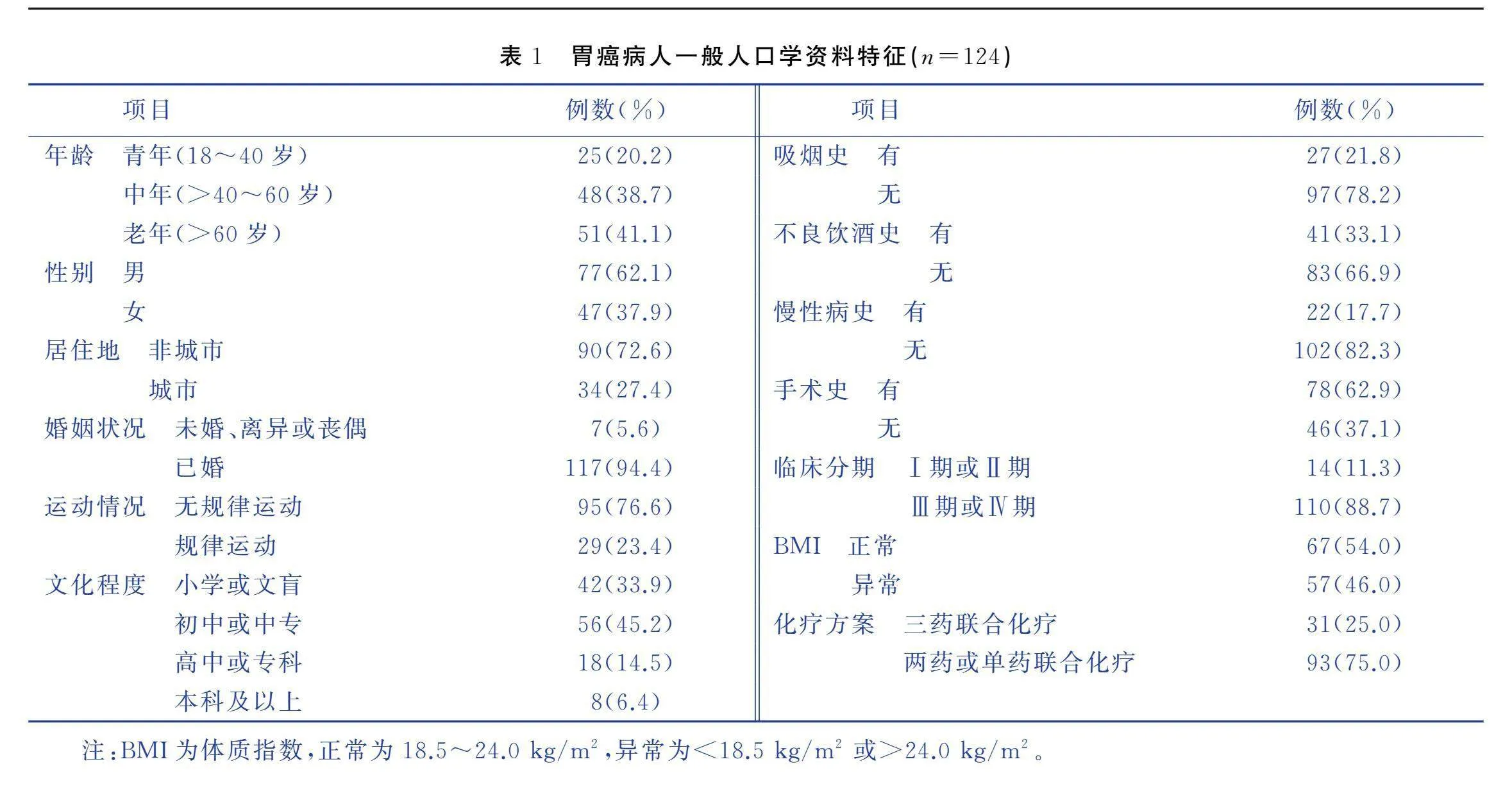
本研究最终至少完成2次调查的研究对象共124例,年龄为25~80(58.80±11.91)岁,一般人口学资料见表1。
2.2 胃癌病人AIS、GAD-7、RPFS得分
胃癌病人AIS得分为(8.49±4.21)分 ,GAD-7得分为(10.77±2.49)分,RPFS得分为(3.74±1.45)分。
2.3 胃癌病人CIPN现状
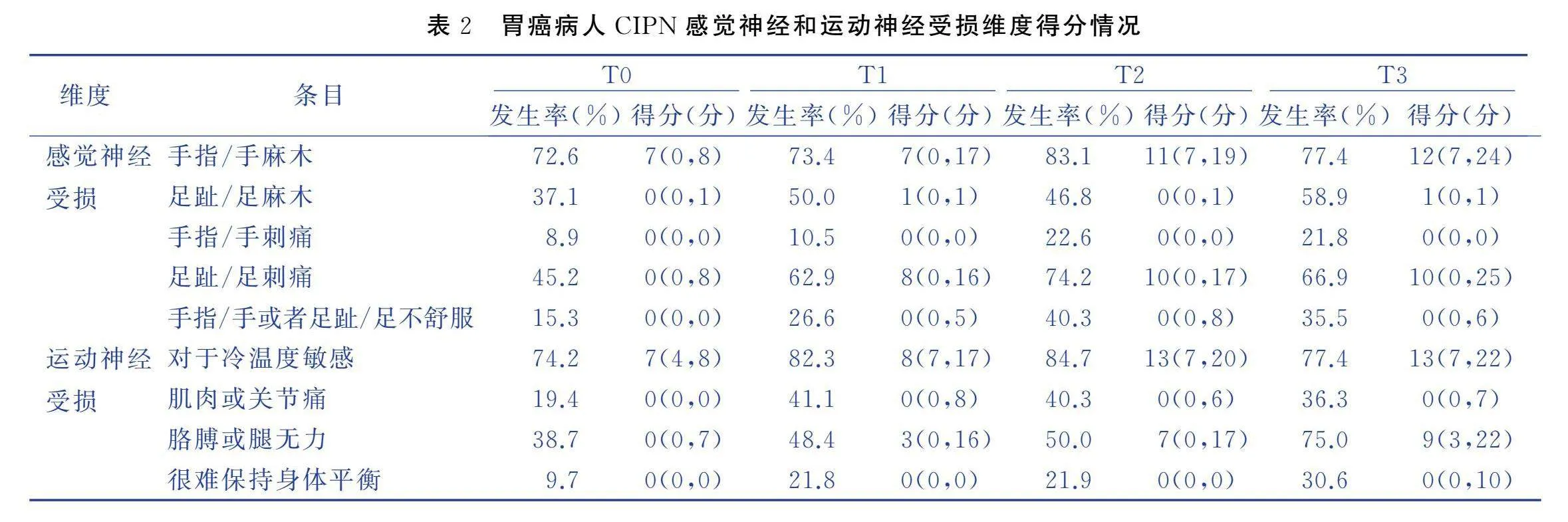
T0、T1、T2、T3时胃癌病人CIPNAT评分分别为(25.39±13.44)分、(52.06±44.53)分、(62.61±39.57)分和(69.21±44.98)分,差异有统计学意义(F=119.508,P<0.001)。感觉神经和运动神经受损维度得分见表2。
2.4 胃癌病人CIPN异质性变化
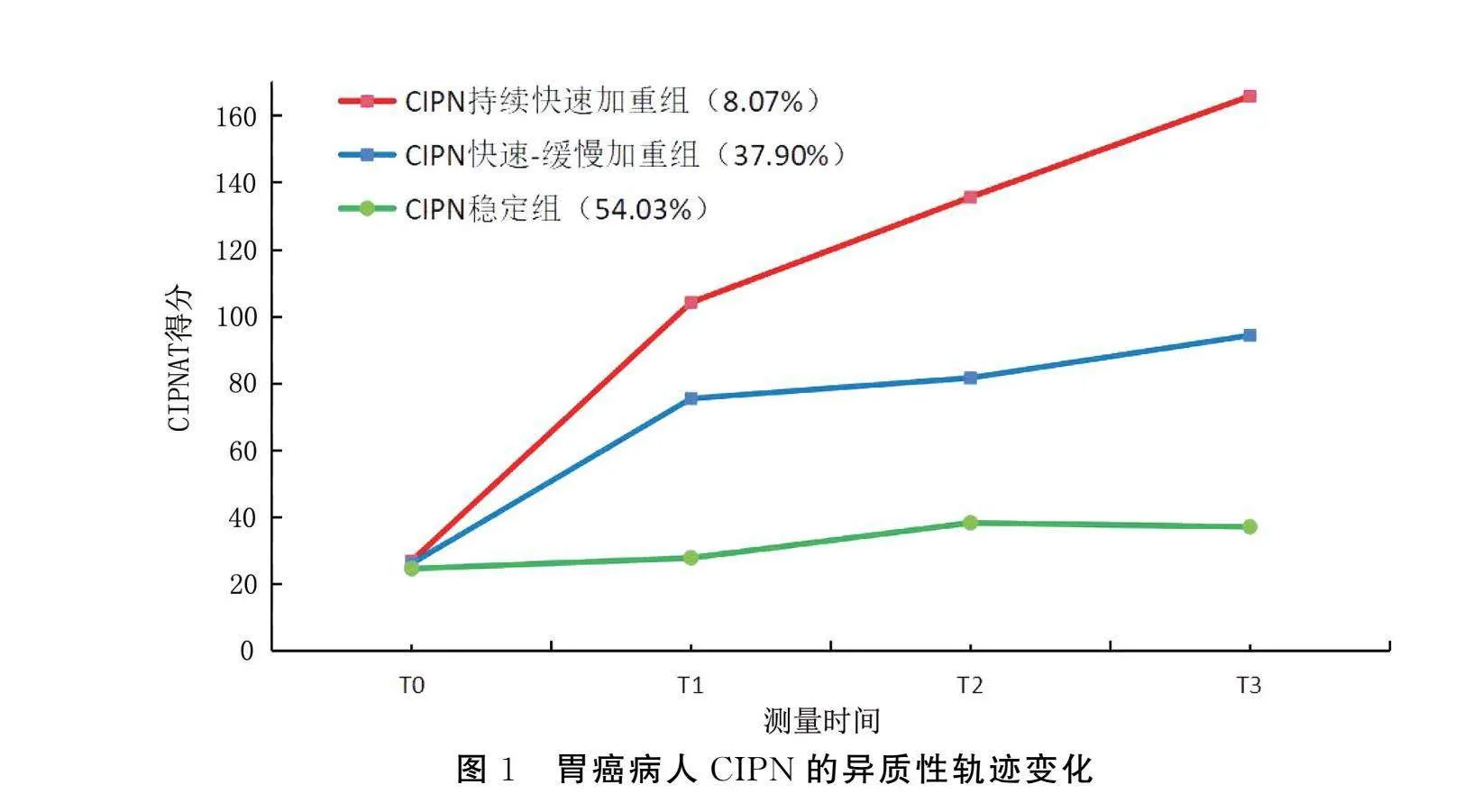
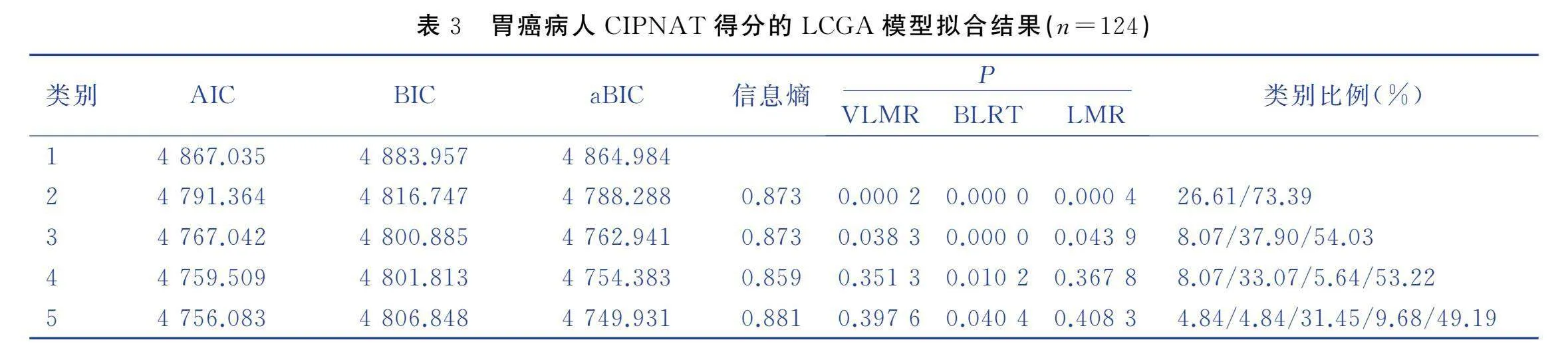
胃癌病人化疗期间CIPN总体呈上升趋势。通过LCGA模型分别拟合了胃癌病人CIPN的5个类别的异质性变化,结果见表3。结果显示,随着类别数目的增加,赤池信息准则(Akaike information criterion,AIC)和贝叶斯信息准则(Bayesian information criterion,BIC)值逐渐下降,k个类别模型的似然比检验(vuong-lo-mendell-rubin likelihood ratio test,VLMR)、Bootstrap的似然比检验 (Bootstrapped likelihood ratio test,BLRT)和罗-梦戴尔-鲁本校正似然比 (Lo-Mendell-Rubin,LMR)在类别3模型中差异有统计学意义(P<0.05)。随着类别数目的增加,第4个模型中VLMR、LMR无统计学意义(P>0.05)。在类别3中,AIC、BIC和调整后的贝叶斯信息准则(adjusted Bayesian Information Criterion,aBIC)值较小,信息熵(Entropy)>0.8,根据LCGA拟合指标数值的实际意义,类别3的模型拟合最佳,模型分类精准性最好。因此,本研究将胃癌病人的CIPN异质性分为3个潜在类别。以CIPNAT得分为纵坐标,以 T0、T1、T2、T3为横坐标绘制3个潜在类别的变化图,根据各潜在类别组的变化趋势及特征进行命名。类别1:T0时CIPN处于较低水平(截距=28.961),但在随访期间,CIPN一直呈快速上升趋势(斜率=47.11,P<0.001),将其命名为“CIPN持续快速加重组”,该组共10例(8.07%)病人。类别2:T0时CIPN处于较低水平(截距=28.696),在随访过程中,CIPN总体呈上升趋势,刚开始上升较快,之后上升程度较为缓慢(斜率=23.391,P<0.001),将其命名为“CIPN快速-缓慢加重组”,该组共47例(37.90%)。类别3:T0时CIPN处于较低水平(截距=24.896),在整个随访过程中,CIPN程度呈总体不变趋势,处于较低水平,但还是有CIPN症状出现(斜率=5.157,P<0.001),将其命名为“CIPN稳定组”,该组占比最多,共67例(54.03%)。见图1。
2.5 胃癌病人CIPN异质性轨迹变化的预测因素
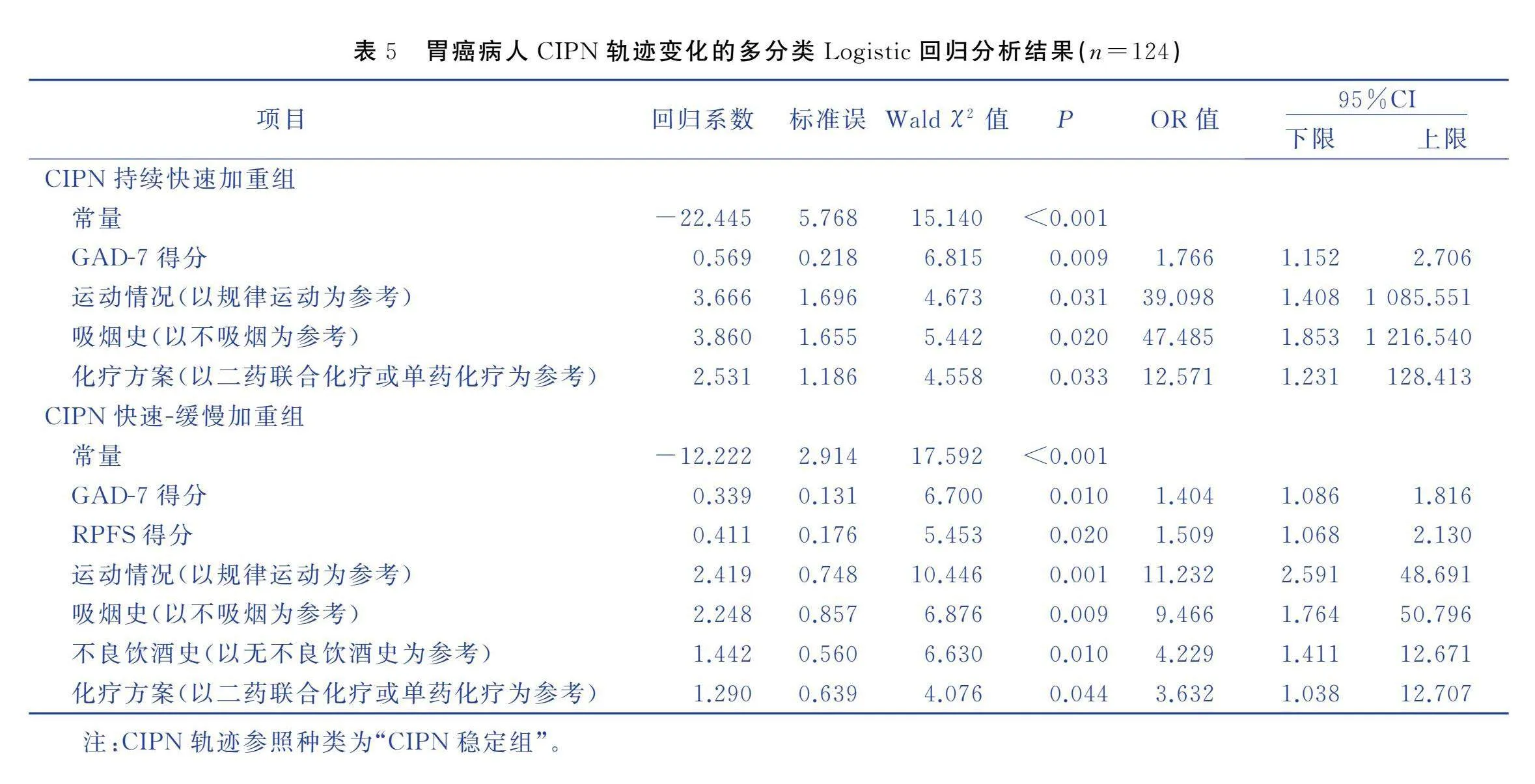
以CIPN变化的异质性轨迹为因变量,将病人的一般资料、疾病相关资料、AIS得分、GAD-7得分和RPFS得分情况纳入多分类Logistic回归分析。以“CIPN稳定组”为参照组,自变量赋值方式见表4。结果显示,存在焦虑、无规律运动、吸烟史和三药联合化疗的病人越有可能被分配到“CIPN持续快速加重组”(P<0.05)。焦虑、疲乏、无规律运动、吸烟史、不良饮酒史和三药联合化疗的胃癌病人越容易被分配到“CIPN快速-缓慢加重组”(P<0.05),见表5。
3 讨论
3.1 胃癌化疗病人CIPN轨迹存在群体异质性
CIPN是抗肿瘤药物常见的副作用之一,发生率为19%~85%,其中铂类药物发生率为70%~100%,紫杉烷类药物发生率为11%~87%, 居前2位[16]。化疗药物损害神经系统结构并引起CIPN的病理机制涉及微管破坏、氧化应激和线粒体损伤、离子通道活性改变、髓鞘损伤、脱氧核糖核酸(DNA)损伤、免疫过程和神经炎症[17]。CIPN表现为不同程度的感觉、运动和自主神经功能缺陷,影响病人的生活质量,导致病人跌倒风险增加,甚至出现瘫痪和残疾[18]。本研究发现,随着化疗进展,CIPN呈现群体异质性,采用LCGA拟合了3条CIPN的异质性轨迹,分别为CIPN持续快速加重组(8.07%)、CIPN快速-缓慢加重组(37.90%)和CIPN稳定组(54.03%)。本研究中的CIPN异质性种类少于Wang等[6]的研究,该研究对CIPN随访12个月后将病人分为4种症状群类型,分别是感觉神经病变型、运动神经病变型、感觉运动神经病变型和自主神经病变型,其原因可能在于Wang等[6]的研究主要集中于将CIPN中突出的症状进行了症状群的分类,因此分类更细致,本研究主要根据CIPN的严重程度进行分类,将CIPN的变化情况分为3个类别。同时,本研究CIPN稳定组病人占比最高,说明大多数病人在化疗期间CIPN的变化较为稳定,该结论与Teng等[19]的研究相似,Teng等在铂类化疗后6、12、24、36个月时评估CIPN的患病率分别为58%、45%、32%和24%,且有46.7%的病人在紫杉烷化疗后24个月内CIPN持续出现,无明显变化,说明随着疗程进展,大多数病人对化疗均可耐受,同时加上使用一些营养神经药物的辅助,使CIPN呈现较为平稳的状态。因此,随着化疗时间的延长,大多数病人的CIPN的严重程度没有呈现快速增长趋势,而是呈现一个相对平稳的状态。 此外,本研究结果显示,有8.07%的病人CIPN呈持续快速加重,37.90%的病人处于快速-缓慢加重,说明仍有部分胃癌病人由于治疗因素或自身原因使CIPN呈快速增长趋势。因此,提示胃癌病人化疗时,护理人员需要及时评估病人CIPN的症状体验和日常生活活动的影响,同时询问病人的主观感受,对于CIPN严重的病人及时给予尽早干预。此外,不能忽视现阶段CIPN情况较好但具有潜在快速加重风险的胃癌化疗病人。
3.2 焦虑、疲乏、运动、吸烟史、不良饮酒史和化疗方案是胃癌化疗病人CIPN轨迹潜在类别的预测因素
Logistic回归分析结果显示,以“CIPN稳定组”为参照,存在焦虑、无规律运动、吸烟史和三药联合化疗的病人越有可能被分配到“CIPN持续快速加重组”(P<0.05);存在焦虑、疲乏、无规律运动、吸烟史、不良饮酒史以及三药联合化疗的胃癌病人越容易被分配到“CIPN快速-缓慢加重组”(P<0.05)。有研究发现,焦虑程度较重的病人5-羟色胺和去甲肾上腺素分泌减少,自我感觉不适更加明显,不愉悦等心理症状因素会加重症状产生的影响,导致CIPN更加明显[20]。同时,焦虑等不良情绪会导致病人出现免疫力下降,加重治疗副作用。疲乏与白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)等促炎因子上升有关,这些促炎因子会阻碍损伤的周围神经的恢复。此外,焦虑、疲乏与CIPN之间可能存在相互作用,当病人出现手足麻木及全身无力症状时,也会加重负性情绪和疲乏状态[21]。因此,医护人员应关注化疗病人的焦虑和疲乏状态,采用心理干预和放松疗法等减轻病人的疲乏和负性情绪。既往多项随机对照试验和Meta研究均证实,运动疗法能有效降低肿瘤化疗病人的神经毒性[22]。分析原因可能是:运动可以加快组织代谢,提高血氧饱和度,改善副交感神经活性,促进周围神经再生,提高神经传导速度,缓解神经疼痛,运动疗法对周围神经病变具有保护作用[23]。Greenlee等[24]研究发现,每周规律进行5 h的中、高强度体力活动的乳腺癌病人,CIPN症状加重的可能性降低了60%。本研究结果显示,相比规律运动人群,无规律运动的人群CIPN的严重程度呈现上升趋势,提示医护人员可以先综合评估肿瘤病人的身体耐受情况,鼓励病人养成规律运动的习惯,为CIPN病人制定个体化、切实有效的运动方案。 有研究显示,长期吸烟会引起白细胞浸润神经组织,激活炎症相关信号通路,导致炎症因子过度释放,这些炎症因子对外周神经产生直接毒性作用,加速神经的退行性变,同时,吸烟能减少外周血流量,尼古丁会增加对紫杉醇诱发的神经病变的易感性,吸烟被确定为CIPN的危险因素(OR=1.54,P=0.004)[25]。但也有些学者研究表明,烟草与CIPN并没有关联[26]。本研究结果显示,有吸烟史的病人CIPN水平呈快速加重趋势,提示医护人员需及时指导病人戒烟,关注有吸烟史病人的CIPN发展情况。关于饮酒与CIPN之间的关系,研究结果各不相同。国外一项169例接受奥沙利铂化疗病人的研究发现,饮酒与神经病变相关[27]。但2项针对乳腺癌病人的研究发现,CIPN与饮酒没有相关性[28]。本研究结果发现有不良饮酒史的病人更容易被分配到“CIPN快速-缓慢加重组”,即饮酒容易加重CIPN症状。有研究指出,调查对象中可能存在酒精相关的周围神经病变,而这种病变与酒精中毒相关[29],其症状与CIPN极其相似,过量饮酒也是影响糖尿病神经病变的危险因素[30]。提示医护人员要关注既往有长期饮酒史的病人,及时评估CIPN情况。本研究结果显示,化疗方案是影响CIPN异质性轨迹的预测因素。三药联合化疗的病人CIPN上升较为显著。化疗药物、累积剂量及化疗持续时间被公认为CIPN的危险因素,化疗时间越长,化疗药物在体内的累积剂量越高,CIPN症状越明显,但各种化疗药物引起CIPN的累积剂量各不相同,紫杉醇为135~1 400 mg/m2,奥沙利铂累积剂量>850 mg/m2,顺铂>200~300 mg/m2即可有明显的CIPN[31]。与FOLFOX、XELOX等两药联合方案相比,POF等三药联合方案中,Ⅲ度、Ⅳ度中性粒细胞减少和脱发的发生率明显降低,肾毒性和血栓发生率也有所下降,但是Ⅲ度、Ⅳ度腹泻和外周神经毒性的发生率较高[32]。三药联合化疗方案和化疗药物的蓄积,使病人CIPN症状呈快速增长趋势,导致CIPN对病人日常生活活动造成的影响越来越明显,提示护理人员需要随时掌握病人的化疗方案,配合医生,帮助病人达到最佳治疗效果,同时最大限度地降低药物引起的副作用。
4 小结
本研究通过纵向跟踪方法,采用潜类别增长分析方法识别3种胃癌病人CIPN异质性轨迹,分别是CIPN持续快速加重组、CIPN快速-缓慢加重组和CIPN稳定组,说明胃癌化疗病人CIPN轨迹存在群体异质性。相对于CIPN稳定组,存在焦虑、无规律运动、吸烟史和三药联合化疗是CIPN持续快速加重组的预测因素;焦虑、疲乏、无规律运动、吸烟史、不良饮酒史和三药联合化疗是CIPN快速-缓慢加重组的预测因素。但考虑到本研究仅在一家肿瘤专科医院进行收集,样本来源有限,样本量较少,同时在随访过程中放弃治疗、拒绝调查等病人较多,可能造成一定的失访偏倚。建议在今后的研究中可以延长随访时间,同时建立信息化跟踪系统,避免参与者的丢失。
参考文献:
[1] 王海霞,王燕.FOLFOX4化疗方案对中晚期胃癌患者生活质量和免疫功能的影响[J].中国肿瘤临床与康复,2018,25(9):1061-1064.
[2] 杨晓燕.化疗所致外周神经毒性中西医研究进展[D].北京:北京中医药大学,2013.
[3] 王悦.癌症患者化疗所致周围神经病变评估的相关研究[D].西安:第四军医大学,2017.
[4] HONG J S,TIAN J,WU L H.The influence of chemotherapy-induced neurotoxicity on psychological distress and sleep disturbance in cancer patients[J].Curr Oncol,2014,21(4):174-180.
[5] MLLER J,KREUTZ C,RINGHOF S,et al.Chemotherapy-induced peripheral neuropathy:longitudinal analysis of predictors for postural control[J].Sci Rep,2021,11(1):2398.
[6] WANG M,CHENG H L,LOPEZ V,et al.Redefining chemotherapy-induced peripheral neuropathy through symptom cluster analysis and patient-reported outcome data over time[J].BMC Cancer,2019,19(1):1151.
[7] 洪悦颖,徐晨,于海燕,等.癌症患者化疗所致周围神经病变及影响因素分析[J].中华护理教育,2019,16(12):892-896.
[8] MOLASSIOTIS A,CHENG H L,LEUNG K T,et al.Risk factors for chemotherapy-induced peripheral neuropathy in patients receiving taxane-and platinum-based chemotherapy[J].Brain Behav,2019,9(6):e01312.
[9] 刘媛,赵林.《2022 NCCN胃癌临床实践指南》更新解读[J].协和医学杂志,2022,13(6):999-1004.
[10] 王悦,白燕妮,郑玉杰,等.化疗所致周围神经病变评估工具的汉化及信效度检测[J].解放军护理杂志,2018,35(5):14-18.
[11] SOLDATOS C R,DIKEOS D G,PAPARRIGOPOULOS T J.Athens Insomnia Scale:validation of an instrument based on ICD-10 criteria[J].J Psychosom Res,2000,48(6):555-560.
[12] SPITZER R L,KROENKE K,WILLIAMS J B W,et al.A brief measure for assessing generalized anxiety disorder:the GAD-7[J].Arch Intern Med,2006,166(10):1092-1097.
[13] 王瑜,陈然,张岚.广泛性焦虑量表-7在中国综合医院住院患者中的信效度研究[J].临床精神医学杂志,2018,28(3):168-171.
[14] 李链,朱玲慧.癌因性疲乏诊断和评估量表研究进展[J].新疆医学,2016,46(11):1458-1461.
[15] 朱虹玉,张云飞,柯熹,等.不同步行运动量对胃癌化疗患者癌因性疲乏影响的研究[J].中华护理杂志,2021,56(5):652-658.
[16] BANACH M,JURANEK J K,ZYGULSKA A L.Chemotherapy-induced neuropathies--a growing problem for patients and health care providers[J].Brain Behav,2016,7(1):e00558.
[17] ARETI A,YERRA V G,NAIDU V,et al.Oxidative stress and nerve damage:role in chemotherapy induced peripheral neuropathy[J].Redox Biol,2014,2:289-295.
[18] PARK S B,GOLDSTEIN D,KRISHNAN A V,et al.Chemotherapy-induced peripheral neurotoxicity:a critical analysis[J].CA Cancer J Clin,2013,63(6):419-437.
[19] TENG C,COHEN J,EGGER S,et al.Systematic review of long-term chemotherapy-induced peripheral neuropathy(CIPN)following adjuvant oxaliplatin for colorectal cancer[J].Support Care Cancer,2022,30(1):33-47.
[20] CONLEY C C,KAMEN C S,HECKLER C E,et al.Modafinil moderates the relationship between cancer-related fatigue and depression in 541 patients receiving chemotherapy[J].J Clin Psychopharmacol,2016,36(1):82-85.
[21] BAO T,BASAL C,SELUZICKI C,et al.Long-term chemotherapy-induced peripheral neuropathy among breast cancer survivors:prevalence,risk factors,and fall risk[J].Breast Cancer Res Treat,2016,159(2):327-333.
[22] 张莹,李之华,刘子晗.运动疗法防治肿瘤患者化疗所致周围神经病变效果的Meta分析[J].现代临床护理,2023,22(5):72-79.
[23] 潘元青.非药物补充替代医学辅助治疗乳腺癌术后不良反应的循证研究[D].兰州:兰州大学,2015.
[24] GREENLEE H,HERSHMAN D L,SHI Z X,et al.BMI,lifestyle factors and taxane-induced neuropathy in breast cancer patients:the pathways study[J].J Natl Cancer Inste,2017,109(2):djw206.
[25] TRENDOWSKI M R,LUSK C M,RUTERBUSCH J J,et al.Chemotherapy-induced peripheral neuropathy in African American cancer survivors:risk factors and quality of life outcomes[J].Cancer Med,2021,10(22):8151-8161.
[26] UWAH A N,ACKLER J,LEIGHTON J C Jr,et al.The effect of diabetes on oxaliplatin-induced peripheral neuropathy[J].Clin Colorectal Cancer,2012,11(4):275-279.
[27] VINCENZI B,FREZZA A M,SCHIAVON G,et al.Identification of clinical predictive factors of oxaliplatin-induced chronic peripheral neuropathy in colorectal cancer patients treated with adjuvant Folfox Ⅳ[J].Support Care Cancer,2013,21(5):1313-1319.
[28] PEREIRA S,FONTES F,SONIN T,et al.Chemotherapy-induced peripheral neuropathy after neoadjuvant or adjuvant treatment of breast cancer:a prospective cohort study[J].Support Care Cancer,2016,24(4):1571-1581.
[29] MELLION M,GILCHRIST J M,DE LAMONTE S.Alcohol-related peripheral neuropathy:nutritional,toxic,or both?[J].Muscle Nerve,2011,43(3):309-316.
[30] ZIEGLER D.Current concepts in the management of diabetic polyneuropathy[J].Curr Diabetes Rev,2011,7(3):208-220.
[31] 周海辉,张海霞,李嘉琪,等.化疗药物诱导外周神经病变作用机制的研究进展[J].现代药物与临床,2017,32(11):2283-2286.
[32] 郭仁宏.晚期胃癌的一线药物治疗进展[J].中国医学前沿杂志(电子版),2011,3(1):47-52.
(收稿日期:2024-01-02;修回日期:2024-10-10)
(本文编辑张建华)
