基于CiteSpace糖尿病营养干预领域的研究热点与趋势分析
2024-11-08吕坛唐安林王静杨亚平

Research hotspots and trends analysis on diabetes nutrition intervention based on CiteSpace
LYU Tan1,2,TANG Anlin1,2,WANG Jing2*,YANG Yaping2
1.School of Medicine,Tongji University,Shanghai 200092 China;2.Yangpu Hospital,School of Medicine,Tongji University*Corresponding Author WANG Jing,E-mail:840518242@qq.com
Keywords diabetes;nutrition intervention;research hotspots;bibliometrics;visualization analysis
摘要 目的:分析糖尿病营养干预相关文献,了解该领域研究热点和前沿趋势,为我国糖尿病营养研究提供借鉴与参考。方法:检索1975年5月1日—2023年3月8日Web of Science核心合集数据库收录的糖尿病营养干预相关文献,应用CiteSpace 6.2.R3对国家、机构、作者、关键词等进行可视化分析。结果:共纳入糖尿病营养干预文献1 525篇,平均每年发文量32篇,我国总发文量居第2位。美国和伊朗是该研究的主力军,其他国家研究机构和作者间缺乏大规模且紧密的合作。关键词葡萄糖和维生素D等营养素出现频次较高;妊娠糖尿病、血脂谱、营养推荐等关键词聚类效果明显;妊娠期糖尿病的营养管理、微量元素锌和Meta分析方法是近期的突现词;妊娠糖尿病、血脂谱和营养推荐是未来研究方向。结论:国际糖尿病营养相关研究发展态势良好,糖尿病前期营养干预策略、妊娠糖尿病的饮食模式与微量营养补充剂的作用是当前学术研究的热点内容。我国研究实力有待提升,未来还需开展大量的高质量研究,针对新型膳食模式对糖尿病病人疗效的影响以及饮食结构对糖尿病病人血脂水平的作用进行深入探究,丰富我国糖尿病营养领域研究内容。
关键词 糖尿病;营养干预;研究热点;文献计量学;可视化分析
doi:10.12102/j.issn.2095-8668.2024.21.015
糖尿病(diabetes mellitus,DM)是一种代谢紊乱性疾病,由于胰岛素分泌受损、胰岛素作用缺陷或两者存在,造成机体处于高血糖状态[1]。因长期高血糖,导致多个组织器官慢性损伤和功能障碍,严重影响病人的生活质量。目前,全世界超过5.37亿成年人患有糖尿病,预计到2030年和2045年全球糖尿病病人总数将达到6.43亿人和7.83亿人[2]。近年来,随着我国经济发展和膳食结构调整,糖尿病患病人数逐年增加。据统计,2021年我国糖尿病病人约1.41亿人,发病率高达12.8%[2]。糖尿病作为世界十大死亡疾病之一,严重威胁着病人的生命健康。我国糖尿病死亡率由2010年10.25/10万增长至2020年的17.58/10万[3]。现阶段,尚无彻底根除糖尿病的治疗方式,但可通过药物、运动、教育和营养等干预方式控制血糖水平。营养干预作为糖尿病病程管理中必不可少的措施[4],受到国内外学者的重视。我国糖尿病营养相关研究起步较晚,通过了解国际糖尿病营养干预研究的发展脉络和研究进展有助于推动我国糖尿病营养干预的发展。本研究采用文献计量分析软件CiteSpace以探究近48年来糖尿病营养研究的前沿和趋势,为我国糖尿病管理提供新思路和新启发,提高糖尿病病人的生活质量。
1 资料与方法
1.1 文献检索与筛选标准
研究文献来自Web of Science核心合集,检索时限为1975年5月1日—2023年3月8日。检索字段为“TI”“AB”和“TS”,检索词设定为“diabetes mellitus”“parenteral nutrition+”“nutritional support+”和“nutrition*”等。过滤器语种限制为“English”,文献类型“Article”。文献导出格式为纯文本文件,记录内容为全记录与引用的参考文献。纳入标准:主题为糖尿病营养干预的相关文献。排除标准:1)会议摘要、新闻和简报等非学术性文献;2)动物类型的研究;3)重复发表、信息模糊的文献。
1.2 研究工具
采用CiteSpace 6.2.R3软件对文献进行可视化分析。CiteSpace以数据可视化的方式将文献信息转化为可视化图形,方便用户在海量文献中获取其关心领域的热点内容,把握学科发展前沿和趋势[5]。在CiteSpace参数设置界面,时间切片设置范围为1975年5月1日—2023年3月8日,时间段默认为1年进行时区分割。文本处理保持默认设置,节点类型选择作者、机构、国家、关键词、引文和期刊。连接保持默认设置。节点筛选方式选择g-index,k=25。精简化和可视化保持默认设置。
1.3 文献筛选与资料提取
由2名研究者按照纳入与排除标准独立筛选文献,若存有争议,寻求第3方帮助。使用文献管理软件NoteExpress 3.7删除重复文献,将纳入研究的文献信息导入CiteSpace 6.2.R3进行可视化分析。
2 结果
2.1 发文量
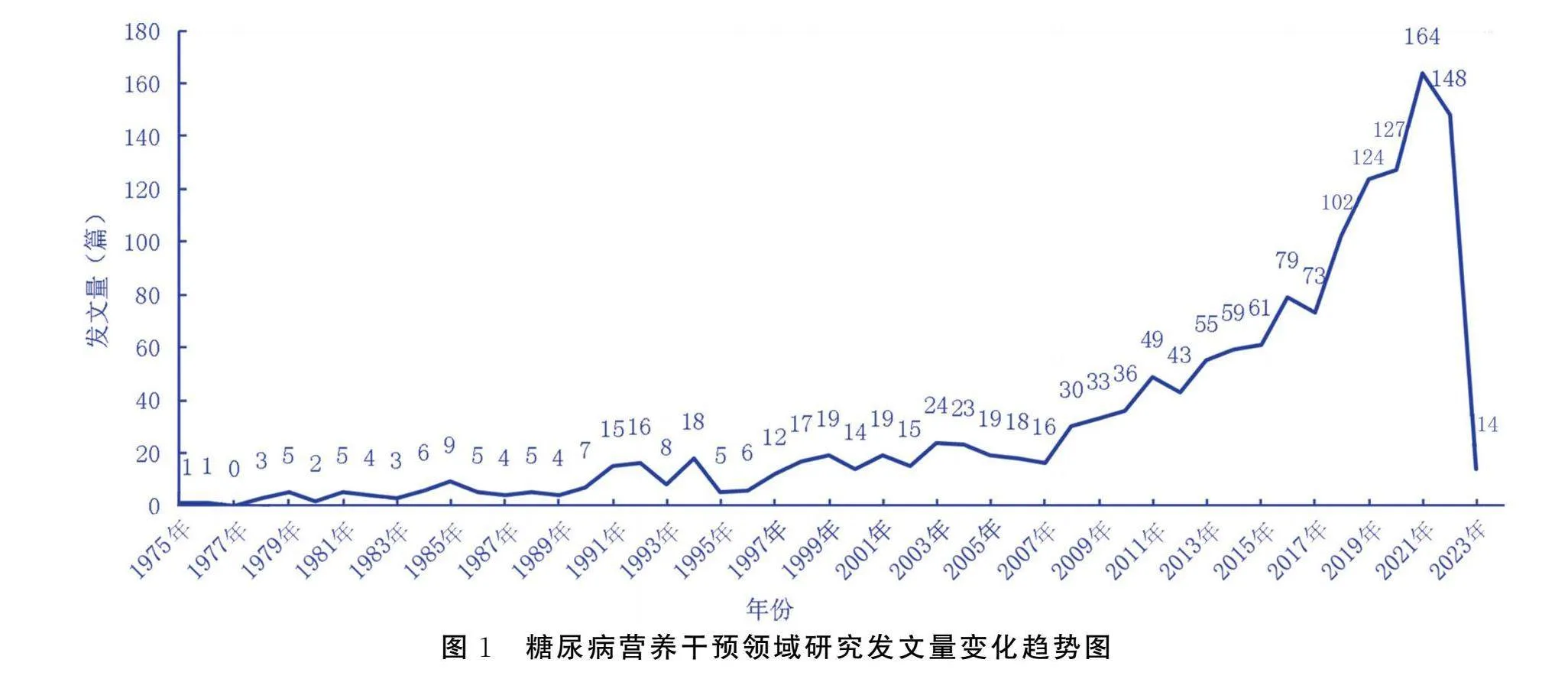
共检索24 974篇文献,通过阅读标题、摘要和关键词等内容,排除重复或与主题不符的文献,共纳入文献1 525篇,平均每年发文量32篇。研究发展趋势可分为两个阶段,第一阶段为缓慢增长期,2007年前糖尿病营养干预研究内容较少且增长缓慢。第二阶段为快速发展期,2007—2023年糖尿病营养干预研究急剧增长,发展态势良好,其中2021年发文量最多,近5年糖尿病营养干预研究受到学术界重视,相关文献大量涌现,未来糖尿病营养干预研究将持续保持增长趋势。见图1。
2.2 国家合作网络分析
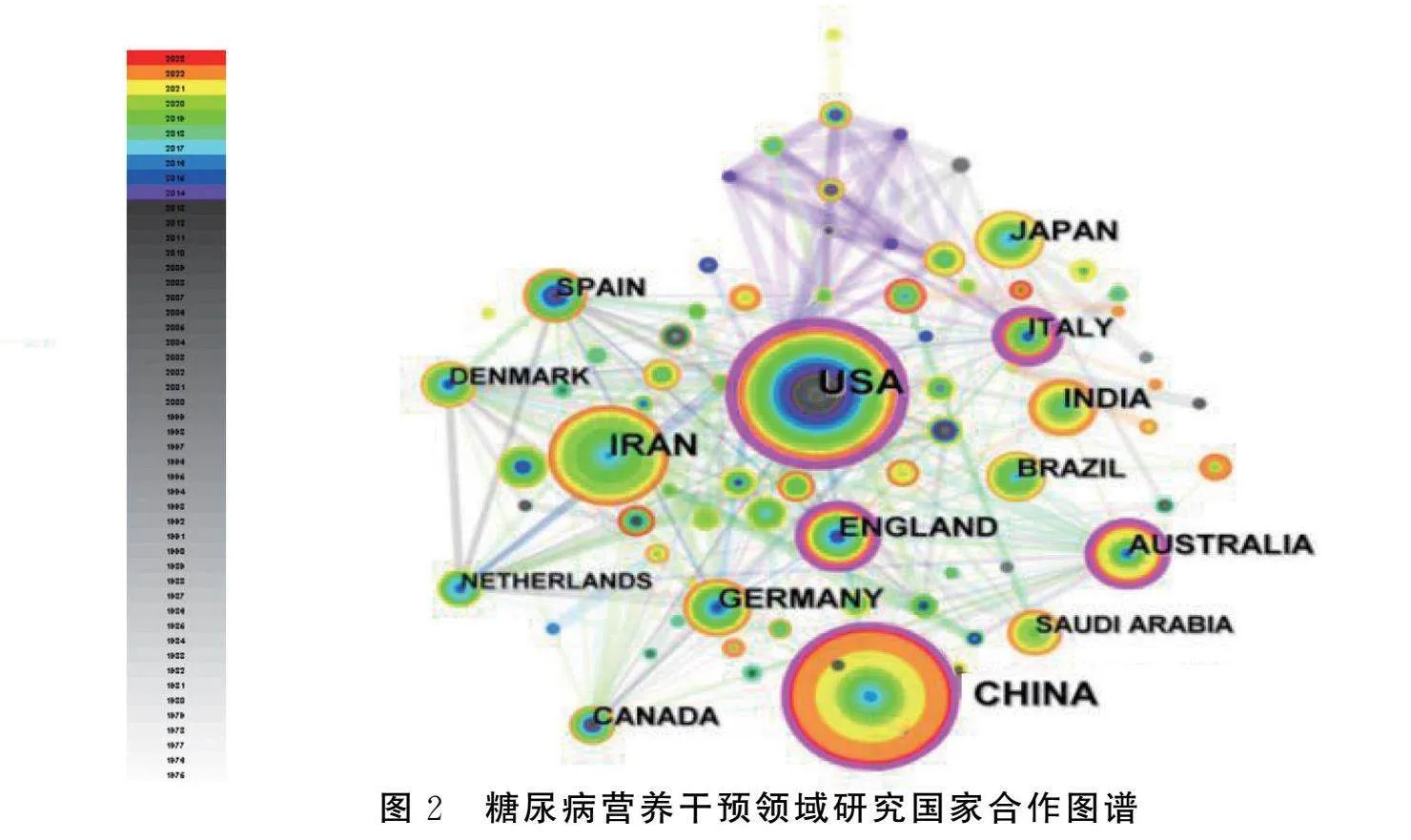
可视化结果显示,共有438个国家发表糖尿病营养干预的相关文献。发文量居前3位的国家分别是美国、中国、伊朗,其中美国发文量最高为306篇,占总发文量的20.07%。美国为主要的合作枢纽,与其他国家构建了合作网络,但各国家间联系的紧密性还有待提升。见图2。
2.3 机构合作网络分析
1975—2023年共有4 906所机构开展糖尿病营养相关研究,其中Tehran University of Medical Sciences、Harvard University、Brigham and Women′s Hospital发表文献的数量较多,是糖尿病营养干预研究领域内具有学术影响能力的机构。见图3。以Tehran University of Medical Sciences和Harvard University为中心构建了规模较大的合作网络,其他研究机构间的合作规模较小但较为紧密。总体上,各研究机构已建立国家间的合作网络,但缺乏跨国家和地区的学术交流。
2.4 作者合作分析
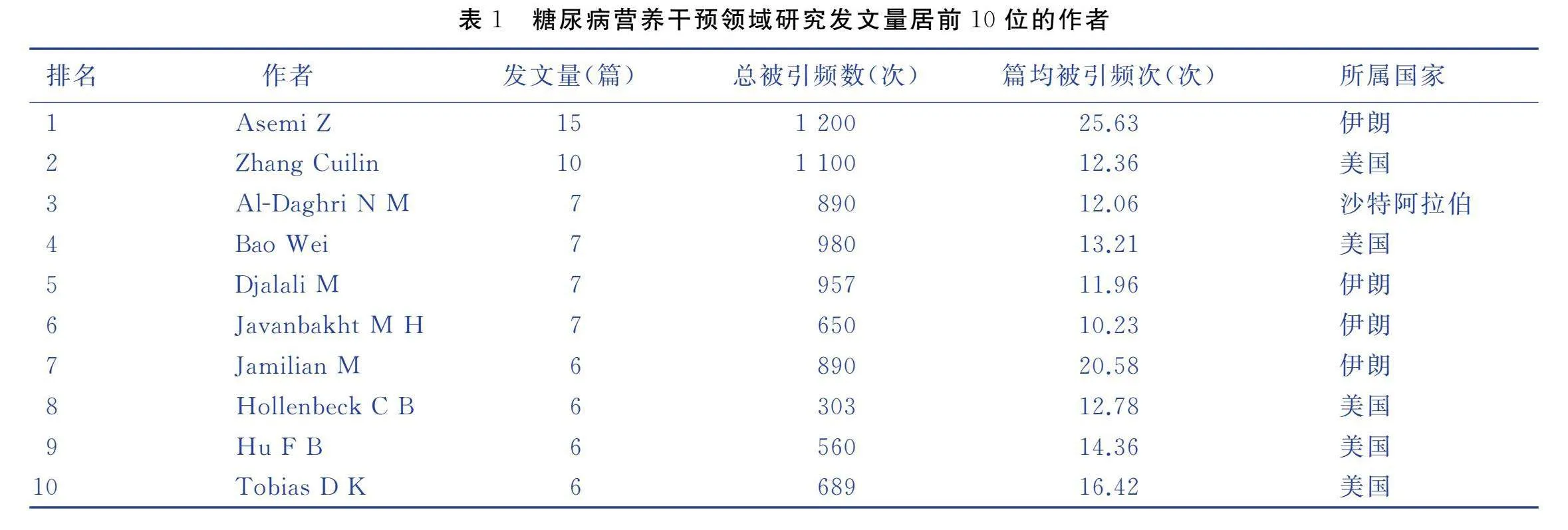
对研究作者进行分析,结果共有7 947名研究人员参与了糖尿病营养干预的相关研究。统计发文量居前10位的作者,见表1。来自伊朗的Asemi Z发文量最高(15篇)。
2.5 研究热点和研究前沿趋势
2.5.1 关键词共现分析
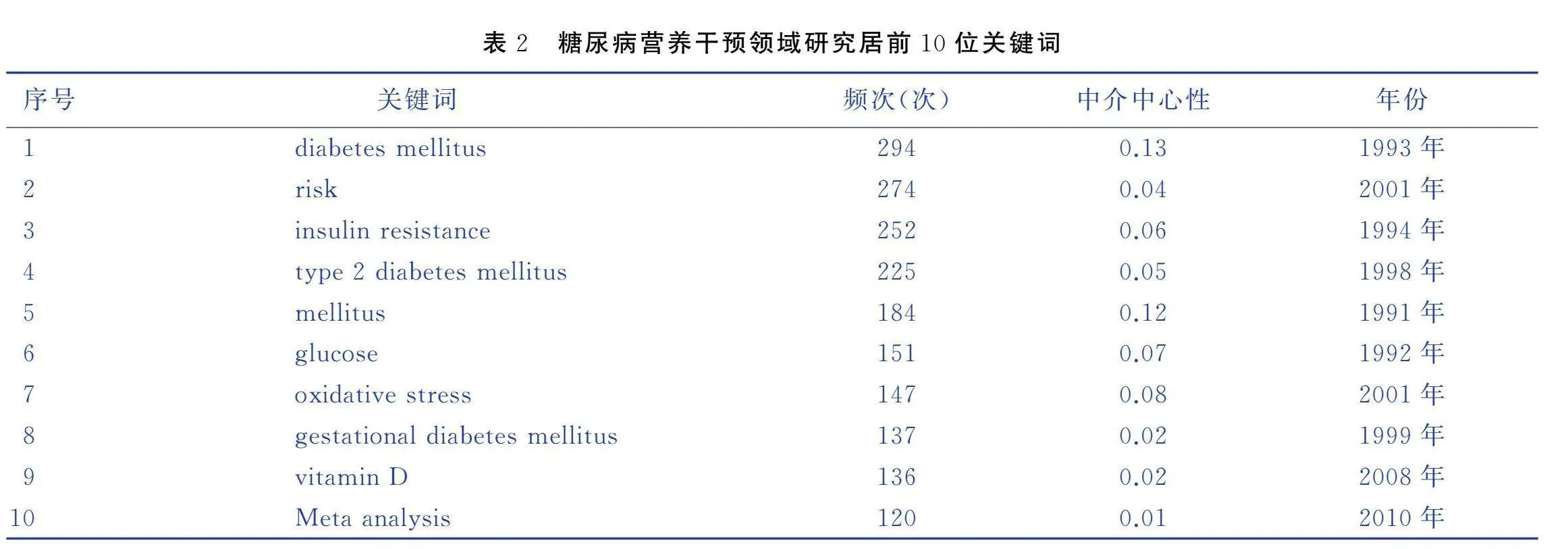
关键词反映主要研究内容,关键词的词频大小用于展现研究的热点内容。节点的中介中心性是测量节点在网络中位置重要性的指标,中介中心度越大说明节点越重要。以关键词为节点,进行关键词共现分析,提取出现频次排名居前10位的关键词进行分析。见表2。其中,关键词diabetes mellitus作为糖尿病营养研究的基础术语,出现频次最高为294次,其中介中心性为0.13。另外,oxidative stress、glucose、insulin resistance的中介中心性均>0.05,这表明该类关键词是糖尿病营养干预领域较为重要的内容。
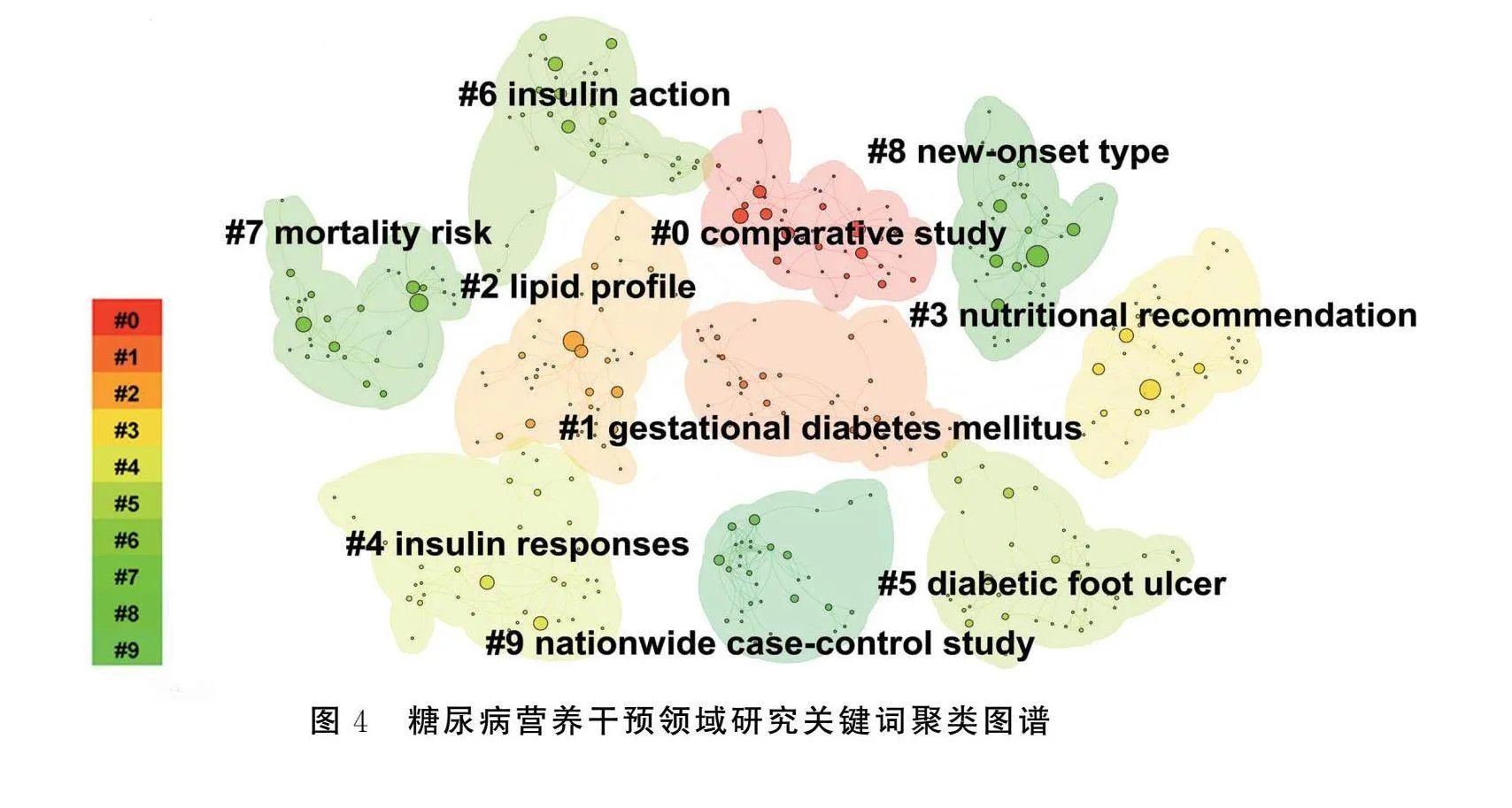
2.5.2 关键词聚类分析
通过潜在语义索引(latent semantic indexing,LSI)算法对关键词共现网络进行聚类,得到10个聚类词条。见图4。Modularity值和Sihouette值是用来衡量聚类效果的指标,其值越大则说明聚类效果越加明显。聚类结果显示,Modularity Q=0.302 4(>0.3),Silhouette=0.665 7(>0.5)表明聚类网络结构显著且聚类结果合理,能够代表糖尿病营养干预领域的热点内容。
2.5.3 关键词突现分析
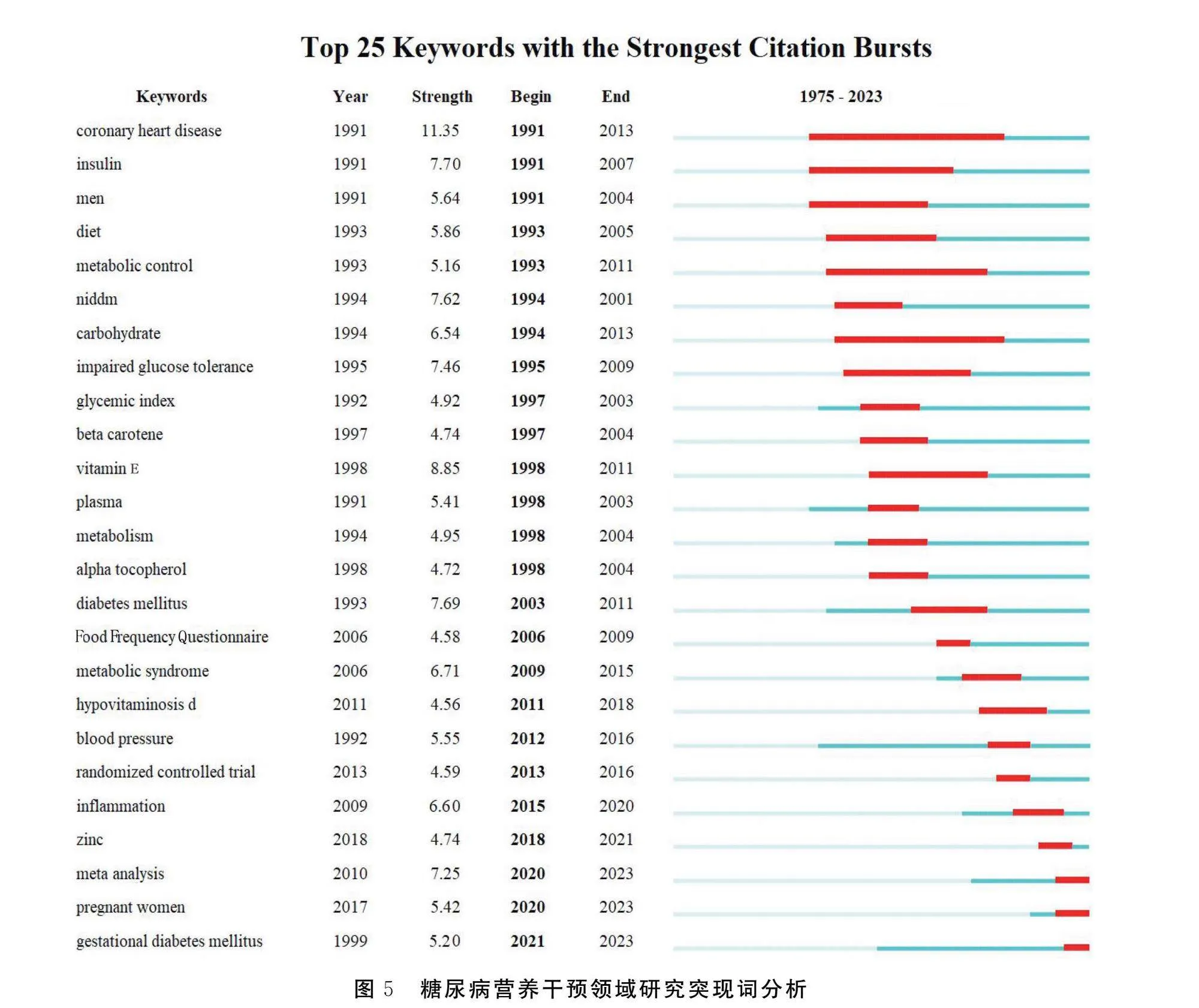
突现词是指一定时间范围内使用频次较高的词汇信息,通过突现词分析可以把握领域内研究热点演变趋势[6]。按照关键词突发起止的时间进行排序,显示前25个突现词信息。见图5。其中关键词coronary heart disease、carbohydrate、metabolic control突现时间较长。1975—2023年糖尿病营养干预研究领域热点主题不断变化,1991—2002年重点关注niddm、diet、carbohydrate、impaired glucose tolerance和营养素,如beta carotene和vitamin E;2003—2018年研究热点主要集中在diabetes mellitus、Food Frequency Questionnaire、metabolic syndrome、hypovitaminosis D等内容。近年来,Meta分析研究方法运用于糖尿病营养干预的相关研究中,随着糖尿病患病率的增长,研究者重视妊娠期糖尿病营养管理及微量元素锌对控制血糖的作用。
2.5.4 关键词时间线图和峰峦图分析
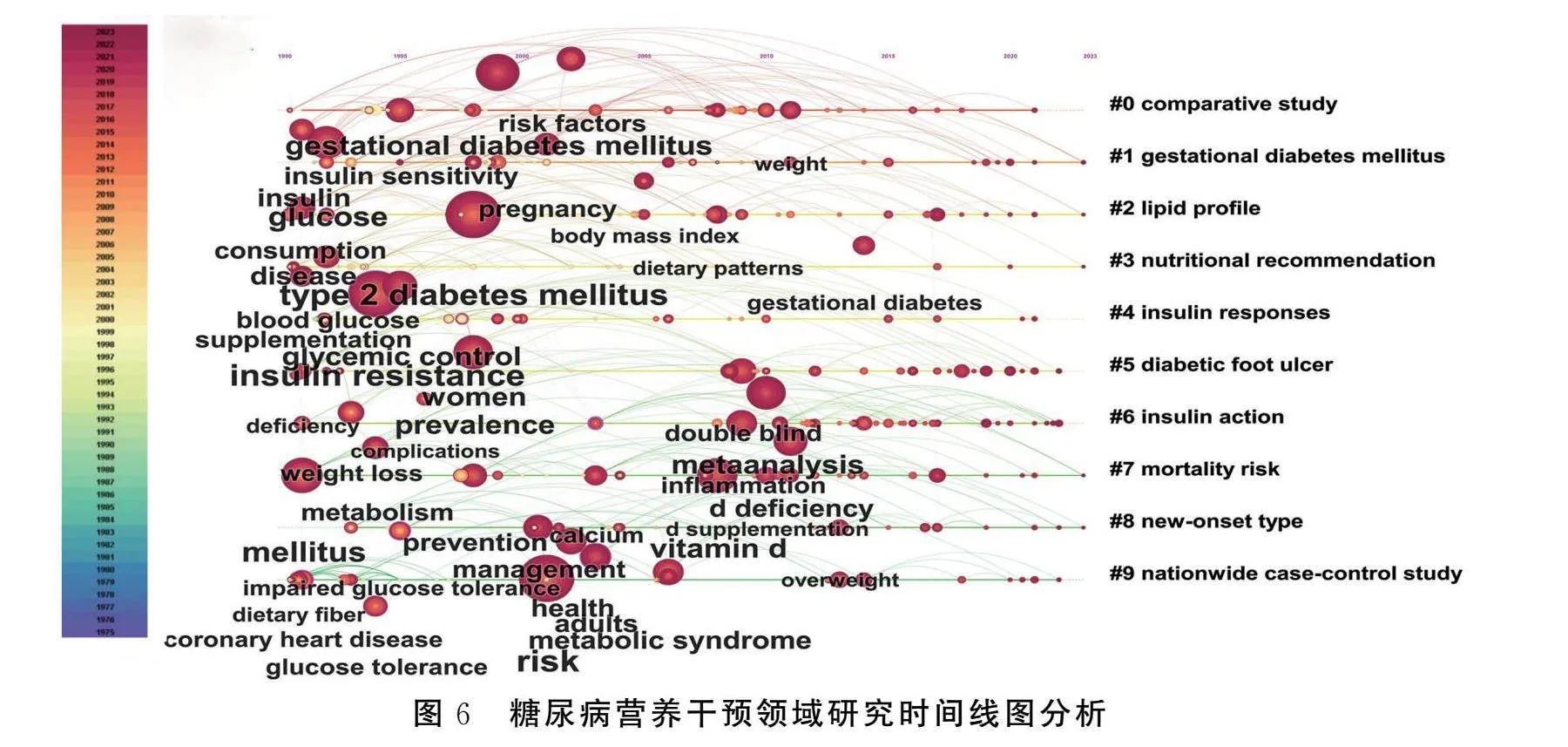
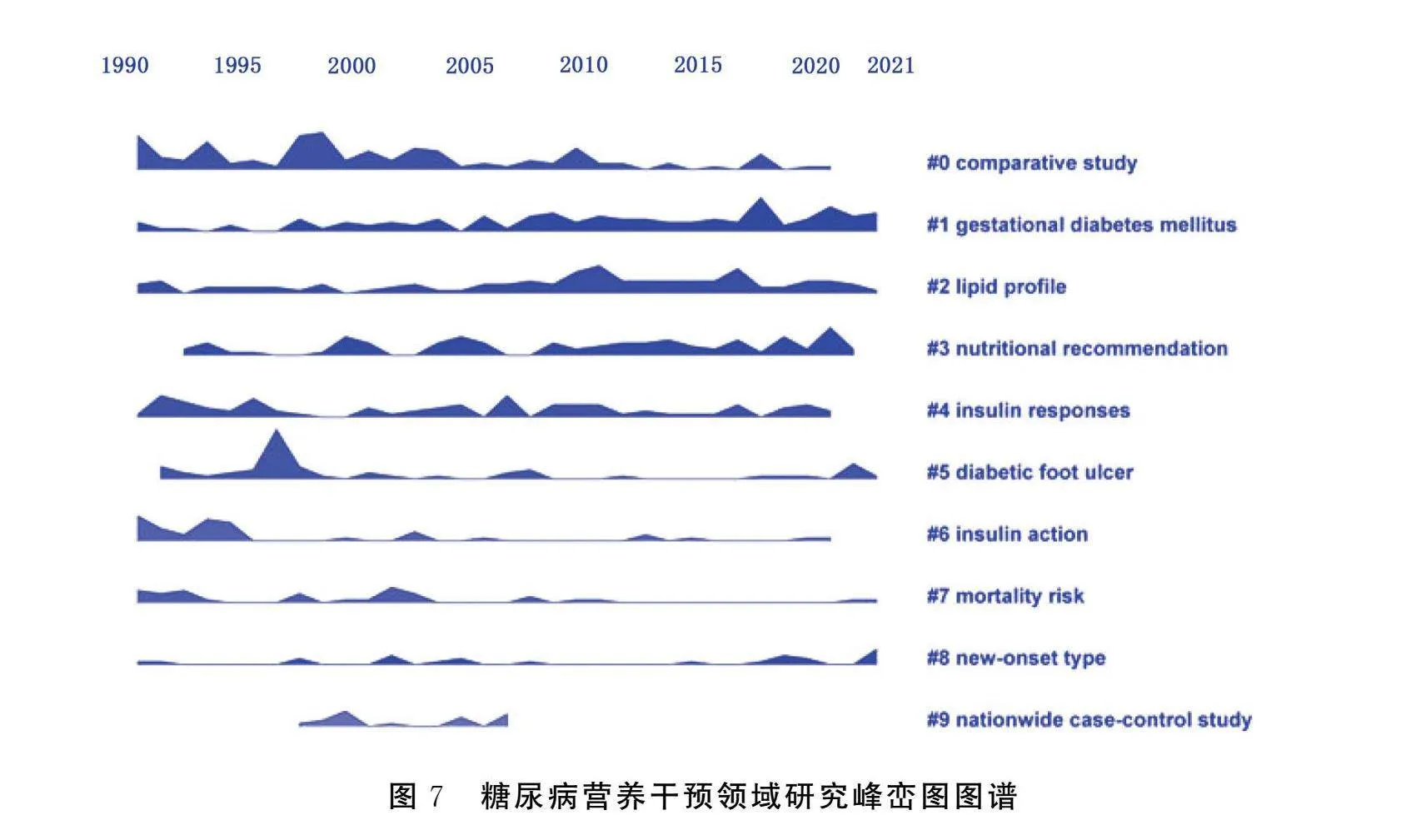
时间线图是对关键词聚类后的信息进行再分析,并聚类成新的条目,横轴是研究时间、纵轴是聚类类别,可展现各个聚类随时间的演化进程和发展脉络。峰峦图将时间线图按研究热度平铺,可直观地展现研究热度随时间的演进变化。从图6、图7得知,糖尿病营养干预领域整体发展较为平稳,新兴热点不断涌现。gestational diabetes mellitus(GDM)、lipid profile和nutrition recommendation从1990年至今仍然是活跃的研究热点,insulin response和diabetes foot ulcer近年来也受到了研究者的关注。nationwide case-control study从1990—2005年研究热度较高,diabetes foot ulcer在1995—2000年研究热度最高,形成明显的研究峰峦,其他研究条目在一定时间内形成了短暂的研究热度。
3 讨论
3.1 糖尿病营养干预领域研究发展态势
糖尿病营养干预领域发文量变化趋势图表明,该领域近48年发文量呈稳定增长的趋势,说明国际糖尿病营养干预研究热点持续存在。特别是2017年以来,学术界对糖尿病营养干预重视程度的提高,促进相关研究文献大量发表。随着经济发展和居民膳食结构的改变,糖尿病患病人数大幅增长,糖尿病营养管理对降低医疗保健成本、提高病人生活质量以及预防或延缓糖尿病并发症至关重要。
3.2 糖尿病营养干预领域研究以发达国家为主体,我国研究实力有待提升
研究结果表明,美国发文量最多,位于首位,我国发文量位居第2位,不同国家之间的合作网络尚未完全建立,未来还需加强跨地区和国家的大规模糖尿病营养研究。美国和伊朗两国是研究主力,大部分研究机构和作者之间缺乏紧密的合作交流。1971年,美国糖尿病学会(American Diabetes Association,ADA)发表《糖尿病患者营养与饮食推荐原则》指出,糖尿病病人具有特殊的营养需求,应对糖尿病病人进行饮食管理,并推荐了总热量、碳水化合物和脂肪的摄入量[7]。美国开展糖尿病营养干预研究时间早,产出大量的研究成果,研究机构和作者之间的合作网络较为紧密。我国糖尿病营养相关研究起步较晚。2010年中国医师协会营养医师专业委员会联合中华医学会糖尿病学分会共同制定了我国首个糖尿病医学营养治疗指南,糖尿病营养研究得到学术界的认可,随后有关糖尿病营养相关指南陆续更新发布。虽然我国糖尿病营养干预相关研究起步略晚,但在国家政策的支持下,我国糖尿病营养干预研究具有较大发展空间。此外,我国研究者应加强与其他国家和地区的研究机构的交流和合作,提高我国糖尿病营养干预领域的国际影响力。
3.3 研究热点分析
通过对关键词共现、聚类以及突现词分析,并结合纳入文献的具体内容,将研究热点归纳为以下3个方面。
3.3.1 糖尿病前期营养干预策略
关键词impaired glucose tolerance、insulin resistance、insulin response、insulin action、oxidative stress体现了糖尿病前期阶段营养干预策略。糖尿病前期,又称为糖耐量受损(impaired glucose tolerance,IGT)或空腹血糖受损(impaired fasting glucose,IFG),是介于正常血糖水平与2型糖尿病(tapy 2 diabetes,T2DM)之间的一种中间状态[8]。该阶段,人体对胰岛素的反应开始出现异常,表现为胰岛素抵抗或胰岛β细胞功能缺陷,导致血糖控制能力下降,但尚未达到糖尿病的确诊标准。针对这一阶段,营养干预策略显得尤为重要,通过调整饮食结构以增强机体对胰岛素的敏感性。研究证据表明,合理的饮食干预能够明显改善糖耐量受损者的血糖控制情况,降低餐后2 h血糖和空腹血糖水平[9]。此外,Banaszak等[10]的研究揭示了素食与纯素饮食模式在对抗胰岛素抵抗方面具有积极作用,增加植物性食物比例同时减少动物性食品摄入可以有效缓解胰岛素抵抗,并有助于预防糖尿病前期向T2DM进展。Kahleova等[11]的研究则通过随机交叉设计进一步证实了植物性膳食的优势:T2DM病人进食纯素餐后胰岛素分泌有所增加,提示植物性饮食在恢复和优化β细胞功能、辅助治疗T2DM方面具有切实的潜力。因此,适时采取科学的营养干预措施,特别是推广植物性为主的健康饮食模式,对于糖尿病前期病人的血糖管理及疾病预防具有重要的临床价值。
3.3.2 GDM病人的饮食模式
关键词gestational diabetes mellitus、nutrition recommendation、diet表明GDM成为糖尿病营养干预研究的重点关注内容。GDM是指在妊娠期发病或首次发生的任何程度的葡萄糖不耐受[12],是妊娠期最常见的代谢紊乱。GDM受多种因素的影响,若GDM病人血糖控制不佳,影响胎儿生长发育,增加流产、妊娠期高血压等并发症风险。优化饮食模式对于GDM的风险管理和预防具有重要作用。Zareei等[13]研究指出,坚持富含水果、蔬菜和低脂奶制品的健康饮食习惯与降低GDM发生率之间存在正相关。表明孕妇增加营养均衡食物的摄入量有助于预防GDM,保障母体及胎儿的健康。此外,在有GDM病史的女性群体中,增加水果和蔬菜的摄入量能够有效减少糖耐量受损的发生概率[14]。然而,关于蛋白质对GDM影响的研究尚存争议。Wu等[15]研究表明,妊娠中期过高的总蛋白尤其是动物源性蛋白摄入可能与GDM风险上升有关,相较于以植物蛋白为主的饮食模式,倾向于食用红肉或白肉蛋白的妇女更易患上GDM。因此,科学合理地调整膳食结构,偏向于植物性食物和适量高质量蛋白质的摄入,是GDM预防与控制的有效策略之一。
3.3.3 微量营养补充剂的作用
关键词glucose和vitamin D和突现词diet、vitamin E和zinc反映微量营养素补充剂一直是糖尿病营养干预领域的热点之一。多项研究表明,维生素D补充剂与T2DM、糖尿病并发症、高血糖和胰岛素抵抗风险呈负相关[16-19]。最近的随机对照试验表明,补充维生素D降低血糖的作用很小,主要表现在基线维生素D缺乏症病人中[20-22]。补充维生素D对T2DM病人代谢特征的益处尚不一致,这与维生素D合成、转运、分解代谢和表观遗传因素的多态性,病人维生素D水平异质性较大有关[23]。有研表明,维生素E可改善糖尿病病人的内皮细胞功能障碍究[24-25],但尚不清楚是否通过影响血糖指数和胰岛素抵抗或其他途径介导的。有研究报道,维生素E水平降低与T2DM的危险因素呈正相关[26]。一项最新的系统评价指出,维生素E补充剂的短期干预降低糖尿病病人空腹血糖[27]。尽管一些研究指出维生素E可能对糖尿病病人有益,但也有研究发现维生素E的补充对某些糖尿病病人存在一定风险[28-29]。锌是机体生长发育必需的微量元素[30],具有抗氧化、抗炎和抗凋亡的作用[31]。多项研究表明,锌改善糖尿病病人胰岛素抵抗和胰岛β细胞分泌功能,对糖尿病周围神经病变、糖尿病心肌病化和糖尿病肾病等糖尿病并发症有益[31-33]。总的来说,关于微量营养素补充剂与糖尿病之间的关系仍然是一个活跃的研究领域,需要更多大规模、多中心的前瞻性研究来明确其最佳的治疗剂量、作用机制和潜在益处。
3.4 研究趋势分析
根据时间线图和峰峦图变化把握研究趋势的变化轨迹,将研究领域的发展脉络和前沿趋势变化概括为以下两个方面。
3.4.1 新型膳食模式与效果评估
随着科研进展和临床实践的深化,新型膳食模式及其在糖尿病病人中应用的效果评估已成为糖尿病营养干预领域的前沿热点课题。这些新型膳食模式结合了最新的营养学研究成果,如地中海饮食模式、低升糖饮食、低碳水化合物饮食以及其他个性化的膳食模式,旨在通过科学调整食物类型、比例以及进食时间等方式,改善糖尿病病人的血糖控制、胰岛素敏感性和整体健康状况。De Latorre等[34]对932例妊娠妇女进行地中海饮食干预的前瞻性研究表明,地中海饮食干预可降低GDM的发病率和不良结果,可将其推广为GDM的一线治疗方法。Goldenberg等[35]研究指出,GDM病人坚持低或极低碳水化合物饮食6个月可以延缓糖尿病的进展,但非常低的碳水化合物饮食对糖尿病作用尚不明确,需要进一步的研究。Chiavaroli等[36]开展低血糖指数饮食对糖尿病影响随机对照试验,结果表明低升糖饮食模式可以小幅度改善血糖中度控制的T2DM成人病人的血糖、血脂、肥胖和血压水平。Ajala等[37]研究指出,地中海饮食与低碳水化合物、生酮饮食与纯素饮食相比,地中海饮食对T2DM的降糖效果最明显。地中海饮食是一种均衡的饮食,T2DM更容易接受,可作为长期维持的饮食计划[38]。目前,关于糖尿病饮食模式的研究干预与随访时间较短,未来还需调查这些饮食模式的长期影响和可管理性。
3.4.2 饮食模式对糖尿病血脂谱的影响与调控
饮食模式对糖尿病病人血脂谱的影响已经成为糖尿病营养干预领域内的前沿研究方向之一。近年来,越来越多的研究聚焦于探究不同类型的饮食结构如何调节糖尿病病人的血脂水平。T2DM病人常伴有脂质代谢紊乱,表现为血脂谱异常,包括三酰甘油(triglyceride,TG)水平升高、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)降低,以及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平升高。糖尿病的综合治疗方案中,除了控制血糖外,改善血脂谱的异常也是重要的组成部分。由于HDL-C和TG被视为胰岛素抵抗独立的风险标志物,通过合理饮食干预优化血脂水平不仅有助于增强机体对胰岛素的敏感性,进而改善胰岛素抵抗状态,同时有利于有效预防心血管并发症的发生[39-40],凸显了饮食调节在糖尿病全面管理中的重要价值。一项荟萃分析研究表明,生酮饮食在T2DM病人的体重管理和血糖控制方面具有明显效果,特别是对于超重的T2DM病人,可有效改善其血脂指标[41]。基于此,生酮饮食被推荐作为超重组T2DM病人的治疗性饮食干预方案。另有研究数据也显示,在肥胖/超重的T2DM群体乃至整体病人中,低碳水化合物的生酮饮食确实能够明显降低TG水平并提高HDL-C水平[42]。除了生酮饮食外,其他饮食干预手段在优化糖尿病病人血脂谱、预防心血管并发症以及整体代谢管理中的重要作用。一项涉及591例T2DM病人的Meta分析结果显示,补充益生菌有助于降低T2DM病人的TC、TG及LDL-C水平,同时提高HDL-C水平[43]。另有研究还发现,富含蔬菜和水果的饮食模式可能与1型糖尿病病人血脂异常呈负相关[44]。这表明健康饮食模式对于不同类型糖尿病病人血脂调控的重要性。未来还需深入探讨糖尿病病人血脂谱变化与各种饮食模式之间的关系,并结合现代科学技术手段,设计个体化的饮食结构和营养补充方案,帮助糖尿病病人更好地管理血脂异常,从而改善整体代谢状况并降低并发症发生率。因此,深入研究并优化适宜糖尿病病人的饮食模式,科学地指导其对血脂谱的调控作用,不仅是糖尿病营养干预的核心内容,同时也是全球糖尿病防治研究的重点发展趋势。
4 展望
本研究利用CiteSpace软件,基于Web of Science核心数据库,对近48年来糖尿病营养干预研究进行可视化分析。研究表明,我国糖尿病营养干预领域发文量尚可,但还需加强跨地区间的合作,开展高质量的临床试验,进一步探究相关营养素调控血糖的临床机制。因本研究仅检索1个数据库的文献,存在一定的局限性,未来还需检索更多的数据库,进一步分析糖尿病营养干预的研究热点与趋势。整体来看,营养干预作为糖尿病综合治疗重要组成部分,有效改善血糖管理并降低相关并发症的风险,但目前关于微量营养素补充剂对糖尿病治疗剂量尚未达成共识,微量营养素对糖尿病病人的潜在益处的作用机制尚不明晰,需要更多高质量的干预性试验来确定最佳的治疗剂量及潜在保护作用,为糖尿病病人微量营养素的补充制定适当的策略。此外,营养干预对GDM病人效果显著,针对不同时期GDM病人给予其个性化的饮食模式,进而提高病人的生活质量,促进我国糖尿病医学营养治疗领域的蓬勃发展。
参考文献:
[1] PETERSMANN A,MLLER-WIELAND D,MLLER U A,et al.Definition,classification and diagnosis of diabetes mellitus[J].Experimental and Clinical Endocrinology & Diabetes,2019,127(S1):S1-S7.
[2] SUN H,SAEEDI P,KARURANGA S,et al.IDF diabetes atlas:global,regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Research and Clinical Practice,2022,183:109119.
[3] 中国疾病预防控制中心慢性非传染性疾病预防控制中心,国家卫生健康委统计信息中心.中国死因监测数据集—2020[M].北京:中国科学技术出版社,2021:80-90.
[4] Nutrition and Metabolic Management Branch of China International Exchange and Promotive Association for Medical and Health Care,Clinical Nutrition Branch of Chinese Nutrition Society,Chinese Diabetes Society,et al.Chinese guidelines for medical nutrition therapy for patients with diabetes(2022 edition)[J].Asia Pacific Journal of Clinical Nutrition,2024,33(2):118-152.
[5] 李杰,陈超美.CiteSpace:科技文本挖掘及可视化[M].3版.北京:首都经济贸易大学出版社,2022:2-4.
[6] LIANG Y D,LI Y,ZHAO J,et al.Study of acupuncture for low back pain in recent 20 years:a bibliometric analysis via CiteSpace[J].Journal of Pain Research,2017,10:951-964.
[7] ANON.Principles of nutrition and dietary recommendations for patients with diabetes mellitus:1971[J].Diabetes,1971,20(9):633-634.
[8] 吴相慰,曾海涓,马灵灵,等.糖尿病前期人群早期评估及综合性干预的研究进展[J].中国老年保健医学,2023,21(6):104-107.
[9] GONG Q H,KANG J F,YING Y Y,et al.Lifestyle interventions for adults with impaired glucose tolerance:a systematic review and Meta-analysis of the effects on glycemic control[J].Internal Medicine,2015,54(3):303-310.
[10] BANASZAK M,GRNA I,PRZYSAWSKI J.Non-pharmacological treatments for insulin resistance:effective intervention of plant-based diets--a critical review[J].Nutrients,2022,14(7):1400.
[11] KAHLEOVA H,TURA A,KLEMENTOVA M,et al.A plant-based meal stimulates incretin and insulin secretion more than an energy-and macronutrient-matched standard meal in type 2 diabetes:a randomized crossover study[J].Nutrients,2019,11(3):486.
[12] ANON.Queensland health[EB/OL].(2022-05-19)[2024-01-02].https://www.health.qld.gov.au/search?query=Guideline%3A+
Gestational+Diabetes+Mellitus+%28GDM%29.
[13] ZAREEI S,HOMAYOUNFAR R,NAGHIZADEH M M,et al.Dietary pattern in pregnancy and risk of gestational diabetes mellitus(GDM)[J].Diabetes & Metabolic Syndrome,2018,12(3):399-404.
[14] MERCIER R,PERRON J,WEISNAGEL S J,et al.Associations between fruit and vegetables intake and abnormal glucose tolerance among women with prior gestational diabetes mellitus[J].European Journal of Nutrition,2019,58(2):689-696.
[15] WU W J,TANG N,ZENG J J,et al.Dietary protein patterns during pregnancy are associated with risk of gestational diabetes mellitus in Chinese pregnant women[J].Nutrients,2022,14(8):1623.
[16] HUANG S Z,FU J F,ZHAO R X,et al.The effect of combined supplementation with vitamin D and omega-3 fatty acids on blood glucose and blood lipid levels in patients with gestational diabetes[J].Annals of Palliative Medicine,2021,10(5):5652-5658.
[17] WANG L L,LIU X,HOU J,et al.Serum vitamin D affected type 2 diabetes though altering lipid profile and modified the effects of testosterone on diabetes status[J].Nutrients,2020,13(1):90.
[18] AHMED L H M,BUTLER A E,DARGHAM S R,et al.Association of vitamin D2 and D3 with type 2 diabetes complications[J].BMC Endocrine Disorders,2020,20(1):65.
[19] ALQAHTANI R M,ALSULAMI E F.The association between glycated hemoglobin(HbA1c)level and vitamin D level in diabetes mellitus patients:a cross-sectional study[J].Cureus,2023,15(10):e47166.
[20] RASOULI N,BRODSKY I G,CHATTERJEE R,et al.Effects of vitamin D supplementation on insulin sensitivity and secretion in prediabetes[J].The Journal of Clinical Endocrinology and Metabolism,2022,107(1):230-240.
[21] LO M C,ABUSHAMAT L,MRAMBA L K.Effect of treating vitamin D deficiency in uncontrolled type 2 diabetes:a randomized,placebo-controlled study[J].American Journal of Therapeutics,2019,26(4):e441-e451.
[22] GULSETH H L,WIUM C,ANGEL K,et al.Effects of vitamin D supplementation on insulin sensitivity and insulin secretion in subjects with type 2 diabetes and vitamin D deficiency:a randomized controlled trial[J].Diabetes Care,2017,40(7):872-878.
[23] AL-DAGHRI N M,MOHAMMED A K,AL-ATTAS O S,et al.Vitamin D receptor gene polymorphisms modify cardiometabolic response to vitamin D supplementation in T2DM patients[J].Scientific Reports,2017,7(1):8280.
[24] MINTER B E,LOWES D A,WEBSTER N R,et al.Differential effects of Mito Vit-E,α-tocopherol and trolox on oxidative stress,mitochondrial function and inflammatory signalling pathways in endothelial cells cultured under conditions mimicking sepsis[J].Antioxidants,2020,9(3):195.
[25] BAVANI N G,SANEEI P,HASSANZADEH K A,et al.Magnesium intake,insulin resistance and markers of endothelial function among women[J].Public Health Nutrition,2021,24(17):5777-5785.
[26] CHUA G H I,PHANG S C W,WONG Y O,et al.Vitamin E levels in ethnic communities in Malaysia and its relation to glucose tolerance,insulin resistance and advanced glycation end products:a cross-sectional study[J].Nutrients,2020,12(12):3659.
[27] ASBAGHI O,NAZARIAN B,YOUSEFI M,et al.Effect of vitamin E intake on glycemic control and insulin resistance in diabetic patients:an updated systematic review and Meta-analysis of randomized controlled trials[J].Nutrition Journal,2023,22(1):10.
[28] DALAN R,GOH L L,LIM C J,et al.Impact of Vitamin E supplementation on vascular function in haptoglobin genotype stratified diabetes patients(EVAS trial):a randomised controlled trial[J].Nutrition & Diabetes,2020,10(1):13.
[29] HASHEMI S.Adiponectin and glycemic profiles in type 2 diabetes patients on eicosapentaenoic acid with or without vitamin E[J].Acta Endocrinologica(Bucharest),2014,10(1):84-96.
[30] MAMMADOVA-BACH E,BRAUN A.Zinc homeostasis in platelet-related diseases[J].International Journal of Molecular Sciences,2019,20(21):5258.
[31] SUN W X,YANG J X,WANG W N,et al.The beneficial effects of Zn on Akt-mediated insulin and cell survival signaling pathways in diabetes[J].Journal of Trace Elements in Medicine and Biology,2018,46:117-127.
[32] CRUZ K J C,DE OLIVEIRA A R S,MORAIS J B S,et al.Zinc and insulin resistance:biochemical and molecular aspects[J].Biological Trace Element Research,2018,186(2):407-412.
[33] NOROUZI S,ADULCIKAS J,SOHAL S S,et al.Zinc stimulates glucose oxidation and glycemic control by modulating the insulin signaling pathway in human and mouse skeletal muscle cell lines[J].PLoS One,2018,13(1):e0191727.
[34] DE LATORRE N G,ASSAF-BALUT C,JIMNEZ VARAS I,et al.Effectiveness of following mediterranean diet recommendations in the real world in the incidence of gestational diabetes mellitus(GDM)and adverse maternal-foetal outcomes:a prospective,universal,interventional study with a single group.the st Carlos study[J].Nutrients,2019,11(6):1210.
[35] GOLDENBERG J Z,JOHNSTON B C.Low and very low carbohydrate diets for diabetes remission[J].BMJ,2021,373:n262.
[36] CHIAVAROLI L,LEE D,AHMED A,et al.Effect of low glycaemic index or load dietary patterns on glycaemic control and cardiometabolic risk factors in diabetes:systematic review and Meta-analysis of randomised controlled trials[J].BMJ,2021,374:n1651.
[37] AJALA O,ENGLISH P,PINKNEY J.Systematic review and Meta-analysis of different dietary approaches to the management of type 2 diabetes[J].The American Journal of Clinical Nutrition,2013,97(3):505-516.
[38] CHESTER B,BABU J R,GREENE M W,et al.The effects of popular diets on type 2 diabetes management[J].Diabetes/Metabolism Research and Reviews,2019,35(8):e3188.
[39] ACCURSO A,BERNSTEIN R K,DAHLQVIST A,et al.Dietary carbohydrate restriction in type 2 diabetes mellitus and metabolic syndrome:time for a critical appraisal[J].Nutrition & Metabolism,2008,5:9.
[40] YUAN X J,WANG J P,YANG S,et al.Effect of the ketogenic diet on glycemic control,insulin resistance,and lipid metabolism in patients with T2DM:a systematic review and Meta-analysis[J].Nutrition & Diabetes,2020,10:38.
[41] ZHOU C,WANG M,LIANG J L,et al.Ketogenic diet benefits to weight loss,glycemic control,and lipid profiles in overweight patients with type 2 diabetes mellitus:a Meta-analysis of randomized controlled trails[J].International Journal of Environmental Research and Public Health,2022,19(16):10429.
[42] LUO W,ZHANG J,XU D,et al.Low carbohydrate ketogenic diets reduce cardiovascular risk factor levels in obese or overweight patients with T2DM:a Meta-analysis of randomized controlled trials[J].Frontiers in Nutrition,2022,9:1092031.
[43] HE J,ZHANG F,HAN Y.Effect of probiotics on lipid profiles and blood pressure in patients with type 2 diabetes:a Meta-analysis of RCTs[J].Medicine,2017,96(51):e9166.
[44] SAJJADPOUR Z,NASLI-ESFAHANI E,SIASSI F,et al.Healthy dietary pattern is related to blood lipids in patients with type 1 diabetes mellitus:a cross-sectional study from a developing country[J].International Journal of Preventive Medicine,2021,12:7.
(收稿日期:2024-01-17;修回日期:2024-08-21)
(本文编辑张建华)
