2型糖尿病合并肾脏损伤的临床病理特征及预测指标
2024-11-02王勾琴曾嵘




[摘要] 目的探讨可预测糖尿病肾病(diabetic kidney disease,DKD)和糖尿病合并非糖尿病肾病(non-diabetic kidney disease,NDKD)患者的临床或实验室指标。方法回顾性分析兰州大学第二医院肾病内科2017年1月至2021年12月肾脏病理确诊为2型糖尿病合并肾脏损伤的130例患者,根据肾脏病理类型分为DKD组(77例)、NDKD组(34例)和DKD+NDKD组(19例)三组。比较三组患者的临床及实验室指标。多因素Logistic回归分析探讨DKD和NDKD的独立危险因素,受试者操作特征曲线(receiver operatingcharacteristiccurve,ROC曲线)预测DKD和NDKD的敏感度和特异性。结果 原发性肾小球肾炎为2型糖尿病合并NDKD最主要的肾脏损伤类型,其中最常见的病理类型为IgA肾病,其次为膜性肾病和微小病变性肾小球病。单因素方差分析提示,与DKD组比较,NDKD组患者糖尿病病史更短,发生糖尿病视网膜病变及心脏舒张功能减退的比例均更低。多因素Logistic回归分析发现2型糖尿病病史和糖尿病视网膜病变是预测患者发生DKD和NDKD的独立危险因素。ROC曲线分析显示2型糖尿病病史<6.5年和无糖尿病视网膜病变是预测NDKD的良好临床指标。结论NDKD是2型糖尿病合并肾脏损伤的一种常见病变类型。短期糖尿病病史及无视网膜病变预示可能为NDKD,应及时完善肾活检穿刺以明确诊断。
[关键词] 糖尿病肾病;糖尿病合并非糖尿病肾病;糖尿病视网膜病变;糖尿病病史;肾活检;病理
[中图分类号] R587.1[文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.27.013
Clinical pathological characteristicsand predictive index of kidney injury inpatientswithtype 2 diabetesmellitus
Departmentof Nephrology, the SecondHospital of Lanzhou University, Lanzhou730030, Gansu, China
[Abstract]ObjectiveTodiscussclinical or laboratory indicators that can predict diabetic kidney disease (DKD) and diabetespatients with non-diabetic kidney disease (NDKD).MethodsA total of 130 casestype 2 diabetes mellituswith renal injury confirmed by renal biopsy from January2017 to December 2021 in the Department of Nephrology, the Second Hospital of Lanzhou Universitywereretrospectivelyanalyzed.According to the pathological type of kidney, the patients were divided into three groups: DKD group (77 cases), NDKD group (34 cases), andDKD+NDKDgroup (19 cases).Clinical orlaboratory indicators among three groups were compared. Multivariate Logistic regression was used to analyze the independent risk factors of DKD and NDKD, receiver operatingcharacteristic(ROC) curve was used to predict sensitivity and specificity of DKD and NDKD. ResultsPrimary glomerulonephritis wasthe main type of renal injury in type 2 diabetes mellituspatients with NDKD,of which IgA nephropathy wasthe most common pathological type,followed by membranous nephropathy and minimal change glomerulonephritis.Single factor analysis of variance showed that compared with DKD group,NDKD group had a shorter history of diabetes, and a lower proportionof diabetes retinopathy and impaired cardiac diastolic function.Multivariate Logistic regression analysis found that the history of diabetes and diabetes retinopathy were risk factors for predicting DKD and NDKD. ROCcurve analysis showed that the history of diabetes<6.5 years and nodiabetesretinopathy could be used as clinical indicators to better predict NDKD.ConclusionNDKD is a common type of type 2 diabetes mellituswith renal injury. The short history of diabetes and no diabetes retinopathy suggest that it may be NDKD, and renal biopsy should be performed in time to make a clear diagnosis.
[Key words]Diabetic kidney disease; Diabetes combined with non-diabetic kidney disease; Diabetes retinopathy; Historyof diabetes;Renal biopsy; Pathology
糖尿病肾病(diabetic kidney disease,DKD)是2型糖尿病的主要微血管并发症之一,也是导致终末期肾病的主要原因[1]。DKD临床诊断基于长期的糖尿病病史(通常10年以上),存在糖尿病视网膜病变和蛋白尿[2]。然而DKD并不是2型糖尿病患者唯一的肾脏损伤类型,还可合并非糖尿病肾病(non- diabetic kidney disease,NDKD)或在DKD的基础上合并NDKD等肾脏损伤,需借助肾活检进行诊断与鉴别诊断。当前研究数据显示2型糖尿病合并NDKD的患病率为3.0%~82.9%,DKD合并NDKD患病率为4.0%~45.5%,这种患病率的差异可能与研究人群不同及不同研究对糖尿病患者肾活检的指标把握不同有关[3]。由于某些患者存在活检的禁忌证或由于临床医生未常规对患者进行肾组织病理检查,可能导致对NDKD的误诊或延误治疗。因此,正确识别可区分DKD和NDKD的临床指标,对疑似2型糖尿病合并NDKD患者及时完善肾脏病理检查以明确诊断,对改善肾脏预后意义重大。本研究通过分析肾脏病理证实的DKD和NDKD患者的临床指标,建立预测DKD和NDKD的模型,以帮助临床医生更准确地识别糖尿病合并NDKD患者。
1 资料与方法
1.1 一般资料
e4ccb1f215cc47e224f991ce24a82607回顾性分析兰州大学第二医院肾病内科2017年1月至2021年12月经肾脏病理确诊为2型糖尿病合并肾脏损伤的130例患者。根据肾脏病理类型分为DKD组(77例)、NDKD组(34例)和DKD+NDKD组(19例)三组。
纳入标准:①年龄≥18岁;②肾活检穿刺前已确诊的2型糖尿病患者;③肾脏病理确诊为DKD或NDKD的患者。排除标准:①1型糖尿病或其他类型的糖尿病(如类固醇性糖尿病)患者;②恶性肿瘤患者;③临床资料不完整的患者。糖尿病的诊断符合美国糖尿病协会(American Diabetes Association,ADA)的诊断标准[4]。本研究经兰州大学第二医院医学伦理委员会审批通过(伦理审批号:2024A-752)。
1.2 数据采集及辅助检查
采集患者的临床数据:性别、年龄、2型糖尿病病史、身高、体质量、血压、有无糖尿病视网膜病变;实验室数据:尿红细胞计数、血红蛋白、空腹血糖、餐后2h血糖、糖化血红蛋白、血肌酐、血尿酸、血清白蛋白、总胆固醇、三酰甘油、低密度脂蛋白及24h尿蛋白定量。计算体质量指数(body mass index,BMI)=体质量(kg)/身高2(m2);采用慢性肾脏病流行病学协作组(chronic kidney disease epidemiology collaboration,CKD-EPI)公式估算患者的肾小球滤过率(estimated glomerular filtration rate,eGFR);借助超声评估患者的心脏功能,眼底造影明确患者有无糖尿病视网膜病变。
1.3 统计学方法
采用SPSS 26.0统计学软件对数据进行处理分析。计数资料以例数(百分率)[(%)]表示,比较采用2检验,计量资料以均数±标准差(x±s)表示,比较采用检验。多因素Logistic回归分析评估DKD和NDKD的临床预测因素。应用受试者操作特征曲线(receiver operatingcharacteristiccurve,ROC曲线)分析预测临床指标的敏感度和特异性。<0.05为差异有统计学意义。
2 结果
2.1 三组患者的一般资料及实验室指标比较
与NDKD组及DKD+NDKD组比较,DKD组患者的糖尿病病史更长,发生糖尿病视网膜病变及心脏舒张功能减退的比例更高(<0.05)。与NDKD组比较,DKD组患者的收缩压升高及血尿酸、eGFR降低更显著(<0.05)。与DKD+NDKD组比较,DKD组患者的血红蛋白浓度更低(<0.05)。三组患者的性别、年龄、BMI、糖化血红蛋白、血肌酐、血清白蛋白、血脂、舒张压、尿蛋白定量、镜下血尿及心脏收缩功能比较,差异无统计学意义(>0.05),见表1。
2.2 NDKD组和DKD+NDKD组患者的肾脏损伤病理类型
进一步病理分析结果表明原发性肾小球肾炎是NDKD组患者的最主要病变类型,其中以IgA肾病最为常见,其次为膜性肾病和微小病变性肾小球病。狼疮性肾炎是NDKD组患者最常见的继发性肾脏疾病类型,其次为过敏性紫癜性肾炎和乙肝肾炎。DKD+NDKD组患者最常见的病理类型为IgA肾病,其次为膜性肾病,见表2。
2.3 DKD和NDKD的临床预测因素
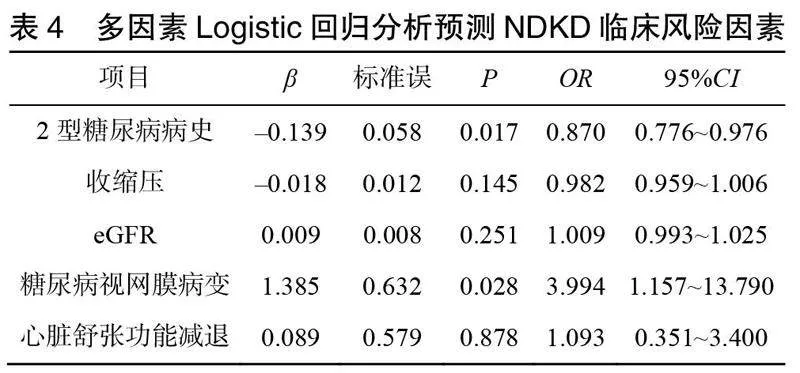
采用多因素Logistic回归分析预测DKD和NDKD的临床危险因素,结果显示2型糖尿病病史和糖尿病视网膜病变是预测DKD的独立危险因素,见表3和表4。2型糖尿病病史每增加1年,患DKD的风险增加1.149倍;2型糖尿病合并视网膜病变者发生DKD的风险是未合并视网膜病变者的3.994倍。ROC曲线分析评估糖尿病病史和视网膜病变预测DKD及NDKD的敏感度和特异性,结果提示,无糖尿病视网膜病变和2型糖尿病病史<6.5年可作为预测NDKD的临床指标,见表5。
3 讨论
本研究结果显示DKD、NDKD和DKD+NDKD患者数分别占2型糖尿病合并肾脏损伤患者的59.2%、26.2%和14.6%,提示2型糖尿病合并NDKD患病率较高,临床医生在诊断时应高度警惕,不应忽略NDKD的存在。NDKD的病理类型以原发性肾小球肾炎为主,病变类型主要为IgA肾病、膜性肾病及微小病变性肾小球病;狼疮性肾炎是NDKD最常见的继发性肾脏疾病。研究显示DKD和NDKD患者5年内进展至终末期肾病的比例分别为29.5%和4.0%,可见NDKD的肾脏预后明显优于DKD[5]。因此早期识别NDKD临床预测的危险因素、及时通过肾活检明确诊断可使NDKD患者获益,可极大改善肾脏预后结局。本研究结果显示较长的糖尿病病史和存在糖尿病视网膜病变是预测DKD的独立风险因素,而较短的糖尿病病史和无糖尿病视网膜病变则预示NDKD的可能性较高。研究显示eGFR、镜下血尿、糖化血红蛋白及收缩压也是区分DKD和NDKD的临床指标[6-9];但本研究显示,与DKD组和NDKD组患者镜下血尿和糖化血红蛋白比较,差异无统计学意义。另外,本研究显示,与NDKD组比较DKD组患者的eGFR明显较低,NDKD组患者的血尿酸、收缩压较DKD组升高,进一步Logistic回归分析结果显示eGFR、血尿酸、收缩压并不能作为预测DKD和NDKD的临床危险因素。
微量蛋白尿是诊断早期DKD的重要临床指标。患者从正常白蛋白尿过度到微量蛋白尿再进展至大量蛋白尿是典型2型糖尿病DKD的演变过程,通常从确诊2型糖尿病发展到出现微量蛋白尿的时间是10年[10-11]。本研究结果显示糖尿病病史≥6.5年可作为预测DKD的临床指标;另一项研究显示糖尿病病史>5年是预测DKD的最佳临床指标,糖尿病病史≤5年是预测NDRD的独立风险因素[12]。但需注意的是较多患者并不清楚自身糖尿病的准确发病时间,在确诊糖尿病时疾病可能已存在较长时间。因此,患者提供的糖尿病病史不能十分准确预测DKD和NDKD,肾活检是明确诊断的唯一方法。
糖尿病视网膜病变是糖尿病另一种常见的微血管并发症,与DKD的发生存在相似的病理生理机制。据统计2型糖尿病合并糖尿病视网膜病变的患病率为25.26%,DKD阶段合并糖尿病视网膜病变的发病率为68%[13-14]。现已证实高血糖、高血压和血脂紊乱与糖尿病视网膜病变的发生有关[15]。5~12年的糖尿病病史是发生视网膜病变的重要风险因素,不同研究存在较大差异[16]。多数研究认为糖尿病视网膜病变可作为诊断DKD的临床指标,但其严重程度与DKD的严重程度并不呈正相关[14]。本研究结果显示DKD组和NDKD组合并糖尿病视网膜病变的患病率分别为79.2%和23.5%,结合ROC曲线分析结果提示存在糖尿病视网膜病变可作为预测DKD的良好临床指标,而无糖尿病视网膜病变预示可能为NDKD。但需注意并非所有DKD患者均合并糖尿病视网膜病变,本研究结果显示DKD未合并视网膜病变者占20.8%。因此对无糖尿病视网膜病变者并不能完全排除DKD,还需进一步肾脏病理检查确诊。
综上所述,本研究显示NDKD是2型糖尿病合并肾脏损伤的一种常见病变类型。糖尿病病史≥6.5年和存在糖尿病视网膜病变可作为预测DKD的良好临床指标,而糖尿病病史<6.5年及无糖尿病视网膜病变则预示NDRD的可能性较大,应及时行肾活检穿刺明确诊断。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] THOMAS M C, COOPER M E, ZIMMET P. Changing epidemiology of type 2 diabetes mellitus and associated chronic kidney disease[J]. Nat Rev Nephrol, 2015, 12(2): 73–81.
[2] 中华医学会肾脏病学分会专家组. 糖尿病肾脏疾病诊断、预后评估和生物标志物应用专家共识[J]. 中华肾脏病杂志, 2022, 38(8): 771–784.
[3] MARCO F, DAVIDE B, VLADIMIR T, et al. Renal biopsy in patients with diabetes: A pooled Meta-analysis of 48 studies[J]. Nephrol Dial Transplant, 2017, 32(1): 97–110.
[4] American Diabetes Association Professional Practice Committee. Classification and diagnosis of diabetes: Standards of medical care in diabetes-2022[J]. Diabetes Care, 2022, 45(Suppl 1): S17–S38.
[5] WANG J, HAN Q, ZHAO L, et al. Identification of clinical predictors of diabetic nephropathy and non-diabetic renal disease in Chinese patients with type 2 diabetes, with reference to disease course and outcome[J]. Acta Diabetol, 2019, 56(8): 939–946.
[6] MAMI I, HARZALLAH A, KAAROUD H, et al. Non-diabetic renal disease in patients with type 2 diabetes[J]. Saudi J Kidney Dis Transpl, 2017, 28(4): 842–850.
[7] CHEMOUNY J M, BOBOT M, SANNIER A, et al. Kidney biopsy in type 2 diabetes: A multicenter cross-sectional study[J]. Am J Nephrol, 2021, 52(2): 131–140.
[8] LIU S, GUO Q, HAN H, et al. Clinicopathological characteristics of non-diabetic renal disease in patients with type 2 diabetes mellitus in a northeastern Chinese medical center: A retrospective aBu5Z9j62yVaR1G7jNi/pSw==nalysis of 273 cases[J]. Int Urol Nephrol, 2016, 48(10): 1691–1698.
[9] WANG XY, LI J, HUO L, et al. Clinical characteristics of diabetic nephropathy in patients with type 2 diabetic mellitus manifesting heavy proteinuria: A retrospective analysis of 220 cases[J]. Diabetes Res Clin Pract, 2019, 157: 107874 .
[10] OTU H H, CAN H, SPENTZOS D, et al. Prediction of diabetic nephropathy using urine proteomic profiling 10 years prior to development of nephropathy[J]. Diabetes Care, 2007, 30(3): 638–643.
[11] OSHIMA M, SHIMIZU M, YAMANOUCHI M, et al. Trajectories of kidney function in diabetes: A clinicopathological update[J]. Nat Rev Nephrol, 2021, 17(11): 740–750.
[12] DONG Z, WANG Y, QIU Q, et al. Clinical predictors differentiating non-diabetic renal diseases from diabetic nephropathy in a large population of type 2 diabetes patients[J]. Diabetes Res Clin Pract, 2016, 121: 112–118.
[13] YAU J W, ROGERS S L, KAWASAKI R, et al. Global prevalence and major risk factors of diabetic retinopathy[J]. Diabetes Care, 2012, 35(3): 556–564.
[14] JIANG S, YU T, ZHANG Z, et al. Diagnostic performance of retinopathy in the detection of diabetic nephropathy in type 2 diabetes: A systematic review and Meta-analysis of 45 studies[J]. Ophthalmic Res, 2019, 62(2): 68–79.
[15] CHEW E Y, AMBROSIUS W T, DAVIS M D, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes[J]. N Engl J Med, 2010, 363(3): 233–244.
[16] FONG D S, AIELLO L, GARDNER T W, et al. Diabetic retinopathy[J]. Diabetes Care, 2003, 26(1): 226–229.
(收稿日期:2024–02–20)
(修回日期:2024–08–13)
