miR-145联合TGF-β1检测在NSCLC中的临床价值研究
2024-11-02龙钰乔丹
[摘要] 目的 检测微小核糖核酸145(microRNA 145,miR-145)、转化生长因子-β1(transforming growth factor β1,TGF-β1)在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达并研究其临床价值。方法选取2020年1月至2021年1月杭州市中医院诊治的92例NSCLC患者(NSCLC组)及45例肺部良性疾病患者(对照组)为研究对象。检测并比较两组患者的miR-145、TGF-β1表达差异。采用受试者操作特征曲线(receiver operatingcharacteristiccurve,ROC曲线)分析miR-145联合TGF-β1预测NSCLC预后不良的敏感度及特异性。多因素Cox回归分析探讨NSCLC患者预后的危险因素。Kaplan-Meier模型分析miR-145、TGF-β1与生存期的关系。结果与NSCLC组癌旁正常组织和对照组活检组织比较,NSCLC组肿瘤组织的miR-145表达显著降低(<0.001),TGF-β1表达显著升高(<0.001)。T分期T3~T4、区域淋巴结N2+N3、有远处转移及TNM分期Ⅲ~Ⅳ期NSCLC患者的miR-145表达低于T分期T1~T2、区域淋巴结N0+N1、无远处转移及TNM分期Ⅰ~Ⅱ期患者,TGF-β1高于T分期T1~T2、区域淋巴结N0+N1、无远处转移及TNM分期Ⅰ~Ⅱ期患者,差异有统计学意义(<0.001)。miR-145联合TGF-β1预测NSCLC患者预后不良的敏感度、特异性高于miR-145、TGF-β1、T分期、区域淋巴结、远处转移及TNM分期(<0.05)。NSCLC组中miR-145≤0.61且TGF-β1≥0.85患者的中位生存期显著低于其他患者(miR-145>0.61或TGF-β1<0.85)[中位生存期(29.37±5.51)个月(34.34±6.09)个月,Log Rank=16.478,<0.001]。结论 NSCLC患者miR-145表达显著降低而TGF-β1显著升高,在NSCLC病情及预后评估中具有一定的临床价值。miR-145及TGF-β1联合检测可显著提高预测NSCLC预后不良的敏感度及特异性。
[关键词] 非小细胞肺癌;微小核糖核酸145;转化生长因子-β1;临床病理特征;预后
[中图分类号] R734.2[文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.27.011
Study on the clinical value of miR-145 combined with TGF-β1detection in non-small cell lung cancer
1.Department of Pathology, Hangzhou Hospital of Traditional Chinese Medicine, Hangzhou 310007, Zhejiang,China;2.Department of Pathology, Run Run Shaw Hospital, Affiliated to Zhejiang University School of Medicine, Hangzhou, 310007, Zhejiang, China
[Abstract] Objective To detect the expression of microRNA 145(miR-145)and transforming growth factor β1(TGF-β1) in non-small cell lung cancer (NSCLC) and study their clinical value. Methods92 NSCLC patients (NSCLC group) and 45 patients with benign lung diseases (control group) diagnosed and treated from January 2020 to January 2021 in Hangzhou Hospital of Traditional Chinese Medicinewere selected as the research subjects. The expression differences of miR-145 and TGF-β1between two groups of research subjects were detected and compared. Receiver operatingcharacteristic(ROC) curve was used to analyze the sensitivity and specificity of miR-145 combined with TGF-β1in predicting poor prognosis of NSCLC. Multivariate Cox regression analysis was used forrisk factors ofprognosis in NSCLC patients. Kaplan-Meier model was used to analyze the relationship between miR-145, TGF-β1and survivaltime. ResultsCompared with the adjacent normal tissue inNSCLC group and the biopsy tissue in control group, the expression of miR-145 in the tumor tissue of NSCLC group was significantly reduced (<0.001), and the expression of TGF-β1was significantly increased (<0.001). The expression of miR-145 in NSCLC patients with T stage T3-T4, regional lymph nodes N2+N3, distant metastasis and TNM stage Ⅲ-Ⅳis lower than that in T stage T1-T2, regional lymph nodes N0+N1, no distant metastasis and TNMstage Ⅰ-Ⅱ. TGF-β1was higher than that in patients with T stage T1-T2, regional lymph nodes N0+N1, no distant metastasis and TNM stage Ⅰ-Ⅱ, and the difference was statistically significant (<0.001). The sensitivity and specificity of miR-145 combined with TGF-β1in predicting poor prognosis in NSCLC patients was higher than that of miR-145, TGF-β1, T stage, regional lymph nodes, distant metastasis and TNM stage (<0.05). In NSCLC group, the median survival time of patients with miR-145≤0.61 and TGF-β1≥0.85 was significantly lower than that of other patients (miR-145>0.61 or TGF-β1<0.85) [median survival time (29.37±5.51)months (34.34±6.09)months, Log Rank=16.478, <0.001]. ConclusionThe expression of miR-145 is significantly reduced and TGF-β1is significantly increased in NSCLC patients, which has certain clinical value in the evaluation of NSCLC condition and prognosis. Combined detection of miR-145 and TGF-β1can significantly improve the sensitivity and specificity in predicting poor prognosis of NSCLC.
[Key words]Non-small cell lung cancer; MicroRNA 145; Transforming growth factor β1; Clinicopathological characteristics; Prognosis
非小细胞肺癌(non-small cell lung cancer,NSCLC)发病率呈逐年上升趋势,起病隐匿且确诊时往往处于进展期,导致目前NSCLC近远期疗效较差,改善NSCLC临床诊疗现状并提高患者的生存期具有重要意义[1]。NSCLC发病机制与空气污染和肺部慢性炎症诱导的基因突变有关,基因表达异常与NSCLC临床病理特征和生存期密切相关,对NSCLC病情和预后评估的临床价值高于肿瘤标志物和TNM分期[2]。微小核糖核酸145(microRNA 145,miR-145)具有调控细胞增殖、凋亡等多种功能,可抑制肿瘤细胞迁移、侵袭等恶性生物学行为,其在多种恶性肿瘤中表达降低,与临床病理特征相关,其水平降低为多种恶性肿瘤预后不良的标志[3-4]。转化生长因子-β1(transforming growth factor β1,TGF-β1)与肿瘤细胞的增殖、迁移、侵袭等恶性生物学行为有关,在多种恶性肿瘤细胞中可检测到其表达异常[5-6]。研究发现miR-145可靶向调控TGF-β1参与良恶性疾病发病机制[7-8]。目前miR-145和TGF-β1在N0e817cb28f022a674c90aef4eaad119eSCLC中的检测及其临床价值尚未完全明确。本研究分析检测NSCLC患者的miR-145和TGF-β1表达并研究其临床价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年1月杭州市中医院诊治的92例NSCLC患者(NSCLC组)作为研究对象。纳入标准:①经病理组织学检查确诊(肺穿刺或术后病理);②临床资料完整;③术前影像学检查(CT等)和(或)术后病理检查有明确的TNM分期(cTNM或pTNM);④知情并同意参加本研究。排除标准:①合并其他良恶性肿瘤、肺部转移瘤;②无法配合本研究;③合并神经精神疾病;④随访时脱访者。同期选取45例肺良性疾病可取得病理组织的患者(包括良性结节、肺结核、肺炎等)作为对照组。两组患者的一般资料比较,差异无统计学意义(>0.05),具有可比性,见表1。本研究经杭州市中医院医学伦理委员会审批通过(伦理审批号:2024KLL071)。
1.2miR-145和TGF-β1检测
RNA提取试剂盒购自上海翌圣公司;定量反转录聚合酶链反应(quantitative reverse transcriptase-mediated polymerase chain reaction,qRT-PCR)检测试剂购自大连宝生物公司;qRT-PCR扩增仪为美国赛默飞公司QuantStudio 6 Pro系统。收集NSCLC组患者的肿瘤组织及癌旁正常组织(仅限术后病理组织学),收集对照组患者的肺部活检组织。提取两组患者的组织总RNA后纯化并定量,采用qRT-PCR检测miR-145和TGF-β1,miR-145正向引52e3e5ea711589cbd78b8e01fa260064物为5′-GTCCAGTTTTCCCAGGA-3′,反向引物为5′-GAACATGTCTGCGTATCTC-3′;TGF-β1正向引物为5′-TACCTGAACCCGTGTTGCTCTC-3′,反向引物为5′-GTTGCTGAGGTATCGCCAGGAA-3′;U6正向引物为5′-CTCGCTTCGGCAGCACAT-3′,反向引物为5′-TTTGCGTGTCATCCTTGCG-3′;β-肌动蛋白正向引物为5′-CACCATTGGCAATGAGCGGTTC-3′,反向引物为5′-AGGTCTTTGCGGATGTCCACGT-3′。miR-145选择U6为参照,TGF-β1选择β-肌动蛋白为参照,分别采用2-△△-ct计算miR-145和TGF-β1的相对表达量。
1.3 预后随访及生存统计
NSCLC组患者定期门诊或住院复查,随访截至2024年1月,统计患者生存及预后状况(生存、预后、肿瘤复发等),其中出现疾病进展(复发或转移)、死亡、严重并发症(恶病质、大咯血、气管纵隔漏)等定义为预后不良。
1.4 统计学方法
采用Sigmaplot 12.00统计学软件及R语言中R-statistics统计模块对数据进行统计学分析。计量资料经K-S检验符合正态分布,以均数±标准差(x±s)表示,两组间比较采用检验。多组间比较采用单因素方差分析(组间比较采用LSD检验)。计数资料以例数(百分率)[(%)]表示,比较采用2检验。采用受试者操作特征曲线(receiver operatingcharacteristiccurve,ROC曲线)的曲线下面积(area under the curve,AUC)分析各指标预测NSCLC患者预后不良的效能。Kaplan-Meier模型分析生存期并进行Log-Rank比较。对单因素分析中<0.05的变量予以多因素Cox回归分析。<0.05为差异有统计学意义。
2 结果
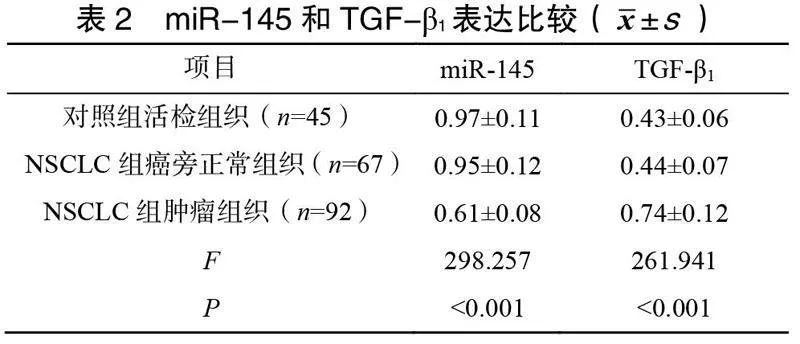
2.1miR-145和TGF-β1表达比较
与对照组患者的活检组织和NSCLC组患者的癌旁正常组织比较,NSCLC组患者的肿瘤组织miR-145表达显著降低,TGF-β1表达显著升高,差异均有统计学意义(<0.001),见表2。
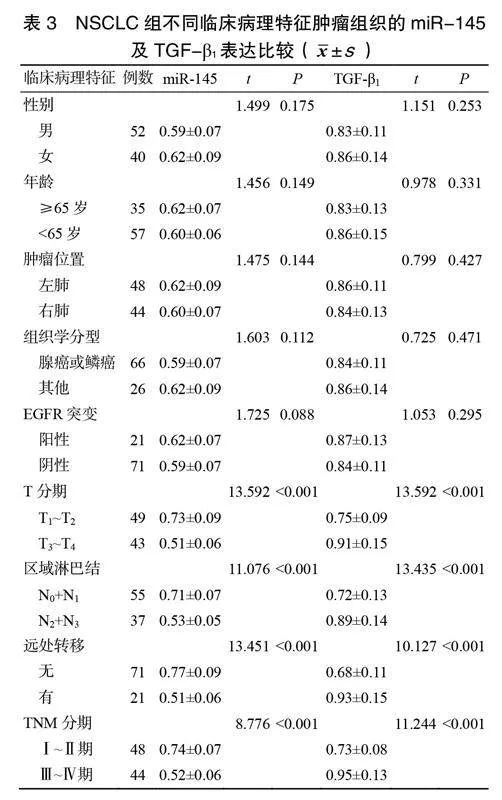
2.2miR-145、TGF-β1表达与临床病理特征的关系
NSCLC组患者的肿瘤组织miR-145、TGF-β1表达与性别、年龄、肿瘤位置、组织学分型及表皮生长因子受体(epidermal growthfactorreceptor,EGFR)突变无关(>0.05),与T分期、区域淋巴结、远处转移及TNM分期有关(<0.001)。T分期T3~T4、区域淋巴结N2+N3、有远处转移及TNM分期Ⅲ~Ⅳ期患者的miR-145表达低于T分期T1~T2、区域淋巴结N0+N1、无远处转移及TNM分期Ⅰ~Ⅱ期患者,TGF-β1表达高于T分期T1~T2、区域淋巴结N0+N1、无远处转移及TNM分期Ⅰ~Ⅱ期患者,差异有统计学意义(<0.001),见表3。
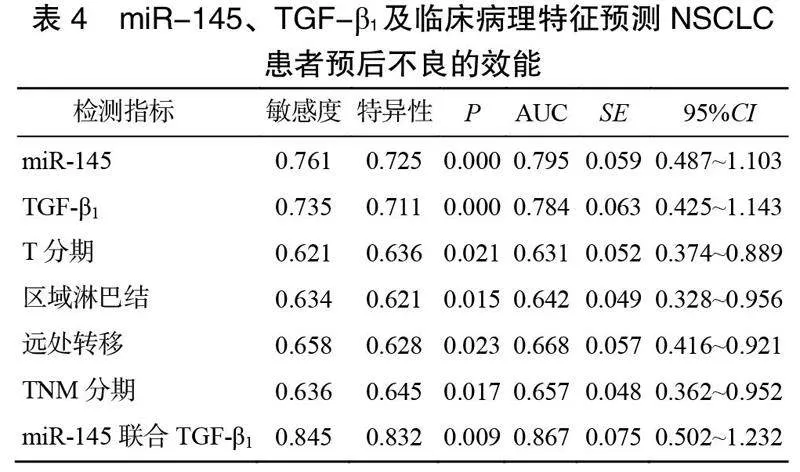
2.3 miR-145、TGF-β1及临床病理特征预测NSCLC患者预后不良的效能
miR-145、TGF-β1预测NSCLC患者预后不良的敏感度、特异性及AUC显著高于T分期、区域淋巴结、远处转移及TNM分期(<0.05)。miR-145联合TGF-β1预测NSCLC患者预后不良的敏感度、特异性及AUC显著高于miR-145、TGF-β1、T分期、区域淋巴结、远处转移及TNM分期(<0.05),见表4。
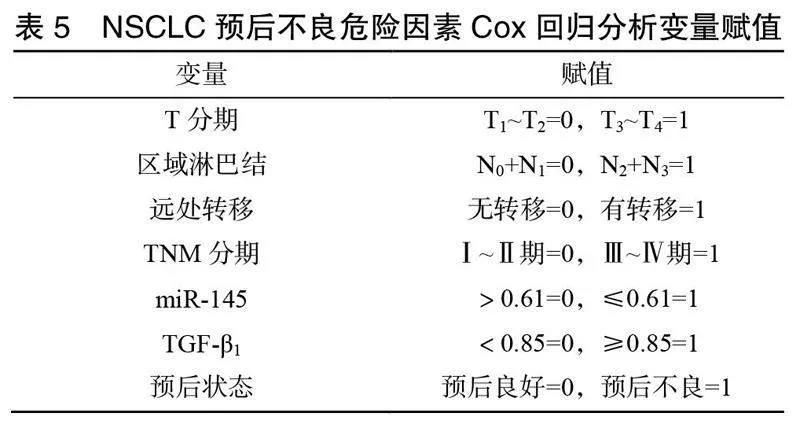
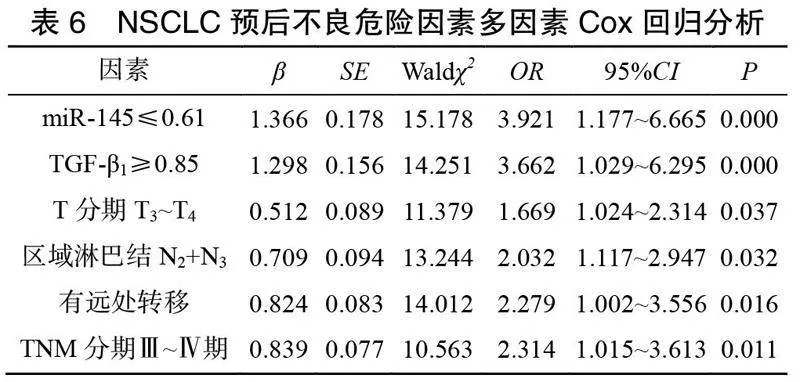
2.4 NSCLC预后不良的危险因素分析
以T分期、区域淋巴结、远处转移、TNM分期、miR-145及TGF-β1为自变量,预后状态为因变量行多因素Cox回归分析,变量赋值见表5。分析显示miR-145≤0.61、TGF-β1≥0.85、T分期T3~T4、区域淋巴结N2+N3、有远处转移、TNM分期Ⅲ~Ⅳ期为NSCLC预后不良的独立危险因素(<0.05),见表6。
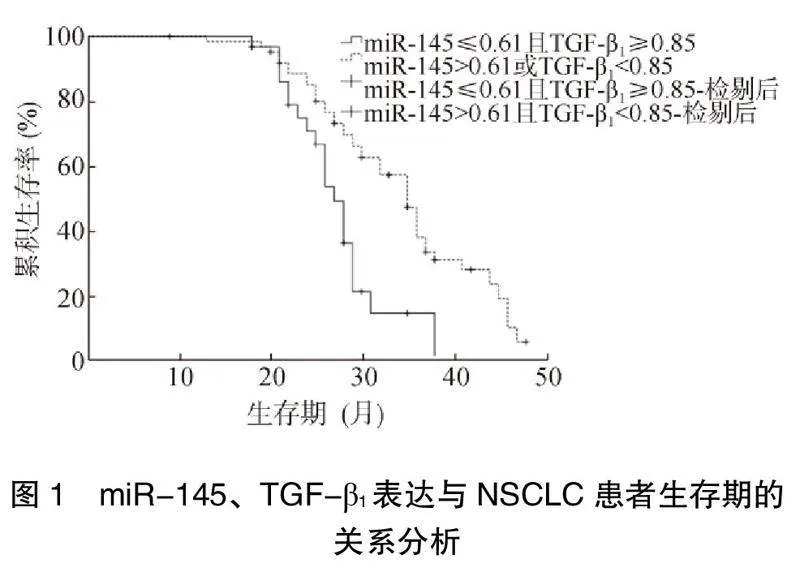
2.5 miR-145、TGF-β1表达与NSCLC患者生存期的关系分析
NSCLC组中miR-145≤0.61且TGF-β1≥0.85患者的中位生存期显著低于其他患者(miR-145>0.61或TGF-β1<0.85)[中位生存期(29.37±5.51)个月(34.34±6.09)个月,Log Rank=16.478,<0.001],见图1。
3 讨论
NSCLC的分子机制主要为各种因素导致的基因表达异常,其中miRNA在NSCLC发生、发展及转归中扮演重要角色,通过调控细胞迁移、侵袭及微血管再生等多种方式参与其发病机制[9]。研究发现miRNA表达异常在NSCLC广泛存在,且与病情及预后相关指标紧密相关,可作为NSCLC病情及预后评估的标志物[10]。miRNA具有翻译前基因表达调控功能,可结合靶基因抑制其表达[11-12]。miR-145为新近发现的类似抑癌功能的miRNA,通过调控细胞增殖、迁移及侵袭等功能参与恶性肿瘤的发生、发展及转归,为恶性肿瘤的保护性因素。miR-145为具有促癌作用的miRNA,通过多个靶基因调控细胞周期、迁移侵袭及上皮间质转化等功能[13]。研究证实miR-145通过靶向调控TGF-β1等参与恶性肿瘤发病机制与呼吸系统肿瘤等多种恶性肿瘤发病机制相关[14]。研究发现miR-145在呼吸系统肿瘤中表达显著降低,与肿瘤分期及恶性程度密切相关,为预后不良的生物标志物[15]。Yan等[16]检测NSCLC患者血清miR-145表达,发现miR-145低表达与NSCLC患者预后不良有关。本研究中NSCLC组患者肿瘤组织miR-145表达均低于癌旁正常组织和对照组,与T分期、区域淋巴结、远处转移及TNM分期有关,miR-145≤0.61为NSCLC预后不良的独立危险因素,表明miR-145与NSCLC病情及预后存在关联,在NSCLC病情及预后评估中具有一定临床价值。
TGF-β1与恶性肿瘤的发病机制密切相关,对肿瘤的作用呈时空依赖性,在肿瘤早期可抑制细胞增殖诱导凋亡并发挥抑癌基因作用,在肿瘤细胞恶性增殖进展期可增强肿瘤细胞恶性生物学行为而具有促癌基因功能[17-18]。研究发现TGF-β1自身或作为多种miRNA靶标参与NSCLC发病机制,在NSCLC病情及预后评估中具有一定临床价值[19]。郑宗耀等[20]发现TGF-β在肺癌细胞中通过Smad通路下调过氧化物酶体增殖物激活受体γ辅助激活因子1α表达抑制线粒体代谢功能,促进细胞上皮间质转化。周士霞等[21]采用免疫组化法检测NSCLC患者肿瘤组织TGF-β1表达,发现其TGF-β1阳性率显著高于癌旁正常组织,为预后不良的标志物。越来越多的研究证实TGF-β1信号通路与NSCLC的发生、发展及转归相关,可作为NSCLC诊断及疗效评估的标志物[22-23]。本研究中NSCLC组肿瘤组织TGF-β1表达均高于癌旁正常组织和对照组,与T分期、区域淋巴结、远处转移及TNM分期有关,TGF-β1≥0.85为NSCLC预后不良的独立危险因素,证实TGF-β1在NSCLC中表达升高且与病情和预后密切相关。
当前NSCLC病情及预后评估的方法多为血清学肿瘤标志物及TNM分期,存在敏感度及特异性不高及依赖于阅片者主观经验等缺点,普适性差而导致在临床应用中的价值有限[24-25]。随着对NSCLC发病机制的阐明及分子技术检测水平的进展,基因层次的分子检测因其扩增放大效应在NSCLC病情及预后评估中具有更佳的敏感度及特异性、可重复性高等优点,但单个指标的检测尚无法达到临床广泛应用的目的,目前多采用多个指标、多种检测技术联合应用以提高临床价值[26-27]。本研究中,miR-145联合TGF-β1预测NSCLC预后不良的敏感度、特异性均高于传统的TNM分期等,表明miR-145、TGF-β1表达检测预测NSCLC预后不良的效能高于现行检测指标。此外,本研究中miR-145联合TGF-β1检测可显著提高预测NSCLC预后不良的敏感度及特异性,提示在NSCLC临床诊疗方面应密切监测miR-145和TGF-β1表达以提高疗效。
综上所述,NSCLC患者miR-145表达显著降低,TGF-β1表达显著升高,与T分期、区域淋巴结、远处转移、TNM分期等传统指标存在相关性,在NSCLC病情及预后评估中具有一定临床价值,miR-145联合TGF-β1检测时更具有临床价值。值得注意的是,本研究为单中心研究且样本量较小,miR-145联合TGF-β1检测在NSCLC病情及预后评估中的临床价值有待进一步研究证实。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] MEMON D, SCHOENFELD A J, YE D, et al. Clinical and molecular features of acquired resistance to immunotherapy in non-small cell lung cancer[J]. Cancer Cell, 2024, 42(2): 209–224.
[2] CORDS L, ENGLER S, HABERECKER M, et al. Cancer-associated fibroblast phenotypes are associated with patient outcome in non-small cell lung cancer[J]. Cancer Cell, 2024, 42(3): 396–412.
[3] ABDOLRAHMANI A, KARDOUNI KHOOZESTANI N, AZMOUDEH-ARDALAN F, et al. Prognostic impact of MUC1 and potential regulatory miR-145 and miR-21 expression in salivary mucoepidermoid carcinoma[J]. Head Neck Pathol, 2022, 16(4): 1134–1145.
[4] GEATER S L, CHANIAD P, TRAKUNRAM K, et al. Diagnostic and prognostic value of serum miR-145 and vascular endothelial growth factor in non-small cell lung cancer[J]. Oncol Lett, 2022, 23(1): 12.
[5] ZHANG Q, JIA Y, PAN P, et al. α5-nAChR associated with Ly6E modulates cell migration via TGF-β1/Smad signaling in non-small cell lung cancer[J]. Carcinogenesis, 2022, 43(4): 393–404.
[6] ZHANG S, WANG Y, LUO D, et al. Pirfenidone inhibits TGF-β1-induced metabolic reprogramming during epithelial-mesenchymal transition in non-small cell lung cancer[J]. J Cell Mol Med, 2024, 28(3): e18059.
[7] QIU J L, ZHANG G F, CHAI Y N, et al. Ligustrazine attenuates liver fibrosis by targeting miR-145 mediated transforming growth factor-β/Smad signaling in an animal model of biliary atresia[J]. J Pharmacol Exp Ther, 2022, 381(3): 257–265.
[8] SHEN J, WANG Z, LIU M, et al. LincRNA-ROR/miR-145/ZEB2 regulates liver fibrosis by modulating HERC5-mediated p53 ISGylation[J]. FASEB J, 2023, 37(6): e22936.
[9] WANG B, LI J, LI Y, et al. MiR-630 suppresses non-small cell lung cancer by targeting vimentin[J]. J Clin Lab Anal, 2022, 36(9): e24536.
[10] ZHENG Y K, ZHOU Z S, WANG G Z, et al. MiR-122-5p regulates the mevalonate pathway by targeting p53 in non-small cell lung cancer[J]. Cell Death Dis, 2023, 14(4): 234.
[11] QIAN S, LIU J, LIAO W, et al. METTL3 promotes non-small-celllung cancer growth and metastasis by inhibiting FDX1 through copper death-associated pri-miR-21-5p maturation[J]. Epigenomics, 2023, 15(23): 1237–1255.
[12] 万晶晶, 姚莉, 李梦琳, 等. TOP2A联合miR-21检测在宫颈癌病情及预后评估中的价值[J]. 疑难病杂志, 2023, 22(10): 1045–1050.
[13] ROSHANI M, MOLAVIZADEH D, SADEGHI S, et al. Emerging roles of miR-145 in gastrointestinal cancers: A new paradigm[J]. Biomed Pharmacother, 2023, 166: 115264.
[14] TABEI A, SAKAIRI T, HAMATANI H, et al. The miR-143/145 cluster induced by TGF-β1suppresses Wilms’ tumor 1 expression in cultured human podocytes[J]. Am J Physiol Renal Physiol, 2023, 325(1): F121–F133.
[15] GUPTA S, SILVEIRA D A, PIEDADE G, et al. A dynamic Boolean network reveals that the BMI1 and MALAT1 axis is associated with drug resistance by limiting miR-145-5p in non-small cell lung cancer[J]. Noncoding RNA Res, 2024, 9(1): 185–193.
[16] YAN M, KANG W, LIU X, et al. Prognostic value of plasma microRNAs for non-small cell lung cancer based on data mining models[J]. BMC Cancer, 2024, 24(1): 52.
[17] GULLEY J L, SCHLOM J, BARCELLOS-HOFF M H, et al. Dual inhibition of TGF-β and PD-L1: A novel approach to cancer treatment[J]. Mol Oncol, 2022, 16(11): 2117–2134.
[18] PENG D, FU M, WANG M, et al. Targeting TGF-β signal transduction for fibrosis and cancer therapy[J]. Mol Cancer, 2022, 21(1): 104.
[19] SEO Y, SEO M, KIM J. Effects of cilengitide derivatives on TGF-β1-induced epithelial-to-mesenchymal transition and invasion in gefitinib-resistant non-small cell lung cancer cells[J]. Front Pharmacol, 2023, 14: 1277199.
[20] 郑宗耀, 陈智鹏, 曾观娣. TGF-β通过调控线粒体功能影响肺癌细胞的侵袭和迁移[J]. 暨南大学学报(自然科学与医学版), 2023, 44(2): 113–123.
[21] 周士霞, 王海莉, 赵蓉爽. PAX-9、CXCL-14、TGF-β1在非小细胞肺癌中的表达及与其预后的关系[J]. 分子诊断与治疗杂志, 2023, 15(8): 1323–1326, 1330.
[22] 黄如敬, 鲁洪岭, 吴超, 等. 甘草甜素调节TGF-β/Smad信号通路对肺癌荷瘤小鼠放射性肺损伤的影响[J]. 临床肺科杂志, 2024, 29(4): 566–571.
[23] 薛鸣, 帖永新, 张如楠, 等. 肺癌放疗后放射性肺炎合并肺部感染病原菌及PCT和IL-16与TGF-β水平[J]. 中华医院感染学杂志, 2024, 34(3): 332–336.
[24] YANG S R, SCHULTHEIS A M, YU H, et al. Precision medicine in non-small cell lung cancer: Current applications and future directions[J]. Semin Cancer Biol, 2022, 84: 184–198.
[25] WANG D R, WU X L, SUN Y L. Therapeutic targets and biomarkers of tumor immunotherapy: Response versus non-response[J]. Signal Transduct Target Ther, 2022, 7(1): 331.
[26] GUO H, ZHANG J, QIN C, et al. Biomarker-targeted therapies in non-small cell lung cancer: Current status and perspectives[J]. Cells, 2022, 11(20): 3200.
[27] PELLINI B, CHAUDHURI A A. Circulating tumor DNA minimal residual disease detection of non-small-cell lung cancer treated with curative intent[J]. J Clin Oncol, 2022, 40(6): 567–575.
(收稿日期:2024–05–25)
(修回日期:2024–09–08)
