核酸适配体在抗生素分析检测中的研究进展
2024-10-31唐盛周雪艳邝敬宇张景慧胡涛何静唐良秀沈薇


摘 要: 抗生素作为一种常用的疾病治疗药物,在生物医疗、公共卫生等领域中发挥着巨大作用.然而,当其通过食物链在人体内大量累积时,会对机体造成较大的危害.因此,针对食品、药品及环境中残留抗生素的高效检测至关重要.基于核酸适配体传感器的分析技术是一类简单、高效、灵敏的检测方法,在食品分析、环境监测和医药检测等领域有着广泛应用.该类方法借助多种酶促或非酶促核酸扩增策略,构建不同类型(荧光、比色、电化学等)的核酸适配体传感器来检测不同种类的抗生素,实现分析方法的高灵敏度和低检测限.文中综述了当前核酸适配体传感器在抗生素分析检测领域的应用及研究进展,并归纳总结了几类常见的抗生素分析方法的优缺点,最后对核酸适配体在抗生素分析领域的应用和发展进行了前景展望,并总结其未来发展趋势、研究焦点与挑战.
关键词: 抗生素;核酸适配体;信号放大;传感器;生物分析
中图分类号:O65"" 文献标志码:A"""" 文章编号:1673-4807(2024)02-093-08
Research progress of nucleic acid aptamers in antibiotic detection
Abstract:Antibiotics, as commonly used drugs for the treatment of diseases, play a crucial role in the fields of biomedicine and public health. However, when antibiotics accumulate in a large amount in the human body through the food chain, it will cause great harm to the body. Therefore, the efficient detection of antibiotic residues in food, medicine and the environment is crucial. The analysis technology based on nucleic acid aptamer sensor is a kind of simple, efficient and sensitive detection method, which has been widely used in the fields of food analysis, environmental monitoring and medical detection. This kind of method relies on a variety of enzymatic or non-enzymatic nucleic acid amplification strategies to construct different types (fluorescence, colorimetric, electrochemical, etc.) nucleic acid aptamer sensors to detect different kinds of antibiotics, and realize the high sensitivity and low detection limits. This paper reviews the recent advances of nucleic acid aptamer-based sensors for the antibiotic detection, summarizes the advantages and disadvantages of these methods, and finally looks forward to the application and development of nucleic acid aptamers, and summarizes its future development trend, research focus, and challenges in future work.
Key words:antibiotics, aptamers, signal amplification, sensors, biological analysis
抗生素的发现和应用是人类社会发展过程中的一项伟大革命.自第一种抗生素—青霉素发现以来,因其在抑制和杀灭病菌中的关键作用,抗生素已经越来越广泛地应用于日常生活中[1].常见的抗生素有很多,大环内酯类抗生素有红霉素、阿奇霉素、克拉霉素等,氨基糖苷类有卡那霉素、庆大霉素等,喹诺酮类有氧氟沙星、左旋氧氟沙星等.我国是当前世界上抗生素使用量最大的国家之一,其中有48%左右的抗生素用于人类医疗[2].据报道,约占五成住院患者在治疗期间使用了抗生素,并且在使用抗生素的患者中,多数会同时使用两种及以上的抗生素.但抗生素的滥用会导致一系列的健康风险和隐患,从环境残留到食品安全等诸多方面,影响到人体健康及生态平衡.抗生素在动植物源性食品中(如肉,蛋,奶等)的残留,最终通过食物链在人体中累积.过度累积的抗生素难以被机体通过正常代谢的形式排出体外,长期超出正常标准含量的抗生素将会对机体造成严重的伤害,包括代谢紊乱以及肾脏功能衰竭等疾病,从而引发过敏性休克、肾毒症、耳毒症和菌群失调等症状[3].同时,滥用抗生素会使得细菌的抗药性增强,生物体二次感染时被治愈的难度进一步增大[4].因此,针对环境、食品、药品中的残留抗生素建立高灵敏度、高选择性的高效实时分析检测方法一直是抗生素研究领域的热门话题.
由于实际样品中抗生素基质复杂,浓度低,通常用高选择性和高灵敏度的高效液相色谱(HPLC)[5]、液相色谱-串联质谱(LC-MS)[6]或气相色谱-质谱联用(GC-MS)[7]进行分析检测.为了去除基质干扰以及富集目标物,在仪器检测之前往往会进行样品前处理过程,此过程会直接影响分析检测的准确度和精密度.[JP3]样品前处理方法应该尽可能简单快速,尽量减少对环境的污染,不能污染样品,不能引入待测组分和干扰测定的物质.目前已开发出一系列简单高效、绿色新型的样品前处理方法,如固相萃取、固液萃取、亲和色谱分离及微流控分离[8]等.
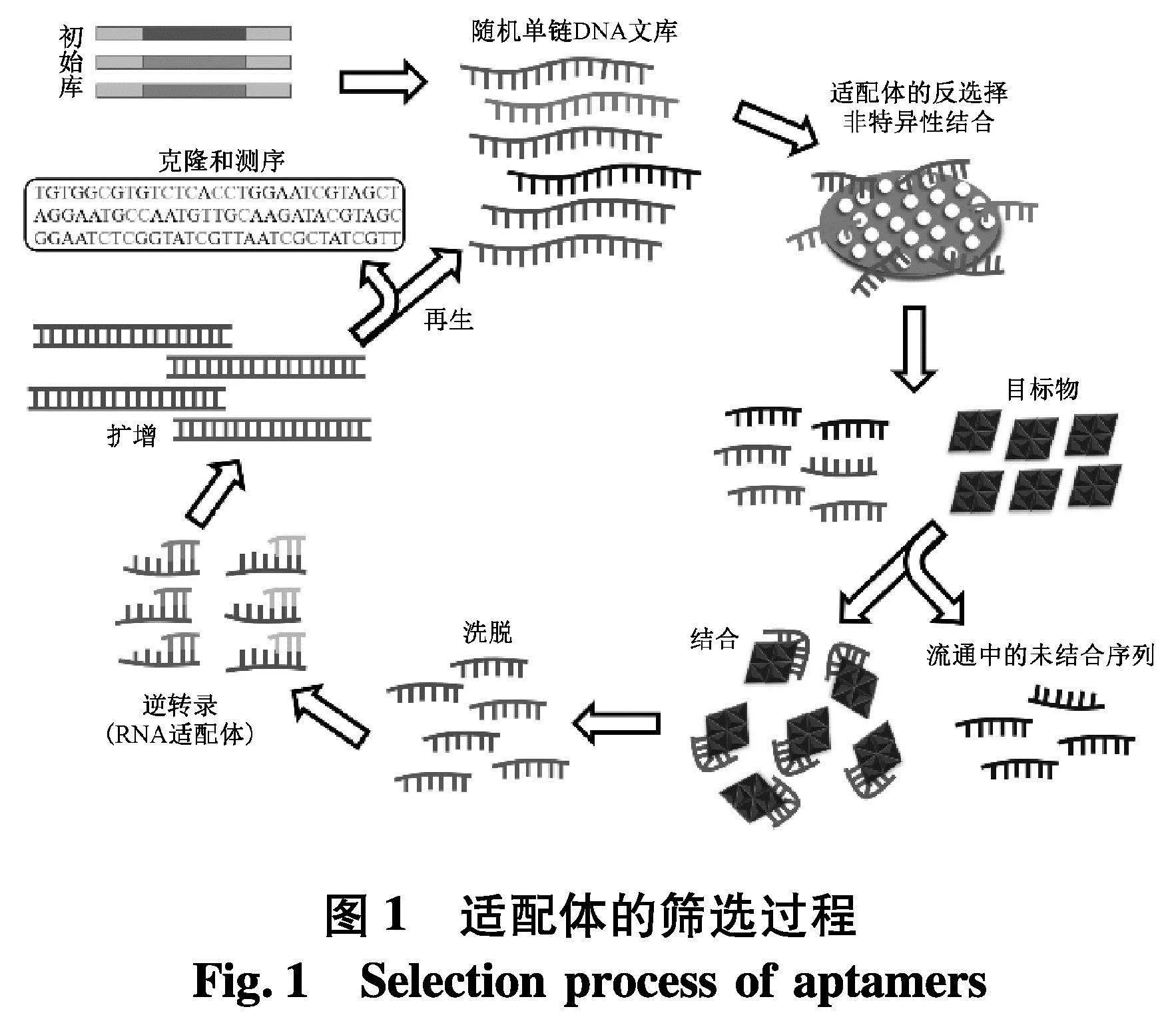
核酸适配体(Aptamer)是通过指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment, SELEX)从随机寡核苷酸文库中筛选获得的对靶标物质具有很高特异性与亲和力的单链DNA或RNA寡核苷酸序列.SELEX筛选过程主要包括结合、分离、洗脱、扩增和调节5个步骤[9](图1).
核酸适配体的设计和选择的主要依据是其特异性、选择性、以及核苷酸序列长短等特性.抗生素核酸适配体筛选方面的技术已有较大进展,如文献[10]采用了Precision-SELEX法对表达KPC-2的细菌进行了精确的适配体筛选,通过将蛋白质和细菌的SELEX结合,筛选的适配体可以特异性识别细菌表面的靶酶.
核酸适配体能够高亲和力、高特异性地结合目标物,与抗体相比,适配体具有合成简单、纯度较高、成本相对较低、易于化学修饰等优势,并且其与目标物结合后具有高度的稳定性[11].适配体的发现为多种目标物质的检测带来了便利,在过去的几十年里,适配体已被广泛应用于药物释放、体内治疗、分子传感器、选择性层析和生物成像等领域.近年来,适配体在分析化学领域受到了特别的关注,通过将适配体与目标物的识别和结合作用转换为灵敏的仪器检测信号,从而构建核酸适配体传感器(Aptasensor),实现了对小分子、多肽、蛋白质、核糖体甚至病毒等多种分析物的识别和检测[12-13].文中综述了目前核酸适配体传感器在抗生素分析检测领域的研究进展,并总结了这些传感器中所涉及的信号放大策略.此外,还介绍了目前基于核酸适配体的抗生素检测在食品分析、环境分析和医药检测等领域的实际应用.最后,对于未来核酸适配体用于检测抗生素所面临的挑战和前景进行了展望.
1 核酸适配体的传感机理
核酸适配体传感器是基于核酸适配体的传感分析策略,其传感机制依赖于适配体特殊的二级或三级结构变化的灵活性.核酸适配体与靶标分子之间的相互作用力来源于分子间的范德华力、氢键、静电相互作用、平面堆叠和形状互补等相互作用力[14].当核酸适配体与靶标结合时,可通过自身电荷分布变化、酶切作用等方式导致其空间结构发生变化[15-16],形成G-四连体(G-quartet)、茎环(Stem-loop)、发夹(Hairpin)、凸环(Bulge loop)、假结(Pseudoknot)等稳定的结构,从而实现对特定靶标的识别和响应,释放用于信号输出的靶标替代物,最终达到基于核酸适配体传感技术的定量检测目的.
同时,这种靶标触发性核酸适配体的构象变化可以通过与多种核酸放大元件相连接,实现靶标检测的信号放大,提高检测灵敏度.这些放大策略主要包括酶促信号放大策略和非酶促信号放大策略,目前使用最广泛的有滚环扩增(RCA)、杂交链式反应(HCR),催化发夹自组装(CHA),以及聚合酶链式反应(PCR)等[17],进一步提高核酸传感分析技术的检测灵敏度.最后通过直接(如荧光、紫外、电化学信号等)或者间接(贵金属纳米材料的催化氧化以及荧光猝灭等)形式产生的信号,借用相关仪器获取和拟合分析信号输出以实现信号检测[18-20].
2 基于核酸适配体的传感器类型及其应用研究
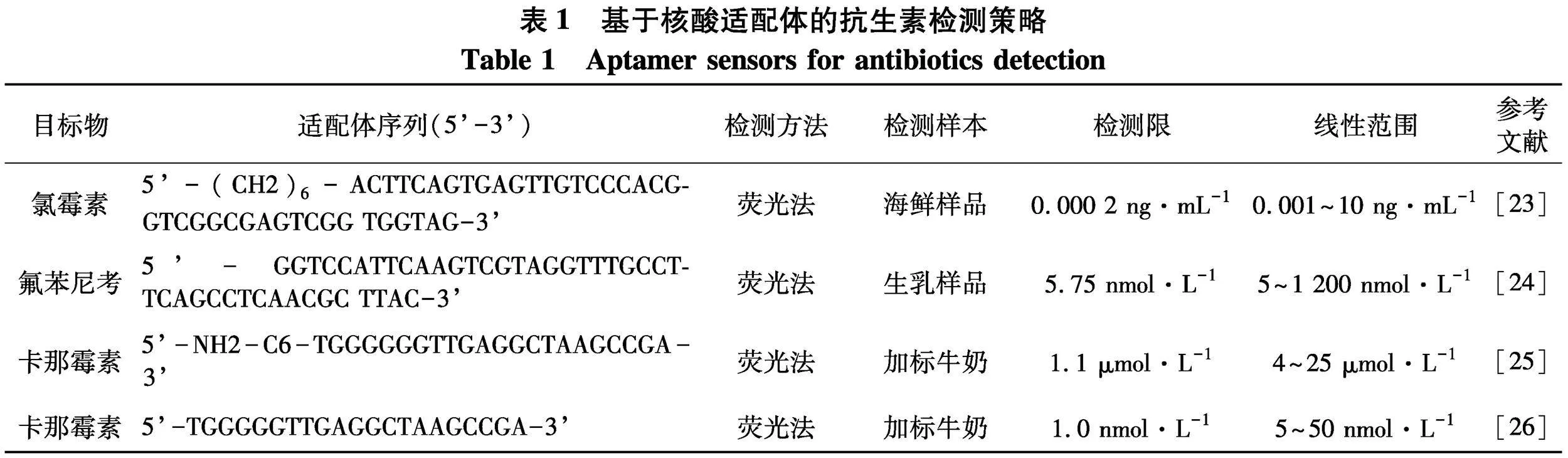
随着核酸适配体的广泛应用,研究者们开发了多种源于核酸适配体的传感器,在电化学、光学等分析策略中得到广泛应用.目前,用于抗生素检测的核酸适配体传感器主要包括荧光适配体传感器、比色适配体传感器以及电化学适配体传感器等[21].文中归纳总结了多种基于核酸适配体传感器的抗生素检测策略,收集其核酸适配体序列信息和检测输出方法,并对比其检测限、线性范围以及在实际样品检测中的应用.
2.1 荧光适配体传感器
荧光检测法由于其灵敏度高、操作简单等特点,已被广泛用于适配体传感器的设计.从荧光信号产生的形式来说,荧光适配体传感器主要包括:荧光-淬灭基团标记的经典分子信标荧光适配体传感器;荧光标记适配体-碳纳米材料淬灭型荧光适配体传感器;荧光标记适配体-特定淬灭结构(如富G序列)荧光适配体传感器;荧光标记适配体(或互补链)直接检测型荧光适配体传感器等[22].基于上述荧光适配体传感器的设计,通过测定荧光信号强度的变化来实现对目标抗生素的定量检测,是目前抗生素检测中运用最广泛的适配体传感器之一.
文献[23]基于荧光共振能量转移(FRET)和核酸外切酶辅助靶循环开发了一种荧光适配体传感器,实现了一步法检测痕量氯霉素(CAP).实验结果表明,该方法的线性范围为0.001~10 ng·mL-1,检测限为0.000 2 ng·mL-1.该检测方法具有简便、低成本、环境友好等特点,为食品安全领域中其他有机污染分子的检测提供了一种新的有效手段.文献[24]基于作为受体的氧化石墨烯和作为供体的荧光标记的氟苯尼考(FF)特异性适配体之间的能量转移,制备了荧光适配体传感器用于快速检测生乳样品中的FF残留(图2).在最佳条件下,该适配体传感器具有5~1 200 nmol·L-1的宽线性范围,检测限为5.75 nmol·L-1,具有优异的选择性和高准确度.
文献[25]建立了一种基于由荧光碳点和层状MoS2组成的FRET供体-受体对的新型荧光适配体传感器,用于检测牛奶和其他动物源性食品中卡那霉素(KANA),该方法显示出高达93%的荧光恢复效率.利用适配体诱导荧光猝灭和回收的优点,可在4~25 μmol·L-1浓度范围内定量检测KANA,检测限为1.1 μmol·L-1,回收率在85%~102%.文献[26]建立了一种基于银纳米团簇和金纳米颗粒(AuNPs)之间的表面等离子体增强能量转移(SPEET)的荧光适配体传感器用于检测KANA.与已报道的KANA检测技术相比,该方法消除了耗时的偶联过程,缩短了检测时间,可以在30 min内完成测定.该方法的分析范围为5~50 nmol·L-1,检测限为1.0 nmol·L-1.此外,通过设计含有不同序列的适配体,该方法可拓展到其他抗生素的分析检测中.
2.2 比色适配体传感器
比色适配体传感器相较于其他传感器而言,因具有可实现肉眼检测、无需昂贵复杂的设备以及便于及时检测的显著优势而受到广泛关注.该类传感器通常与金、银纳米颗粒,以及酶和抗体相关联.AuNPs由于其优良的光学、化学性能可实现信号放大作用,在低分子量化学物质的生化分析中起着关键作用[27].在这类分析中,适配体可以被稳定吸附在AuNPs的表面,从而控制盐诱导的聚集,这归因于相邻颗粒之间的表面等离振子共振耦合.AuNPs表面吸附的适配体与目标分析物发生特异性结合,同时从AuNPs上脱落,随之引发AuNPs的自由聚集,基于AuNPs颗粒间距的光学性质导致其颜色从红色变为紫蓝色,并且可以通过肉眼轻松观察或通过UV-Vis分光光度计对原始分析物进行定量.大量关于抗生素检测的文献报道使用了适配体和金纳米颗粒.文献[28]建立了一种使用互补DNA链修饰的AuNPs和分析物特异的结合适配体检测氟喹诺酮类药物(FQS)的比色分析方法.该方法对FQS具有很高的选择性,并且实现了在1 h内快速检测环丙沙星(CIP),检测限低至1.2 nmol·L-1.该方法可用于加标水、血清和牛奶样品中CIP的测定,检测限分别为1.3、2.6和3.2 nmol·L-1.文献[29]则基于未修饰的AuNPs和单链DNA设计了一种检测妥布霉素的比色适配体传感器,线性范围为40~200 nmol·L-1,检测限为23.3 nmol·L-1.
纳米酶的发展缓解了天然酶稳定性低、成本高、难以批量生产等固有局限性.特别是,基于一些纳米酶的类过氧化物酶活性,许多比色平台已被开发出来,将显色底物在H2O2存在下转化为显色产物.文献[30]基于金纳米团簇(AuNCs)固有的类过氧化物酶活性,利用四环素(TC)特异性适配体提高了AuNCs对H2O2氧化过氧化物酶底物3,3’,5,5’ -四甲基联苯胺(TMB)的催化活性,建立了TC的比色传感平台.该检测平台可定量检测浓度范围为1~16 μmol·L-1的TC,检测限低至46 nmol·L-1.文献[31]以NMOF-Pt纳米示踪剂作为酶模拟物设计了一种新型的模拟酶比色传感器,用于牛奶中KANA的检测.利用环DNA功能化磁珠制备复合探针,靶置换反应后,磁捕获DNA探针可触发发夹组件释放靶,进行信号放大.具有高类过氧化物酶活性的NMOF-Pt杂合体在H2O2存在的情况下有效催化TMB产生明显可见的蓝色,具有较高的选择性和灵敏度,检出限为0.2 pg mL-1.
2.3 电化学适配体传感器
电化学适配体传感器是将核酸适配体作为识别原件与电极相结合而构建的检测装置,近年来受到越来越多的关注.适配体借助固定化技术可以结合到电极表面,通过特异性识别作用生成适配体-目标分析物复合物,产生与之相关联的浓度信号,利用能量转换器转化为可测定的电化学信号,从而以电化学信号作为输出,实现对目标分析物的定量检测[32].与其他适配体传感器相比,它对含量在fmol·L-1至mmol·L-1范围内的抗生素具有很高的灵敏度.例如,文献[33]使用具有相同过氧化物酶样活性的AuNPs和目标诱导的适配体用于KANA检测,该电化学适配体传感器(检测限为0.06 nmol·L-1)的灵敏度远远高于比色法适配体传感器(检测限为2.28 nmol·L-1).文献[34]建立了一种基于适配体-抗生素偶联物对核酸内切酶Dpn II活性保护作用的电化学方法用于氨苄西林检测,该方法的检测限为32 pmol·L-1.文献[35]基于金属离子掺杂的金属有机骨架材料作为信号示踪剂和RecJf核酸外切酶催化的目标回收扩增,开发了一种同时检测土霉素(OTC)和KANA的超灵敏电化学适配体传感器.该适配体传感器在0.5 pmol·L-1至50 nmol·L-1的范围内表现出良好的线性,对OTC和KANA的检测限分别为0.18 pmol·L-1和0.15 pmol·L-1,该方法可以很容易地从含有其他抗生素干扰物的溶液中实现基质分离,且可作为多种抗生素检测的实际应用.
此外,在电化学分析策略中,电化学仪器简单、小型、便携且使用成本低廉,具有现场实时检测的可操作性.现已开发出多种针对抗生素电化学适配体的检测仪器.其中,电化学阻抗谱通过监测电子转移电阻的变化以显示阻抗信号,方波伏安法(SWV)、差示脉冲伏安法(DPV)和循环伏安法(CV)都可以观察到法拉第电流[36],上述方法皆显示出较高灵敏度和低检测限.文献[37]结合CV和SWV等电化学分析手段,利用核酸适配体固定的互相交叉阵列电极芯片实现了对OTC的电化学检测,通过绘制对数OTC浓度与电流变化(SymbolDA@I)之间的线性关系(R2=0.961),确定其检测OTC浓度线性范围为1~100 nmol·L-1.文献[38]通过伏安法检测KANA,其线性范围为0.05 mmol·L-1至9.0 mmol·L-1,检测限为9.4±0.4 nmol·L-1,显示出较高的灵敏度、良好的选择性和长达两个月的长期稳定性,可用于食品分析和临床诊断中KANA的检测.
3 核酸信号放大策略在抗生素检测中的研究进展
基于核酸适配体传感检测的研究基础,为了进一步地使适配体传感器在检测抗生素时具有更高的灵敏度,近年来,学者们已经开发了一些核酸信号放大策略用于抗生素检测过程中的检测信号放大,主要包括酶促信号放大和非酶促信号放大两大类.
3.1 酶促信号放大策略
在分析方法中巧妙地引入了一些酶辅助循环扩增技术来放大信号,可以显著增加检测灵敏度,所用的酶主要包括核酸内切酶(Endonuclease)[39]与核酸外切酶(Exonuclease)[40].DNA酶(DNAzyme)是具有酶活性的DNA分子,能够催化特定反应.文献[41]介绍了一种基于级联酶循环结合DNAzyme扩增的无标记电化学适配体传感器,用于KANA的特异性检测.该方法的检测限低至0.5 pmol·L-1,线性范围为1 pmol·L-1~10 nmol·L-1.文献[42]通过均相生物识别反应诱导DNA纳米结构在电极上的组装形成,开发了一种新的生物传感方法,在外切酶I(Exo I)的作用下,KANA适配体和端基暴露的DNA发夹探针组成的络合物与KANA发生均相反应,继而触发DNA纳米结构层在金电极上的组装形成.高含量亚甲基蓝和辣根过氧化物酶功能化金纳米标签被捕获到电极上,实现电催化信号转导,从而对KANA进行超灵敏的电化学检测.KANA的检测限为9.1 fg·mL-1,线性范围超过5个数量级.文献[43]报道了一种Fe3O4@polydopamine(PDA)纳米复合材料和核酸外切酶III(Exo III)辅助的均相荧光生物传感方法,设计了一种包含KANA适配体序列的DNA发夹探针,利用Exo III的高效催化反应以及PDA选择性吸附分离双重信号扩增手段,用于超灵敏检测牛奶和蜂蜜为实际样品中的KANA含量,其检测限达到0.023 pg·mL-1,线性范围为0.1 pg·mL-1~100 ng·mL-1.文献[39]开发了一种3D DNA Walker和核酸内切酶IV组成的传感系统,由anti-KANA适配体与KANA特异性结合触发HCR扩增,同时结合FRET技术对KANA进行超灵敏荧光传感检测,检测限低至1.01 pmol·L-1,线性范围为5 pmol·L-1~100 nmol·L-1.
3.2 非酶促信号放大策略
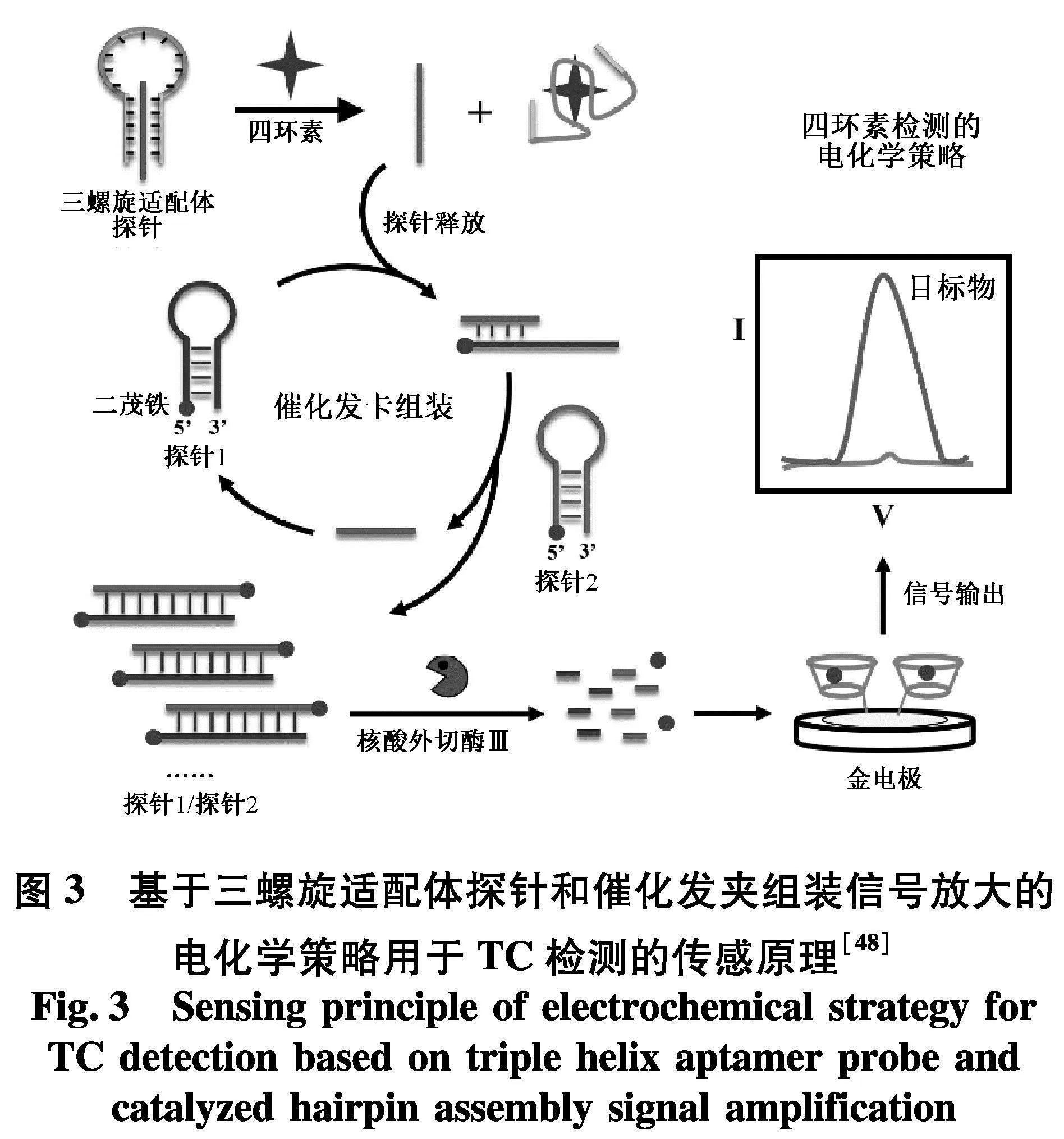
当前常用的非酶促信号放大法主要有CHA,HCR和链置换反应(SDR)[44]等.其中,HCR是一种动力学控制的反应,通过触发两种亚稳态DNA发夹探针之间的一系列杂交反应形成长的dsDNA结构.与传统的检测方法相比,HCR相对简单并且可以在温和的实验条件下进行,是一种操作简单、成本低廉的无酶等温信号放大技术[45].文献[27]开发了一种基于HCR反应的无酶适配体的分析方法,用于测定加标牛奶和鱼类样品中的KANA,检测限为0.29 pg·mL-1,线性范围为1 pg·mL-1~10 ng·mL-1.该方法具有高扩增能力、高通量和高选择性的优点.文献[46]结合三螺旋适配体探针、CHA信号放大和主客体识别等元件,报道了一种电化学灵敏定量检测TC的新型信号传感策略.该方法检测限低至0.13 nmol·L-1,线性范围为0.2 nmol·L-1~100 nmol·L-1(图3).文献[47]开发了一种基于FRET的荧光生物传感器,适配体通过结合目标物释放单链DNA探针,得益于生成的单链DNA探针诱发的CHA信号扩增过程,FRET引起的信号变化进一步被增强,继而实现KANA的高灵敏和高选择性检测.检测限低至0.29 nmol·L-1,线性范围为1.0~80.0 nmol·L-1,并以牛奶作为实际样品评估了该生物传感系统的潜在应用价值.
综上所述,通过对基于核酸适配体的抗生素检测相关文献进行概括对比(表1)可知,不同的检测方法各具优势,通过核酸适配体传感器的策略可以进行多种抗生素的高灵敏检测,并且具有一定的靶标区分度.通过将核酸识别作用转化为不同的检测信号(荧光、比色、电化学等),可实现多场景的抗生素检测.进一步地,通过巧妙地引入多种放大策略,可以实现更灵敏的抗生素检测,为实际场景中痕量抗生素的检测提供了可能.
4 结论与展望
基于核酸适配体的传感器作为一种新兴的传感研究策略,在食品分析、环境监测和医药检测等领域的抗生素检测研究中极具优势.近年来,基于核酸适配体的分析方法因其低成本、低耗时和超高灵敏度而得到了广泛的关注和深入的发展,对实现简单、快速、高灵敏的抗生素检测,保障食品及环境安全具有重要意义.得益于其易合成、高纯度、低成本、易于化学修饰,且在不同环境下和目标物结合后具有高度的稳定性等特点,基于核酸适配体的传感分析方法为抗生素的检测打开了极为广阔的发展和应用空间.但有报道称,在联合AuNPs与适配体用于KANA的检测方法中,最常用的适配体序列似乎不能与靶标发生特异性结合,研究表明该方法忽略了AuNPs与靶标的相互作用,KANA可强烈吸附在AuNPs上导致其聚集引起颜色变化,而与DNA序列无关.目前仍存在一些制约核酸适配体传感器在抗生素检测领域发展的因素,如核酸适配体的稳定性问题、不同核酸适配体亲和力差异、非特异性结合和检出信号的灵敏度问题以及其在实际样品检测中受到复杂基质效应的影响等问题.针对这些问题,研究者们正在尝试不断改进和优化核酸适配体传感研究策略,聚焦于核酸适配体稳定性的提高以及联用多种分离富集方法来改善基质效应对核酸适配体传感器在实际样品检测中的影响.借助于多种选择性的分离手段、高效的信号富集与放大策略,相信在不久的未来,可以实现对于抗生素的更高灵敏度和更快速的检测,并实现现场、临床等检测场景的广泛应用.
参考文献(References)
[1] LI J, YU C F, WU Y N, et al. Novel sensing platform based on gold nanoparticle-aptamer and Fe-metal-organic framework for multiple antibiotic detection and signal amplification[J]. Environment International, 2019,125:135-141.
[2] 刘昌孝. 全球关注:重视抗生素发展与耐药风险的对策[J]. 中国抗生素杂志, 2019,44(1):1-8.
[3] DIETERT R R. Developmental immunotoxicity, perinatal programming and noncommunicable diseases: Focus on human studies[J]. Advances in Medicine, 2014,867805.
[4] DONG Y C, LI F T, WANG Y. Low-dimension nanomaterial-based sensing matrices for antibiotics detection: A mini review[J]. Frontiers of Chemistry, 2020,8:551.
[5] HU C, BEYDA N D, GAREY K W. A vancomycin hplc assay for use in gut microbiome research[J]. Microbiology Spectrum, 2022:e01688-21.
[6] GALLAGHER T, RIEDEL S, KAPCIA J, et al. Liquid chromatography mass spectrometry detection of antibiotic agents in sputum from persons with cystic fibrosis[J]. Antimicrobial Agents and Chemotherapy, 2021,65(2):e00927-20.
[7] GUO Y W, XIE X, DIAO Z X, et al. Detection and determination of spectinomycin and lincomycin in poultry muscles and pork by ASE-SPE-GC-MS/MS[J]. Journal of Food Composition and Analysis, 2021,101:103979.
[8] SAMMANI M S, CLAVIJO S, CERD V. Recent, advanced sample pretreatments and analytical methods for flavonoids determination in different samples[J]. TrAC Trends in Analytical Chemistry, 2021,138:116220.
[9] DARMOSTUK M, RIMPELOVA S, GBELCOVA H, et al. Current approaches in SELEX: An update to aptamer selection technology[J]. Biotechnology Advances, 2015, 33(6):1141-1161.
[10] YU F, CHEN J, WANG Z C, et al. Screening aptamers for serine β-lactamase-expressing bacteria with Precision-SELEX[J]. Talanta, 2021, 224:121750.
[11] YAO Y, HU T, SONG C, et al. Multiply-amplified strategy for the ultrasensitive detection of kanamycin via aptamer-triggered three-dimensional G-quadruplex/Ni–Fe layered double oxide frame networks[J]. Analytica Chimica Acta, 2021, 1187:339169.
[12] YAO Y, CHEN T Y, MAO W, et al. Three-dimensional DNA/Ni-Fe layered double oxide frame networks-induced “cusp-exposure” of Au@Ag nanostars for ultrasensitive determination of kanamycin[J]. Sensors and Actuators B: Chemical, 2021, 343:130082.
[13] YAO Y, KUANG J Y, JU J H, et al. Solvent-free magnetic-tip microextraction into a single drop for fluorescence sensing [J]. Sensors and Actuators B: Chemical, 2022, 352(2):131044.
[14] HERMANN T, PATEL D J. Biochemistry-Adaptive recognition by nucleic acid aptamers[J]. Science, 2000, 287(5454):820-825.
[15] LI T, LI B L, DONG S J. Adaptive recognition of small molecules by nucleic acid aptamers through a label-free approach[J]. Chemistry-A European Journal, 2007, 13(23):6718-6723.
[16] SEFAH K, PHILLIPS J A, XIONG X L, et al. Nucleic acid aptamers for biosensors and bio-analytical applications[J]. Analyst, 2009, 134(9):1765-1775.
[17] ZHU Y, WU J, ZHOU Q. Functional DNA sensors integrated with nucleic acid signal amplification strategies for non-nucleic acid targets detection[J]. Biosensors and Bioelectronics, 2023, 230:115282.
[18] QI T, XU M Y, YAO Y, et al. Gold nanoprism/Tollens′ reagent complex as plasmonic sensor in headspace single-drop microextraction for colorimetric detection of formaldehyde in food samples using smartphone readout[J]. Talanta, 2020, 220:121388.
[19] QI T, SONG C, HE J, ET AL. Highly sensitive detection of multiple micrornas by high-performance liquid chromatography coupled with long and short probe-based recycling amplification[J]. Analytical Chemistry, 2020, 92(7):5033-5040.
[20] TANG S, QI T, XIA D S, et al. Smartphone nanocolorimetric determination of hydrogen sulfide in biosamples after silver-gold core-shell nanoprism-based headspace single-drop microextraction[J]. Analytical Chemistry, 2019, 91(9):5888-5895.
[21] SABZEHMEIDANI M M, KAZEMZAD M. Quantum dots based sensitive nanosensors for detection of antibiotics in natural products[J]. Science of The Total Environment, 2022, 810:151997.
[22] BELLASSAI N, D’AGATA R, SPOTO G. Novel nucleic acid origami structures and conventional molecular beacon-based platforms: A comparison in biosensing applications[J]. Analytical and Bioanalytical Chemistry, 2021, 413:6063-6077.
[23] MIAO Y B, GAN N, LI T H, et al. An ultrasensitive fluorescence aptasensor for chloramphenicol based on FRET between quantum dots as donor and the magnetic SiO2@Au NPs probe as acceptor with exonuclease-assisted target recycling[J]. Sensors and Actuators B: Chemical, 2016, 222:1066-1072.
[24] SADEGHI A S, MOHSENZADEH M, ABNOUS K, et al. Development and characterization of DNA aptamers against florfenicol: Fabrication of a sensitive fluorescent aptasensor for specific detection of florfenicol in milk[J]. Talanta, 2018, 182:193-201.
[25] WANG Y S, MA T C, MA S Y, et al. Fluorometric determination of the antibiotic kanamycin by aptamer-induced FRET quenching and recovery between MoS2 nanosheets and carbon dots[J]. Microchimica Acta, 2016, 184(1):203-210.
[26] YE T, PENG Y, YUAN M, et al. A “turn-on” fluorometric assay for kanamycin detection by using silver nanoclusters and surface plasmon enhanced energy transfer[J]. Microchimica Acta, 2018, 186(1):40.
[27] ZHANG K, GAN N, HU F T, et al. Microfluidic electrophoretic non-enzymatic kanamycin assay making use of a stirring bar functionalized with gold-labeled aptamer, of a fluorescent DNA probe, and of signal amplification via hybridization chain reaction[J]. Microchimica Acta, 2018, 185(3):181.
[28] LAVAEE P, DANESH N M, RAMEZANI M, et al. Colorimetric aptamer based assay for the determination of fluoroquinolones by triggering the reduction-catalyzing activity of gold nanoparticles[J]. Microchimica Acta, 2017, 184(7):2039-2045.
[29] MA Q, WANG Y X, JIA J, et al. Colorimetric aptasensors for determination of tobramycin in milk and chicken eggs based on DNA and gold nanoparticles[J]. Food Chemistry, 2018, 249: 98-103.
[30] ZHANG Z P, TIAN Y, HUANG P C, et al. Using target-specific aptamers to enhance the peroxidase-like activity of gold nanoclusters for colorimetric detection of tetracycline antibiotics[J]. Talanta, 2020, 208:120342.
[31] LUAN Q, GAN N, CAO Y T, et al. Mimicking an enzyme-based colorimetric aptasensor for antibiotic residue detection in milk combining magnetic loop-DNA probes and CHA-assisted target recycling amplification[J]. Journal of Agricultural and Food Chemistry, 2017, 65(28):5731-5740.
[32] LI Y, TIAN J Y, YUAN T, et al. A sensitive photoelectrochemical aptasensor for oxytetracycline based on a signal “switch off-on” strategy[J]. Sensors and Actuators B: Chemical, 2017, 240:785-792.
[33] WANG C S, LIU C, LUO J B, et al. Direct electrochemical detection of kanamycin based on peroxidase-like activity of gold nanoparticles[J]. Analytica Chimica Acta, 2016, 936:75-82.
[34] WANG T T, YIN H S, ZHANG Y T, et al. Electrochemical aptasensor for ampicillin detection based on the protective effect of aptamer-antibiotic conjugate towards DpnII and Exo III digestion[J]. Talanta, 2019, 197:42-48.
[35] CHEN M, GAN N, ZHOU Y, et al. An electrochemical aptasensor for multiplex antibiotics detection based on metal ions doped nanoscale MOFs as signal tracers and RecJf exonuclease-assisted targets recycling amplification[J]. Talanta, 2016, 161:867-874.
[36] DAVID I G, BULEANDRA M, POPA D E, et al. Past and present of electrochemical sensors and methods for amphenicol antibiotic analysis[J]. Micromachines (Basel), 2022, 13 (5):677.
[37] KIM Y S, NIAZI J H, GU M B. Specific detection of oxytetracycline using DNA aptamer-immobilized interdigitated array electrode chip[J]. Analytica Chimica Acta, 2009, 634(2):250-254.
[38] ZHU Y, CHANDRA P, SONG K M, et al. Label-free detection of kanamycin based on the aptamer-functionalized conducting polymer/gold nanocomposite[J]. Biosensors and Bioelectronics, 2012, 36(1):29-34.
[39] QU X N, WANG J F, ZHANG R F, et al. Highly efficient fluorescence sensing of kanamycin using Endo IV-powered DNA walker and hybridization chain reaction amplification[J]. Microchimica Acta, 2020, 187(3):193.
[40] CANOURA J, YU H X, ALKHAMIS O, et al. Accelerating Post-SELEX aptamer engineering using exonuclease digestion[J]. Journal of the American Chemical Society, 2021, 143(2):805-816.
[41] HAN C, LI R G, LI H, et al. Ultrasensitive voltammetric determination of kanamycin using a target-triggered cascade enzymatic recycling couple along with DNAzyme amplification[J]. Microchimica Acta, 2017, 184(8):2941-2948.
[42] HUANG W, ZHOU Y, ZHAN D Y, et al. Homogeneous biorecognition reaction-induced assembly of DNA nanostructures for ultrasensitive electrochemical detection of kanamycin antibiotic[J]. Analytica Chimica Acta, 2021, 1154:338317.
[43] QIN C Y, HU C, YU A M, et al. Fe3O4 @polydopamine and Exo III-assisted homogeneous biorecognition reaction for convenient and ultrasensitive detection of kanamycin antibiotic[J]. Analyst, 2021, 146(4):1414-1420.
[44] PENG Y, WU S, SUN Z W, et al. Multiple signal amplification via coupling DNAzyme with strand displacement reaction for sensitive colorimetric analysis of MUC1[J]. Sensors and Actuators B: Chemical, 2020, 313:128046.
[45] CHENG Y H, LIU S J, JIANG J H. Enzyme-free electrochemical biosensor based on amplification of proximity-dependent surface hybridization chain reaction for ultrasensitive mRNA detection[J]. Talanta, 2021, 222:121536.
[46] WANG Y H, YAO L, NING G, et al. An electrochemical strategy for tetracycline detection coupled triple helix aptamer probe with catalyzed hairpin assembly signal amplification[J]. Biosensors and Bioelectronics, 2019, 143:111613.
[47] [JP3]DENG J K, LIU Y Q, LIN X D, et al. A ratiometric fluorescent biosensor based on cascaded amplification strategy for ultrasensitive detection of kanamycin[J]. Sensors and Actuators B: Chemical, 2018, 273:1495-1500.
[48] ZHOU J J, LI Y Q, WANG W J, et al. Kanamycin adsorption on gold nanoparticles dominates its label-free colorimetric sensing with its aptamer[J]. Langmuir, 2020, 36(39):11490-11498.
