基于病理和超声图像特征的列线图模型预测乳腺癌腋窝淋巴结转移的临床价值
2024-10-30阮彦查国芬郑雨欣张雅娇方程钰胡丹琦刘俊平

摘" " 要" " 目的" " 基于浸润性乳腺癌原发灶的病理和超声图像特征构建列线图模型,探讨其预测腋窝淋巴结转移的临床价值。方法" " 回顾性分析经病理证实的浸润性乳腺癌女性患者369例患者,以7∶3比例随机分为训练集(258例)和验证集(111例)。根据是否发生腋窝淋巴结转移将训练集患者分为转移组(116例)和未转移组(143例),比较两组血清肿瘤标志物、病理和超声图像特征的差异;采用二元Logistic回归分析筛选预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素,并构建预测腋窝淋巴结转移的列线图模型;绘制受试者工作特征(ROC)曲线和校准曲线分别评估该模型的区分度和校准度。结果" " 训练集中转移组与未转移组原发灶病理类型、组织学分级、血清肿瘤标志物[糖类抗原153(CA153)和癌胚抗原(CEA)]水平,以及超声图像特征(最大径、位置、有无高回声晕环)比较,差异均有统计学意义(均Plt;0.05)。二元Logistic回归分析显示,原发灶位置(内下象限)、高回声晕环、最大径、组织学分级均为预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素(OR=0.064、13.278、1.049、9.277,均Plt;0.05)。以此构建的列线图模型预测训练集和验证集浸润性乳腺癌患者发生腋窝淋巴结转移的ROC曲线下面积分别为0.845、0.823,校准曲线与理想曲线高度吻合,其区分度和校准度均高。结论" " 基于浸润性乳腺癌原发灶的病理和超声图像特征构建的列线图模型可预测腋窝淋巴结转移风险,可为临床精准诊疗提供参考。
关键词" " 超声检查;病理;浸润性乳腺癌;腋窝淋巴结转移;列线图
[中图法分类号]R445.1;R737.9" " " [文献标识码]A
Clinical value of nomogram model based on pathological and ultrasound image features in predicting axillary lymph node metastasis of breast cancer
RUAN Yan,ZHA Guofen,ZHENG Yuxin,ZHANG Yajiao,FANG Chengyu,HU Danqi,LIU Junping
Graduate School of Zhejiang Chinese Medicine University,Hangzhou 310053,China
ABSTRACT" " Objective" " To construct a nomogram model based on the pathological and ultrasound image features of the primary lesions of invasive breast cancer,and to investigate its clinical value in predicting axillary lymph node metastasis.Methods" " A total of 369 female patients with pathologically confirmed invasive breast cancer were retrospectively analyzed,and were randomly divided into the training set(n=258) and verification set(n=111) at a ratio of 7∶3.The patients in the training set were divided into metastatic group(n=116) and non-metastatic group(n=143) according to whether axillary lymph node metastasis occurred.The differences of serum tumor marker,pathological and ultrasound image features between the two groups were compared.Binary Logistic regression analysis was used to screen the independent influencing factors for predicting axillary lymph node metastasis in patients with invasive breast cancer,and a nomogram model for predicting axillary lymph node metastasis was constructed.Receiver operating characteristic(ROC) curve and calibration curve were drawn to evaluate the discrimination and calibration,respectively.Results" " The differences in pathological type,histological grade,serum tumor marker(carbohydrate antigen 153 and carcinoembryonic antigen) levels,ultrasound image features(maximum diameter,location and presence or absence of hyperechoic halo) between metastatic group and non-metastatic group in the training set were statistically significant(all Plt;0.05).Binary Logistic regression analysis showed that the location of the primary lesions(inner lower quadrant),hyperechoic halo,maximum diameter and histological grade were independent influencing factors in predicting axillary lymph node metastasis in patients with invasive breast cancer(OR=0.064,13.278,1.049,9.277,all Plt;0.05).The area under ROC curve of the constructed nomogram model for predicting axillary lymph node metastasis in the training set and verfication set were 0.845 and 0.823,respectively.The calibration curve was highly consistent with the ideal curve,and the nomogram model had good discrimination and calibration.Conclusion" " The nomogram model based on the pathological and ultrasound image features of the primary invasive breast cancer can effectively predict the risk of axillary lymph node metastasis,and provide reference for accurate diagnosis and treatment.
KEY WORDS" " Ultrasonography;Pathology;Invasive breast cancer;Axillary lymph node metastasis;Nomogram
乳腺癌是目前发病率最高的恶性肿瘤之一,也是女性癌症相关死亡的主要原因[1],腋窝淋巴结有无转移是乳腺癌的重要预后因素[2]。目前临床常通过前哨淋巴结活检确定腋窝淋巴结受累情况,但其假阴性率约为8.4%,且接受活检的患者会发生更多的手术并发症,包括淋巴水肿、肩关节活动受限、感染和感觉障碍等[3-4]。无创诊断乳腺癌腋窝淋巴结有无转移是目前的研究热点,临床常用的检查腋窝淋巴结的影像学方法有MRI、PET-CT及超声等,但均各有局限,且不易发现淋巴结隐匿性转移。本研究基于浸润性乳腺癌原发灶的病理和超声图像特征构建预测腋窝淋巴结转移的模型并探讨其临床价值,旨在为临床个体化诊疗提供参考。
资料与方法
一、研究对象
回顾性收集2022年6月至2023年10月浙江省肿瘤医院收治的369例浸润性乳腺癌女性患者,包括非特殊性浸润性癌321例、浸润性小叶癌19例、浸润性乳头状癌6例、其他浸润性癌23例;有腋窝淋巴结转移177例,无腋窝淋巴结转移192例。纳入标准:①经病理证实为原发性浸润性乳腺癌;②术前行乳腺超声和肿瘤标志物检查。排除标准:①隐匿性、复发性浸润性乳腺癌或有远处转移者;②乳腺原发灶较大导致超声无法测量;③术前接受抗肿瘤治疗;④有其他恶性肿瘤病史;⑤乳腺植入假体、哺乳期或妊娠期者;⑥资料不完整。以7∶3比例将入组患者随机分为训练集258例和验证集111例。本研究遵守《赫尔辛基宣言》,经浙江省肿瘤医院医学伦理委员会批准[批准号:IRB-2023-953(IIT)],为回顾性研究免除知情同意。
二、仪器与方法
1.超声检查:使用GE Logiq E9、东芝SSA-790A和Philips EPIQ5彩色多普勒超声诊断仪,线阵探头,频率5~18 MHz。参考中国浅表器官超声检查指南获取乳腺原发灶的超声图像。根据美国放射学会发布的第5版BI-RADS[5]评价乳腺癌原发灶的超声图像特征,包括:最大径、位置(外上象限、外下象限、内上象限、内下象限、中央区)、后方回声(无变化、衰减、增强)、内部回声(低回声、混合回声)、形态(规则、不规则)、边缘(光整、不光整)、钙化(无钙化、微钙化、粗大钙化)、高回声晕环(无、有)、平行于皮肤(是、否)。同侧多发乳腺病变者仅对病理证实为浸润性乳腺癌的最大原发灶进行评估。以上操作由两名具有5年以上工作经验的超声医师在未知其他临床资料的情况下完成,意见不一致时与第3名具有10年以上工作经验的超声医师协商统一。由于不同仪器的CDFI敏感性不同,故本研究未纳入原发灶的血流特征进行分析。
2.病理特征收集和血清肿瘤标志物检测:病理特征包括病理类型、组织学分级、雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体-2(HER-2)、核增殖抗原(Ki-67)、雄激素受体(AR)、分子分型[6]。其中病理类型包括浸润性小叶癌、非特殊类型浸润性癌、浸润性乳头状癌及其他浸润性癌。组织学分级分为Ⅰ级、Ⅱ级、Ⅲ级。ER、PR判定标准:≥1%为阳性,lt;1%为阴性。HER-2判定标准[6]:+为阴性,+++为阳性,++则需进一步行FISH检测有无基因扩增,若FISH阳性则判为阳性。Ki-67判定标准:gt;14%为高表达,≤14%为低表达。AR判定标准[6]:≥10%为阳性,lt;10%为阴性。分子分型包括Luminal A型、Luminal B型、HER-2过表达型及三阴性。血清肿瘤标志物主要包括糖类抗原125(CA125)、糖类抗原153(CA153)、癌胚抗原(CEA)、糖类抗原724(CA724)。
3.分组:收集腋窝淋巴结清扫病理结果为诊断腋窝淋巴结转移的金标准;未行清扫者则以腋窝前哨淋巴结活检病理结果为金标准。本研究根据有无淋巴结转移将训练集患者分为转移组116例和未转移组142例。
三、统计学处理
应用R 4.2.0语言统计软件,正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料以例表示,组间比较采用χ2检验或Fisher确切概率法。基于训练集,采用单因素Logistic回归评估腋窝淋巴结转移与血清肿瘤标志物、病理和超声图像特征的关系,再将其中差异有统计学意义的变量纳入多因素Logistic回归分析,采用向后逐步法筛选预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素,建立预测模型,并绘制列线图可视化。基于训练集和验证集,绘制受试者工作特征(ROC)曲线评估该模型的区分度;绘制校准曲线评估该模型的校准度。Plt;0.05为差异有统计学意义。
结" 果
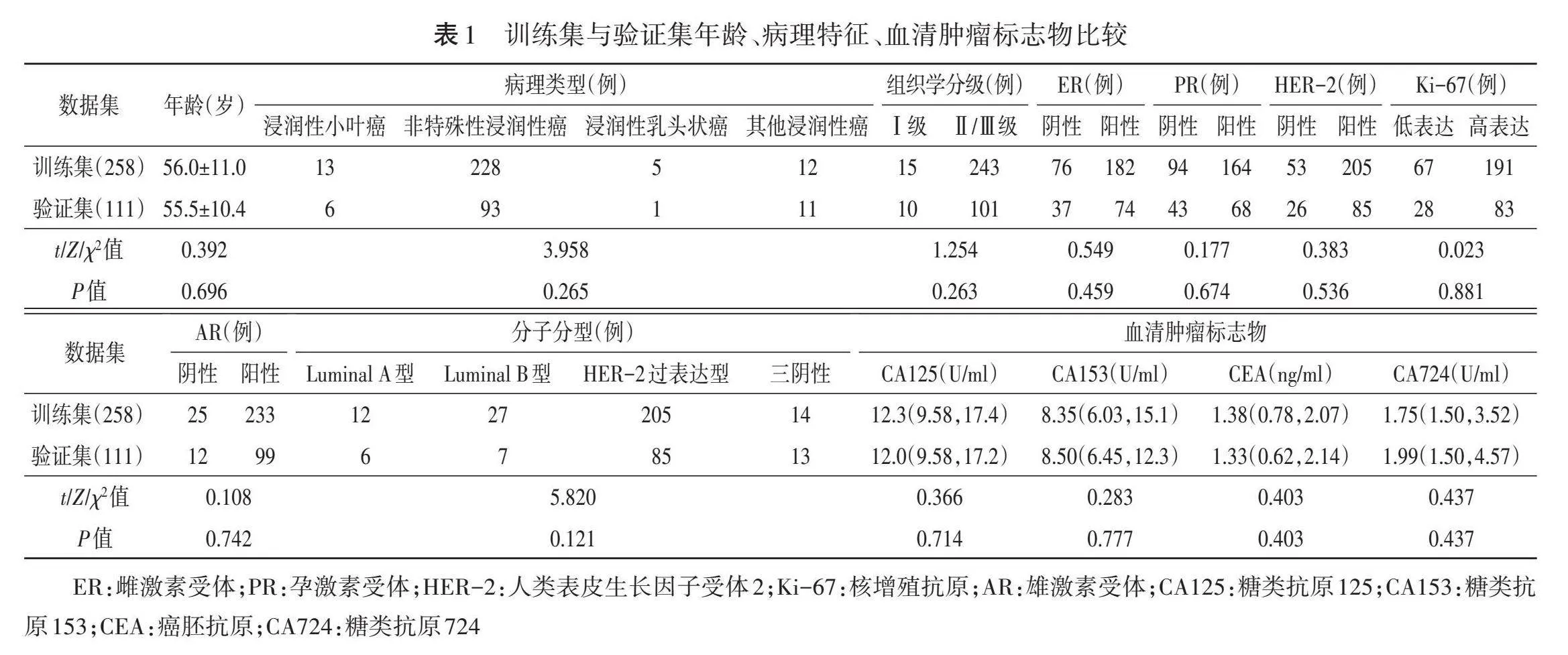
一、训练集与验证集年龄、病理特征、血清肿瘤标志物比较
训练集与验证集年龄、病理特征比较,差异均无统计学意义。见表1。
二、训练集中转移组与未转移组年龄、病理和超声图像特征、血清肿瘤标志物比较
1.与未转移组比较,转移组中非特殊性浸润性癌占比更低、其他浸润性癌占比更高,组织学分级Ⅱ/Ⅲ级占比及CA153、CEA均更高,差异均有统计学意义(均Plt;0.05)。两组年龄、ER、RP、HER-2、Ki-67、AR、分子分型,以及CA125、CA724比较,差异均无统计学意义。见表2。
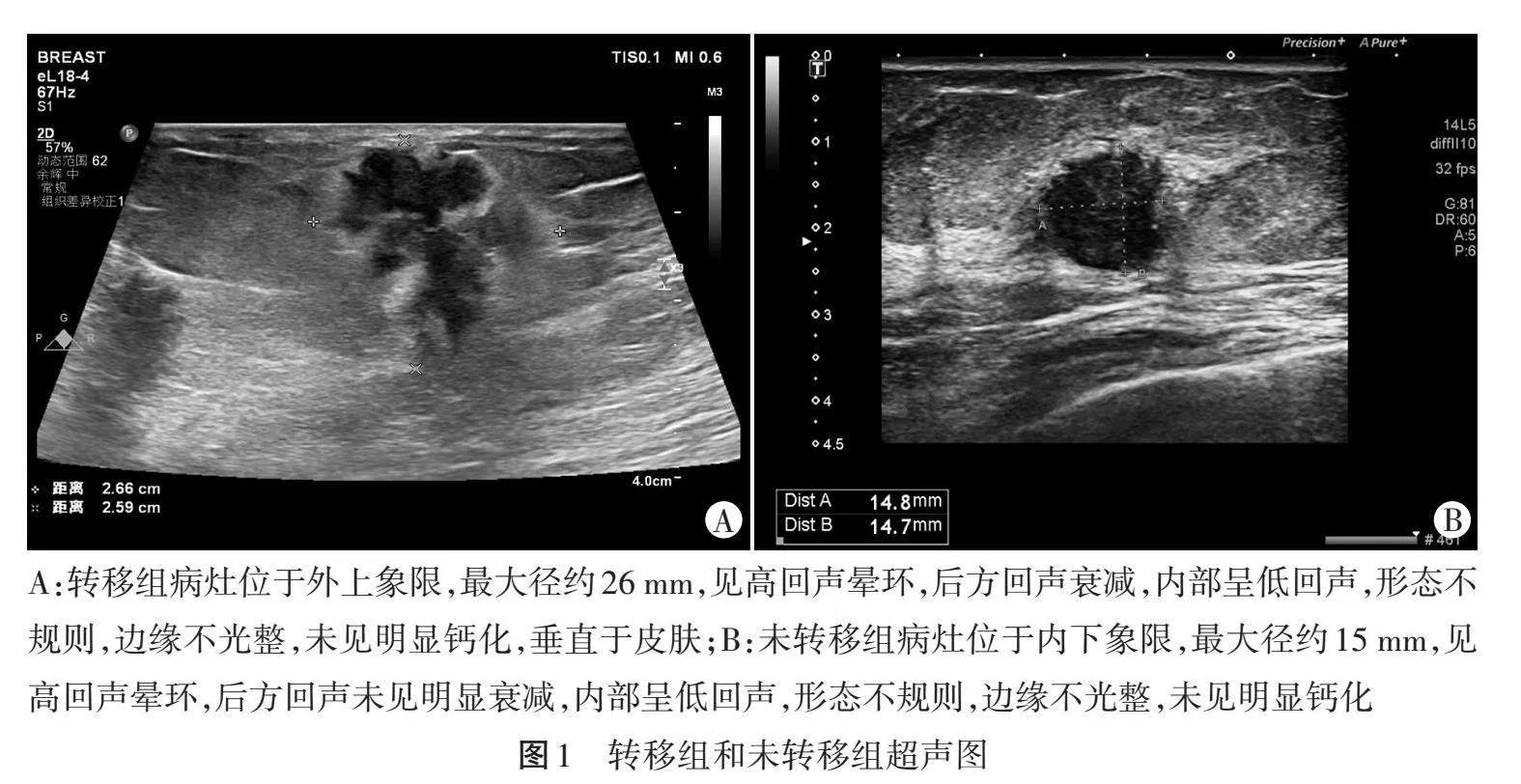
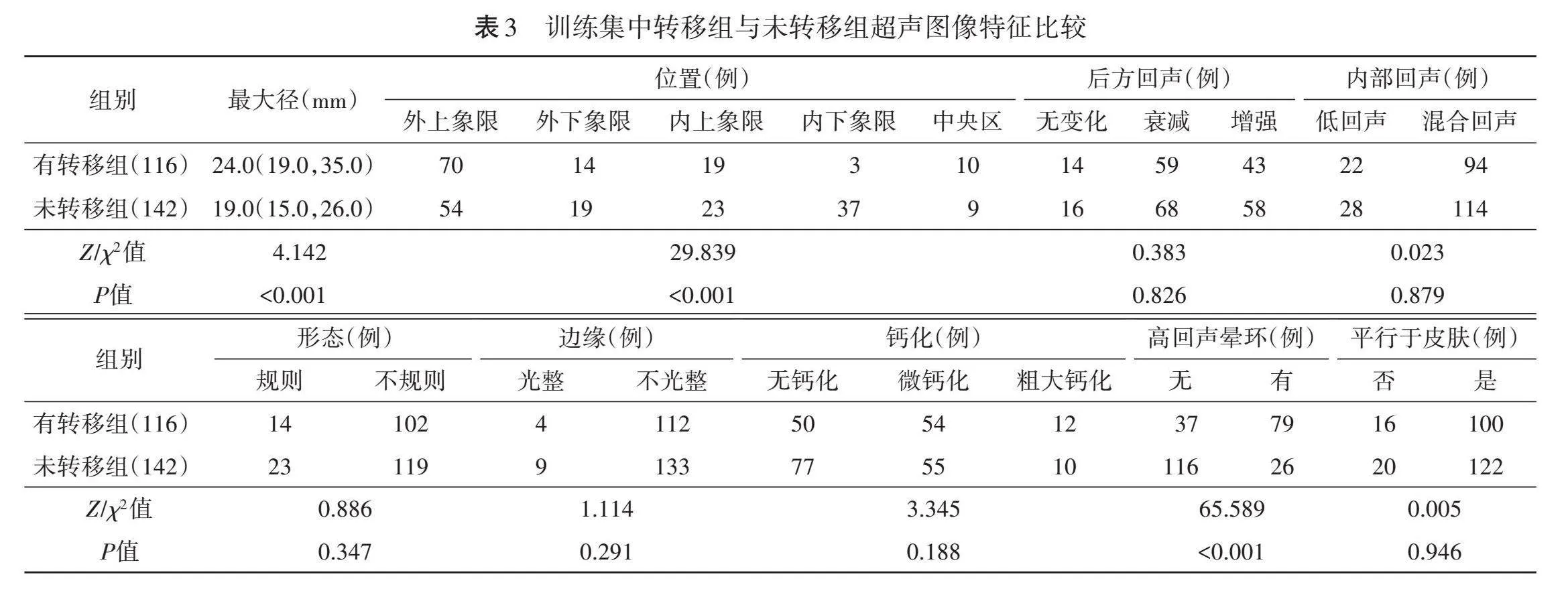
2.与未转移组比较,转移组原发灶最大径更大,高回声晕环占比更高,原发灶位于外上象限者占比更高、位于内下象限者占比更低,差异均有统计学意义(均Plt;0.05)。两组原发灶后方回声、内部回声、形态、边缘、钙化、是否平行于皮肤比较,差异均无统计学意义。见表3和图1。
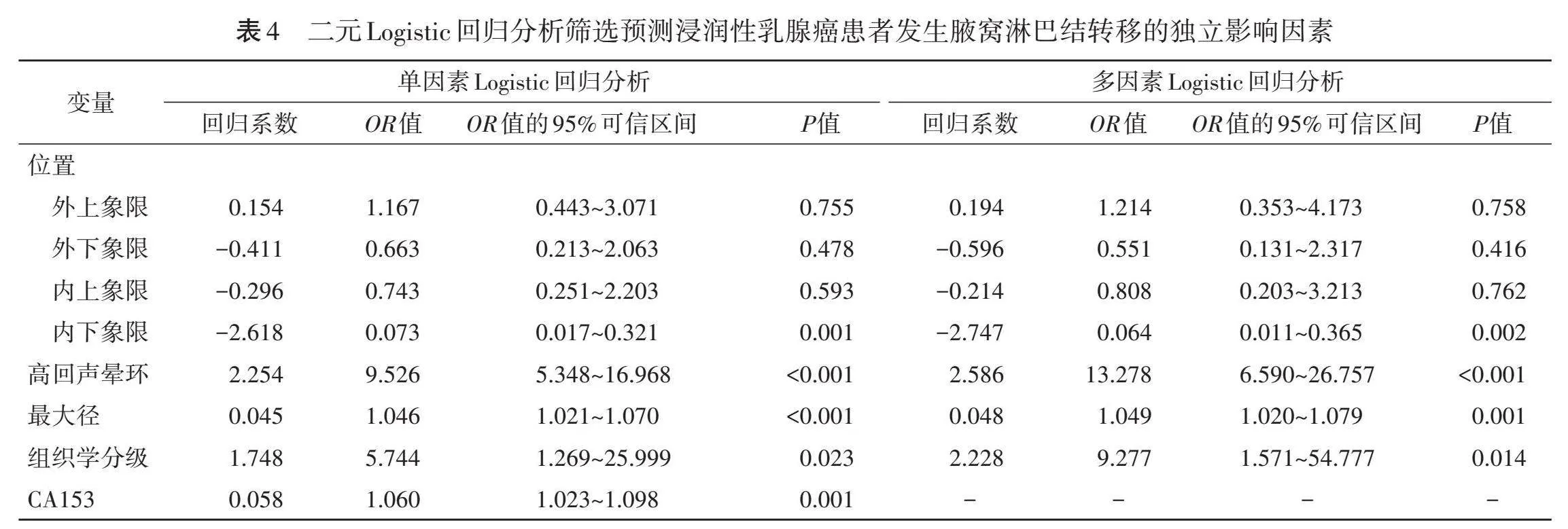
三、二元Logistic回归分析
单因素Logistic分析结果显示,乳腺癌原发灶位置(内下象限)、高回声晕环、最大径、组织学分级、CA153均与腋窝淋巴结转移显著相关(OR=0.073、9.526、1.046、5.744、1.060,均Plt;0.05)。见表4。
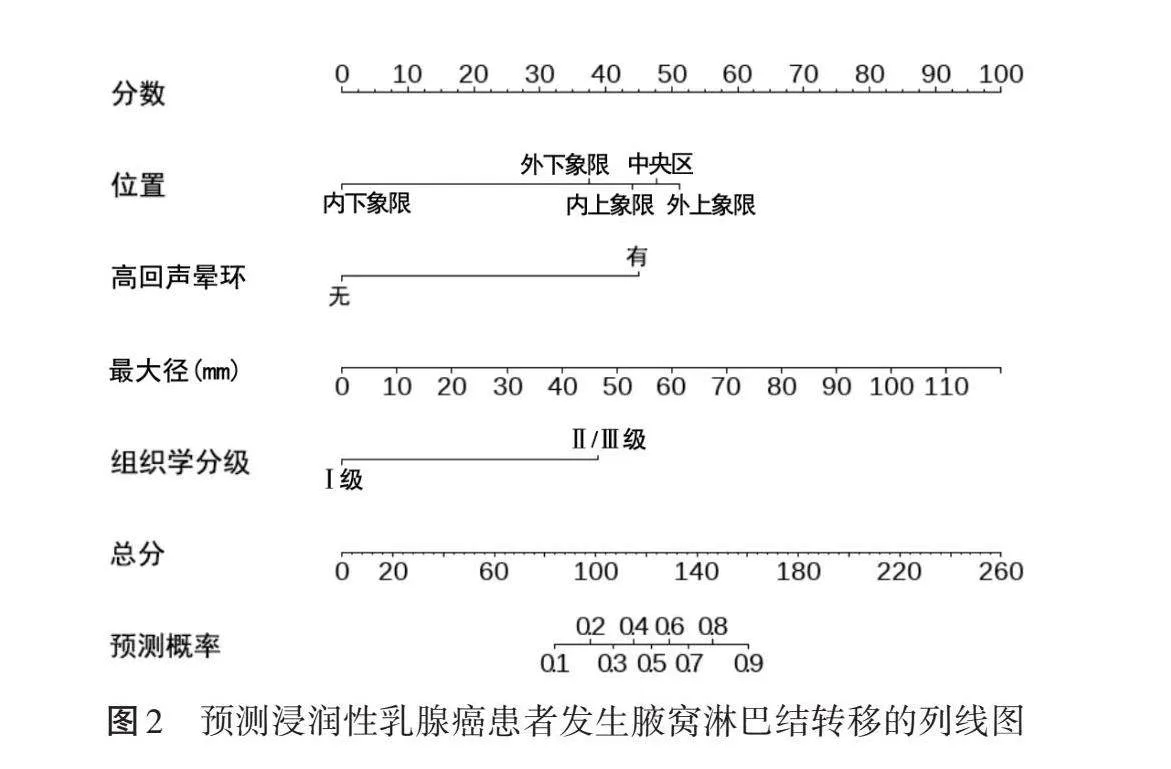
多因素Logistic分析结果显示,原发灶位置(内下象限)、高回声晕环、最大径、组织学分级均为预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素(OR=0.064、13.278、1.049、9.277,均Plt;0.05)。见表4。由此构建预测浸润性乳腺癌患者发生腋窝淋巴结转移的列线图模型见图2。
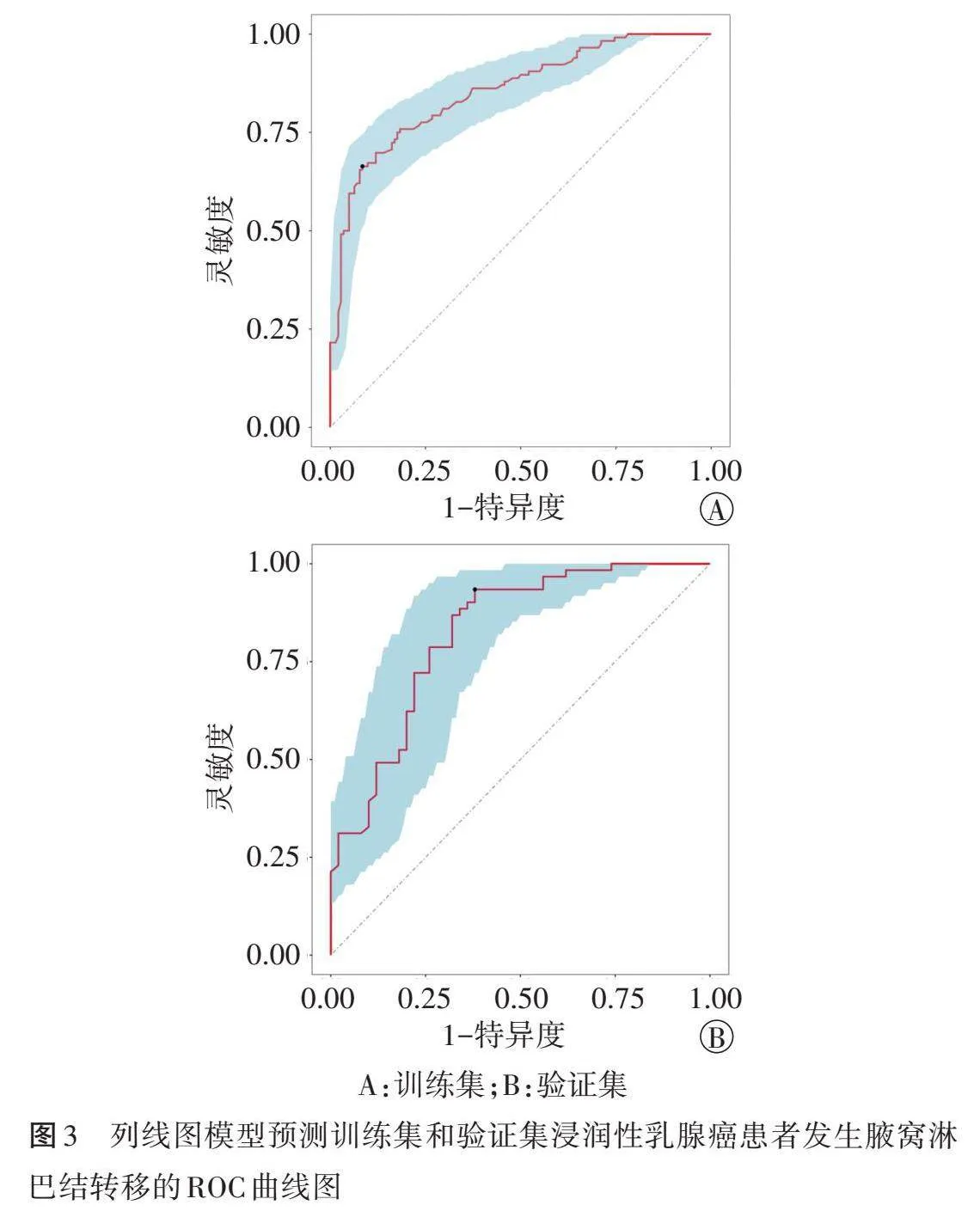
四、模型验证
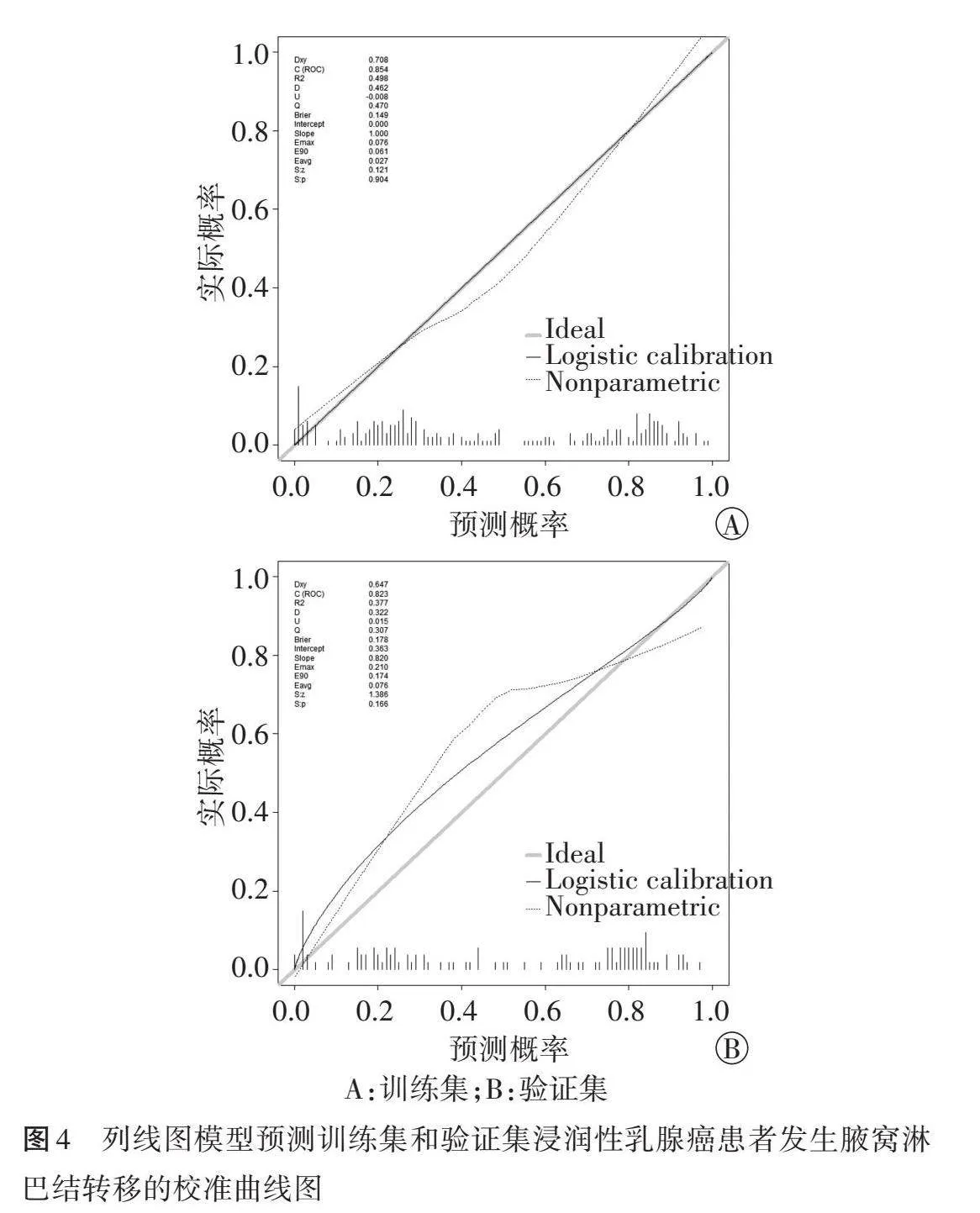
ROC曲线分析显示,列线图模型预测训练集和验证集浸润性乳腺癌患者发生腋窝淋巴结转移的曲线下面积分别为0.854(95%可信区间:0.808~0.900)和0.823(95%可信区间:0.745~0.902),提示该模型区分度高。见图3。校准曲线分析显示,该模型在训练集和验证集中预测曲线与理想曲线均较为吻合,提示其校准度高。见图4。
讨" 论
乳腺癌患者有无发生腋窝淋巴结转移对制定治疗方案及评估预后均具有重要意义,若能在微创甚至无创条件下对腋窝淋巴结状态进行可靠评估,则可以减少转移风险较低的患者进行前哨淋巴结手术活检,进而减少淋巴回流损伤导致的手术并发症[7]。既往研究[8-9]显示,预测腋窝淋巴结转移的独立影响因素包括病灶位置、高回声晕环、最大径、组织学分级。本研究基于浸润性乳腺癌原发灶的病理和超声图像特征构建列线图模型以预测腋窝淋巴结转移风险,旨在为临床个体化诊疗提供参考。
既往多项研究[10-11]均表明,乳腺癌原发灶最大径是腋窝淋巴结受累的重要预测因素,原因为原发灶大小直接反映其侵袭性,更大的原发灶与血管、淋巴管的接触也更多,发生转移的风险更高[7]。本研究结果显示,训练集中转移组原发灶最大径较未转移组更大,差异有统计学意义(Plt;0.05);二元Logistic回归分析显示最大径为预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素(OR=1.049,P=0.001);构建的列线图模型显示最大径越大则预测分数越高,最终预测概率也越高,与上述研究相似。Hwang等[12]研究显示乳腺癌病灶位于外上象限的患者生存率更高,原因为外上象限的病灶首先转移至腋窝淋巴结,更易发现并于首次手术时进行清扫,而其他位置尤其是内下象限的病灶更易向内乳淋巴结转移,更为隐匿。Yang等[13]研究显示乳腺癌病灶位于内下象限时易向内乳淋巴结转移,并认为病灶位于内下象限是乳腺癌预后不良的预测因素。本研究结果与上述研究结果相似,原发灶位于内下象限是预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素(OR=0.064,P=0.002)。此外,本研究还发现原发灶存在高回声晕环也会提高腋窝淋巴结转移的风险,分析其原因为受压的纤维组织或肿瘤向周围组织浸润,超声表现为高回声晕环,反映了肿瘤细胞的侵袭程度。目前研究[8-9]多将高回声晕环定义为乳腺癌预后不良的重要指标,本研究结果也显示高回声晕环为预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素(OR=13.278,Plt;0.001),明确了高回声晕环与腋窝淋巴结转移的关系。
根据Elston-Ellis组织学分级系统[6,14],Ⅱ级、Ⅲ级肿瘤分化程度更差,发生转移的风险更高;Patani等[10]指出组织学分级与腋窝淋巴结转移明确相关,本研究结果亦证实其结论,原发灶组织学分级Ⅱ/Ⅲ级为预测浸润性乳腺癌患者发生腋窝淋巴结转移的独立影响因素(OR=9.277,P=0.014)。
列线图模型是一种可视化预测工具,可以将多参数回归方程以线段和得分的形式直观展示,进而预测风险,具有操作简单、临床适用性强的优点;且直观性也有利于医患沟通,减少医患矛盾。本研究基于二元Logistic回归分析结果,纳入原发灶位置、高回声晕环、最大径、组织学分级构建诊断模型,ROC曲线分析显示其预测训练集和验证集浸润性乳腺癌患者发生腋窝淋巴结转移的曲线下面积分别为0.854(95%可信区间:0.808~0.900)和0.823(95%可信区间:0.745~0.902),提示该模型区分度高;校准曲线分析显示该模型在训练集和验证集中预测曲线与理想曲线均较为吻合,提示其校准度高,表明该模型具有较高的诊断效能,可据此针对性拟定治疗方案,减少不必要的活检。
本研究未纳入模型的指标有ER、PR、HER-2、Ki-67、AR及分子分型,其对腋窝淋巴结转移的影响目前存在争议。Ugras等[15]认为HER-2过表达型乳腺癌是腋窝淋巴结转移的独立危险因素(OR=2.5,Plt;0.001);Dihge等[7]认为三阴性乳腺癌腋窝淋巴结未转移的概率是Luminal A型乳腺癌的5倍以上(OR=5.06,P=0.031);Mattes等[16]认为ER阳性、PR阳性、HER-2阴性均会导致腋窝淋巴结转移风险增高。但上述研究发表时间较早,均未纳入Ki-67这一指标,结果可能不能完全符合最新的St Gallen分子分型标准[17]。本研究按照最新的St Gallen分子分型标准重新进行分型,但仍未发现ER、PR、HER-2、Ki-67、AR中的任意一项或分子分型中某一类与腋窝淋巴结转移独立相关,符合此类指标对腋窝淋巴结转移的影响仍存在争议的特点,也可能与本研究为单中心研究、样本量小有关。
本研究的局限性:①为回顾性研究,存在选择偏倚;②仅基于单一的灰阶超声图像特征构建模型;③缺乏外部验证,后续将开展基于多模态超声的前瞻性、多中心研究进一步深入探讨。
综上所述,基于浸润性乳腺癌原发灶超声图像特征和病理特征的列线图模型可有效预测腋窝淋巴结转移风险,对个体化临床决策具有一定的参考价值。
参考文献
[1] Sung H,Ferlay J,Siegel RL,et al.Global Cancer Statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.
[2] Chang JM,Leung JWT,Moy L,et al.Axillary nodal evaluation in breast cancer:state of the art[J].Radiology,2020,295(3):500-515.
[3] Lyman GH,Giuliano AE,Somerfield MR,et al.American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer[J].J Clin Oncol,2005,23(30):7703-7720.
[4] Chang JY,Wang W,Shen JL,et al.Impact of sentinel lymph node biopsy through the axillary cribriform fascia approach on intraoperative indicators and postoperative complications[J].Updates Surg,2023,75(3):757-767.
[5] Mercado CL.BI-RADS update[J].Radiol Clin North Am,2014,52(3):481-487.
[6] Gradishar WJ,Anderson BO,Balassanian R,et al.NCCN Guidelines Insights:Breast Cancer,Version 1.2017[J].J Natl Compr Canc Netw,2017,15(4):433-451.
[7] Dihge L,Bendahl PO,Ryden L.Nomograms for preoperative prediction of axillary nodal status in breast cancer[J].Br J Surg,2017,104(11):1494-1505.
[8] Tang YL,Wang B,Ou-Yang T,et al.Ultrasound radiomics based on axillary lymph nodes images for predicting lymph node metastasis in breast cancer[J].Front Oncol,2023,13(1):1217309.
[9] Bai X,Wang Y,Song R,et al.Ultrasound and clinicopathological characteristics of breast cancer for predicting axillary lymph node metastasis[J].Clin Hemorheol Microcirc,2023,85(2):147-162.
[10] Patani NR,Dwek MV,Douek M.Predictors of axillary lymph node metastasis in breast cancer: a systematic review[J].Eur J Surg Oncol,2007,33(4):409-19.
[11] Li L,Yu T,Sun J,et al.Prediction of the number of metastatic axillary lymph nodes in breast cancer by radiomic signature based on dynamic contrast-enhanced MRI[J].Acta Radiol,2022,63(8):1014-1022.
[12] Hwang KT,Kim J,Kim EK,et al.Poor prognosis of lower inner quadrant in lymph node-negative breast cancer patients who received no chemotherapy:a study based on nationwide Korean breast cancer registry database[J].Clin Breast Cancer,2017,17(4):169-184.
[13] Yang J,Tang S,Zhou Y,et al.Prognostic implication of the primary tumor location in early-stage breast cancer:focus on lower inner zone[J].Breast Cancer,2018,25(1):100-107.
[14] Gao C,Wang J,He P,Xiong X.Metastatic pattern of breast cancer by histologic grade:a SEER population-based study[J].Discov Med,2022,34(173):189-197.
[15] Ugras S,Stempel M,Patil S,et al.Estrogen receptor,progesterone receptor,and HER2 status predict lymphovascular invasion and lymph node involvement[J].Ann Surg Oncol,2014,21(12):3780-3786.
[16] Mattes MD,Bhatia JK,Metzger D,et al.Breast cancer subtype as a predictor of lymph node metastasis according to the SEER registry[J].J Breast Cancer,2015,18(2):143-148.
[17] Focke CM,Van Diest PJ,Decker T.St Gallen 2015 subtyping of luminal breast cancers:impact of different Ki67-based proliferation assessment methods[J].Breast Cancer Res Treat,2016,159(2):257-263.
(收稿日期:2024-01-21)
