基于增强CT影像组学术前预测肝癌病理分化程度
2024-10-30乔佳业谢宗玉马宜传
摘要:目的" 探讨基于门脉期CT影像组学术前预测肝细胞肝癌病理分化程度的价值。方法" 回顾性收集206例蚌埠医科大学第一附属医院经术后病理证实为肝细胞肝癌患者的临床资料及完整术前增强CT扫描图像,根据病理结果分为低分化组和非低分化组,按7:3的比例随机分为训练组(n=145)及验证组(n=61)。采用ITK-SNAP软件从门脉期手动分割肿瘤,采用Python软件的Pyradiomics包提取肿瘤组织的影像组学特征,应用最小冗余最大相关、最小绝对收缩和选择算子法对特征降维,建立影像组学标签;采用Logistic回归分析构建临床模型、影像组学模型及联合模型,使用100次留组交叉验证检验模型的可靠性;采用ROC曲线、校准曲线和决策曲线评估模型的诊断效能和临床应用价值。结果" 最终得到9个最佳影像组学特征,临床模型、影像组学模型及联合模型在训练组中的曲线下面积分别为0.641、0.740、0.784,在验证组中的曲线下面积分别为0.644、0.692、0.724。结论" 基于门脉期CT影像组学模型对于术前预测肝细胞肝癌病理分化程度具有一定的价值。
关键词:影像组学;肝细胞肝癌;病理学;分化程度
Predicting the degree of pathological differentiation of hepatic carcinomas based on enhanced CT radiomics
QIAO Jiaye, XIE Zongyu, MA Yichuan
Department of Radiology, the First Affiliated Hospital of Bengbu Medical University, Bengbu 233004, China
Abstract: Objective To investigate the value of predicting the degree of pathological differentiation of hepatocellular carcinoma based on portal phase CT radiomics before surgery. Methods A retrospective collection of 206 patients confirmed by postoperative pathology in the First Affiliated Hospital of Bengbu Medical University with clinical data and complete preoperative CT enhanced scan images, they were divided into low differentiation group and non low differentiation group based on pathological results, the patients were randomly divided into training group (n=145) and test group (n=61) at a ratio of 7:3. The ITK-SNAP software was used to manually segment tumors from the portal phase,the radiomics features of the tumor tissues were extracted using the Pyradiomics package of Python software.The minimum redundancy maximum redundancy and the least absolute shrinkage and selection operator methods were used to reduce the dimensionality of radiomics features and establish radiomics labels. Logistic regression analysis was used to establish clinical model, radiomics model and combined model, and 100 leave-group-out cross validation was used to verify the reliability of the model. The ROC curve, calibration curve and decision curve were used to evaluate the diagnostic efficacy and clinical application value of the model. Results 9 optimal radiomics features were obtained. In the training group, the area under the curve of clinical model, radiomics model, and combined model was 0.641, 0.740, 0.784, respectively, and the area under the curve was 0.644, 0.692, 0.724 in the test group, respectively. Conclusion The radiomics model based on portal phase CT has certain value in predicting the degree of pathological differentiation of hepatocellular carcinoma before surgery.
Keywords: radiomics; hepatocellular carcinoma; pathology; degree of differentiation
肝细胞肝癌(HCC)是全球第六大常见癌症[1]。手术切除是治疗HCC的最有效方法,但术后复发率高、预后差[2]。研究表明,HCC的组织病理学分级反映了肿瘤的生物学行为,是预测预后的关键指标之一[3],低分化HCC更容易肝内复发和肝外转移[4, 5];活检是手术前获取肿瘤组织病理特征的唯一方法,但其具有侵入性,存在抽样误差,不推荐用于HCC的诊断[6]。术前无创性预测HCC的组织学分级对HCC患者的治疗和预后至关重要。影像组学是一种新技术,能够对视觉检查之外的医学图像进行定量分析,可以无创性地获取肿瘤内部信息[7]。既往研究表明影像组学在预测HCC病理分化程度方面具有可行性[8-10],但研究结果因方法和纳入队列而异,且所提取特征不同,应进行深入探索研究。有学者[11]利用3D-Slice软件分割提取851个特征,通过建立支持向量机预测模型取得良好的诊断性能,但该研究纳入的实验室检查非常有限且建模所用样本量较少,研究结果未联合临床模型,研究价值仍需进一步探讨。本研究通过收集更全面的临床特征和更多的样本量,结合增强CT影像组学特征,旨在为术前预测HCC分化程度提供可靠依据。
1" 资料与方法
1.1" 一般资料
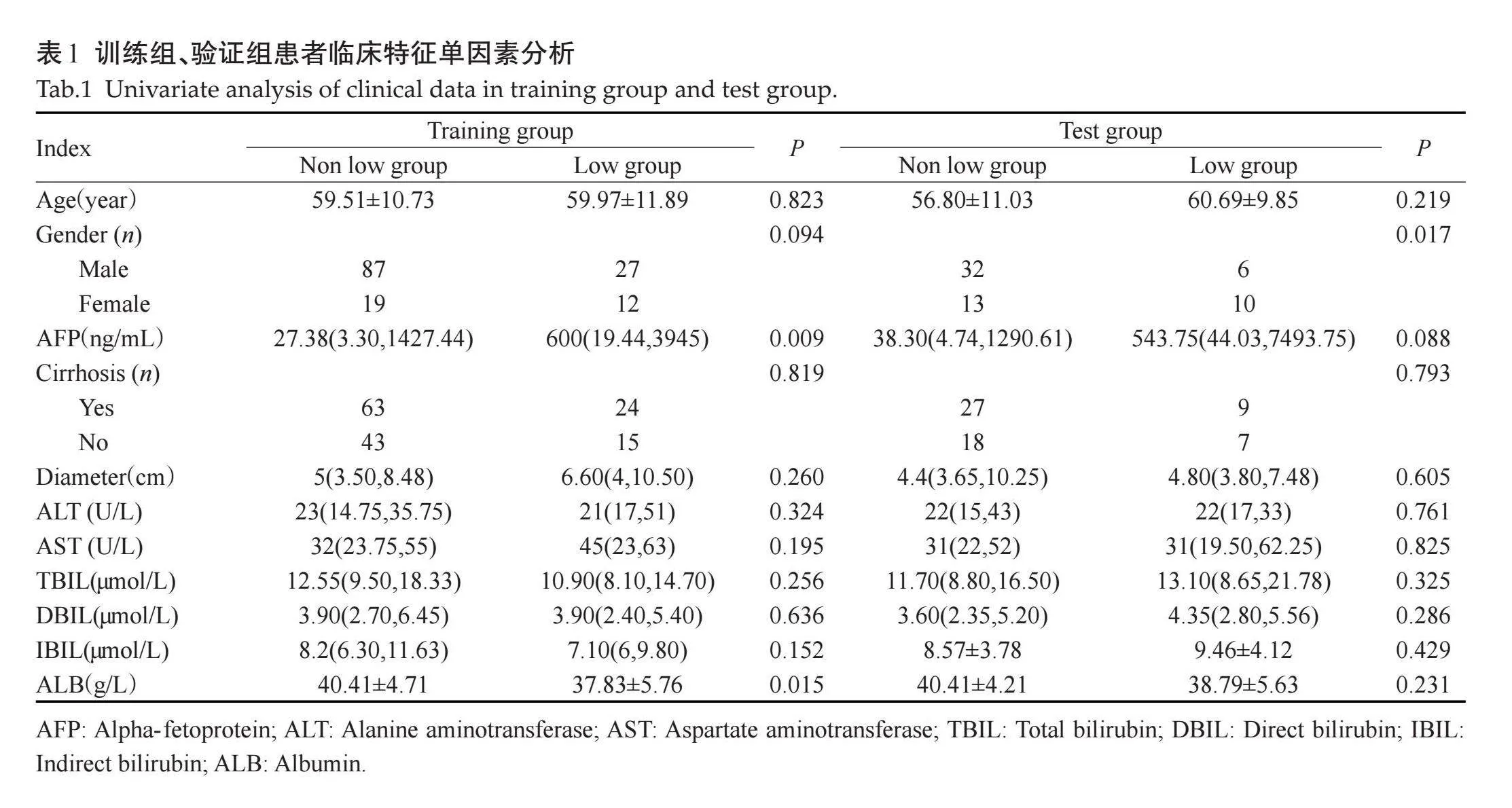
回顾性分析2019年1月~2023年8月在我院行肝部分切除的HCC患者资料。纳入标准:经手术病理证实为HCC,且有明确的WHO病理分级;术前2周内进行上腹部CT增强扫描且图像清晰,病变显示清楚,未接受过抗肿瘤治疗;无其它恶性肿瘤病史。排除标准:病灶lt;1 cm或显示不清;临床资料不完整;没有明确的病理学分级;病灶为复发或有其它恶性肿瘤病史。最终共纳入206例,其中男152例,女54例,年龄18~92(59.10±10.95)岁。根据2010年版世界卫生组织肝脏及肝内胆管肿瘤组织学分类标准,将患者分为低分化组(中低分化、低分化)和非低分化组(高分化、中高分化及中分化)[12],并将患者按照7:3随机分为训练组(n=145)和验证组(n=61)。记录患者的一般资料,包括年龄、性别、肿瘤最大直径、影像肝硬化背景以及实验室检查[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、甲胎蛋白(AFP)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、白蛋白(ALB)]。本研究为回顾性分析,经医院伦理委员会批准(审批号:伦科批字[2023]第440号)。
1.2" 仪器与方法
使用美国GE 64排螺旋CT和GE Revolution 256排螺旋CT扫描仪,扫描参数:管电压120 kV,管电流250 mA,层厚及层间距均为5 mm,螺距1.5 mm,取仰卧位,经肘静脉以3.5 mL/s流率注入碘对比剂60~80 mL,分别在注射对比剂25~30 s、60~70 s和120~180 s后获取上腹部动脉期、门脉期以及延迟期图像。
1.3" 影像组学分析
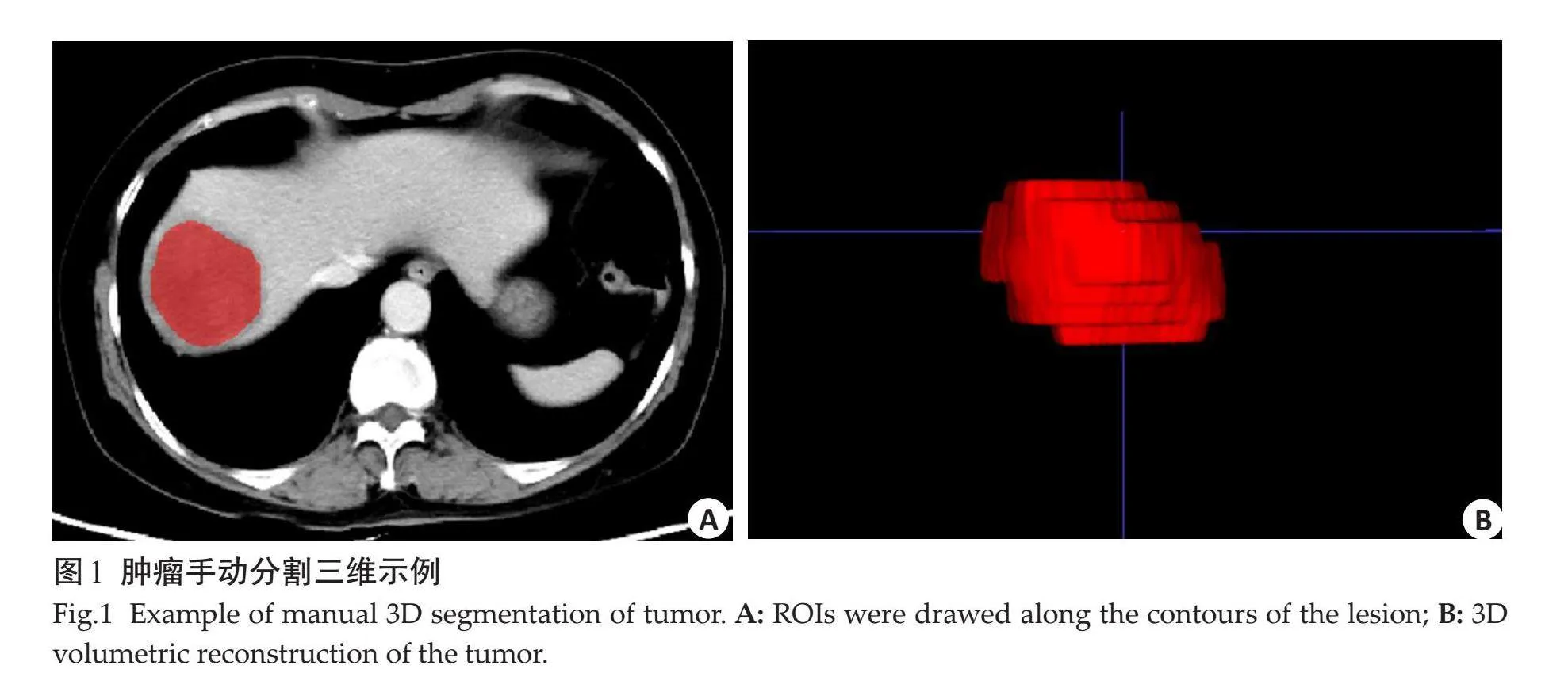
1.3.1" 图像分割" "将患者门脉期CT图像导入ITK-SNAP(http://www.itksnap.org/)软件中,由2位放射科医生(分别具有5年、10年工作经验)手动沿病灶边缘逐层标注感兴趣区(ROI),并进行三维融合(图1)。
1.3.2" 图像预处理及特征提取" "基于患者CT图像及生成的三维图像,利用Anaconda软件(http://repo.anaconda.com/)的Python 3.7 Pyradiomics v3.0.1工具包对图像进行插值算法1 mm×1 mm×1 mm(x,y,z)重采样,将图像标准化,设置25 Hu bit宽度,使体素强度离散化降低图像噪声,然后对三维图像进行影像组学特征提取,包括一阶特征18个、形态特征14个、纹理特征68个、Log-sigma(系数1.0、2.0、3.0、4.0、5.0)转换特征430个、小波滤波(Wavelet)8个滤波通道组合特征688个。
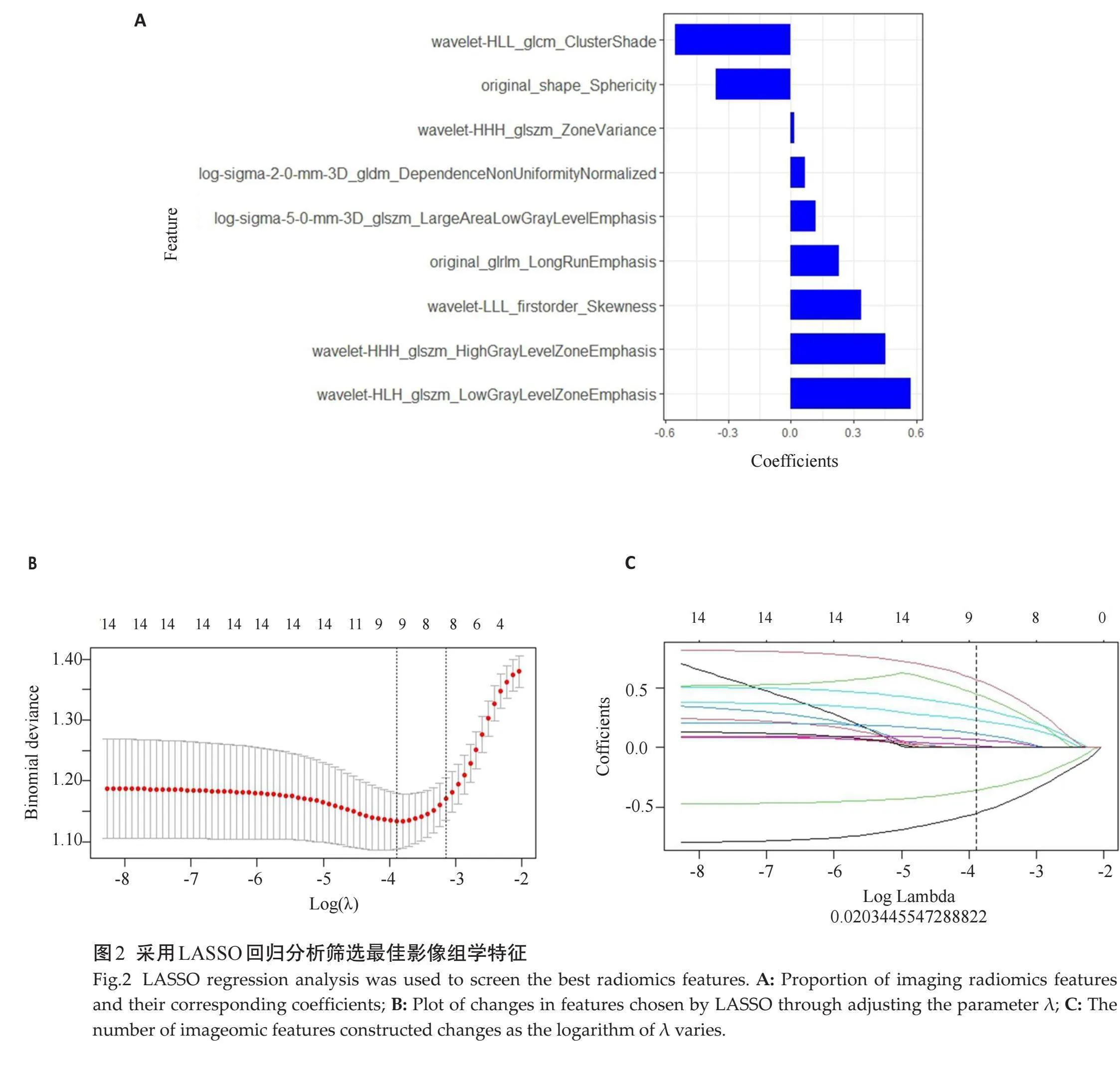
1.3.3" 特征筛选和模型构建" "采用组间相关系数评价2位医师提取特征的一致性。采用Z-score法将数据标椎化处理,以最小冗余最大相关法(mRMR)及最小绝对收缩选择算子法(LASSO)对特征进行筛选、降维,根据最优超参数λ值筛选最佳影像组学特征且排除系数为0的特征,构建影像组学模型,根据特征权重计算影像组学标签得分(Rad-score)。
1.4" 统计学分析
采用R4.0.3、SPSS25.0软件对数据进行分析。计量资料先进行正态性及方差齐性检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(上、下四分位数)表示,组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,采用卡方检验或Fisher检验;采用100次留组交叉验证检验模型的可靠性。采用单因素和多因素Logistic回归分析构建诊断模型,绘制ROC曲线,通过曲线下面积(AUC)评价模型的诊断效能,采用Delong检验比较不同模型的效能差异;采用校准曲线和Hosmer-Lemeshow检验评价模型的校正能力和拟合优度(以Pgt;0.05为拟合优度较好);采用决策曲线分析(DCA)评估模型的临床应用价值;mRMR采用“mRMRe”包,LASSO采用“glmnet”包,校准曲线采用“rms”包,Hosmer-Lemeshow采用“DescTools”包,DCA采用“rmda”包。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 临床模型的构建
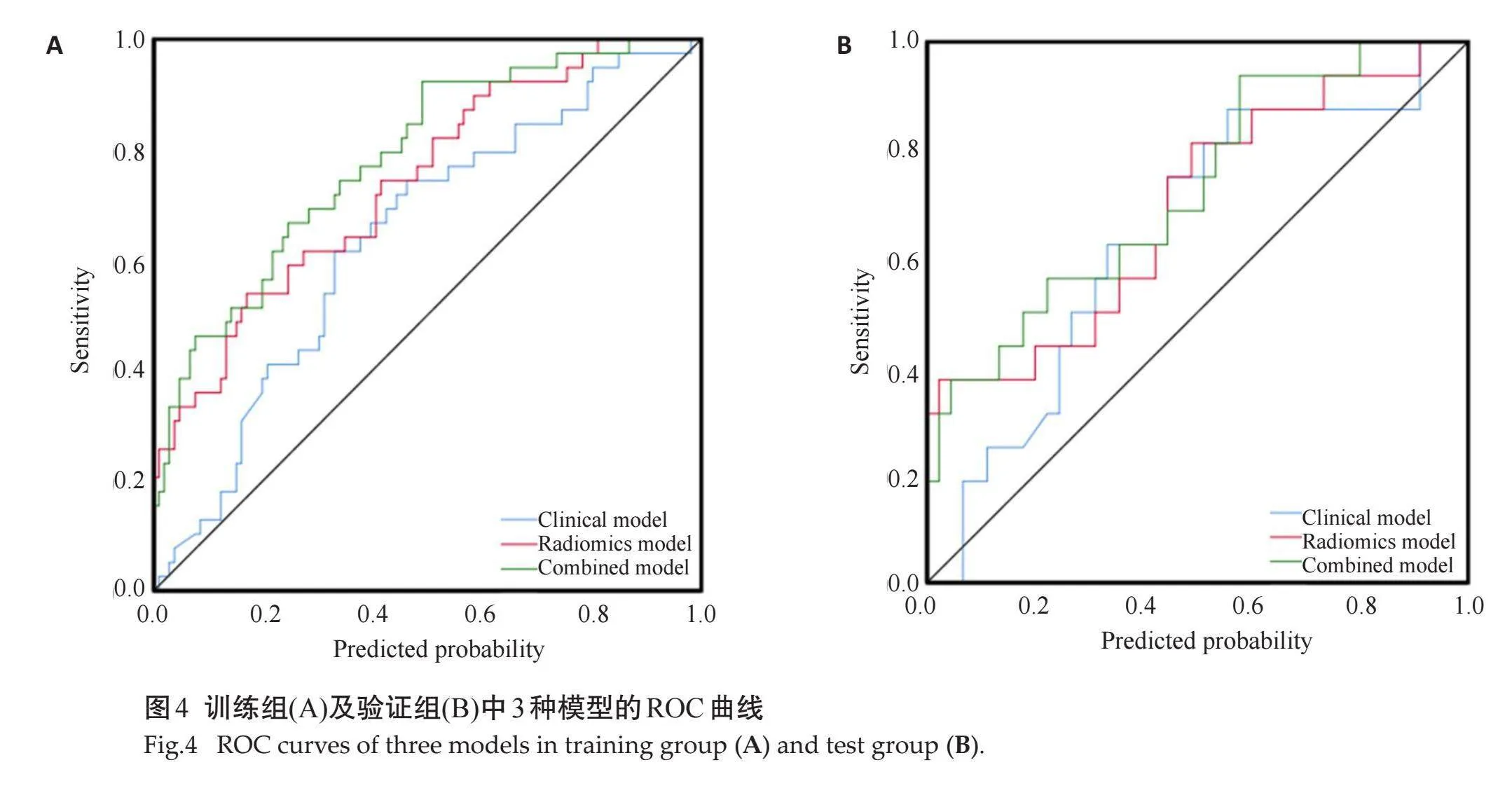
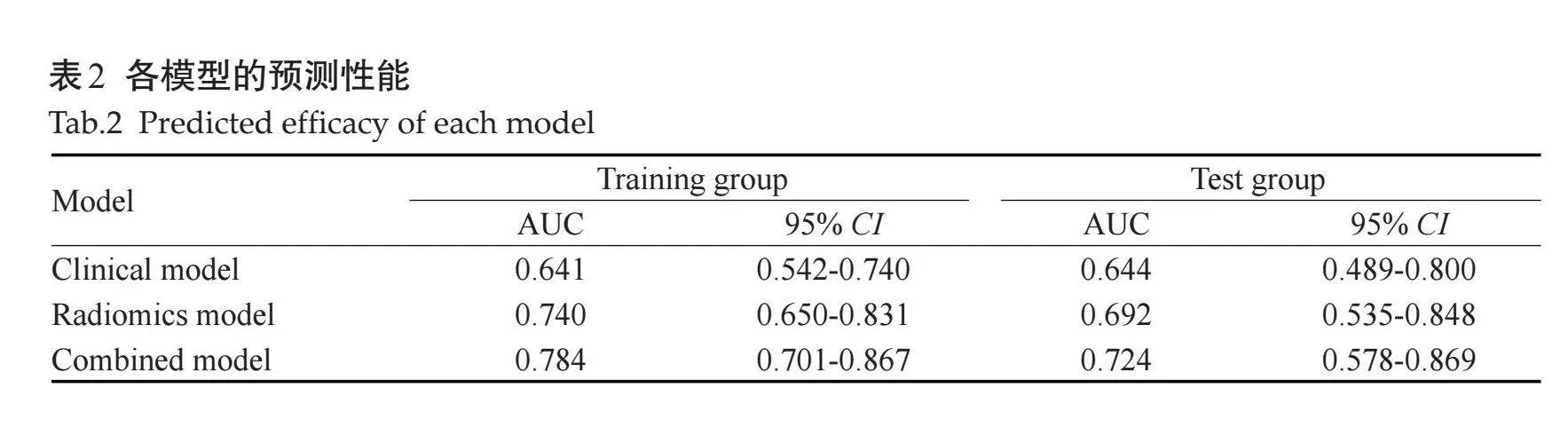
在训练组中,低分化组和非低分化组间AFP、ALB的差异有统计学意义(Plt;0.05),在验证组中,低分化组和非低分化组间性别差异有统计学意义(Plt;0.05),其余特征的差异均无统计学意义(Pgt;0.05,表1),将训练组中Plt;0.05的临床特征纳入二元Logistic回归分析结果显示,AFP是独立预测因子(Plt;0.05),用来构建临床模型,在训练组及验证组中,ROC曲线显示临床模型的AUC值分别为0.641、0.644。
2.2" 特征选择及影像组学模型构建
2位医师提取的影像组学特征一致性较好(组间相关系数gt;0.75),使用高年资医师提取的影像组学特征进行分析。在训练组中通过mRMR去除冗余特征和LASSO降维最终筛选出9个最佳影像组学特征(图2),采用多元逻辑回归分析构建影像组学模型,并计算模型的Rad-score,其计算公式为:Rad-score= -0.36×original_shape_Sphericity+0.231×original_glrlm_LongRunEmphasis+0.068×log-sigma-2-0-mm-3D_gldm_DependenceNonUniformityNormalized+ -0.553×wavelet-HLL_glcm_ClusterShade+0.453×wavelet-HHH_glszm_HighGrayLevelZoneEmphasis+0.119×Log-sigma-5-0-mm-3D_glszm_LargeAreaLowGrayLevelEmphasis+0.335×wavelet-LLL_firstorder_Skewness+0.017×wavelet-HHH_glszm_ZoneVariance+0.574×wavelet-HLH_glszm_LowGrayLevelZoneEmphasis + -0.507。
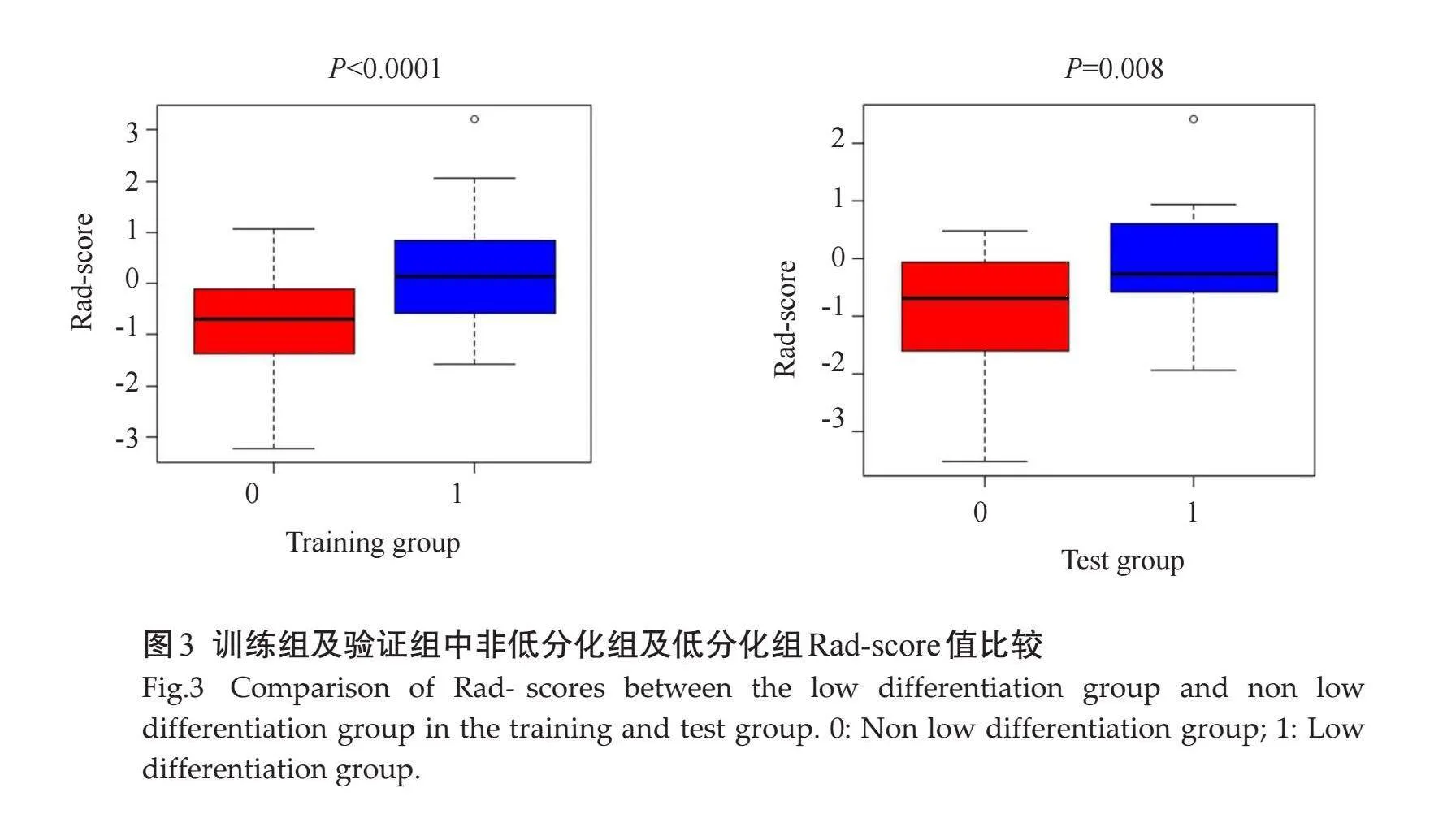
在训练组及验证组中,使用 Wilcoxon 检验比较低分化组及非低分化组之间的Rad-score差异均有统计学意义(Plt;0.05,图3);在训练组及验证组中,ROC曲线显示影像组学模型的AUC值分别为0.740、0.692。联合AFP水平及Rad-score评分构建联合模型,在训练组及验证组中,ROC曲线显示联合模型的AUC值分别为0.784、0.724;经DeLong检验,各模型间AUC的差异无统计学意义(Pgt;0.05)。
2.3" 模型的评价
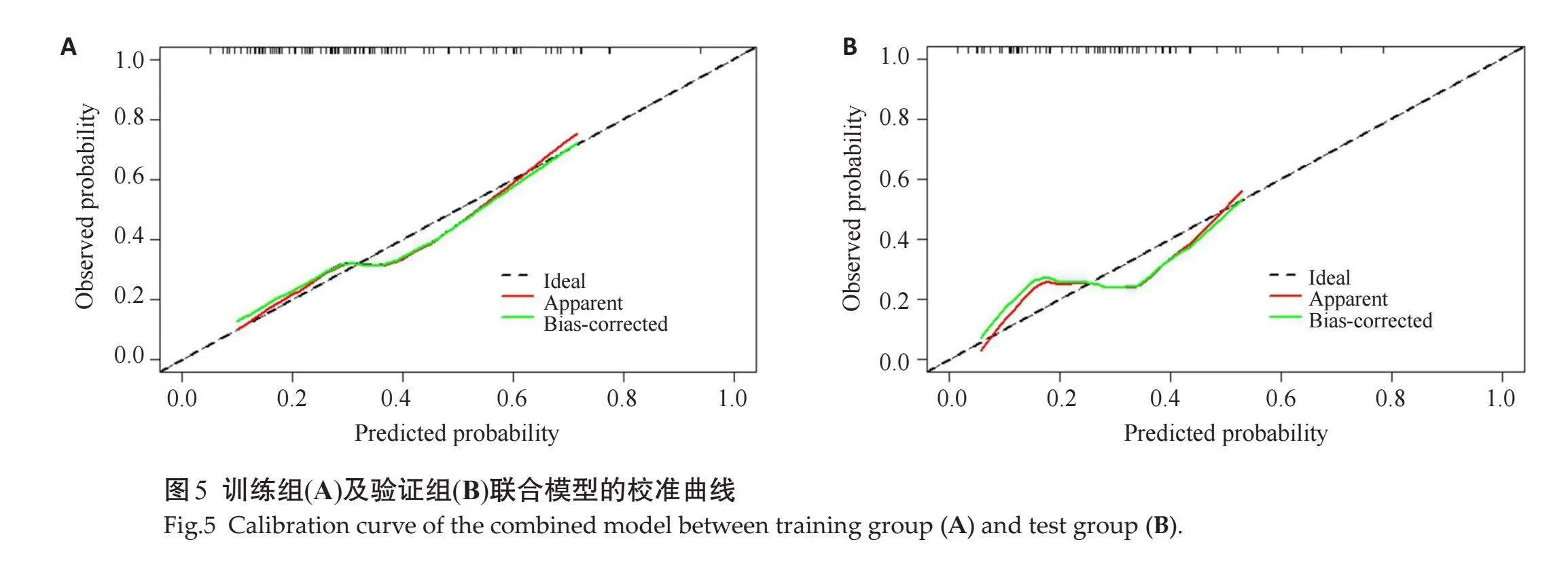
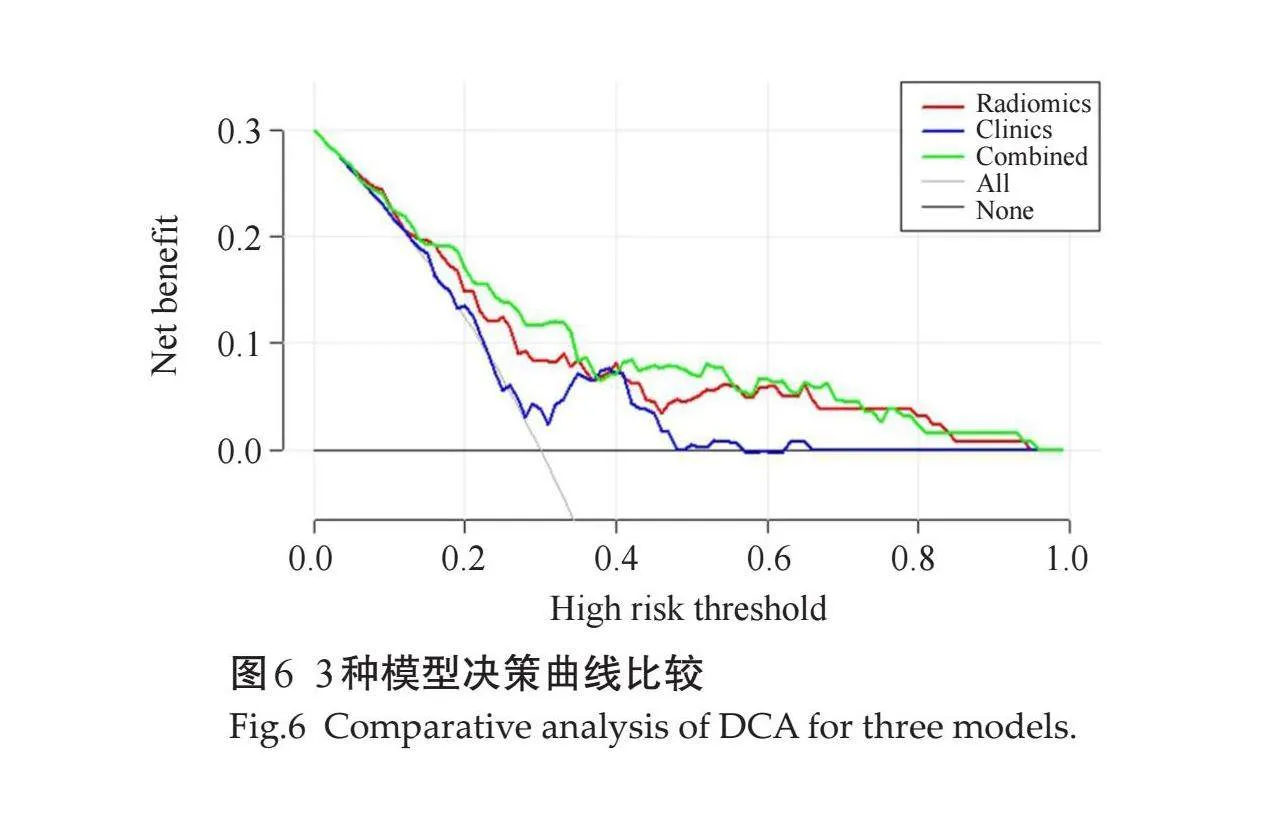
对比3种模型发现,联合模型在训练组及验证组的AUC值均高于其他两组模型,具有较好的预测性能(图4、表2);Hosmer-Lemeshow 检验显示模型的拟合度良好(Pgt;0.05),校准曲线显示模型的性能良好(图5);风险阈值为0.12~0.74时,患者临床受益度较好(图6)。
3" 讨论
HCC是原发性肝癌最常见的病理类型,约占90%以上[13],全球HCC发病率及致死率呈上升趋势,已成为全球重大的公共卫生问题[14]。尽管近年来HCC的治疗取得了一定的进步,但术后复发率仍然很高,导致临床预后较差[15]。既往研究表明,病理分化程度是HCC的独立预后因素,与高分化相比,低分化HCC复发率高,生存期短,需要扩大手术切缘和更频繁的术后随访,准确的术前病理分级预测可为个体化治疗决策选择提供理论依据[16]。然而,肝穿刺活检有时受限于操作水平和相关并发症,这限制了其在术前指导治疗决策的价值。因此,确定一种非侵入性且准确的方法来评估肿瘤的组织特征非常重要。
目前,CT增强作为诊断HCC的常规检查方法得到广泛应用。研究表明,HCC强化特点与其病理分化程度有关[17],但无法提供肿瘤深度信息,价值有限;AFP是临床上常用的检测HCC特异性肿瘤标志物,本研究分析结果显示AFP水平与HCC分化程度之间存在相关性,这与既往研究[8]结果一致,本研究中训练组中ALB、验证组中性别存在差异,不排除人群偶然性造成;在验证组中,AFP水平未表现出统计学差异,可能是因为本研究中部分AFP水平过高,导致AFP水平失衡所致。
影像组学在包括肾癌[18]、膀胱癌[19]、结直肠癌[20]等病理分级方面表现出一定的价值。研究表明,门脉期可能是MR上测量HCC的最佳选择[21],因为在动脉期,肿瘤周围的肝实质可能会发生良性反应性或灌注相关的变化,并可能在该阶段表现为短暂的充血,从而导致测量存在误差,在门脉期造影剂快速流出,且由于假包膜的强化,肿瘤边界显示更清楚,这与CT类似,因此本研究仅将门脉期图像纳入研究。本研究纳入206例HCC病灶,提取肿瘤组织门脉期CT图像影像组学特征,采用Logistic回归分析构建临床模型、影像组学模型及联合模型对HCC分化程度进行分析,结果显示,临床模型的AUC值低于影像组学模型及联合模型,联合模型AUC值最高,这表明相对于临床及影像学检查,影像组学对预测HCC分化程度具有较好的价值,临床特征联合影像组学建模效能更佳,DCA曲线也证实了联合模型具有较好的临床价值。有研究基于门脉期CT图像的影像组学特征,采用递归特征消除方法对特征进行降维并使用XGBoost分类器术前预测HCC的病理分级,可以成功区分HCC的病理分级,结果显示影像组学模型效能优于临床模型,联合临床特征效果进一步提升,提示影像组学特征与肿瘤的生物学行为之间具有潜在的关联[9],这与本研究结果相符,但该研究基于Edmondson-Steiner病理分级方法,与本研究WHO分级方法不同,结果还需要后续进一步探讨;有研究基于门脉期CT图像预测HCC病理分级,提取肿瘤二维影像组学特征,验证组AUC值为0.673[22],低于本研究结果,可能是因为本研究提取肿瘤3D特征,包含更多肿瘤内部信息;有研究基于增强MRI图像建立的逻辑回归模型AUC为0.805[23],高于本研究采用CT增强图像的AUC,因为MR图像具有较好的软组织分辨力,可提供更多肿瘤内部异质性信息,但其样本量有限,且仅提取122个影像组学特征,可能导致结果过拟合现象。
本研究通过对特征进行筛选后共得到9个最优特征,7个特征是由小波变换(n=5)和Log(n=2)的高阶特征衍生而来,小波滤波器通过不同频率信号的组合,分解图像的频率信号,反映了体素空间分布强度等级的关系,小波变换特征可较好地反映肿瘤空间异质性[24];Log特征对图像离散点和噪声较敏感,可从图像中提取具有越来越粗糙的纹理图案的区域,有助于提高图像对比度[25];这表明高阶特征包含更多肿瘤内部信息,高阶特征对构建诊断模型具有重要价值。
本研究存在以下几点局限性:不同组间的HCC样本量相对有限,将HCC分为低分化组和非低分化组,对分组不够细化;本研究是单中心回顾性研究,选择性偏倚在所难免,有待外部验证;未纳入动脉期图像,可能会丢失动脉期有效信息,有待后续进一步研究。
总之,基于增强CT图像的影像组学模型可作为术前预测HCC 组织学分级的新方法,有望对临床决策提供帮助。
参考文献:
[1]" "Forner A, Reig M, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-14.
[2]" "Tabrizian P, Jibara G, Shrager B, et al. Recurrence of hepatocellular cancer after resection: patterns, treatments, and prognosis[J]. Ann Surg, 2015, 261(5): 947-55.
[3]" "Martins-Filho SN, Paiva C, Azevedo RS, et al. Histological grading of hepatocellular carcinoma-a systematic review of literature[J]. Front Med, 2017, 4: 193.
[4]" "Sotiropoulos GC, Molmenti EP, Lösch C, et al. Meta-analysis of tumor recurrence after liver transplantation for hepatocellular carcinoma based on 1, 198 cases[J]. Eur J Med Res, 2007, 12(10): 527-34.
[5]" "Jin J, Jung HY, Lee KH, et al. Nuclear expression of hepatitis B virus X protein is associated with recurrence of early‑stage hepatocellular carcinomas: role of viral protein in tumor recurrence[J]. J Pathol Transl Med, 2016, 50(3): 181-9.
[6]" "Llovet JM, Zucman‑Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 16018.
[7]" "Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-77.
[8]" Wu MH, Tan HN, Gao F, et al. Predicting the grade of hepatocellular carcinoma based on non-contrast-enhanced MRI radiomics signature[J]. Eur Radiol, 2019, 29(6): 2802-11.
[9]" "Mao B, Zhang LZ, Ning PG, et al. Preoperative prediction for pathological grade of hepatocellular carcinoma via machine learning-based radiomics[J]. Eur Radiol, 2020, 30(12): 6924-32.
[10]" 宁培钢, 高" 飞, 海金金, 等. 基于增强CT放射组学预测肝细胞肝癌病理分级[J]. 中国医学影像技术, 2020, 36(7): 1051-6.
[11]" 彭诗涵, 卢再鸣, 由英宁, 等. 基于门脉期CT影像组学预测肝癌病理分化程度的价值[J]. 中国临床医学影像杂志, 2022, 33(5): 334-8, 349.
[12]" Shen JY, Liu JY, Li C, et al. The impact of tumor differentiation on the prognosis of HBV-associated solitary hepatocellular carcinoma following hepatectomy: a propensity score matching analysis[J]. Dig Dis Sci, 2018, 63(7): 1962-9.
[13]Kulik L, El ‑Serag HB. Epidemiology and management of hepatocellular carcinoma[J]. Gastroenterology, 2019, 156(2): 477-91.e1.
[14]" Xie DY, Ren ZG, Zhou J, et al. 2019 Chinese clinical guidelines for the management of hepatocellular carcinoma: updates and insights[J]. Hepatobiliary Surg Nutr, 2020, 9(4): 452-63.
[15]" Marrero JA, Kulik LM, Sirlin CB, et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 practice guidance by the American association for the study of liver diseases[J]. Hepatology, 2018, 68(2): 723-50.
[16]" Kim SU, Jung KS, Lee S, et al. Histological subclassification of cirrhosis can predict recurrence after curative resection of hepatocellular carcinoma[J]. Liver Int, 2014, 34(7): 1008-17.
[17]" 黄" 娟, 周翔平, 刘荣波, 等. 原发性肝癌血供特点的螺旋CT表现及其与病理学特性的相关性研究[J]. 中华放射学杂志, 2000, 34(11): 753-6.
[18]nbsp; Yi XP, Xiao Q, Zeng FY, et al. Computed tomography radiomics for predicting pathological grade of renal cell carcinoma[J]. Front Oncol, 2020, 10: 570396.
[19]" Zhang G, Xu LL, Zhao L, et al. CT-based radiomics to predict the pathological grade of bladder cancer[J]. Eur Radiol, 2020, 30(12): 6749-56.
[20]" Huang XM, Cheng ZX, Huang YQ, et al. CT-based radiomics signature to discriminate high‑grade from low‑grade colorectal adenocarcinoma[J]. Acad Radiol, 2018, 25(10): 1285-97.
[21]" Seuss CR, Kim MJ, Triolo MJ, et al. Comparison of MRI pulse sequences for prediction of size of hepatocellular carcinoma at explant evaluation[J]. AJR Am J Roentgenol, 2014, 203(2): 300-5.
[22]" 陈舒婷. 基于CT的影像组学在肝细胞癌病理分级及肝切除术预后预测的应用研究[D]. 广州: 南方医科大学, 2017.
[23]" Mao YF, Wang JC, Zhu Y, et al. Gd-EOB-DTPA-enhanced MRI radiomic features for predicting histological grade of hepatocellular carcinoma[J]. Hepatobiliary Surg Nutr, 2022, 11(1): 13-24.
[24] Zhou JL, Lu JH, Gao C, et al. Predicting the response to neoadjuvant chemotherapy for breast cancer: wavelet transforming radiomics in MRI[J]. BMC Cancer, 2020, 20(1): 100.
[25]" Meng XC, Xia W, Xie PY, et al. Preoperative radiomic signature based on multiparametric magnetic resonance imaging for noninvasive evaluation of biological characteristics in rectal cancer[J]. Eur Radiol, 2019, 29(6): 3200-9.
(编辑:郎" 朗)
