牙槽骨骨髓间充质干细胞膜片复合PCL/HA支架具有良好早期成骨效果:基于动物模型研究
2024-10-30刘亚男胡磊霍文艳王立凯王海锋

摘要:目的" 评估牙槽骨骨髓间充质干细胞膜片复合PCL/HA支架的骨缺损再生修复效果。方法" 培养牙槽骨骨髓间充质干细胞(Al-BMSCs)膜片和长骨骨髓间充质干细胞(Lon-BMSCs)膜片,熔融沉积成型技术制作PCL/HA支架。取新西兰大白兔共9只,建立双侧下颌骨缺损模型,按植入材料将其分为PCL/HA支架组(A组)、Lon-BMSCs膜片复合PCL/HA支架组(B组)、Al-BMSCs膜片复合PCL/HA支架组(C组),3组共得到18个样本,6个/组。术后4周处死动物,取下颌骨组织,行大体观察、锥形束CT分析、HE染色和Masson染色,对各组成骨情况进行分析。结果" 锥形束CT结果显示C组骨体积分数、骨小梁厚度和骨小梁数量均高于A组和B组,组间差异有统计学意义(Plt;0.05)。HE和Masson染色显示C组成骨最为活跃,有较多的新生骨和血管形成。结论" 牙槽骨骨髓间充质干细胞膜片复合PCL/HA支架具有良好的早期成骨效果,为颌面部骨缺损再生修复提供了一种新的策略。
关键词:牙槽骨骨髓间充质干细胞;细胞膜片;支架材料;骨缺损
Alveolar bone marrow mesenchymal stem cells sheet combined with PCL/HA scaffold displays better osteogenesis effect in the early healing process: based on animal models
LIU Yanan1, HU Lei2, HUO Wenyan1, WANG Likai1, WANG Haifeng1
1Department of Stomatology, Beijing Bo'ai Hospital, China Rehabilitation Research Center, Capital Medical University School of Rehabilitation Medicine, Beijing 100068, China; 2Department of Prosthodontics, Capital Medical University School of Stomatology, Beijing 100050, China
Abstract: Objective To investigate the repairing effect of alveolar bone marrow mesenchymal stem cells (Al‑BMSCs) sheet combined with PCL/HA scaffold in rabbit mandibular defects. Methods Al‑BMSCs sheets and Long bone marrow mesenchymal stem cells (Lon‑BMSCs) sheets were cultured, PCL/HA scaffolds were produced by the fused deposition modeling method. Nine New Zealand rabbits were used to establish bilateral mandibular defect models. According to the implant materials, the rabbits were divided into 3 groups: Group A (PCL/HA scaffold), group B (Lon-BMSCs sheets combined with PCL/HA scaffold), group C (Al‑BMSCs sheets combined with PCL/HA scaffold). A total of 18 samples were harvested, with 6 samples per group. All the experimental animals were sacrificed after 4 weeks. Gross observation, cone beam CT analysis, HE staining and Masson staining were used to evaluate the effect of bone regeneration. Results The results of cone beam CT showed that the value of BV/TV, Tb.Th, Tb.N in the group C were higher than that in group A and group B, and the difference was statistically significant (Plt;0.05). HE staining and Masson staining results showed that the osteogenesis in the group C was the most active, characterized by more newly formed bone and capillaries. Conclusion Al-BMSCs sheets combined with PCL/HA scaffold displays better osteogenesis effect in the early healing process, which is expected to become a new strategy for the regeneration of maxillofacial bone defects.
Keywords: alveolar bone marrow mesenchymal stem cells; cell sheet; scaffold; bone defect
外伤、手术、肿瘤切除及先天疾病等引起的颌骨缺损是临床常见病,修复骨缺损,恢复患者的口腔生理功能和美观是亟需解决问题。近年来干细胞介导的组织再生为口腔颌面部骨组织缺损提供了新的生物性修复方式[1, 2]。在组织工程领域,骨髓间充质干细胞(BMSCs)是最为常用的种子细胞之一[3, 4]。目前,髂骨骨髓抽吸物是BMSCs的主要来源,但对疼痛的恐惧和术后并发症使髂骨BMSCs不能在临床作为常规治疗使用。而在牙种植术中可无痛分离出牙槽骨来源的BMSCs(Al-BMSCs),该方法取材简便,患者更易于接受[5]。传统的组织工程策略是将种子细胞接种到模拟天然细胞外基质结构的支架材料,构成细胞-支架复合体,移植到缺损区域进行修复,但该方法组织再生效率较低[6, 7]。而细胞膜片技术可以保留细胞外基质的完整性,更好地维护和促进细胞在移植及组织再生过程中的作用[8]。既往研究多为细胞膜片单独应用促进骨再生或将长骨来源干细胞膜片与支架结合进行移植实验[9, 10],未见利用牙槽骨骨髓间充质干细胞膜片复合支架材料促进骨缺损再生相关实验。本研究旨在通过将Al-BMSCs诱导成膜片,与聚已内酯/羟基磷灰石(PCL/HA)复合支架结合,在兔下颌骨缺损区域进行骨再生研究,为临床治疗骨缺损提供实验基础和理论依据。
1" 材料与方法
1.1" 实验材料
1.1.1" 细胞" "人Al-BMSCs来自于中国康复研究中心口腔科种植牙手术患者,纳入标准:年龄30~50岁;全口牙周状况良好。排除标准:服用影响骨骼代谢类药物(如糖皮质激素、非甾体类抗炎药物等);患有骨质疏松症。患者术前需签署知情同意书,本研究经过伦理委员会批准(审批号:2018-094-1)。
在种植手术过程中,收集窝洞制备得到的骨屑复合物,用于分离培养人Al-BMSCs[3]。人长骨骨髓间充质干细胞(Lon-BMSCs)为购买的成品细胞系。
1.1.2" 支架材料" "PCL/HA复合支架由江阴瑞康健生物医学科技有限公司通过熔融沉积成型技术制作而成[11],其中PCL和HA混合比例为7:3,支架的孔隙率为49.05%,孔径为432.22±32.72 µm。PCL/HA复合支架大小为10 mm×6 mm×4 mm用于后续动物实验。
1.1.3" 实验动物" 9只新西兰白兔,雄性,6月龄,体质量2.5~3.0 kg,由北京芳元缘动物饲养场提供。
1.2" 实验方法
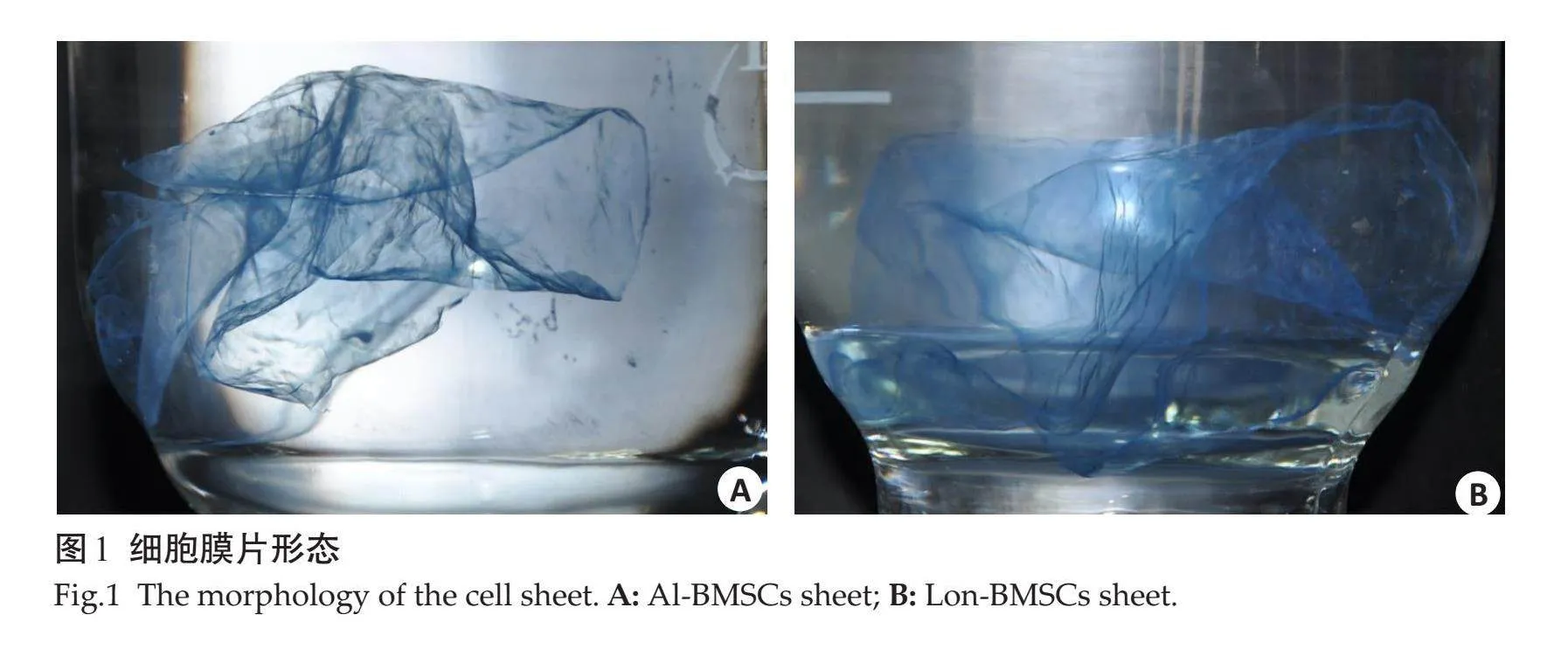
1.2.1" 人Al-BMSCs膜片和Lon-BMSCs膜片的培养" 细胞膜片培养方法同前期实验[12]。将种植手术过程中收集的骨屑分离培养原代Al-BMSCs。 将Al-BMSCs和Lon-BMSCs两种细胞分别培养、扩增、传代至第3代后,接种在60 mm大的培养皿中,待细胞基本完全贴壁,更换为成膜诱导液连续培养14 d后,培养皿底壁可见膜状物质形成,待边缘卷曲时,用镊子将细胞膜片与培养皿底壁分离,获得细胞膜片(图1)。
1.2.2" 细胞膜片包裹支架" 支架回植前,先用钴-60消毒,将支架浸泡于培养液中浸泡24 h。将已获得的Al-BMSCs膜片和Lon-BMSCs膜片包裹支架,在培养液培养24 h后植入动物体内。
1.2.3" 实验分组" 取健康新西兰大白兔9只,于双侧下颌骨上制备大小为10 mm×6 mm×4 mm的骨缺损,缺损区域给予以下处理:植入PCL/HA支架组(A组),植入Lon-BMSCs膜片+PCL/HA支架组(B组),植入Al-BMSCs膜片+PCL/HA支架组(C组),3组共得到18个样本,6个/组。
1.2.4" 手术方法" 实验动物全麻后,备皮,常规消毒铺巾,在距下颌骨下缘约1 cm处切开皮肤约2 cm,逐层切开达骨面,暴露下颌骨颊侧骨面。用快速涡轮钻在兔下颌骨上制备10 mm×6 mm×4 mm的骨缺损,生理盐水充分冲洗以降温。去除颊侧骨皮质后,截断缺损区域牙根,注意保留舌侧骨皮质的完整。按照分组植入相应材料后,分层缝合切口。一侧手术完成后,对侧进行同样的实验步骤(图2)。术后对实验动物肌肉注射青霉素,连续注射3 d。1周内每日观察伤口恢复情况,有无感染。术后4周安乐死处死实验动物行相关检查。
1.3 主要观察指标
1.3.1" 一般观察" "术后实验动物观察其基本生命体征、伤口愈合情况、饮食情况等。实验动物处死后,取下颌骨组织,避免暴力致下颌骨折断,仔细去除附着于骨表面的肌肉等组织。观察骨缺损区表面愈合情况,周围组织有无感染等并进行拍照。
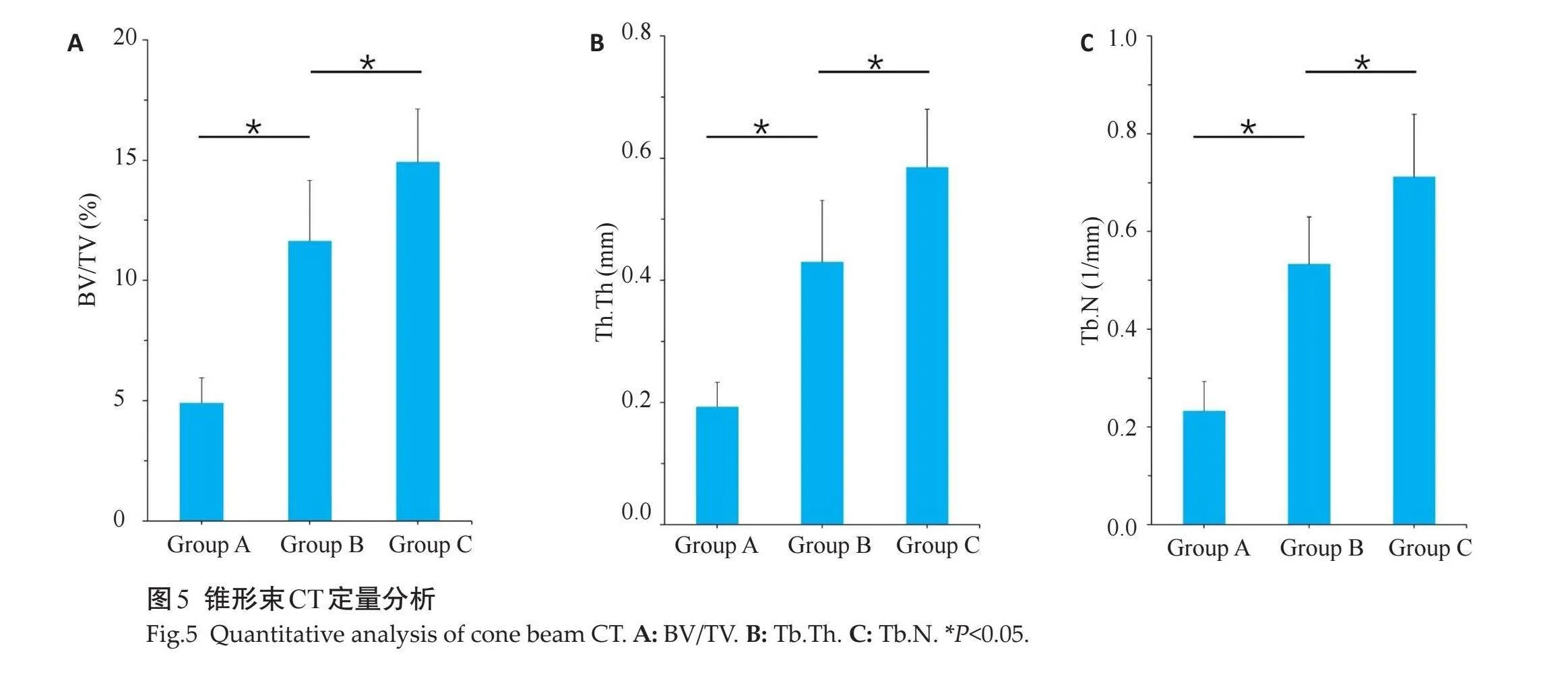
1.3.2" Micro-CT扫描" "下颌骨组织行micro-CT 扫描(Skyscan Bruker),扫描参数:电压80 kV,电流500 mA,像素分辨率8 μm。将下颌骨所制备的10 mm×6 mm×4 mm骨缺损区选中为感兴趣区域,测量分析骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)和骨小梁数量(Tb.N)。
1.3.3" 组织学检测" "在micro-CT 扫描后,下颌骨组织常规脱钙4周,石蜡包埋切片后行HE染色和Masson染色,观察缺损区域骨修复情况。
1.4" 统计学分析
采用SPSS22.0软件对数据进行统计学分析。数据均为正态分布,以均数±标准差表示,组间比较采用单因素方差分析,组间两两比较采用Bonferroni检验,以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 一般观察
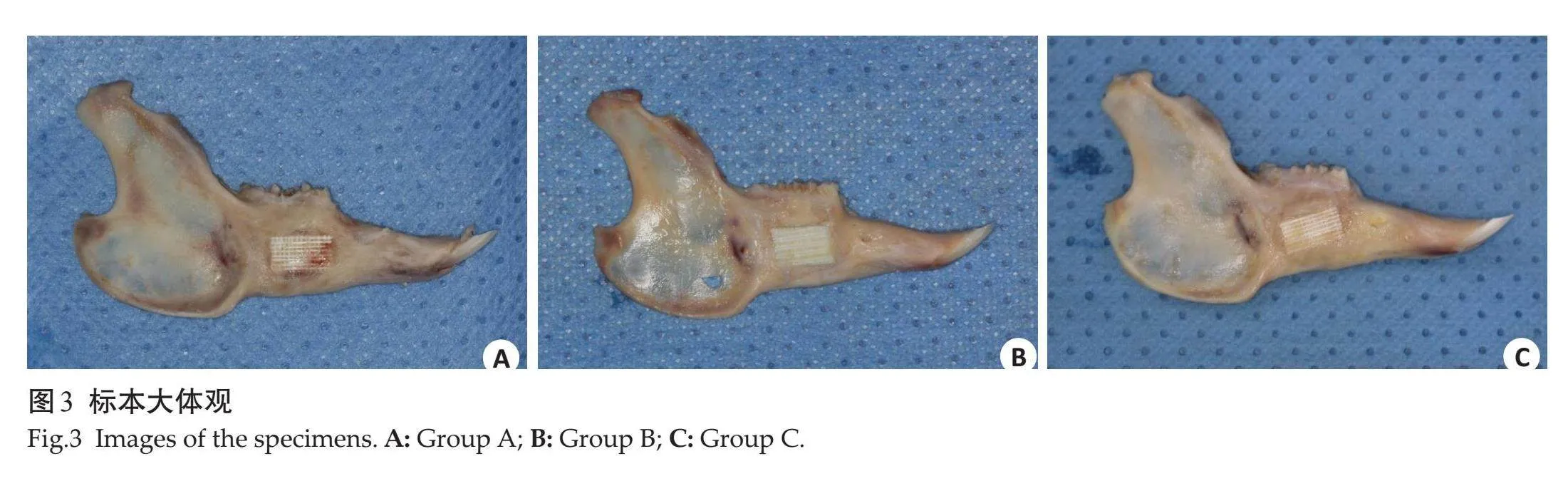
所有组实验动物术后生命体征平稳,进食良好,术区均未见明显感染。下颌骨缺损区表现出不同成骨状态,且支架材料均未完全降解。A组骨缺损处可见大量纤维软组织覆盖(图3A);B组缺损边缘可见纤维软组织与新生骨交织,缺损边界不明显(图3B);C组复合支架与缺损边缘形成部分骨结合,且新生骨长入支架孔隙中(图3C)。
2.2" Micro-CT检测
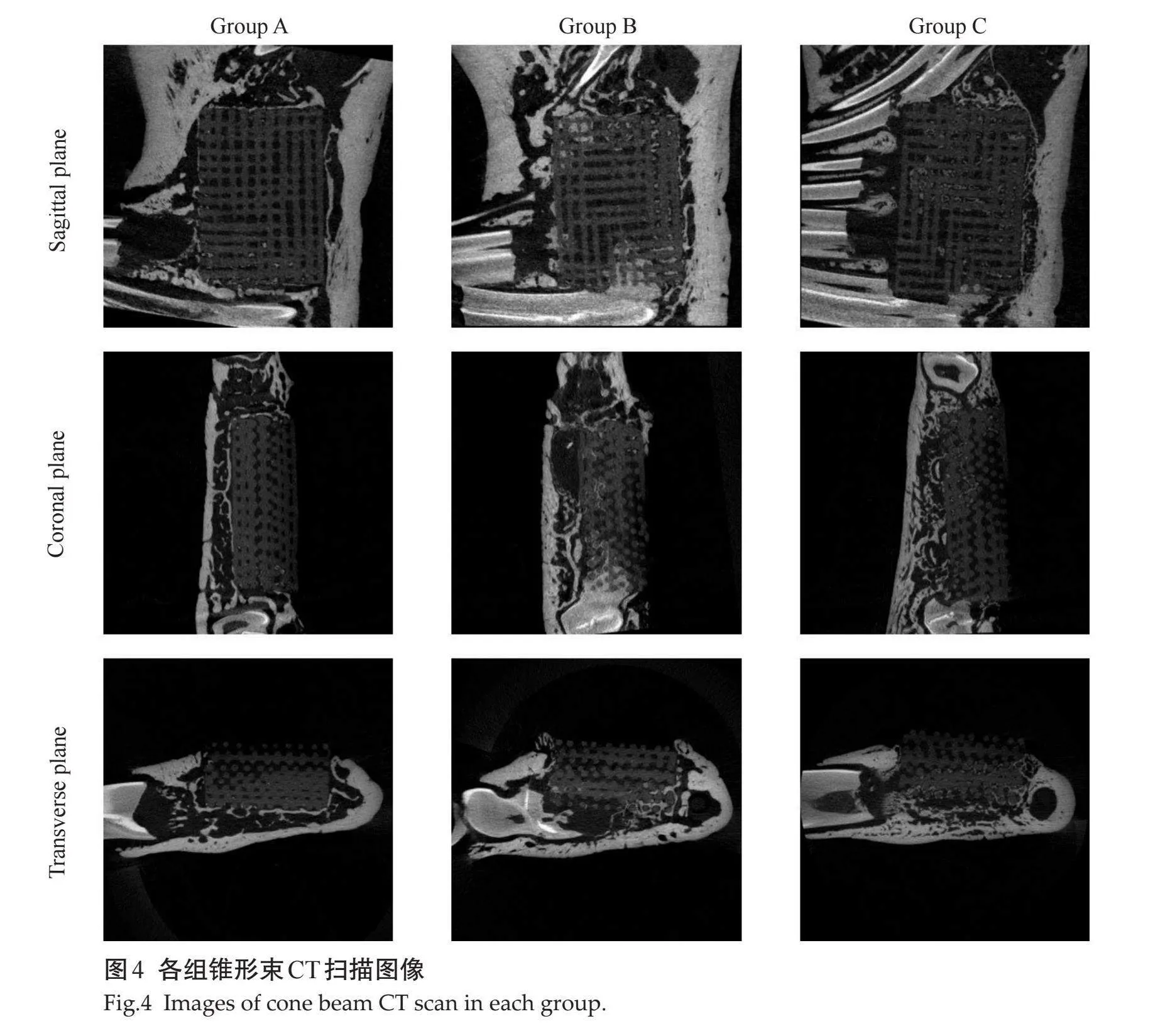
3组样本的micro-CT 扫描结果与大体观察基本一致,发现各组骨缺损均有不同程度的再生。A组仅缺损边缘有少量新生骨,B组边界处有条索样新生骨组织,C组可见骨样组织从边缘深入中央,在支架材料内部可见片状新生骨(图4)。对新生骨组织进行相关定量分析,B组和C组的BV/TV、Tb.Th、Tb.N高于A组,且C组高于B组,差异有统计学意义(Plt;0.05,图5)。
2.3" 组织学观察
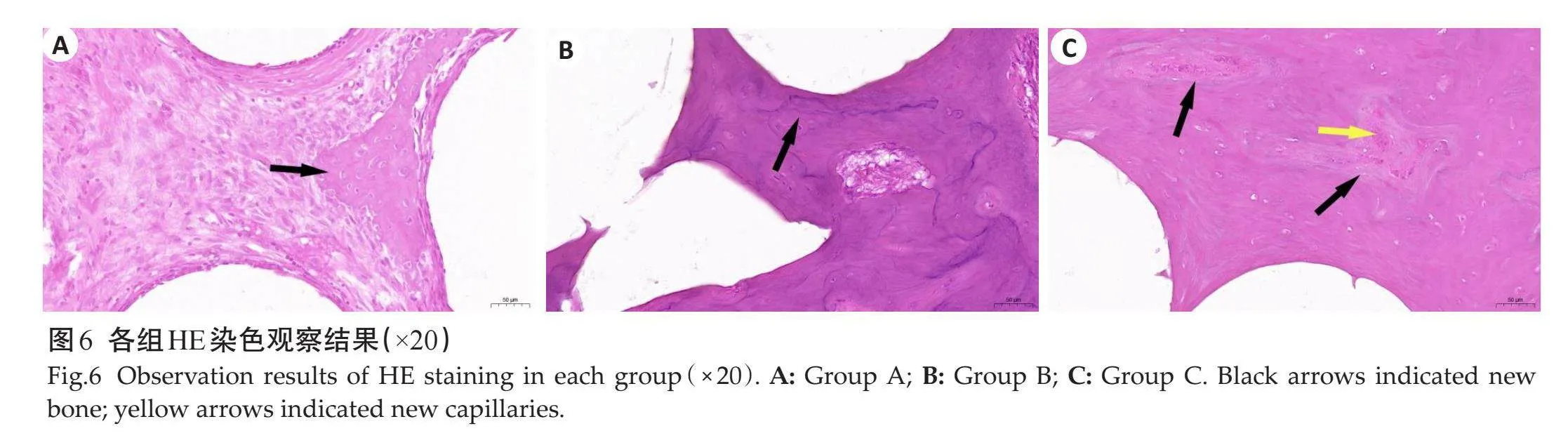
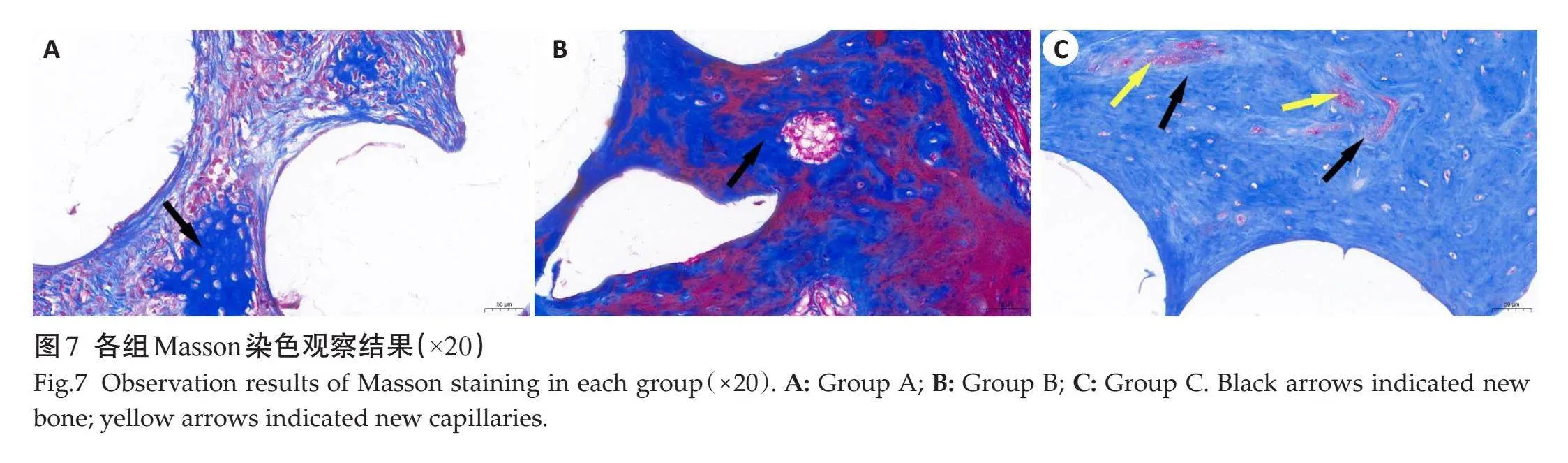
HE染色(图6)和Masson染色(图7)并行组织学观察,结果均显示:各组内均可见支架未完全吸收,不同组别新骨形成程度不同。A组缺损边缘有散在新骨形成,可见大量增生的不规则纤维组织,未见成熟骨小梁结构(图6A、7A);B组可见成熟骨组织,缺损区内可见一些成熟骨小梁样组织形成(图6B、7B);C组内成骨细胞最为活跃,可见大量骨细胞,有丰富新生血管,骨小梁数目更多,排列更为致密(图6C、7C)。
3" 讨论
近年来,以间充质干细胞介导的骨缺损修复再生已在骨组织工程中得到广泛应用。目前用于骨修复再生的BMSCs通常来源于长骨,但因其取材过程中造成的创伤、疼痛和术后并发症等阻碍了其临床推广应用。而从牙槽骨获取BMSCs,具有间充质干细胞相同的表面标志、增殖及多向分化能力[13]。与Lon-BMSCs相比,其取材简便,无需开辟第二术区,在拔除患牙或种植的同时即可取材,对患者的创伤较小,临床接受度高,目前已被广泛研究[14, 15]。课题组前期研究发现人Al-BMSCs比Lon-BMSCs具有更高的成骨分化能力,将两种来源的间充质干细胞诱导成细胞膜片后,体内外实验结果均表明Al-BMSCs膜片组新骨形成更多,这说明以Al-BMSCs膜片为基础的组织再生是一种有效的颌面骨缺损的修复方法。但对于大块骨缺损单纯使用间充质干细胞仅可实现部分骨再生,其原因为缺乏可供间充质干细胞生长的支架[16]。而具有生物活性的“种子细胞+生物支架”复合体已逐渐成为修复大面积骨组织缺损的主要手段[17, 18]。当种子细胞诱导成膜片后,其保留了细胞因子,细胞间蛋白,离子通道等细胞外基质,且与游离细胞悬液相比,膜片能够分泌更多血管生成因子,使移植存活时间明显延长,从而更有效促进缺损区域的再生修复[19, 20]。有研究发现将骨髓间充质干细胞膜片与β-TCP/COL-I支架复合后,与单纯支架组和细胞悬液复合支架组作对比,体内外实验结果均表明膜片复合支架成骨能力更强[10];另有研究将BMSCs膜片包裹PLGA支架植入到比格犬下颌骨缺损处,结果显示其成骨能力显著优于单纯支架组,在术后16周实验组观察到大量新生哈弗系统和板层骨且新生骨密度更高[21]。这均与本研究结果一致,细胞膜片的加入为骨再生提供了一个兼有细胞、细胞外基质以及周围生物活性分子的微环境,有效促进了新生骨形成。
在检测方面,选用了micro-CT评估各组新生骨量的差异。Micro-CT 扫描已被广泛应用于各种实验动物骨缺损修复再生的研究。其通过micro-CT 扫描仪内置软件进行重建,同时基于三维方向计算出新生骨组织相关检测指标[22]。本研究结果显示,三组移植物新生骨量具有差异,Al-BMSCs膜片复合支架组的骨体积分数、骨小梁厚度和骨小梁数目多于其他两组。在组织学分析中同样显示Al-BMSCs膜片复合支架组形成新骨最多,成骨最为活跃,骨小梁数目更多,排列更为致密。因此Al-BMSCs膜片复合PCL/HA支架材料在兔下颌骨缺损修复中效果优于其他两组。
两种膜片在体内显示出不同骨再生效果,是因为Al-BMSCs和Lon-BMSCs无论从细胞来源还是成骨发育的历程均有所不同。有研究将大鼠Al-BMSCs和Lon-BMSCs与明胶结合回植体内,结果显示Al-BMSCs组形成更多、更大的钙化结节和成熟的板层骨,该研究认为Al-BMSCs具有更高的成骨潜能[23]。而从颌面部骨骼获得的移植物,用来修复颌面部的缺损,要比四肢骨来源的移植物修复效果更好,这表明来源于不同骨骼部位的细胞具有特异性差异,会影响移植后的修复效果[24, 25],而在本研究中Al-BMSCs膜片组骨再生效果更好,也证实了以上结论。另外,在分子生物学上研究发现,颌面部和四肢骨再生过程具有差异。其中Hox基因可以调控MSCs的增殖和颌面部及牙齿的发育过程,在下颌骨周围微环境中Al-BMSCs为Hox阴性表达,但将其移植到胫骨缺损处时,Hox呈阳性表达。相反,Lon-BMSCs为Hox阳性表达,即使将其移植到Hox表达阴性的下颌骨缺损中仍能维持Hox阳性状态[26]。Hox基因在供体细胞和受体区的差异表达,使移植的BMSCs不能分化为成骨细胞,影响骨再生的效果,这种选择性的机制表明来源于颌面部和四肢骨的BMSCs在组织修复过程中是不可互相替换。因此,在骨组织工程修复中,应充分考虑BMSCs的胚层来源,以达到最好的修复效果。
本研究将人BMSCs移植进入新西兰大白兔体内,为异种移植,需要考虑是否会发生免疫排斥反应。既往研究表明将人BMSCs植入兔椎间盘或颌骨缺损区域等未发生明显排斥反应[27, 28]。而在本实验中,实验动物术后精神状态良好,饮食排便情况正常,在整个实验周期内实验动物均未出现伤口红肿感染等免疫排斥反应。这表明BMSCs具有低免疫原性,这使其在进行同种异体或异种移植时,不产生或只有极低的免疫排斥反应,并能促进各种组织的再生[29, 30]。
综上所述,本研究创新性利用Al-BMSCs膜片复合支架材料促进颌骨缺损修复,研究结果有助于揭示其作为口腔临床骨缺损新的修复方式,在骨组织工程中具有广阔的应用前景。
参考文献:
[1]" "Andalib N, Kehtari M, Seyedjafari E, et al. In vivo bone regeneration using a bioactive nanocomposite scaffold and human mesenchymal stem cells[J]. Cell Tissue Bank, 2021, 22(3): 467-77.
[2]" "Koons GL, Diba M, Mikos AG. Materials design for bone-tissue engineering[J]. Nat Rev Mater, 2020, 5: 584-603.
[3]" "Dunn CM, Kameishi S, Grainger DW, et al. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell‑based therapies[J]. Acta Biomater, 2021, 133: 114-25.
[4]" "Shang FQ, Yu Y, Liu SY, et al. Advancing application of mesenchymal stem cell-based bone tissue regeneration[J]. Bioact Mater, 2021, 6(3): 666-83.
[5]" "Mason S, Tarle SA, Osibin W, et al. Standardization and safety of alveolar bone-derived stem cell isolation[J]. J Dent Res, 2014, 93(1): 55-61.
[6]" "Daley WP, Yamada KM. ECM-modulated cellular dynamics as a driving force for tissue morphogenesis[J]. Curr Opin Genet Dev, 2013, 23(4): 408-14.
[7]" "Akahane M, Shigematsu H, Tadokoro M, et al. Scaffold-free cell sheet injection results in bone formation[J]. J Tissue Eng Regen Med, 2010, 4(5): 404-11.
[8]" "Liu YH, Ming LG, Luo HL, et al. Integration of a calcined bovine bone and BMSC-sheet 3D scaffold and the promotion of bone regeneration in large defects[J]. Biomaterials, 2013, 34(38): 9998-10006.
[9]" "Shi L, Tee BC, Cotter L, et al. Enhance mandibular symphyseal surface bone growth with autologous mesenchymal stem cell sheets: an animal study[J]. Aesthetic Plast Surg, 2020, 44(1): 191-200.
[10] Lin J, Shao JQ, Juan L, et al. Enhancing bone regeneration by combining mesenchymal stem cell sheets with β-TCP/COL-I scaffolds[J]. J Biomed Mater Res B Appl Biomater, 2018, 106(5): 2037-45.
[11]" Tian LJ, Zhang ZT, Tian B, et al. Study on antibacterial properties and cytocompatibility of EPL coated 3D printed PCL/HA composite scaffolds[J]. RSC Adv, 2020, 10(8): 4805-16.
[12]" Liu YN, Wang HF, Dou HX, et al. Bone regeneration capacities of alveolar bone mesenchymal stem cells sheet in rabbit calvarial bone defect[J]. J Tissue Eng, 2020, 11: 2041731420930379.
[13]" Ye J, Gong P, Zhou FJ, et al. Culture and identification of human bone marrow mesenchymal stem cells from alveolar ridge dental implant site[J]. J Craniofac Surg, 2013, 24(5): 1539-43.
[14] Liu X, Lv SY, Kan WJ, et al. Human alveolar bone-derived mesenchymal stem cell cultivation on a 3D-printed PDLLA scaffold for bone formation[J]. Br J Oral Maxillofac Surg, 2023, 61(8): 527-33.
[15]Cao C, Tarlé S, Kaigler D. Characterization of the immunomodulatory properties of alveolar bone-derived mesenchymal stem cells[J]. Stem Cell Res Ther, 2020, 11(1): 102.
[16] Xu XY, Li X, Wang J, et al. Concise review: periodontal tissue regeneration using stem cells: strategies and translational considerations[J]. Stem Cells Transl Med, 2019, 8(4): 392-403.
[17]" Lau CS, Chua J, Prasadh S, et al. Alveolar ridge augmentation with a novel combination of 3D-printed scaffolds and adipose-derived mesenchymal stem cells-a pilot study in pigs[J]. Biomedicines, 2023, 11(8): 2274.
[18]" Kido HW, Gabbai-Armelin PR, Magri A, et al. Bioglass/collagen scaffolds combined with bone marrow stromal cells on bone healing in an experimental model in cranial defects in rats[J]. J Biomater Appl, 2023, 37(9): 1632-44.
[19] Takeuchi R, Kuruma Y, Sekine H, et al. In vivo vascularization of cell sheets provided better long-term tissue survival than injection of cell suspension[J]. J Tissue Eng Regen Med, 2016, 10(8): 700-10.
[20] Banimohamad-Shotorbani B, Karkan SF, Rahbarghazi R, et al. Application of mesenchymal stem cell sheet for regeneration of craniomaxillofacial bone defects[J]. Stem Cell Res Ther, 2023, 14(1): 68.
[21] Du CH, Yao C, Li NY, et al. Cell sheet-engineered bones used for the reconstruction of mandibular defects in an animal model[J]. Exp Ther Med, 2015, 10(6): 2216-20.
[22] Perilli E, Le V, Ma B, et al. Detecting early bone changes using in vivo micro-CT in ovariectomized, zoledronic acid-treated, and sham-operated rats[J]. Osteoporos Int, 2010, 21(8): 1371-82.
[23] Aghaloo TL, Chaichanasakul T, Bezouglaia O, et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells[J]. J Dent Res, 2010, 89(11): 1293-8.
[24] Weber M, Wehrhan F, Deschner J, et al. The special developmental biology of craniofacial tissues enables the understanding of oral and maxillofacial physiology and diseases[J]. Int J Mol Sci, 2021, 22(3): 1315.
[25] Solidum JGN, Jeong Y, Heralde F 3rd, et al. Differential regulation of skeletal stem/progenitor cells in distinct skeletal compartments[J]. Front Physiol, 2023, 14: 1137063.
[26] Leucht P, Kim JB, Amasha R, et al. Embryonic origin and Hox status determine progenitor cell fate during adult bone regeneration[J]. Development, 2008, 135(17): 2845-54.
[27] Tao H, Lin YZ, Zhang GQ, et al. Experimental observation of human bone marrow mesenchymal stem cell transplantation into rabbit intervertebral discs[J]. Biomed Rep, 2016, 5(3): 357-60.
[28] Wang X, Xing HL, Zhang GL, et al. Restoration of a critical mandibular bone defect using human alveolar bone-derived stem cells and porous nano-HA/collagen/PLA scaffold[J]. Stem Cells Int, 2016, 2016: 8741641.
[29] Peer BA, Bhat AR, Shabir U, et al. Comparative evaluation of fracture healing potential of differentiated and undifferentiated guinea pig and canine bone marrow‑derived mesenchymal stem cells in a guinea pig model[J]. Tissue Cell, 2022, 76: 101768.
[30] Bist D, Pawde AM, Amarpal, et al. Evaluation of canine bone marrow-derived mesenchymal stem cells for experimental full-thickness cutaneous wounds in a diabetic rat model[J]. Expert Opin Biol Ther, 2021, 21(12): 1655-64.
(编辑:林" 萍)
