利用MRI影像组学模型可有效预测乳腺癌前哨淋巴结转移
2024-10-30李新华卢振东丁慧张娜伍康伟陈庞富罗文暄
摘要:目的" 探索基于不同乳腺MRI序列联合临床病理因素的MRI影像组学模型预测乳腺癌前哨淋巴结转移的潜在价值。方法" 回顾性分析182例经病理确诊为乳腺癌伴前哨淋巴结转移状态患者,其中前哨淋巴结转移阳性组91例,前哨淋巴结转移阴性组91例,并按7:3的比例分训练组(阳性组64例、阴性组64例)和验证组(阳性组27例、阴性组27例)。对乳腺癌患者的临床、影像及病理资料进行单因素和多因素Logistic回归分析并筛选出与乳腺癌前哨淋巴结转移相关的独立风险因素;基于T2WI、弥散加权成像、动态对比增强提取最佳影像组学特征,分别构建多个单、多序列影像组学标签评分,并结合临床、病理及影像特征独立风险因素建立影像组学联合预测模型。绘制ROC曲线,计算曲线下面积,评价各模型预测乳腺癌前哨淋巴结转移的效能。结果" 瘤周水肿(Plt;0.001)、肿瘤长径(Plt;0.001)、肿瘤短径(Plt;0.001)、病理分级(Plt;0.001)、脉管侵犯(Plt;0.001)、毛刺征(P=0.006)、弥散加权成像边缘高信号征(P=0.028)及表观弥散系数值(Plt;0.001)为乳腺癌前哨淋巴结转移的独立临床病理因素。在影像组学标签评分中,T2WI+弥散加权成像+动态对比增强联合序列的影像组学标签评分预测效能最佳,其验证组曲线下面积为0.744,进一步联合临床、病理及影像特征独立风险因素建立的影像组学联合预测模型的预测效能得到进一步提高,其验证组曲线下面积为0.834。结论" 基于乳腺MRI的影像组学模型在术前能够有效预测乳腺癌前哨淋巴结的转移。
关键词:磁共振成像;乳腺癌;前哨淋巴结;影像组学
Breast MRI‑based imaging radiomic model can effectively predict sentinel lymph node metastasis in breast cancer prior to surgery
LI Xinhua1, LU Zhendong1, DING Hui1, ZHANG Na2, WU Kangwei1, CHEN Pangfu1, LUO Wenxuan1
1Department of Radiation, 2Department of Obstetrics and Gynecology, Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China
Abstract: Objective To explore the potential value of radiomics model based on different MRI sequences of breast combined with clinicopathological factors in predicting sentinel lymph node metastasis of breast cancer. Methods We retrospectively analyzed 182 cases of breast cancer with sentinel lymph node metastasis diagnosed by pathology, including 91 in the sentinel lymph node positive group and 91 in the sentinel lymph node negative group, and divided them into a training group (64 positive and 64 negative) and a validation group (27 positive and 27 negative) according to the ratio of 7:3. The clinical, imaging and pathological data of breast cancer patients were analyzed by univariate and multivariate logistic regression, and the independent risk factors related to sentinel lymph node metastasis of breast cancer were screened out. Based on T2WI, diffusion-weighted imaging and dynamic contrast enhancement, the best imaging features were extracted, and several single-sequence and multi-sequence radiomics label scores were constructed respectively, and the combined radiomics prediction model was constructed combined with the above independent risk factors of clinical, pathological and imaging features. The effectiveness of each model in predicting breast cancer sentinel lymph node metastasis was evaluated by plotting the ROC curves and calculating the area under the curve (AUC). Results Peritumoural edema (Plt;0.001), tumour long diameter (Plt;0.001), tumour short diameter (Plt;0.001), pathological grade (Plt;0.001) and vascular infiltration (Plt;0.001), burr sign (P=0.006), diffusion-weighted imaging rim high signal sign (P=0.028) and ADC value (Plt;0.001) were the independent clinicopathological factors of anterior sentinel lymph node metastasis in breast cancer. Among the radiomics label scores, the multi-sequence radiomics label score of T2WI+ diffusion-weighted imaging+dynamic contrast enhancement had the best predictive efficiency, its AUC in the validation group was 0.744, and the predictive efficiency of the combined radiomics prediction model established by combining clinical, pathological and imaging feature independent risk factors had been further improved, and its AUC in the validation group was 0.834. Conclusion The breast MRI-based imaging radiomic model can effectively predict sentinel lymph node metastasis in breast cancer prior to surgery.
Keywords: magnetic resonance imaging; breast cancer; sentinel lymph node; radiomics
收稿日期:2023-08-31
基金项目:湛江市科技攻关计划项目(2022B01053)
作者简介:李新华,硕士,主治医师,E-mail: 18718303516@163.com
通信作者:罗文暄,硕士,主治医师,E-mail: 378590588@qq.com
乳腺癌已经成为女性的众癌之首[1-2],其主要死因是远处转移以及局部复发,其中前哨淋巴结(SLN)转移是最关键转移途径[3]。SLN状态是乳腺癌患者预后的关键因素,并对临床医生对病情的判定及最终临床治疗方案的选择产生影响,包括确定术中清扫范围及新辅助化疗方案的选择[4-6]。乳腺癌淋巴结转移的金标准是SLN穿刺或手术病理活检,但SLN活检术具有创伤性,容易导致淋巴水肿、肌力下降和感觉障碍等并发症,造成患者的生活质量下降[5, 7]。在乳腺诸多的传统影像学检查手段中,MRI无辐射及创伤,具有多参数、多方位成像、组织分辨率高及信息丰富等优势,在临床上被广泛应用于乳腺癌早期诊断、术前指导手术方案制订和疗效评估[8]。影像组学能提取肿瘤中人类肉眼无法察觉到的高通量图像异质性信息,在指导临床诊疗方案制定及预后预测方面影像组学具有独特能力及巨大潜能[9-10]。
自影像组学兴起后,已有基于MRI的影像组学预测乳腺癌SLN转移的相关研究,但大部分研究是基于MRI单序列的研究,或者是没有联合临床资料、病理结果及一般影像特征建立的影像组学预测模型的研究。然而单序列的影像组学难以全面反映出乳腺癌与SLN转移相关丰富而复杂的异质性及生物学信息;部分临床、病理信息、一般影像特征与乳腺癌SLN状态有关,甚至是独立的预测因子。本研究基于MRI不同序列和联合序列的影像标签评分及联合临床资料、病理结果及一般影像特征建立更高效能的预测乳腺癌SLN转移的预测模型,现报道如下。
1" 资料与方法
1.1" 一般资料
本回顾性研究经广东医科大学附属医院机构审查委员会批准(批准文号:PJKT2023-087)。回顾性收集2015年3月26日~2022年11月24日于广东医科大学附属医院放射影像中心进行乳腺磁共振扫描检查并且经穿刺和(或)手术病理证实的182例乳腺癌患者的临床、病理及影像资料。患者均为女性,年龄21~78(47±10.60)岁,其中91例患者存在SLN转移,91例患者无SLN转移。纳入标准:手术时间在乳腺MRI检查2周内进行;仅限于肿块或结节型单病灶;既往无放化疗及内分泌治疗。排除标准:磁共振检查前已穿刺活检;患者既往有放射、化学药物治疗及乳腺肿瘤手术史;临床病理资料不全;图像资料质量差。记录患者临床资料、病理结果及形态学特征,包括年龄、乳腺腺体类型、病理组织学分级、脉管侵犯、人表皮生长因子受体-2(HER-2)、孕激素受体(PR)、增殖细胞核抗原-67(Ki-67)和雌激素受体(ER)的情况、时间-信号强度曲线(TIC)类型、弥散加权成像(DWI)边缘高信号征、磁共振波谱成像(MRS)-Cho峰、瘤周水肿、边缘强化征、肿瘤长径、肿瘤短径、肿瘤长径/短径比例和表观弥散系数(ADC)值。检查前患者均签署知情同意书。
1.2" 仪器与方法
采用GE Discovery MR 750 3.0T磁共振设备及专用8通道乳腺相控阵线圈扫描。扫描参数:T2WI:TR 5139.0 ms,TE 85.0 ms,层厚4.0 mm,层间距1 mm,矩阵320×320;DWI:TR 5500 ms,TE 60.6 ms,层厚4.0 mm,层间距1 mm,b值为1000 s/mm2;DCE-MRI:乳腺容积成像,动态增强前先扫蒙片,再经肘静脉团注Gd-DTPA 20 mL(0.3 mm/kg),注射速率为3.0 mL/s,注入对比剂后采用三维快速梯度回波序列连续扫描7期,每个时相采集60 s,扫描参数:TR 6.1 ms,TE 3.0 ms,矩阵448×350,层厚1.4 mm,层数112层,FOV:3.3 cm×3.3 cm;MRS:TR 700 ms,TE 120 ms。乳腺MRI影像学特征由具备乳腺影像诊断经验的高年资主治医师和副主任医师独立分析,并记录乳腺癌病灶影像学特征,当出现分歧时共同讨论得出结论。另由2位医师采用双盲法利用A.K.影像组学后处理软件在T2WI、DWI及DCE强化最显著期分割肿瘤三维区域作为感兴趣区(ROI),提取肿瘤影像学特征。2位影像医师提取影像组学纹理特征的一致性通过组内相关系数(ICC)来评价,剔除ICClt;0.75的特征。病理资料在病理系统收集。
1.3" 统计学分析及构建模型
采用SPSS26.0统计软件对患者临床、病理及影像特征行统计分析。符合正态分布的数据用均数±标准差表示,符合偏态分布的数据则用中位数(上下四分位数)表示。符合正态分布且方差齐的计量资料组间比较采用独立样本t检验;若符合偏态分布或方差不齐,组间采用秩和检验。所有计数资料以n(%)表示,组间比较采用卡方检验。影像组学数据在IPMs数据分析统计平台进行统计分析;在测试组中通过单因素特征筛选和多因素特征筛选进行筛选出最佳影像特征,其中单因素筛选包括根据自变量与自变量的相关系数筛选、根据自变量与因变量的相关系数筛选)、根据方差筛选、单因素逻辑回归进行分析,多因素筛选包括降维至选定主成分、采用逐步逻辑回归进行分析及保留对分类贡献大的自变量方法。根据最佳影像组学特征建立单序列及多序列影像组学标签,并联合临床、病理及影像特征建立影像组学联合预测模型。绘制ROC曲线,计算曲线下面积(AUC),评估各影像组学标签评分及影像组学联合模型预测乳腺癌SLN转移的效能。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 患者临床、病理及影像特征
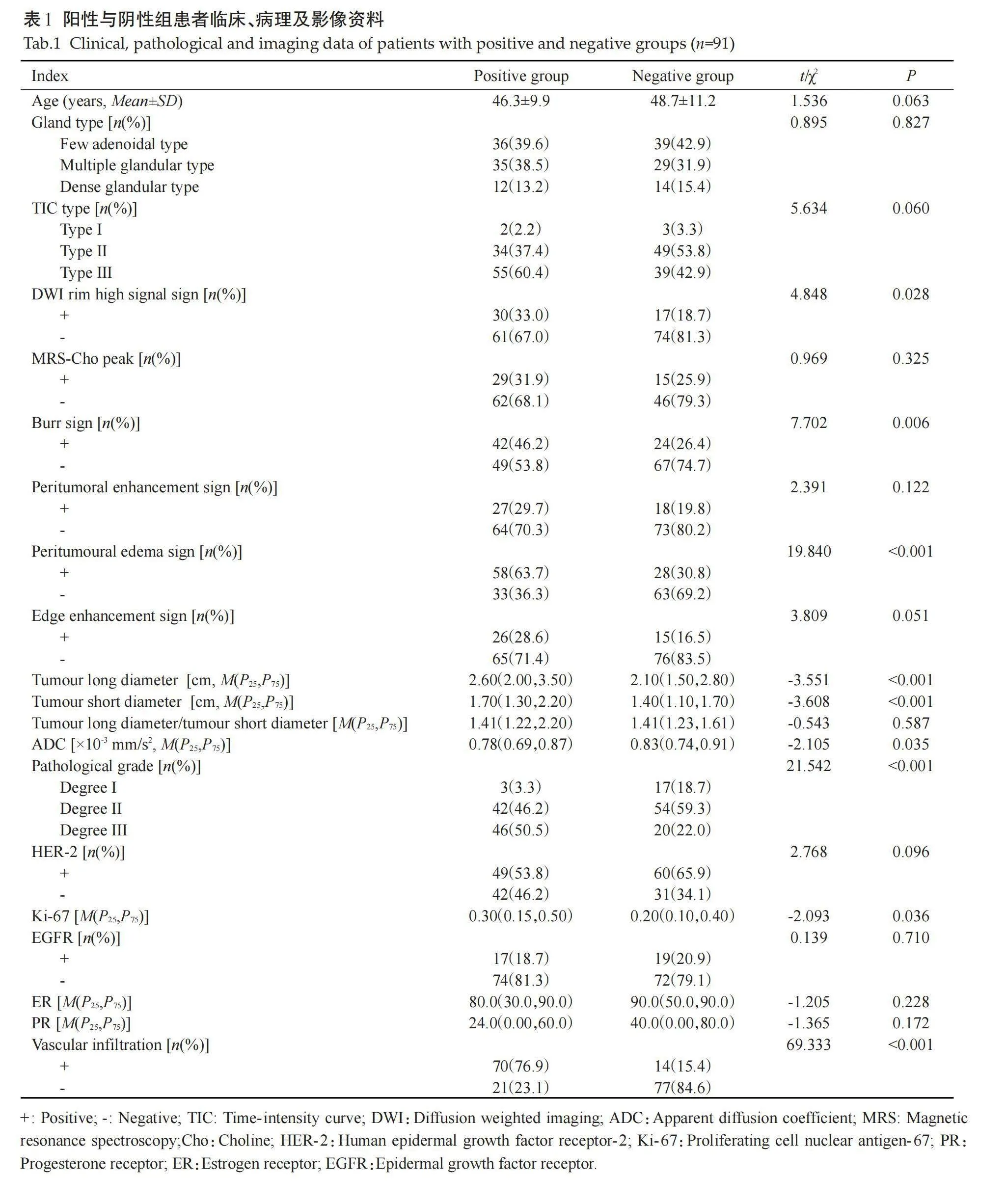
SLN转移阳性组和SLN转移阴性组患者的病理组织学分级、脉管侵犯、Ki-67、瘤周水肿、肿瘤长径、肿瘤短径、毛刺征、DWI边缘高信号征、边缘强化征及ADC值的差异有统计学意义(Plt;0.05),其他特征的差异无统计学意义(Pgt;0.05,表1)。
2.2" 建立影像组学标签评分
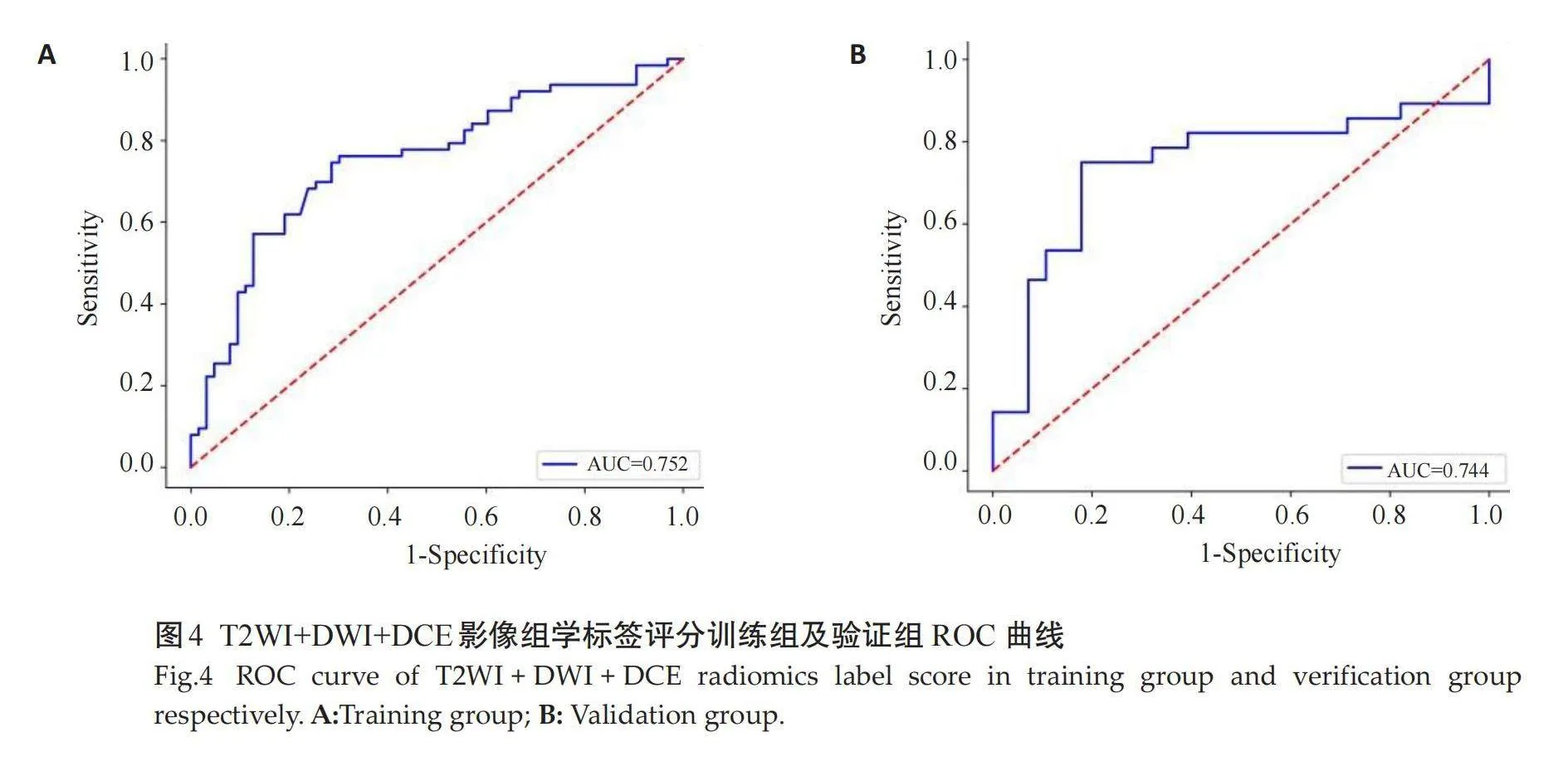
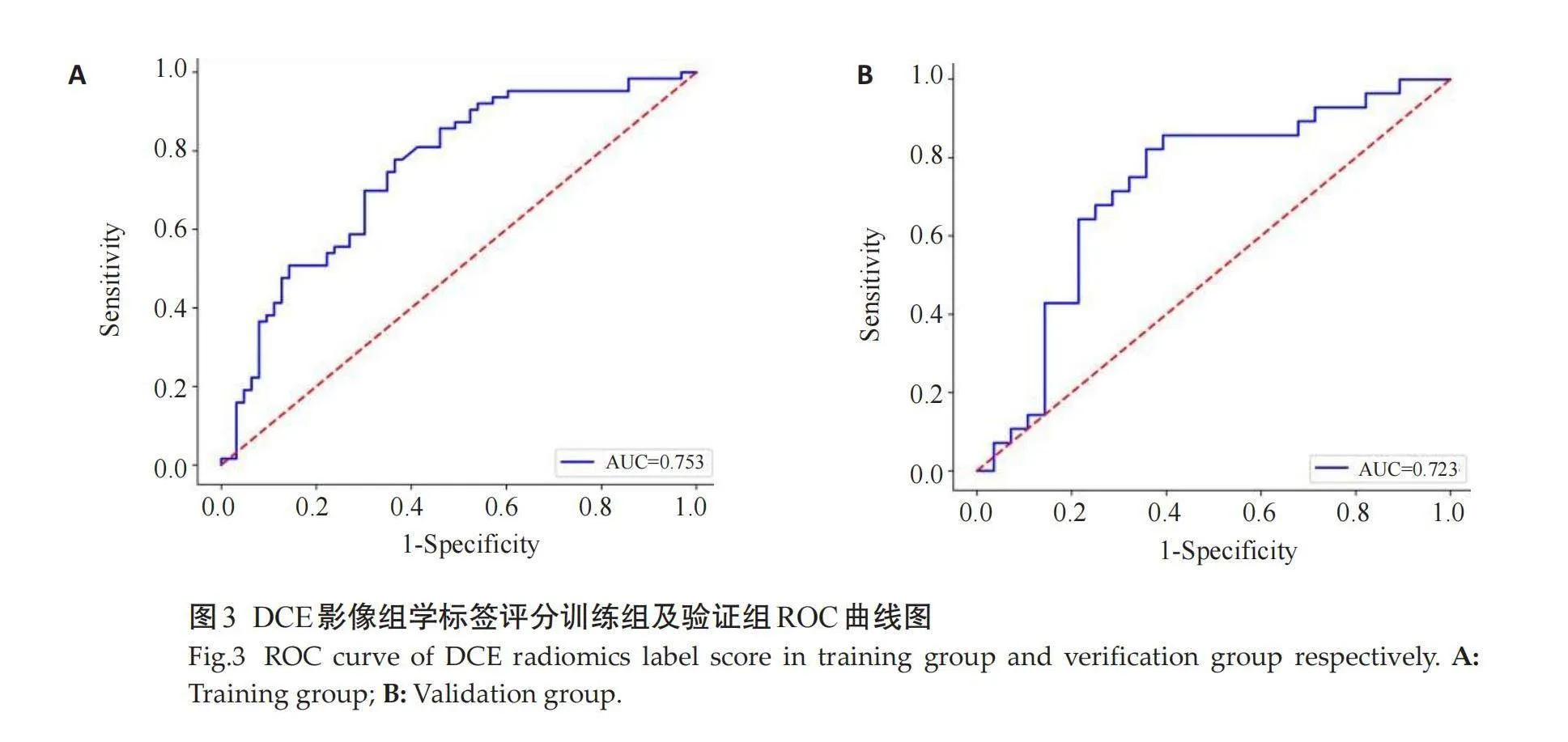
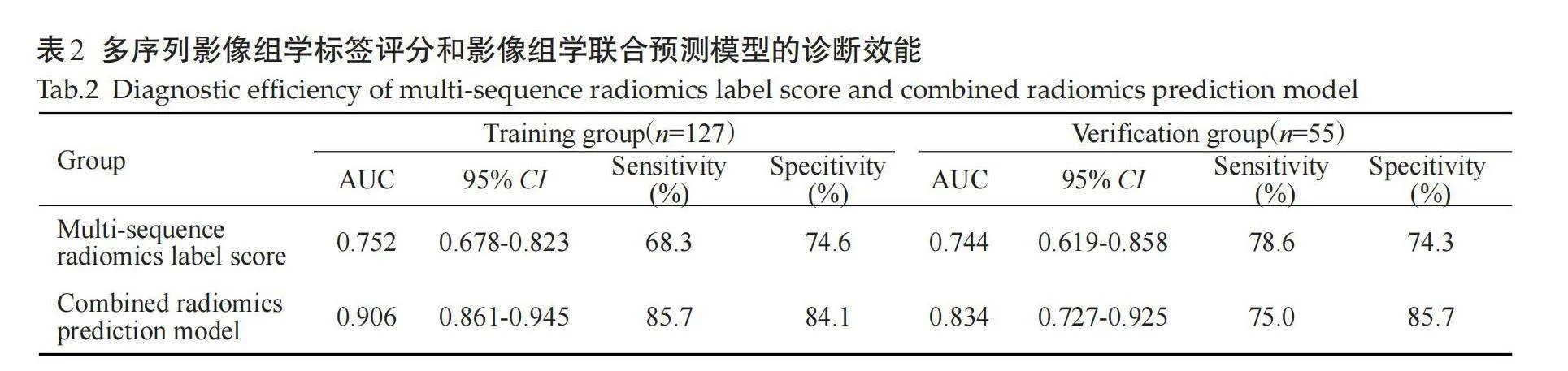
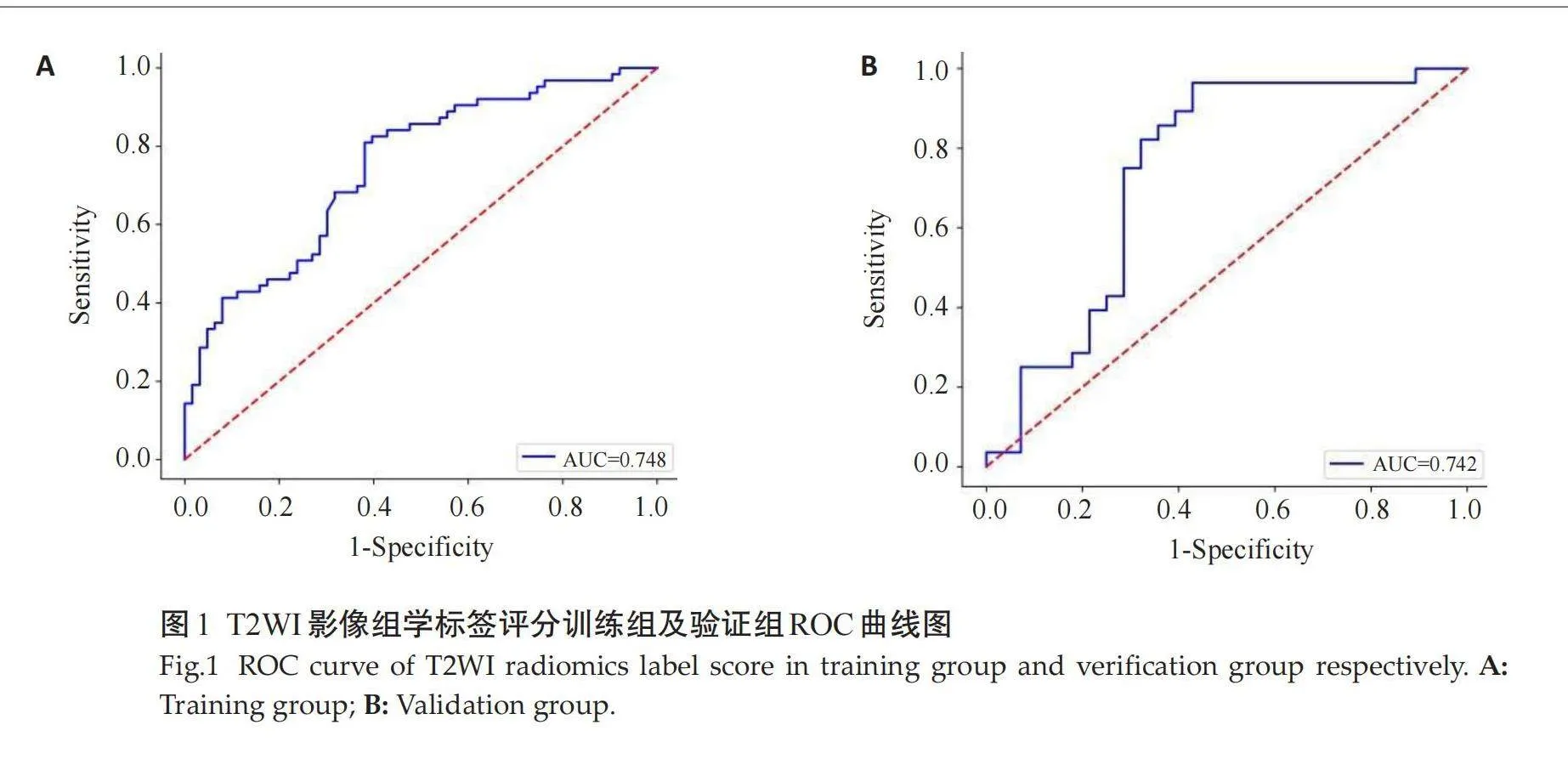
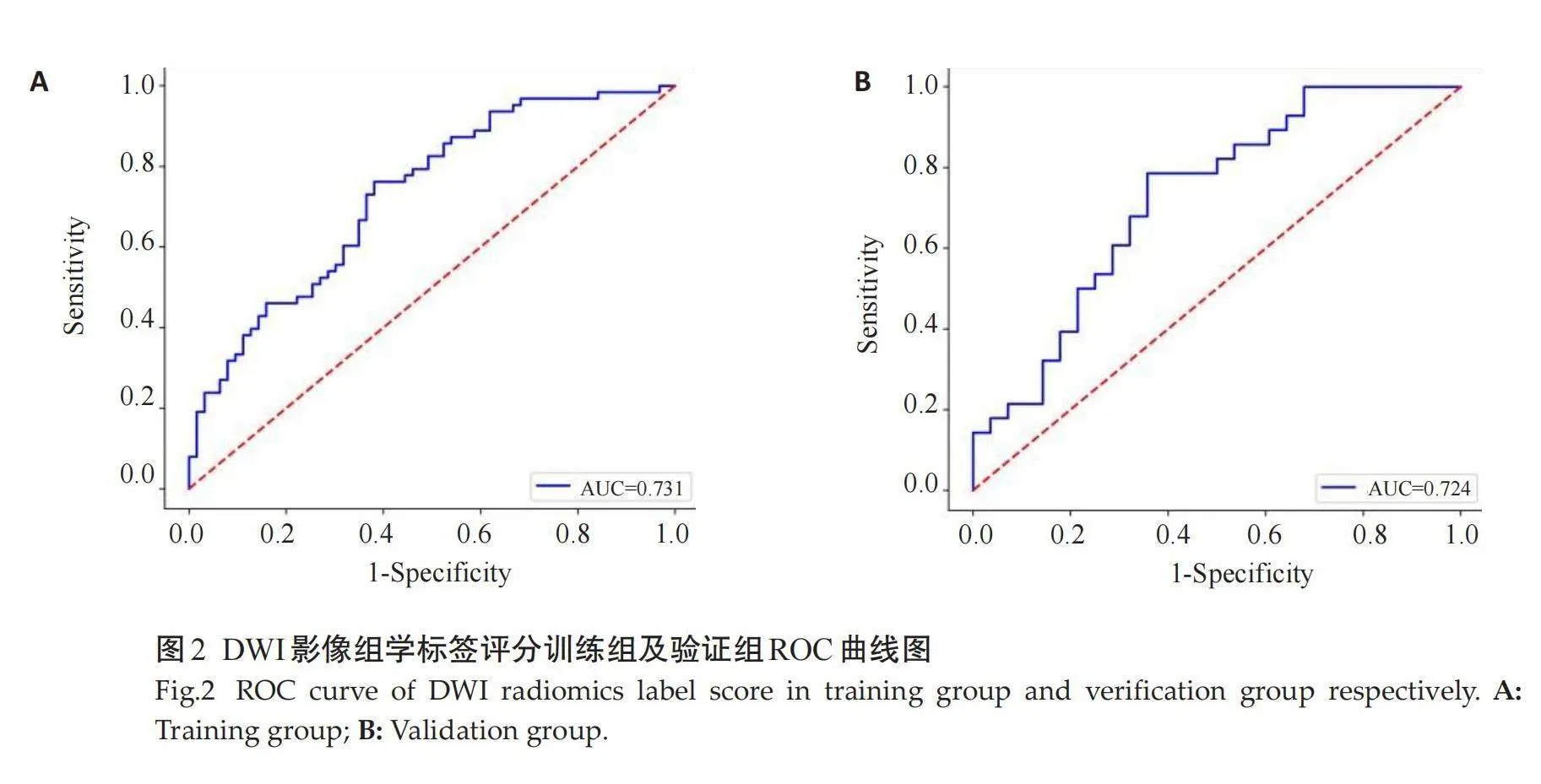
通过降维后从T2WI、DWI、DCE、T2WI+DWI+DCE分别获得11、16、15、7个最优影像特征,分别建立3个单序列影像组学标签评分和1个多序列影像组学标签评分,并对以上4个影像组学标签评分的训练组和验证组进行ROC曲线分析,在训练组中T2WI影像组学标签评分的AUC 为0.748(95% CI: 0.672~0.821),DWI影像组学标签评分的 AUC 为0.731(95% CI: 0.654~0.801),DCE影像组学标签评分的 AUC 为0.724(95% CI: 0.600~0.832),T2WI+DWI+DCE影像组学标签评分的 AUC 为0.752(95% CI: 0.678~0.823);在验证组中T2WI影像组学标签评分的AUC 为0.742(95% CI: 0.618~0.858),DWI影像组学标签评分的AUC 为0.724(95% CI: 0.600~0.832),DCE影像组学标签评分的 AUC 为0.723(95% CI: 0.599~0.842),T2WI+DWI+DCE多序列影像组学标签评分的 AUC 为0.744(95% CI: 0.619~0.858)。多序列影像组学标签评分的诊断效能稍高,其在验证组中的敏感度为78.6%,特异性为 74.3%(图1~4)。
2.3" 建立影像组学预测模型
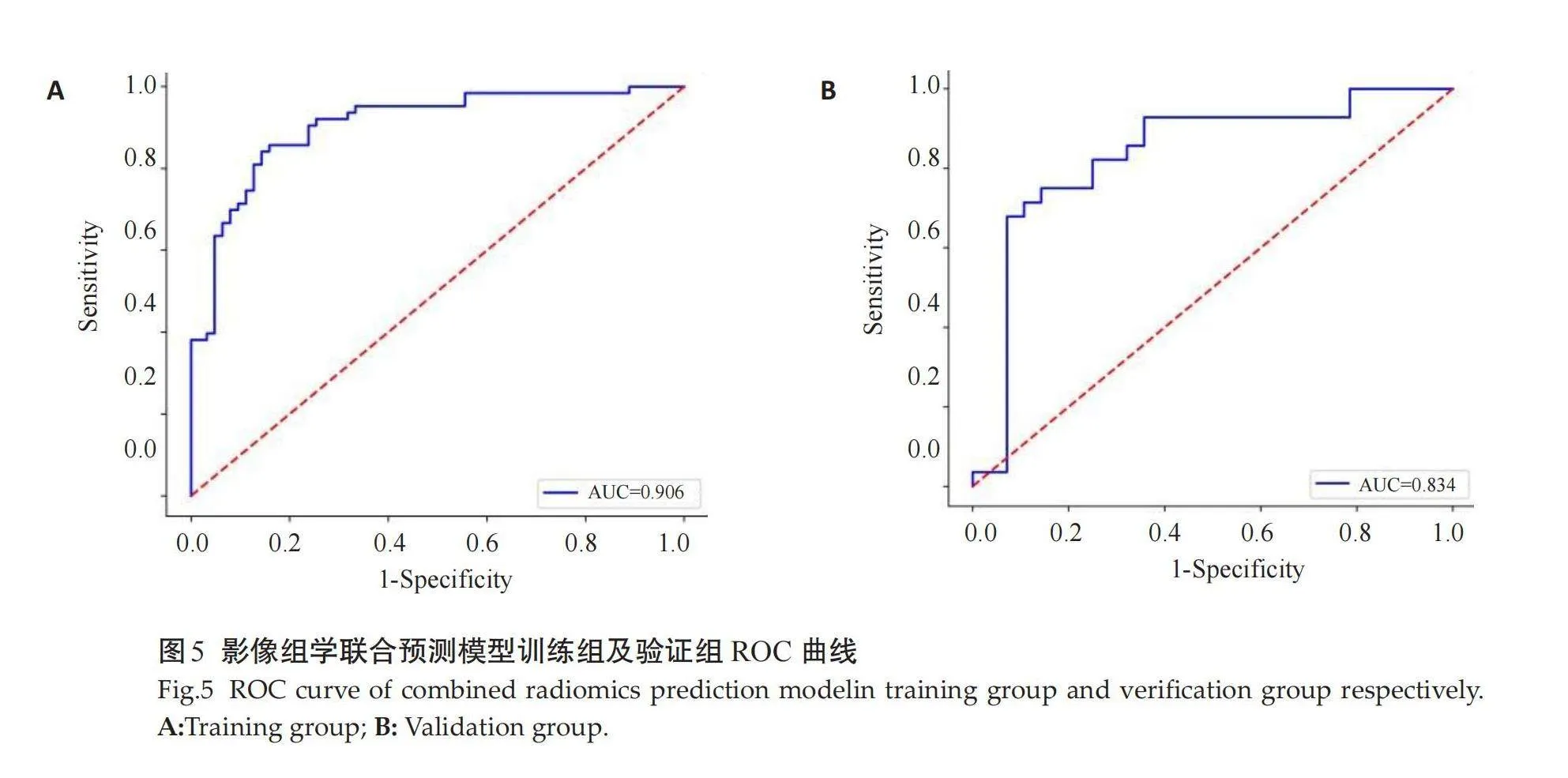
将临床、病理及影像特征联合多序列影像组学标签评分采用多因素Logistic回归建立影像组学联合预测模型,模型纳入的变量有病理组织学分级、脉管侵犯、Ki-67、瘤周水肿、肿瘤长径、肿瘤短径、毛刺征、DWI边缘高信号征、边缘强化征及ADC值,影像组学联合预测模型在训练集和测试集的AUC值分别为0.906、0.834,优于单纯影像组学标签评分的诊断效能(表2、图5)。
3" 讨论
本研究为预测术前乳腺癌SLN状态,建立了不同单序列及多序列影像组学标签评分,并进一步纳入与乳腺癌SLN状态相关的临床、病理及影像学因素建立了影像组学联合预测模型,结果显示多序列影像组学标签评分预测乳腺癌SLN转移的诊断效能较好,并且影像组学联合预测模型的诊断效能优于单纯多序列影像组学标签评分的诊断效能。
研究表明,与SLN转移相关的临床病理特征独立预测因子包含:患者年龄、乳腺癌肿瘤位置、肿瘤大小、组织学分级、组织病理类型、淋巴管及脉管侵犯等[11-12] 。在本研究中SLN阳性组患者肿瘤长径及短径较阴性组更大(Plt;0.05),这一研究结果与既往研究[13-14] 相符,其研究认为,随着乳腺原发肿瘤瘤体增大,接触淋巴管几率增加,进而引起淋巴结转移的概率增高[15-16] 。毛刺征是判断肺部和乳腺肿瘤良恶性的重要征象之一,表现为恶性病变边缘见毛刺或不规则状,有研究认为乳腺癌的毛刺征象提示肿瘤周围组织的浸润程度较高,瘤周组织内的血管内皮生长因子可受肿瘤组织的诱导而表达增高,造成新生血管及淋巴管密度增高,从而增大肿瘤血行及淋巴管的概率[15-16] ,本研究SLN转移阳性组和SLN转移阴性组乳腺癌毛刺征的差异有统计学意义,与上述研究结论相符。本研究SLN阳性乳腺癌患者瘤周水肿发生率较SLN阴性乳腺癌的发生率高,推测原因可能与病灶引流淋巴管内存在癌栓,导致脉管内液体渗漏形成有关。肿瘤边缘强化征由肿瘤内的微血管分布情况和肿瘤边缘的微血管分布情况共同作用而形成[17] ,其与肿瘤的迅速生长、较高的组织学等级和淋巴结的高反应状态等具有一定的相关性[18-20] ,因此出现边缘强化征,提示肿瘤有淋巴结转移倾向,这与本研究结果相一致。在对肿瘤良恶性及淋巴结状态移判断方面,DWI及ADC值已被广泛运用,本研究中SLN阳性组与阴性组间DWI边缘高信号征及ADC值的差异有统计学意义,阳性组患者ADC值较阴性组更低,这与薛梅等[21] 研究的观点相同,其研究表明当乳腺癌原发病灶的ADC值越低,淋巴结转移率越高。乳腺癌各类病理信息及相关生物因子表达有可能是影响SLN状态的因素。本研究显示SLN阳性组与阴性组间脉管侵犯的差异有统计学意义,原因为脉管侵犯是在肿瘤细胞通过淋巴管和(或)血管向淋巴结及远处转移过程的关键环节,这与既往研究[22] 结果相仿。本研究发现阳性组的患者病理分级中Ⅲ级患者人数及占比最多,阴性组的患者病理分级中Ⅱ级患者人数及占比最多,阳性组患者的病理分级高于阴性患者,符合既往研究[12] 病理组织分级为SLN转移相关的独立预测因子的结果。当Ki-67阳性表达率增高时,肿瘤的增殖活性与其呈正比例增加,对应肿瘤生长及淋巴结转移等预后指标均表现较差,本研究与既往研究[23] 结果一致,即乳腺癌ALN转移患者具有Ki-67阳性高表达的倾向,提示乳腺癌患者Ki-67表达与SLN转移相关。在组织病理学中HER-2、EGFR、ER及PR未见差异,以上病理组化指标是否与SLN转移存在相关性仍无统一定论。本研究中SLN状态与患者乳腺腺体组织类型、瘤周强化征、TIC增强曲线类型、MRS-Cho峰及肿瘤长径/短径方面的差异均无统计学意义,推测原因可能为本研究样本量不够大,另未见较多相关研究参考,后续仍需要更多大样本量实验探究。
已有多项与乳腺癌诊疗相关的影像组学研究结果显示多序列影像组学标签评分即多参数影像组学模型的诊断效能取得了理想的结果。有学者分别从T1WI、T2WI、弥散峰度成像图、ADC图中提取影像组学特征并联合动态增强磁共振药代动力学参数,使用支持向量机分类器建立基于单个序列和联合序列模型,最终基于T2WI、弥散峰度成像图影像组学并联合动态增强磁共振药代动力学参数建立的组合模型对乳腺良恶性病变的鉴别能力最高,其AUC为0.921[24] 。有研究建立的DCE+T2WI+ADC图联合序列影像组学模型,得到鉴别三阴性型与非三阴性型乳腺癌的模型AUC为0.965,鉴别HER-2过表达型与非HER-2过表达型的模型AUC为0.840[25] 。本研究T2WI+DWI+DCE多参数影像组学标签评分的预测效能亦优于单参数影像组学标签评分,多序列影像组学标签评分的预测效能较好归因于联合序列影像学特征更为全面,相较单序列影像组学标签评分可更为全面反映乳腺癌的异质性。
与第一增强期相比,根据时间信号曲线描绘出最强增强期的ROIs,可以更清晰地显示出病变的边界,此外,最强的增强期能更好地反映肿瘤的异质性和侵袭性[26] 。因此本研究以DCE各期中的强化最显著期作为ROIs。本研究DCE强化最显著期预测乳腺癌SLN状态的诊断效能与既往研究[27] 结果接近。
单纯的影像组学标签评分仅能反映肿瘤本身的异质性,纳入的高风险因素有限,但是乳腺癌SLN转移与否受多发复杂因素及机制的综合影像,其中临床特征、病理组织学、分子生物学、肿瘤生物学过程、肿瘤本身异质性及瘤周微环境等均能影响其SLN状态。纳入临床、病理及一般影像特征的影像组学联合预测模型诊断效能得到了进一步的提高。有学者建立的多参数MRI序列(包括T2WI、DWI、DCE序列)联合临床病理特征的影像组学模型预测乳腺癌新辅助化疗疗效,与单独的临床模型和影像组学模型相比,其模型提高了预测的准确性[28] 。有研究建立基于术前多参数MRI(T2WI、pre-DCE、DCE和DCE减影图)联合临床病理建立的影像组学列线图评估患者的无病生存期,其评估效能相对于影像组学标签、临床病理模型的效能而言进一步提高[29] 。为寻求更为有效的预测乳腺癌淋巴结转移方法,有学者建立了预测乳腺癌SLN或腋窝淋巴转移的影像组学-临床病理特征联合预测模型。既往研究建立的联合预测模型[30-32] 与本研究联合模型的预测效能相近,提示MRI多参数影像组学联合临床特征的预测模型能够更为全面揭示肿瘤的异质性,提供肿瘤更为丰富的生物学信息。
本研究的局限性:本研究为单中心的回顾性研究,且样本量偏少;ROI的分割均为放射科医师手动绘制,受主观判断及个人经验影响;本研究所构建影像组学标签及影像组学预测模型ROC曲线未使用Delong检验比较之间的差异性。
综上所述,利用临床资料、组织病理学、影像学特征及影像组学参数建立的影像组学联合预测模型能够在术前有效的预测乳腺癌SLN转移状态,为临床决策提供依据。
参考文献:
[1]" "Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA A Cancer J Clinicians, 2021, 71(1): 7-33.
[2]" "Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clinicians, 2021, 71(3): 209-49.
[3]" Eberlein TJ. Comparison of models to predict nonsentinel lymph node status in breast cancer patients with metastatic sentinel lymph nodes: a prospective multicenter study[J]. Yearb Surg, 2010, 2010: 301-3.
[4]" "Liu CL, Ding J, Spuhler K, et al. Preoperative prediction of sentinel lymph node metastasis in breast cancer by radiomic signatures from dynamic contrast-enhanced MRI[J]. J Magn Reson Imaging, 2019, 49(1): 131-40.
[5]" "Qiu PF, Liu JJ, Wang YS, et al. Risk factors for sentinel lymph node metastasis and validation study of the MSKCC nomogram in breast cancer patients[J]. Jpn J Clin Oncol, 2012, 42(11): 1002-7.
[6]" "Weigel MT, Dowsett M. Current and emerging biomarkers in breast cancer: prognosis and prediction[J]. Endocr Relat Cancer, 2010, 17(4): R245-62.
[7]" "Sakorafas GH, Peros G, Cataliotti L, et al. Lymphedema following axillary lymph node dissection for breast cancer[J]. Surg Oncol, 2006, 15(3): 153-65.
[8]" "Liu J, Sun D, Chen LL, et al. Radiomics analysis of dynamic contrast-enhanced magnetic resonance imaging for the prediction of sentinel lymph node metastasis in breast cancer[J]. Front Oncol, 2019, 9: 980.
[9]" "Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-77.
[10]" 马晓雯, 罗娅红. 影像组学在乳腺癌应用中的研究进展[J]. 磁共振成像, 2018, 9(8): 637-40.
[11]" Fujii T, Yajima R, Tatsuki H, et al. Significance of lymphatic invasion combined with size of primary tumor for predicting sentinel lymph node metastasis in patients with breast cancer[J]. Anticancer Res, 2015, 35(6): 3581-4.
[12]" La Verde N, Biagioli E, Gerardi C, et al. Role of patient and tumor characteristics in sentinel lymph node metastasis in patients with luminal early breast cancer: an observational study[J]. SpringerPlus, 2016, 5: 114.
[13]" Kim H, Dumont DJ. Molecular mechanisms in lymphangiogenesis: model systems and implications in human disease[J]. Clin Genet, 2003, 64(4): 282-92.
[14]" Chen K, Liu JQ, Li SR, et al. Development of nomograms to predict axillary lymph node status in breast cancer patients[J]. BMC Cancer, 2017, 17(1): 1-10.
[15]" Colpaert C, Vermeulen P, van Beest P, et al. Intratumoral hypoxia resulting in the presence of a fibrotic focus is an independent predictor of early distant relapse in lymph node-negative breast cancer patients[J]. Histopathology, 2001, 39(4): 416-25.
[16] Walker RA. The complexities of breast cancer desmoplasia[J]. Breast Cancer Res, 2001, 3(3): 1-3.
[17]" 张" 晖, 单春辉, 王" 勇. 磁共振动态对比增强及扩散加权成像技术在诊断和预估乳腺癌复发中的价值[J]. 磁共振成像, 2017, 8(11): 827-33.
[18]" Ahn SG, Lee HM, Cho SH, et al. The difference in prognostic factors between early recurrence and late recurrence in estrogen receptor-positive breast cancer: nodal stage differently impacts early and late recurrence[J]. PLoS One, 2013, 8(5): e63510.
[19] Teifke A, Behr O, Schmidt M, et al. Dynamic MR imaging of breast lesions: correlation with microvessel distribution pattern and histologic characteristics of prognosis[J]. Radiology, 2006, 239(2): 351-60.
[20]" Lee SH, Cho N, Kim SJ, et al. Correlation between high resolution dynamic MR features and prognostic factors in breast cancer[J]. Korean J Radiol, 2008, 9(1): 10.
[21]" 薛" 梅, 李" 静, 车树楠, 等. 乳腺癌多模态磁共振影像特征与腋窝淋巴结转移的相关性研究[J]. 磁共振成像, 2020, 11(7): 540-5.
[22]" Okuno J, Miyake T, Sota Y, et al. Development of prediction model including microRNA expression for sentinel lymph node metastasis in ER-positive and HER2-negative breast cancer[J]. Ann Surg Oncol, 2021, 28(1): 310-9.
[23]" "杨" 丽, 张春霞, 王文超. 人表皮生长因子受体-2与细胞增殖抗原Ki67在乳腺癌中表达及临床意义[J]. 中华实用诊断与治疗杂志, 2015, 29(2): 166-8.
[24]" Zhang Q, Peng YS, Liu W, et al. Radiomics based on multimodal MRI for the differential diagnosis of benign and malignant breast lesions[J]. J Magn Reson Imag, 2020, 52(2): 596-607.
[25]" Huang YH, Wei LH, Hu YL, et al. Multi-parametric MRI-based radiomics models for predicting molecular subtype and androgen receptor expression in breast cancer[J]. Front Oncol, 2021, 11: 706733.
[26]" Teruel JR, Heldahl MG, Goa PE, et al. Dynamic contrast-enhanced MRI texture analysis for pretreatment prediction of clinical and pathological response to neoadjuvant chemotherapy in patients with locally advanced breast cancer[J]. NMR Biomed, 2014, 27(8): 887-96.
[27]" 刘梅婕, 毛" 宁, 马" 恒, 等. 基于影像组学构建乳腺癌前哨淋巴结转移预测模型的研究[J]. 中国中西医结合影像学杂志, 2020, 18(3): 227-31.
[28]" Liu ZY, Li ZL, Qu JR, et al. Radiomics of multiparametric MRI for pretreatment prediction of pathologic complete response to neoadjuvant chemotherapy in breast cancer: a multicenter study[J]. Clin Cancer Res, 2019, 25(12): 3538-47.
[29]" Park H, Lim Y, Ko ES, et al. Radiomics signature on magnetic resonance imaging: association with disease-free survival in patients with invasive breast cancer[J]. Clin Cancer Res, 2018, 24(19): 4705-14.
[30]" 朱娅娣. 基于磁共振多参数影像组学术前预测乳腺癌前哨淋巴结转移的研究[D]. 苏州: 苏州大学, 2022.
[31]" Zhang X, Yang ZH, Cui WJ, et al. Preoperative prediction of axillary sentinel lymph node burden with multiparametric MRI-based radiomics nomogram in early-stage breast cancer[J]. Eur Radiol, 2021, 31(8): 5924-39.
[32]" Han L, Zhu YB, Liu ZY, et al. Radiomic nomogram for prediction of axillary lymph node metastasis in breast cancer[J]. Eur Radiol, 2019, 29(7): 3820-9.
(编辑:郎" 朗)
