定量CT评估2型糖尿病并发肺间质异常的应用价值
2024-10-30张丽樊秋菊党珊韩冬张敏于楠

摘要:目的" 探讨定量CT有效识别2型糖尿病(T2DM)并发肺间质异常的敏感影像学指标,旨在帮助T2DM合并间质性肺病的早期诊断。方法" 回顾性收集陕西中医药大学附属医院2022年1月~2023年8月临床确诊的T2DM患者且胸部CT发现肺间质异常的患者70例,同时收集胸部CT无异常改变的非糖尿病体检筛查者62例。采用Dexin-FACT“数字肺”软件对胸部CT图像进行后处理,获得各项CT定量参数,主要包括全肺容积、肺气肿指数(LAA-950%)、肺纤维化评价指标(LAA-700~-200%)、肺小血管指标(双肺下叶内2 mm支气管周围的血管管腔面积与数量之比,TAV/TNV)。比较两组间定量CT参数的差异性,并进行ROC曲线分析。结果" T2DM患者组的LAA-700~-200%高于对照组(Z=-4.229,Plt;0.001),而T2DM患者组的LAA-950%及TAV/TNV低于对照组(Z=-2.173,Plt;0.05;t=-3.904,Plt;0.001);两组间全肺容积的差异无统计学意义(Pgt;0.05)。LAA-700~-200% 区分T2DM并发肺间质异常的诊断效能最高,AUC为0.71。结论" T2DM并发肺间质异常患者的肺部CT定量参数与对照组相比具有差异性,而且肺部小血管损伤可能是T2DM患者肺损伤的关键靶器官。
关键词:糖尿病;肺间质异常;定量分析;肺损害;CT
Application value of quantitative CT in evaluating type 2 diabetes mellitus complicated with interstitial lung abnormalities
ZHANG Li1, FAN Qiuju2, DANG Shan2, HAN Dong2, ZHANG Min2, YU Nan1,2
1School of Medical Technology, Shaanxi University of Chinese Medicine, Xianyang 712046, China; 2Department of Medical Imaging, Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
Abstract: Objective To explore the sensitive imaging indicators of effective recognition of type 2 diabetes mellitus (T2DM) complicated with interstitial lung abnormalities by quantitative CT, aim at contributing to the early diagnosis of T2DM complicated with interstitial lung disease and effectively delaying the progression of diabetic lung damage. Methods Seventy patients with clinically diagnosed T2DM with interstitial lung abnormalities detected on chest CT from January 2022 to August 2023 at the Affiliated Hospital of Shaanxi University of Chinese Medicine were retrospectively collected, and 62 non-diabetic physical examination screeners without abnormal changes on chest CT were also collected. The chest CT images were postprocessed by Dexin-FACT \"digital lung\" software, and the quantitative parameters of CT were obtained, including whole lung volume, emphysema index (LAA-950%), pulmonary fibrosis evaluation index (LAA-700~-200%), pulmonary small vessel index (the ratio of lumen area to number of blood vessels around the bronchus with a diameter of 2mm in the lower lobe of the lung, TAV/TNV). The differences of quantitative CT parameters between the two groups were compared and the indexes with statistical significance were analyzed by ROC curve. Results the LAA-700--200% in the T2DM group was significantly higher than that in the control group (Z=-4.229,Plt;0.001), while the LAA-950% and TAV/TNV in the T2DM group were significantly lower than those in the control group (Z=-2.173, Plt;0.05; t=-3.904, Plt;0.001), but there was no significant difference in whole lung volume between the two groups (Pgt;0.05). LAA-700--200% had the highest diagnostic efficiency in distinguishing T2DM complicated with interstitial lung abnormalities, with an AUC of 0.71. Conclusion The quantitative parameters of lung CT in patients with T2DM complicated with interstitial lung abnormalities are different from those in the control group, and small blood vessel injury in the lung may be a key target organ for lung injury in T2DM patients.
Keywords: diabetes mellitus; interstitial lung abnormalities; quantitative analysis; lung damage; CT
收稿日期:2023-10-29
基金项目:陕西科技厅基础研究项目(2022JM-453);陕西省教育厅青年创新团队项目(23JP036)
作者简介:张" 丽,在读硕士研究生,E-mail: 1459039857@qq.com
通信作者:于" 楠,博士,副教授,副主任医师,E-mail: yunan0512@sina.com
糖尿病是一种慢性全身性血管性疾病[1]。由于肺部有丰富的微血管循环,其结构和功能容易受到高血糖的持续损害,因此肺损害同样是2型糖尿病(T2DM)常见的并发症之一[2-3]。既往研究表明,T2DM肺损害的主要表现是肺间质改变和肺部微循环障碍,由于肺部丰富的毛细血管网络及结缔组织,肺部组织中的发展比其他器官更晚,且肺间质异常(ILAs)是在临床未怀疑间质性肺病(ILD)的人群中偶然发现的一种放射学表现[4-7]。因此糖尿病并发ILAs常常被忽视,且关于糖尿病并发ILAs的研究鲜少报道,糖尿病性肺损害也尚未引起重视。随着持续性的高血糖损害及病程延长,ILAs可进展为ILD,尤其是糖尿病诱发的肺纤维化[8],肺纤维化可导致患者肺功能进行性下降及死亡。在ILD早期行抗纤维化治疗可有效延缓进展,减少肺功能下降速率,改善患者预后[9]。早期识别并评估ILAs有助于ILD的早期诊断,若能提早给予药物干预,有望延缓病程,改善预后[7]。此外,已有组织学研究表明,T2DM的肺部微循环障碍导致肺泡上皮和肺毛细血管基底层增厚,引起肺小血管容量减少[10],但目前尚缺乏大量的体内研究证实糖尿病性肺损害的小血管变化。
ILAs是一种纯粹的放射学表现,指在临床未怀疑ILD的人群中,CT扫描时偶然发现的非重力依赖性肺间质异常改变,异常范围至少累及5%的任意肺区[7],其与肺纤维化的死亡率增加有关[11]。目前,对于T2DM并发ILAs的早期识别及进展主要依靠影像学检查的视觉主观评价,但视觉主观评价存在观察者间及观察者内部的差异性,缺乏可靠性;而且视觉评价对于ILAs的细微进展不易察觉,细微进展可能代表着间质异常改变范围的相对大幅增加[7]。因此需要一种更客观、准确的方法来评估T2DM并发ILAs。定量CT不仅能够更加客观精准地反映肺部的整体变化,而且还能通过量化的指标评价肺间质异常及肺小血管改变。本研究通过分析2型糖尿病并发ILAs患者肺部CT定量参数的变化,探讨定量CT有效识别T2DM并发ILAs的敏感影像学指标,并在体内验证糖尿病性肺损害的肺小血管改变,旨在有效识别T2DM患者的ILAs,有助于ILD的早期诊断并在随访过程中指导临床严格控制血糖并及时进行抗纤维化治疗,有效延缓糖尿病性肺损害的进行性进展及降低肺纤维化的死亡率。
1" 资料与方法
1.1" 一般资料
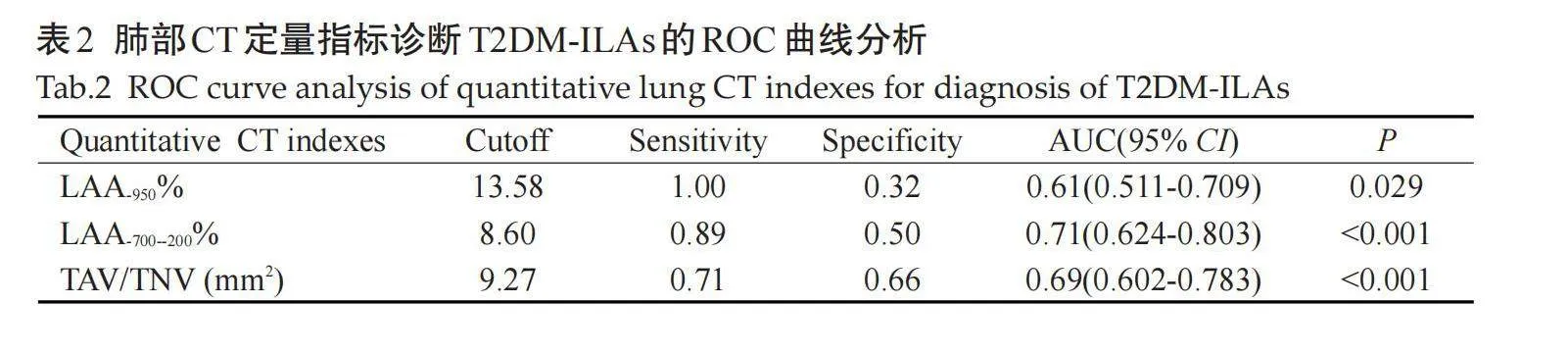
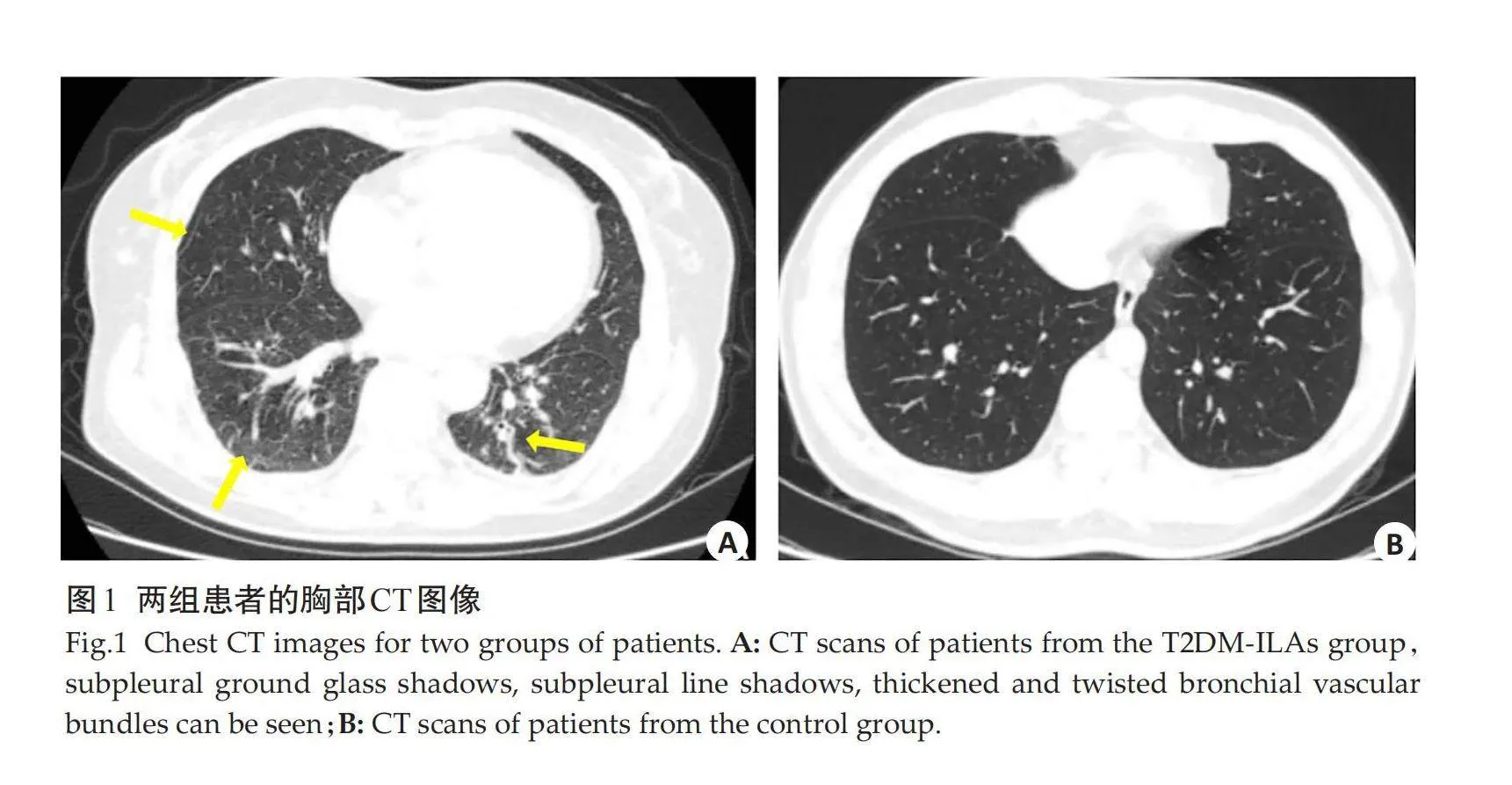
回顾性收集2022年1月~2023年8月在陕西中医药大学附属医院确诊的T2DM并发ILAs患者70例,作为T2DM-ILAs组。纳入标准:临床确诊的T2DM患者,符合中国T2DM防治指南(2020年版)的诊断标准[12];来院后接受胸部CT检查;根据2020年Fleischner协会共识[7],由2位具有5年以上工作经验的放射科医生判读为ILAs患者;包括CT偶然发现的非重力依赖性肺间质改变;ILAs的影像学表现至少累及5%的肺区域,影像学征象包括两下肺胸膜下的磨玻璃影,网格影,牵拉性支气管扩张,蜂窝影等肺间质改变征象(图1)。排除标准:年龄lt;20岁或≥60岁;临床基础资料或胸部影像资料不全;具有肺间质性疾病家族史者;其他肺间质性疾病患者,或结缔组织疾病病史患者;影响图像分割的疾病:如肺部肿瘤、血管瘤、胸腔积液、胸部手术史等。同时收集同时段就诊的胸部CT无异常改变的非糖尿病体检筛查者62例为对照组。本研究已获得伦理批准,并进行临床研究注册(ChiCTR-OCH-140049272)。
T2DM-ILAs组男性56例,女性14例,年龄37~58(47.41±4.56)岁;病程1~26年,其中gt;5年的46例,空腹血糖11.54±3.59 mmol/L;对照组男性50例,女性12例,年龄36~58(46.66±5.10)岁。两组年龄与性别的差异无统计学意义(Pgt;0.05)。
1.2" CT检查方法
使用 GE Discovery 750HD进行CT图像的采集。检查前对患者进行呼吸训练。扫描时患者仰卧位,双臂上举抱头,头先进,于深吸气末进行全肺扫描。扫描范围从肺尖到肺底,扫描参数:管电压120 kV,管电流200 mA,矩阵512×512,扫描层厚5.0 mm,机架旋转时间0.50 s/周,螺距1.375:1,采用骨算法重建,重建层厚及重建间隔设为1.25 mm。
1.3" CT定量数据的测量
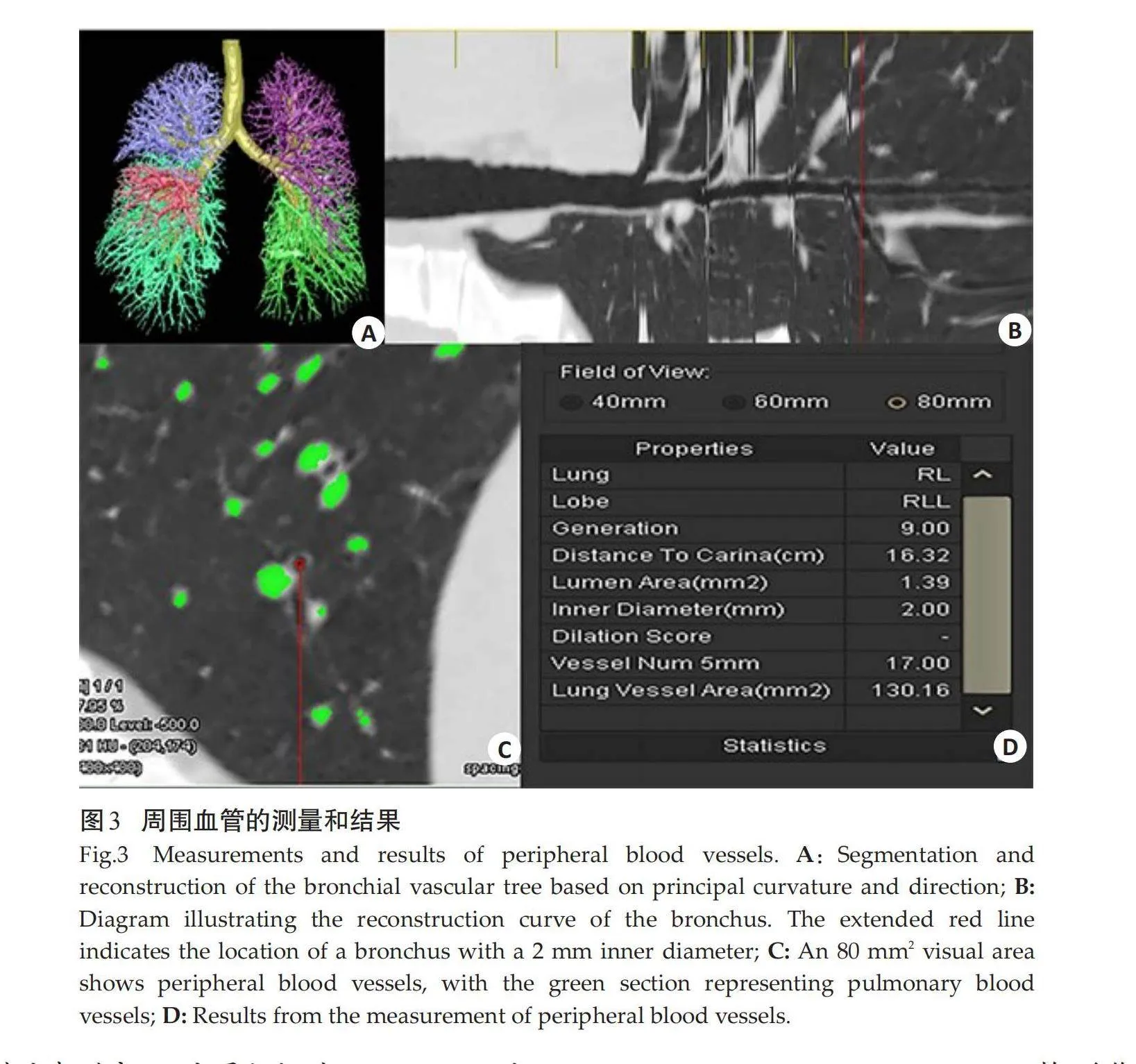
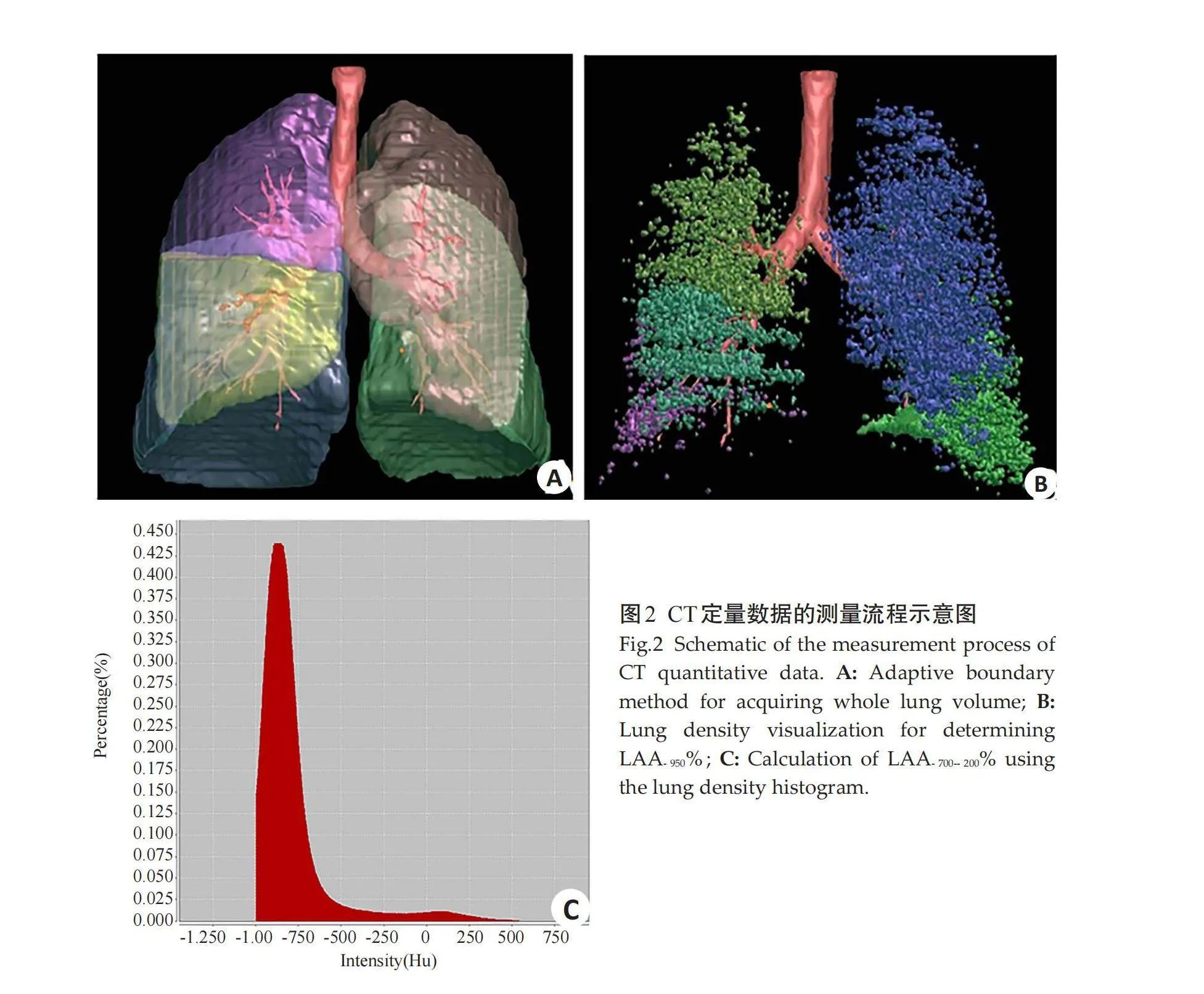
将吸气相CT扫描获得的原始数据导入 “数字肺”平台(Dexin-FACT,西安),具体测量过程参照文献[13]:该软件采用三维自适应边界行进算法获取全肺数据,自动计算全肺容积(TLV);CT图像上肺气肿定义为吸气相肺密度等于或低于-950 Hu,使用该软件的肺气肿自动测量模块测量双肺内低密度衰减区肺容积占全肺容积的百分比(LAA-950%)以评估肺气肿的程度;使用该软件的肺部密度直方图自动测量模块,测量CT值为-700~-200 Hu肺容积占全肺容积的百分比(LAA-700~-200%)作为肺纤维化指数;该软件根据主曲率及主方向区分并分割支气管及肺血管树,生成支气管、肺血管的三维图像,采用肺血管自动测量模块从双肺下叶内选取直径为 2 mm的支气管,测量视区面积80 mm2内的周围血管数量(TNV)及管腔面积(TAV)。同时为了避免生理性解剖的影响,计算双肺下叶内2 mm支气管周围血管管腔面积与数量之比(TAV/TNV)。
1.4" 统计学分析
采用SPSS26.0进行数据分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用两独立样本t检验;非正态分布的计量资料以中位数(上下四分位数)表示,组间比较采用非参数Mann-Whitney U检验;计数资料以n(%)表示,组间比较采用χ2检验。采用ROC曲线下面积(AUC)来评价肺部CT定量指标的区分效能。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 肺部CT定量指标
T2DM-ILAs组LAA-700~-200%高于对照组(Z=-4.229,Plt;0.001);T2DM-ILAs组的LAA-950%及TAV/TNV低于对照组(Z=-2.173,P=0.030; Z=-3.904,Plt;0.001);T2DM-ILAs组和对照组的TLV差异无统计学意义(t=-1.546,Pgt;0.05,表1)。肺部CT定量指标的测量(图2~3)。
2.2" ROC曲线分析肺部CT定量指标对T2DM-ILAs的诊断价值
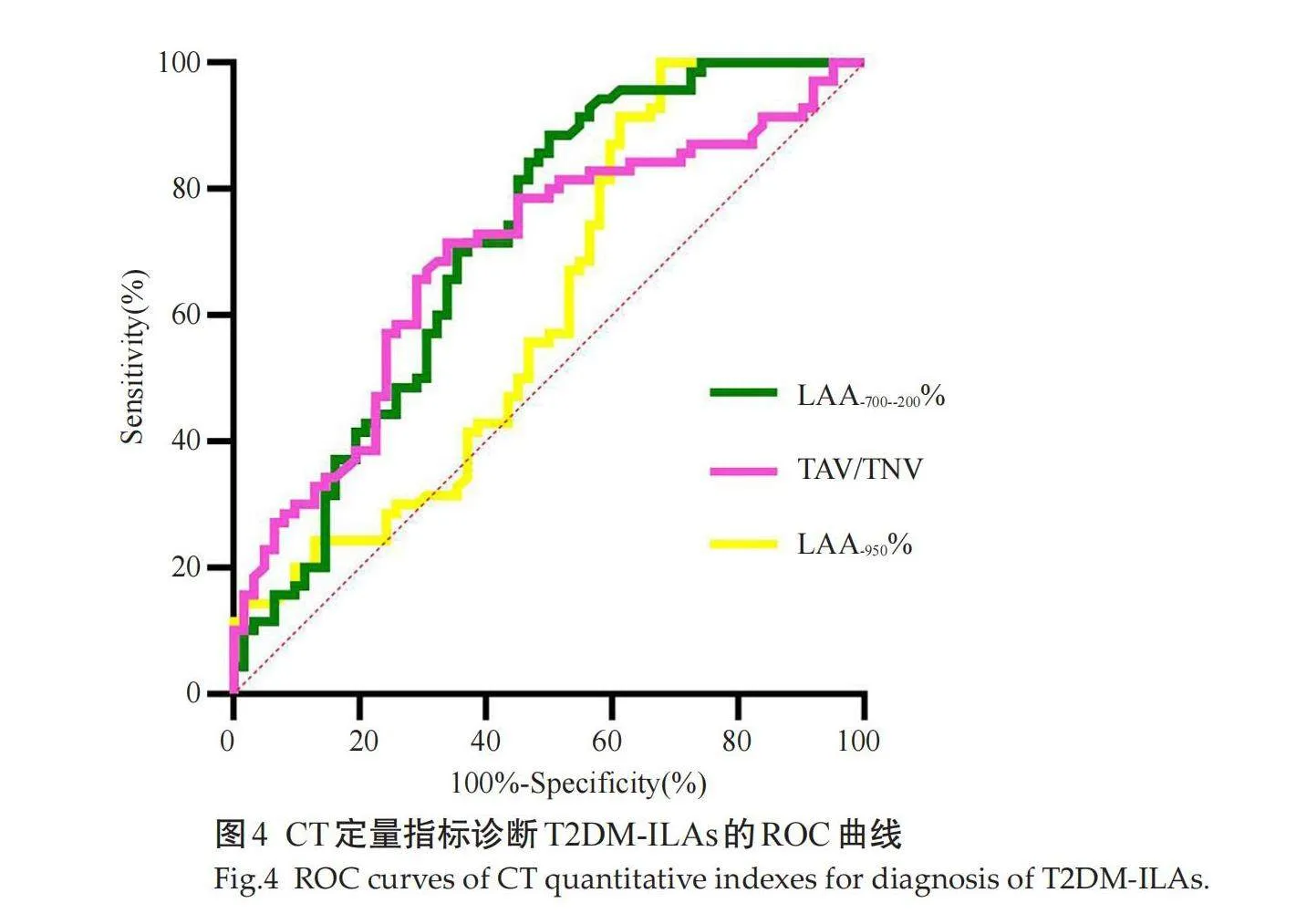
ROC曲线的分析结果显示各项肺部CT定量指标LAA-700~-200%、TAV/TNV、LAA-950%均可鉴别T2DM-ILAs(Plt;0.05)。AUC值由高到低为:0.71、0.69、0.61(表2、图4)。
3" 讨论
肺部由于其丰富的肺泡毛细血管网,可能会受到微血管病变的影响,而成为糖尿病的靶器官之一,主要表现为ILAs。ILAs分为非胸膜下型、胸膜下非纤维化型和胸膜下纤维化型3类[7]。有研究表明,基于HRCT检查没有肺部疾病史的T2DM患者,发现HRCT容易显示出与病理变化一致的间质性肺炎,尤其是胸膜下纤维化型[14]。与其他型相比,胸膜下纤维化型不仅具有更高的进展率和死亡率[15],而且是ILD诊断、死亡率和生存期降低的独立危险因素[16]。此外,ILAs与进展风险有关,其可能是特发性肺纤维化或其他进展性纤维化ILD的前兆[7]。有研究表明良好的血糖控制可有效减少糖尿病性肺损害的发展,否则随着疾病的进展,将逐渐影响患者的呼吸状况并引起肺功能的进行性下降,最终导致呼吸衰竭引起患者死亡[17]。因此对T2DM并发ILAs进行及早识别具有重要意义。一项关于T2DM患者胸部CT表现的研究结果表明T2DM患者的胸部CT影像学特征主要为肺间质的异常改变,并且以下肺部分布为主,在短期内随访患者胸部的影像学变化有助于指导临床治疗,但是该研究使用的是视觉半定量评估,可能会受到多种因素的影响,缺乏可靠性[18]。定量CT在识别与评估肺间质异常改变方面具有客观性及准确性[19],利用肺部密度直方图量化磨玻璃、网状异常及纤维化组织对应区间的体积占全肺容积的百分比不仅具有可重复性,而且与病理结果相一致[20-22]。因此本研究对T2DM患者组的CT图像进行定量分析,应用LAA-700~-200%评价间质性肺改变的程度,结果表明,与对照组相比,T2DM患者组肺纤维化的水平明显升高。
既往研究报道,糖尿病性肺纤维化达到一定程度将进一步导致肺顺应性减低、肺功能异常及全肺容积减少[23]。有研究基于定量CT评估T2DM伴有限制性通气功能障碍或一氧化碳弥散量受损患者的结果表明,与对照组相比,患者组的全肺容积减低[24-25]。本研究T2DM患者组的肺容积虽然同样减低,但与对照组相比尚不明显,这一方面可能是因为肺容积为肺部整体指标,与LAA-700~-200%相比具有滞后性;另一方面可能是因为本研究中选取的是T2DM并发ILAs患者,肺部病变较轻而且肺部具有强大的代偿能力。
本研究结果显示,T2DM患者组的肺气肿指数LAA-950%低于对照组,LAA-950%是在患者充分吸气的状态下扫描重建所获得的肺部CT定量指标,由此可以推测T2DM并发ILAs患者更容易发生吸气不良的状况。这与既往研究报道[24-25]相一致,其原因可能是由于持续性高血糖所致的氧化应激、慢性炎症损伤Ⅱ型肺泡上皮细胞,进而导致分泌的肺泡表面活性物质减少、肺泡萎缩甚至塌陷,使得肺内气体潴留减少[26],造成定量指标的变化。
肺部微血管病变是糖尿病性肺损伤的主要表现之一,由高血糖所诱导的氧化与抗氧化失衡、慢性炎症在肺内皮损伤及肺部纤维化中扮演着重要的角色,主要表现为肺泡间隔、肺泡壁、肺泡以及肺毛细血管的基底膜增厚,引起肺小血管容量的减少,进一步加重了周围血管的改变[6, 27],在CT上表现为周围血管管腔面积的减小。由于肺血管随支气管走行并构成肺间质,因此选取肺周围呼吸性细支气管可有效定位周围血管[13, 28]。本研究选取双肺下叶直径为 2 mm 的呼吸细支气管,测量其周围血管的管腔面积及数量,并且为了避免生理性解剖的影响还使用周围血管数量对周围血管面积进行了矫正。本研究结果显示,与对照组相比,T2DM患者组的周围血管管腔面积显著减少,与其病理改变相一致[10]。
目前对糖尿病肺部损伤影像学变化的评估主要是视觉评估,但是视觉评估会受到观察者间以及观察者自身等多种因素的影响,定量CT能够更加客观及准确地反映肺部整体的变化,对于及早识别T2DM并发肺间质异常改变具有重要意义,本研究中ROC曲线分析结果表明了肺部CT定量指标可用于诊断并发ILAs的T2DM患者,其中以肺纤维化的评价指标LAA-700~-200%的诊断效能最高。
本研究存在一定的局限性:本研究为回顾性研究,需进一步通过前瞻性研究验证T2DM并发ILAs的小血管变化;尚未对性别进行分层分析,可能对ROC曲线分析的结果存在影响;本研究仅仅针对全肺整体进行定量分析,还需对各个肺叶分别分析进行更为全面的研究。
综上所述,对没有呼吸系统症状的T2DM患者进行预防性的定量CT筛查是很有必要的,及早有效识别T2DM并发ILAs患者,有助于ILD的早期诊断并在出现肉眼容易忽视的细微影像学进展时及时进行抗纤维化治疗和严格控制血糖,有效延缓糖尿病性肺损害的进行性进展及降低肺纤维化的死亡率。
参考文献:
[1]" "Sharma A, Sharma A, Chauhan R. Spirometric lung functions in type 2 diabetes mellitus: a hospital-based study[J]. Cureus, 2023, 15(5): e38919.
[2]" "Machado LMQ, Serra DS, Neves TG, et al. Pulmonary impairment in type 2 diabetic rats and its improvement by exercise[J]. Acta Physiol, 2022, 234(1): e13708.
[3]" "Zhang XP, Liu Y, Shao RX, et al. Cdc42-interacting protein 4 silencing relieves pulmonary fibrosis in STZ-induced diabetic mice via the Wnt/GSK-3β/β-catenin pathway[J]. Exp Cell Res, 2017, 359(1): 284-90.
[4]" "Roberts TJ, Burns AT, MacIsaac RJ, et al. Diagnosis and significance of pulmonary microvascular disease in diabetes[J]. Diabetes Care, 2018, 41(4): 854-61.
[5]" "Zhang QH, Wang Y, Tian C, et al. Clinical characteristics and genetic analysis of a Chinese pedigree of type 2 diabetes complicated with interstitial lung disease[J]. Front Endocrinol, 2022, 13: 1050200.
[6]" "Rajasurya V, Gunasekaran K, Surani S. Interstitial lung disease and diabetes[J]. World J Diabetes, 2020, 11(8): 351-7.
[7]" "Hatabu H, Hunninghake GM, Richeldi L, et al. Interstitial lung abnormalities detected incidentally on CT: a Position Paper from the Fleischner Society[J]. Lancet Respir Med, 2020, 8(7): 726-37.
[8]" "Kopf S, Kumar V, Kender Z, et al. Diabetic pneumopathy-a new diabetes-associated complication: mechanisms, consequences and treatment considerations[J]. Front Endocrinol, 2021, 12: 765201.
[9]" "Walsh SLF, Richeldi L. Subclinical interstitial lung abnormalities: lumping and splitting revisited[J]. Am J Respir Crit Care Med, 2019, 200(2): 121-3.
[10] Matsubara T, Hara F. The pulmonary function and histopathological studies of the lung in diabetes mellitus[J]. Nihon Ika Daigaku Zasshi, 1991, 58(5): 528-36.
[11]" Hunninghake GM, Goldin JG, Kadoch MA, et al. Detection and early referral of patients with interstitial lung abnormalities: an expert survey initiative[J]. Chest, 2022, 161(2): 470-82.
[12]" 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志, 2021,13(4): 315-409.
[13]" Pu DD, Yuan H, Ma GM, et al. CT quantitative analysis of pulmonary changes in rheumatoid arthritis[J]. J Xray Sci Technol, 2023, 31(3): 545-53.
[14]" Talakatta G, Sarikhani M, Muhamed J, et al. Diabetes induces fibrotic changes in the lung through the activation of TGF-β signaling pathways[J]. Sci Rep, 2018, 8(1): 11920.
[15] Lee JE, Chae KJ, Suh YJ, et al. Prevalence and long-term outcomes of CT interstitial lung abnormalities in a health screening cohort[J]. Radiology, 2023, 306(2): e221172.
[16]" Balata H, Punjabi A, Chaudhuri N, et al. The detection, assessment and clinical evolution of interstitial lung abnormalities identified through lung cancer screening[J]. ERJ Open Res, 2023, 9(3): 632-2022.
[17] Maan HB, Meo SA, Al Rouq F, et al. Effect of glycated hemoglobin (HbA1c) and duration of disease on lung functions in type 2 diabetic patients[J]. Int J Environ Res Public Health, 2021, 18(13): 6970.
[18]" 陈义磊, 张闽光. 2型糖尿病患者胸部CT表现及短期随访观察[J]. 中国糖尿病杂志, 2013, 21(8): 724-7.
[19]" Chen A, Karwoski RA, Gierada DS, et al. Quantitative CT analysis of diffuse lung disease[J]. Radiographics, 2020, 40(1): 28-43.
[20] Obert M, Kampschulte M, Limburg R, et al. Quantitative computed tomography applied to interstitial lung diseases[J]. Eur J Radiol, 2018, 100: 99-107.
[21]" Ariani A, Imperatori A, Castiglioni M, et al. Quantitative computed tomography detects interstitial lung diseases proven by biopsy[J]." Sarcoidosis Vasc Diffuse Lung Dis, 2018, 35(1): 16-20.
[22]Rea G, Sverzellati N, Bocchino M, et al. Beyond visual interpretation: quantitative analysis and artificial intelligence in interstitial lung disease diagnosis \"expanding horizons in radiology\"[J]. Diagnostics, 2023, 13(14): 2333.
[23] Sonoda N, Morimoto A, Tatsumi Y, et al. A prospective study of the impact of diabetes mellitus on restrictive and obstructive lung function impairment: the Saku study[J]. Metabolism, 2018, 82: 58-64.
[24]" 贺程成, 屈兆宇, 袁若涵, 等. 2型糖尿病肺损害容积变化的相关性研究[J]. 中国CT和MRI杂志, 2023, 9(7): 46-8.
[25]" 贺程成, 方玮玮, 屈兆宇, 等. 定量CT评估2型糖尿病肺损害的应用价值[J]. 放射学实践, 2023, 38(4): 441-5.
[26] Yaribeygi H, Sathyapalan T, Atkin SL, et al. Molecular mechanisms linking oxidative stress and diabetes mellitus[J]. Oxid Med Cell Longev, 2020, 2020: 8609213.
[27] Ozşahin K, Tuğrul A, Mert S, et al. Evaluation of pulmonary alveolo‑capillary permeability in Type 2 diabetes mellitus: using technetium 99mTc-DTPA aerosol scintigraphy and carbon monoxide diffusion capacity[J]. J Diabetes Complications, 2006, 20(4): 205-9.
[28]" 蒲豆豆, 袁" 慧, 马光明, 等. 定量CT在评估类风湿性关节炎相关间质性肺病中的应用[J]. 中国医学物理学杂志, 2022, 39(7): 860-4.
(编辑:林" 萍)
