轻中度狭窄性大脑中动脉粥样硬化斑块特征与缺血性卒中责任斑块形成的相关性
2024-10-30李莹师毅冰华荣王颖白胜杰王晴



摘要:目的" 采用高分辨率磁共振血管壁成像(VW-HRMRI)分析导致轻中度狭窄的大脑中动脉粥样硬化斑块特征,探讨其与责任斑块形成的相关性及临床诊断价值。方法" 回顾性分析于徐州市中心医院就诊的大脑中动脉轻中度狭窄的有症状患者(n=33)和无症状患者(n=19),所有患者均行VW-HRMRI检查,共识别出68个斑块,将识别出的斑块分为责任斑块组(n=33)与非责任斑块组(n=35)。使用二元Logistic回归分析和ROC曲线分析斑块特征与缺血性卒中发生的关联及临床诊断价值。结果" 相较于非责任斑块,责任斑块表现出更高的重构指数(P=0.03)与强化等级(P=0.01)以及更大的斑块体积(P=0.003)与陡峭度(P=0.002),二元Logistic回归分析显示,正性重构(OR=5.400;95% CI:1.334~21.857)、强化等级(OR=4.431,95% CI:1.750~11.219)、斑块体积(OR=1.09,95% CI:1.014~1.171)及陡峭度(OR=1.122,95% CI:1.038~1.214)均与责任斑块独立相关。ROC曲线分析显示,正性重构、强化等级、斑块体积与陡峭度4种危险因素的曲线下面积分别0.631、0.696、0.705、0693,而预测模型(4种危险因素联合)的曲线下面积为0.875,敏感度和特异性分别为0.818与0.800。结论" 正性重构、强化等级、斑块体积与陡峭度为责任斑块的独立危险因素,4种影像特征联合应用能更好的预测责任斑块的发生,为及早进行临床治疗提供影像依据。
关键词:大脑中动脉;轻中度狭窄;缺血性卒中;责任斑块;磁共振血管壁成像
Correlation between atherosclerotic plaque characteristics of mild‑to‑moderate stenotic middle cerebral artery and ischemic stroke responsible plaque
LI Ying1, SHI Yibing1, 2, HUA Rong2, WANG Ying2, BAI Shengjie2, WANG Qing1
1Graduate School, Bengbu Medical College, Bengbu 233000, China; 2Department of Photography, Xuzhou Central Hospital, Xuzhou 221009, China
Abstract: Objective To analyze the characteristics of atherosclerotic plaques that lead to mild to moderate narrowing in the middle cerebral artery, utilizing high-resolution magnetic resonance imaging of the vascular wall (VW-HRMRI), and explore the connection between these characteristics and the formation of culprit plaques, in addition to their clinical diagnostic significance. Methods A retrospective analysis was performed on both symptomatic (n=33) and asymptomatic (n=19) patients experiencing mild to moderate stenosis of the middle cerebral artery at Xuzhou Central Hospital. VW-HRMRI was employed to examine each patient, resulting in the identification of 68 plaques. These plaques were then classified into two categories: those deemed to be culprit plaques (n=33) and those identified as non-culprit plaques (n=35). Binary Logistic regression analysis and ROC curve analysis were applied to determine the relationship between the characteristics of these plaques and the risk of ischemic stroke, as well as their clinical diagnostic relevance. Results Culprit plaques were identified by notably higher remodeling indices (P=0.03), enhancement grades (P=0.01), volumes (P=0.003), and slopes (P=0.002) in comparison to non-culprit plaques. Logistic regression analysis showed that positive remodeling (OR=5.400, 95%CI: 1.334-21.857), enhancement grade (OR=4.431, 95% CI: 1.750-11.219), plaque volume (OR=1.09, 95% CI: 1.004-1.171), and slope (OR=1.112, 95%CI: 1.038-1.214) were independently associated with the occurrence of culprit plaques. The AUC for the four risk factors, which include positive remodeling, enhancement grade, plaque volume, and slope, was measured at 0.631, 0.696, 0.705 and 0.693. Subsequently, the predictive model that integrates these risk factors reached an AUC of 0.875, showing a sensitivity of 0.818 and a specificity of 0.800. Conclusion Positive remodeling, enhancement grade, plaque volume, and slope stand as independent risk factors for culprit plaques. The collective use of these four imaging features significantly enhances the predictive accuracy for identifying culprit plaques, thereby offering crucial imaging-based evidence to support early clinical interventions.
Keywords: middle cerebral artery; mild to moderate stenosis; magnetic resonance vessel wall; imaging of ischemic stroke; responsible plaque
收稿日期:2023-11-14
作者简介:李" 莹,在读硕士研究生,E-mail: liying20211012@163.com
通信作者:师毅冰,硕士,主任医师,硕士生导师,E-mail: ctsyb@163.com
颅内动脉粥样硬化性疾病(ICAD)是发生缺血性脑卒中(IS)的重要原因之一[1] 。即使在症状发生后采取积极治疗,IS复发及死亡率仍然很高[2]。目前对于IS的治疗,狭窄程度常作为评估卒中病因及风险的主要标志,然而管腔狭窄可能仅意味着远端血管的灌注不足,并不能解释卒中机制,如动脉-动脉型栓塞、(血栓/斑块形成)堵塞穿支动脉等。因此,结合血管壁及斑块的病理变化特征才能更准确评估其危险度[3-4]。
目前临床常用的影像检查如CTA、MRA等致力于通过评估管腔狭窄度来预测IS风险,但并不能观察到动脉粥样硬化斑块及起源的血管壁情况,且常常因受血流伪影等限制,无法准确评估颅内动脉的狭窄程度,这使得仅造成轻中度狭窄的斑块在IS进展中的危险度受到低估[5]。随着影像技术的进展,高分辨率磁共振血管壁成像(VW-HRMRI)有着独特的成像模式,具有更高的采集效率与图像信噪比,实现了各向同性分辨率采集[6]。作为无电离辐射的非侵入性成像技术,可以对责任血管的血管壁及斑块进行可视化分析,并且在狭窄度测量中与DSA检查有着良好的一致性,这对于轻中度狭窄ICAD的诊断、斑块稳定性的评估、进而早期进行临床治疗具有重要价值[7]。既往对于低级别大脑中动脉(MCA)狭窄的责任斑块研究显示,斑块强化率、斑块体积与分布特征等方面与非责任斑块组存在差异[8, 9],但相关研究相对较少且并未提出相关危险因素的临床预测价值,因此在轻中度MCA狭窄患者的临床危险因素与斑块病变特征方面需要更深入调查。本研究旨在为进一步补充研究数据并为临床结局的预测提供方向,应用VW-HRMRI分析轻中度MCA狭窄患者的临床危险因素及斑块特征,探讨其与责任斑块形成的相关性及临床诊断价值,早期识别出具有潜在风险的ICAD,从而及时制定治疗策略,并为目前面临IS风险的患者提供更精准的治疗指导。
1" 资料与方法
1.1" 一般资料
回顾性分析2018年7月~2023年10月于徐州市中心医院就诊的MCA轻中度狭窄的52名患者,其中有症状患者33例(55.8%),无症状患者19例(44.2%)。纳入标准:年龄18~90岁;发病15 d内接受VW-HRMRI检查;根据3D-SPACE图像计算出MCA狭窄程度为轻中度狭窄(狭窄率为30%~69%);至少存在1种高危脑血管危险因素,例如高血压、糖尿病、吸烟或高脂血症。排除标准:非动脉粥样硬化性颅内动脉疾病,例如血管炎、烟雾病或颅内动脉夹层;潜在心源性卒中,例如房颤等;患侧颈动脉狭窄程度大于30%;图像质量差,无法评估。
所有患者均行VW-HRMRI检查,依据患者近2周内是否出现MCA分布中的IS或短暂性脑缺血发作分为有症状组(n=33)与无症状组(n=19),其中症状组标准则根据临床表现、磁共振弥散加权成像序列以及神经系统检查判定,无症状组则定义为无脑血管病史或在MCA以外的血管区域发生的缺血性中风事件的患者。最终纳入68个斑块,根据临床症状及弥散加权成像的结果,将纳入的斑块分为责任斑块(n=33)和非责任斑块(n=35)。责任斑块定义为发生IS同侧MCA分布中唯一的病变或当卒中同一血管分布中出现多处病变时,最狭窄的病变;非责任斑块定义为无症状患者MCA的斑块或发生IS对侧MCA分布的斑块。
收集患者一般资料,包括性别、年龄、高血压史、糖尿病史、高血脂史、吸烟史等,并完善相关血液学检查,包括甘油三酯、胆固醇、高密度脂蛋白、低密度脂蛋白、同型半胱氨酸、空腹血糖及糖化血红蛋白。两组患者一般资料与临床指标的差异均无统计学差意义(Pgt;0.05,表1)。本研究获江苏省徐州市中心医院医学伦理委员会批准(审批号: XZXY-LK-20230406-053)。
1.2" 仪器与方法
采用Siemens Skyra 3.0T磁共振成像系统,使用20通道头颈线圈,成像序列包括扩散加权成像(DWI)、3D-TOF MRA以及三维完美采样可变翻转角优化对比序列(3D-SPACE)平扫+增强。关键序列参数:3D TOF MRA:TR 20 ms,TE 3.43 ms,层厚0.60 mm,层数:136层,矩阵256 mm×230 mm;3D T1WI SPACE:TR 900 ms,TE 15 ms,层厚0.6 mm,层数:224,矩阵384 mm×384 mm;增强扫描采用高压注射器注射钆喷酸葡胺注射液(商品名:马根维显),用量0.1 mmol/kg,流速3.0 mL/s,注射对比剂后延迟5 min进行扫描。VW-HRMRI扫描范围从颅底至颅顶部,具体包括两侧颈内动脉颅内段、椎基底动脉、大脑前、中、后动脉。
1.3" 图像分析
使用Vessels analysis 4.9.4 软件进行图像后处理与分析。图像后处理及测量由1位影像诊断医师间隔1周测量2次,取2次测量的平均值。由2位高年资的影像诊断医师在盲法下共同完成图像判读工作,如出现结论不一致情况,则由两位医师商讨并做出最终决定。
在后处理工作站中,将原始矢状面3D T1-SPACE平扫和增强图像及3D TOF MRA图像分别导入后处理工作站,将重建的横断面T1-SPACE增强图像放大,在0.5 mm层厚下手动勾画出斑块所处位置所有层面感兴趣区(斑块处管腔与血管壁的轮廓)后获得定量参数:狭窄率、标准化管壁指数、重构指数、斑块体积。狭窄率=(1-最狭窄处管腔面积/参考管腔面积)×100%,管腔狭窄程度的评估依据WASID标准[10],将狭窄率为30%~69%归为轻中度狭窄;标准化管壁指数(NWI)=(最狭窄处管壁面积/最狭窄处管腔面积)×100%,重构指数(RI)=(最狭窄层面血管面积/参考层面血管面积)×100%,RI≥1.05为正性重构(PR),RIlt;0.95为负性重构[11]。斑块体积的计算方法为:
斑块体积=[N](管壁面积-管腔面积)×斑块所处所有层数
斑块分布则根据文献[12]中血管的上、下、腹或背侧面来划定偏心性斑块的方向,若斑块位于2个或多个象限,则全部记录下来。斑块的陡峭度定义为斑块的高度与其纵向测量的长度之比[13]。斑块表面不规则定义为斑块接近管腔的表面不连续。斑块内出血定义为在TIW1上表现出高信号且信号强度高于邻近肌肉的1.5倍[14]。强化等级则分为3级:0级为斑块强化程度小于周围正常血管壁的强化,1级为斑块强化介于正常血管壁强化与垂体漏斗柄强化程度之间,2级为斑块强化大于等于垂体漏斗柄的强化[15]。
1.4" 统计学分析
采用SPSS26.0 软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,符合偏态分布的计量资料以中位数(上下四分位数)表示;计数资料以n(%)表示。计量资料的组间比较采用独立样本t检验(符合正态分布)或Mann-Whitney U检验(符合偏态分布),计数资料的组间比较采用卡方检验。将Plt;0.05的变量纳入二元Logistic回归,分析其导致责任斑块发生的独立危险因素,采用ROC曲线分析评估最佳预测模型。以Plt;0.05为差异有统计学意义。
2" 结果
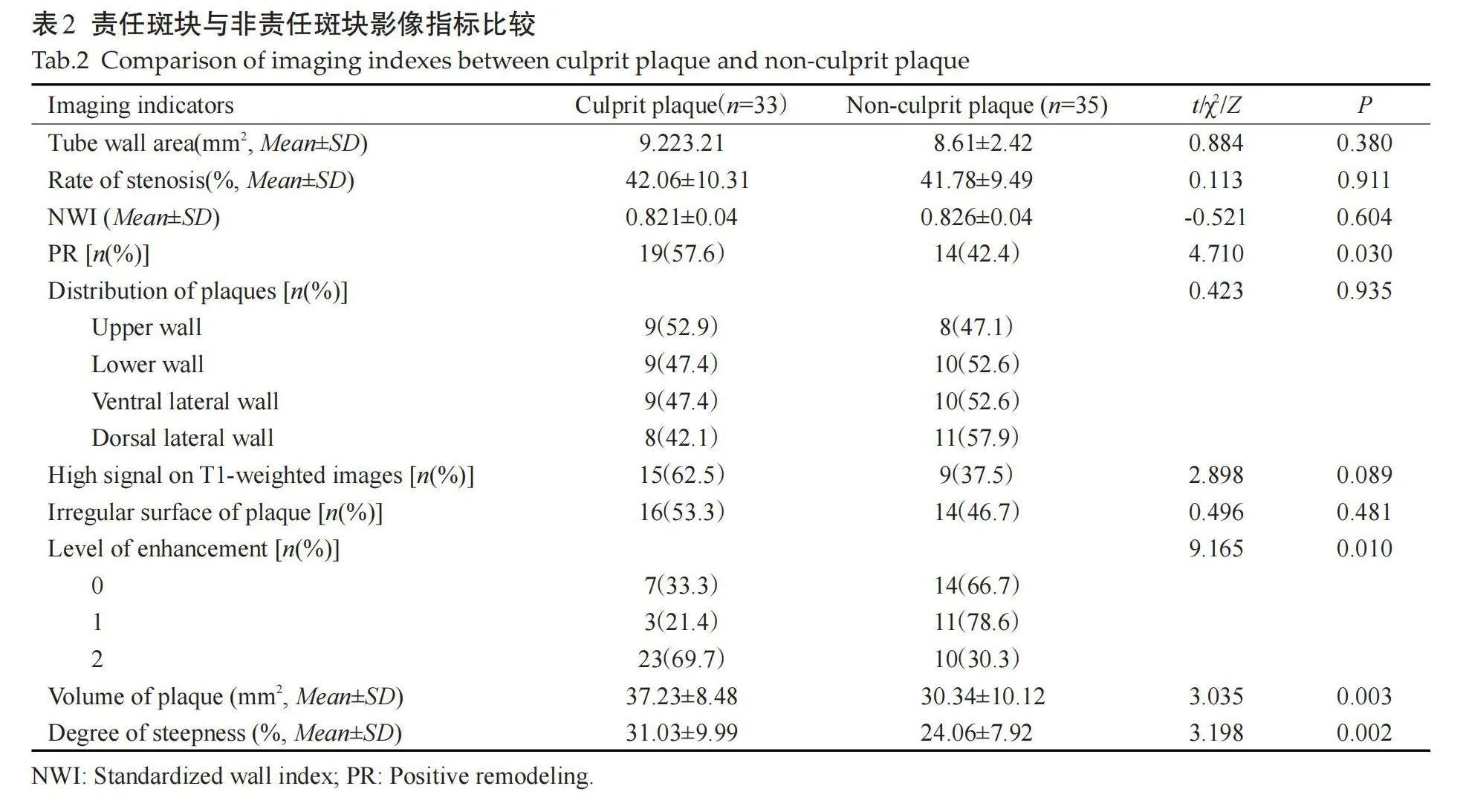
2.1" 责任斑块与非责任斑块影像指标比较
16例斑块为发生在IS对侧MCA分布的斑块,6例斑块占据2个象限。责任斑块组PR(P=0.030)、强化等级(P=0.010)、斑块体积(P=0.003)与陡峭度(P=0.002)均高于非责任斑块组,两组影像指标差异有统计学意义(Plt;0.05,表2)。
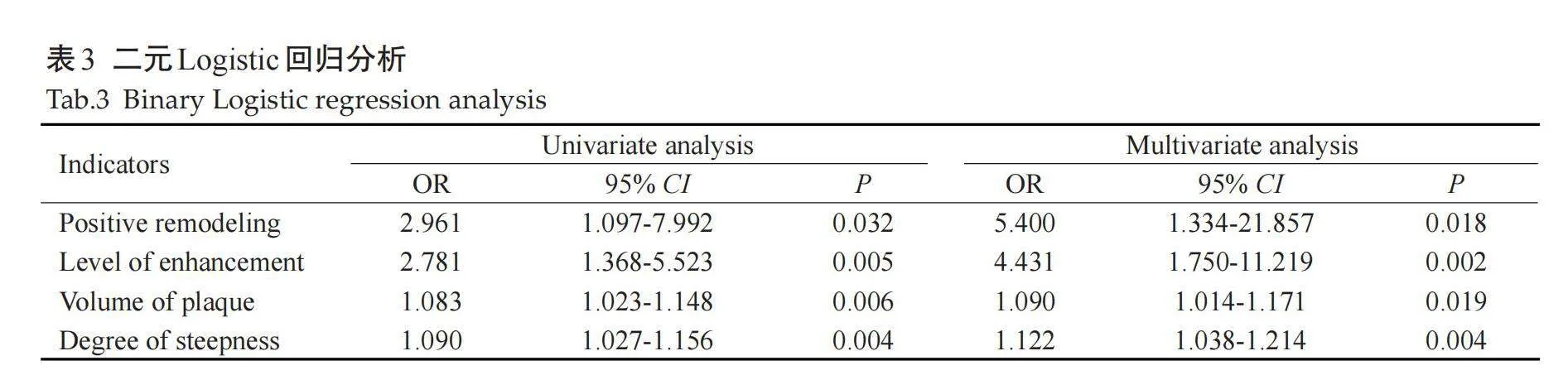
2.2" 二元Logistic回归分析
引起责任斑块的危险因素(PR、强化等级、斑块体积及陡峭度)均为引起MCA责任斑块的独立危险因素(OR=5.400、4.431、1.090、1.122,P=0.018、0.002、0.019、0.004,表3)。
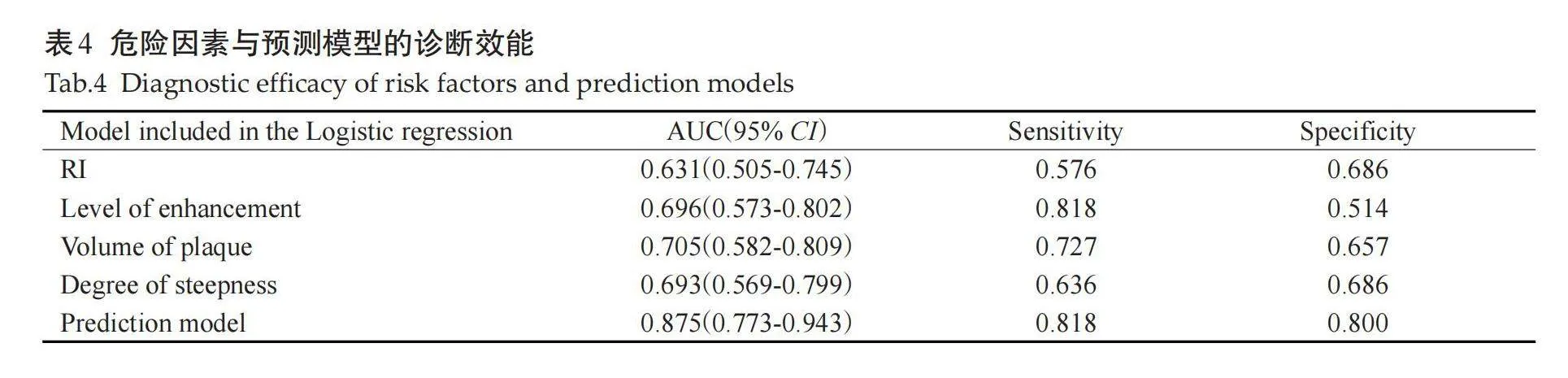
2.3" ROC曲线分析危险因素与预测模型的诊断效能
将PR、强化等级、斑块体积及陡峭度分别作为预测指标并将四者联合构建预测模型:Z=-9.728+1.489×强化等级(0、1、2)+1.686×PR(是)+0.08×斑块体积+0.115×陡峭度。将4种危险因素作为预测指标与预测模型分别进行ROC曲线分析,结果显示PR、强化等级、斑块体积与陡峭度4种危险因素的曲线下面积分别0.631、0.696、0.705、0693,而预测模型(4种危险因素联合)的曲线下面积值为0.875,敏感度和特异性分别为0.818与0.800(表4、图1)。
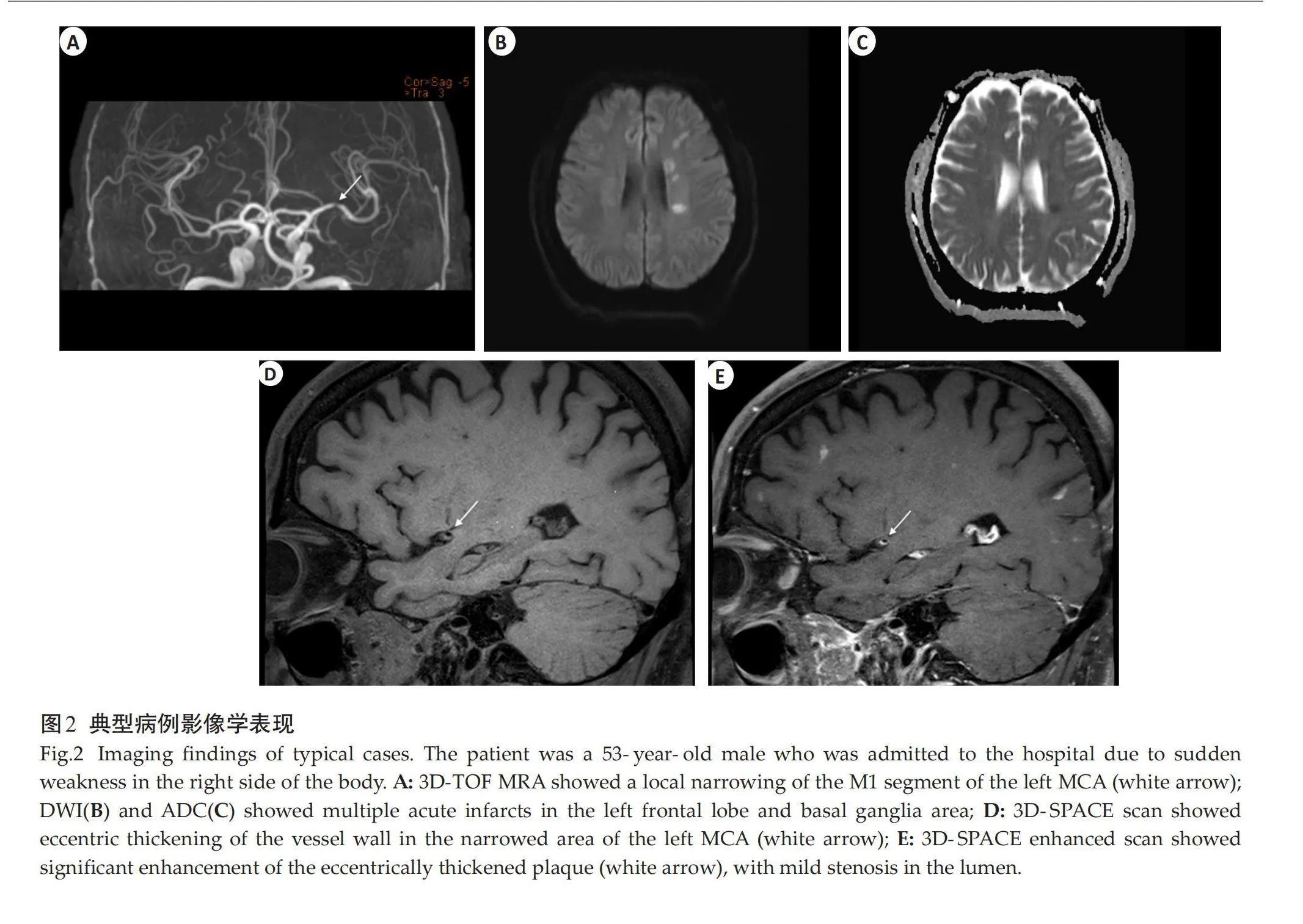
2.4" 典型病例分析
53岁男性,因突发右侧肢体无力入院。3D-TOF MRA示左侧MCA M1段局部狭窄(白箭头,图2A);DWI(图2B)及ADC(图2C)示左侧额叶及基底节区多发急性梗塞灶;3D-SPACE平扫示左侧MCA狭窄区域管壁偏心性增厚(白箭头,图2D);3D-SPACE增强扫描示偏心性增厚的斑块明显强化(白箭头,图2E),管腔为轻度狭窄。
3" 讨论
既往对于IS的研究常侧重于重度的管腔狭窄,目前更多的证据表明管腔的狭窄并不是引起IS的原因,而是由血管壁与斑块本身的性质改变所引起的[16]。为此本研究以MCA为例,应用VW-HRMRI独特的成像模式分析研究了轻中度狭窄的斑块特征及相关临床危险因素与发生IS风险的相关性。本研究纳入了52例轻中度MCA狭窄的患者,共68例斑块,相比于非责任斑块组,责任斑块具有更多的PR、更高的强化等级、更大的斑块体积与陡峭度,结合这四者进行综合评估,探究其临床应用价值,结果显示预测模型识别责任斑块的敏感度与特异度更优,这为识别斑块的稳定性提供了影像依据。
斑块强化作为斑块不稳定的标志,间接反映斑块的炎症和新生血管的形成[17]。有研究表明,斑块的高度强化与高敏C反应蛋白密切相关,斑块强化程度与炎症的浓度呈正相关,在组织病理学上解释了不稳定斑块中存在炎症因子从而加速了斑块的进展[18]。相较于颅外动脉的生理性脉管系统,颅内动脉在解剖上缺乏滋养血管,且周围被脑脊液所包绕,不会出现类似于颅外动脉的血管周围脂肪衰减的炎症等相关变化,这使得斑块的强化特征能更好的反应斑块的病理变化[19]。一项对于颅内动脉粥样硬化患者责任斑块的研究表明,约2/3的责任斑块表现为2级强化,两者呈显著正相关[15],这与本研究的结果一致,结合斑块的增强特征可以更好的识别罪犯斑块,而对于斑块强化等级与缺血性脑卒中复发之间的关系有待后续在随访中验证。
动脉重构最初发现于对冠状动脉的研究,后续研究发现动脉重构是粥样硬化斑块在形成过程中血管壁发生的一种代偿现象,动脉重构可以是双向的,病变部位外弹力板区域通过扩张或收缩从而产生正性与负性重构现象[20]。一般来说,在有动脉粥样硬化斑块的情况下,扩大的动脉能供应提供更多的血液,但随着管壁代偿性的扩张,血管的脆性与斑块的负荷也会增加[21]。这在本研究中同样得到了验证,本研究在观察症状型患者的MCA责任斑块时,发现其拥有着更多的PR特征。虽然目前血管壁重构引起IS症状发生的机制尚不明确,有学者结合HRMRI和经颅彩色多普勒检测微栓子信号,对症状型大脑中动脉粥样硬化狭窄的代偿重构进行的研究中发现,在具有PR特征的斑块中观察到了更多的微栓子信号,这表明PR型斑块更容易发生脱落并导致远端分支血管的栓塞[22]。这一观察结果可能解释了双重抗血小板治疗方案在ICAD中的疗效,同时这也为卒中患者的二级预防及治疗提供了方向。也有学者发现,血管壁的重构模式可能与血流动力学相关,PR的斑块具有更高的壁剪切应力[23]。另有学者解释到高剪切应力的斑块通过增加一氧化氮的表达和细胞外基质的降解来引起血管向外重塑,适当的血管重塑可维持斑块高剪切应力的稳定,但过度的扩张则会适得其反[24]。本研究提出的陡峭度是一个几何形态学参数,反映的是血管壁斑块的纵向曲率,应用这种间接方式来解释斑块的壁剪切应力,较高的壁剪切应力将会使斑块处于更大的血流冲击力,引起更大的坏死核心、钙化以及纤维化等有关,从而导致斑块更脆弱[25]。有研究在分析斑块的位置分布中发现,高壁剪切应力的斑块更常位于动脉-动脉型栓塞型患者的责任动脉上游区域,这对于IS梗塞机制的识别与预测提供了客观的影像学依据[26]。斑块体积作为斑块易损特征最初发现于颈动脉与冠状动脉的研究,较大体积的斑块同样也会使其壁剪切应力增加,与此同时斑块内脂质的积聚、氧化等使得斑块的稳定性降低[27]。既往研究表明,斑块体积与MCA轻中度狭窄的患者症状的发生、复发显著相关[28],这可能与较大的斑块更容易堵塞穿支动脉的开口或更容易破裂发生动脉-动脉型的栓塞有关。本研究进一步验证了斑块体积是MCA轻中度狭窄的患者责任斑块形成的独立危险因素。在未来临床试验中,这一斑块特征为患者在选择血管内支架置入或药物治疗提供了影像学依据,从而有效降低血管损伤及发生穿支动脉 “雪犁效应”等的风险[12]。然而,斑块体积与斑块负荷的意义并不相同,斑块体积代表的是整个斑块所含层面的所有面积之和,以重构指数量化的斑块负荷则代表的是斑块所在最狭窄层面的面积百分比,能更加全面地评估斑块与血管壁的情况[28]。除了管壁面积与管腔面积,NWI也是衡量斑块负荷较为准确的指标之一,它增加了对不同个体之间血管壁斑块特征的可比性,并且在既往研究中证明标准化管壁指数与缺血性脑卒中的发生密切相关[29],但本研究发现两组间的NWI差异并无统计学意义,笔者认为这可能与本次纳入的狭窄程度较轻或样本量较小有关,需要对此进行后续研究。
本研究存有一些局限性:首先,样本量相对较小,为单中心研究,这可能导致了一定的选择偏倚,在后续的研究中应进行大样本、多中心的进一步研究,并对其进行随访来验证研究结果;第二,本研究采用回顾性方法,未对研究对象的预后继续随访,所观察到的斑块强化可能是暂时性的,因此还需进一步设计前瞻性方案来进行验证;此外,目前大多数研究使用计算流体动力学来间接测量血流动力学,本研究采用斑块陡峭度来假设与血流动力学之间的关联,并且所有数据均为人工测量,存在一定的误差,在未来的研究中,可以尝试引入人工智能等方法,建立精确测量血流动力学的模型,将颅内动脉血流的功能学以影像形式呈现。
综上,VW-HRMRI为颅内动脉粥样硬化性疾病患者提供了重要的诊断价值,对于轻中度MCA狭窄的患者,联合斑块重构模式、强化等级、斑块体积与陡峭度能更好的识别责任斑块,能够为识别斑块的稳定性、预测患者预后并及早进行临床治疗提供影像依据。
参考文献:
[1]" "Yang RW, Yuan J, Chen XE, et al. Vessel wall magnetic resonance imaging of symptomatic middle cerebral artery atherosclerosis: a systematic review and meta-analysis[J]. Clin Imaging, 2022, 90: 90-6.
[2]" "Qureshi AI, Ishfaq MF, Balasetti VKS, et al. The stenting versus aggressive medical therapy for intracranial arterial stenosis trial: reanalysis using the FDA \"on label\" criteria[J]. J Neuroimaging, 2020, 30(6): 857-61.
[3]" "Shi Z, Zhao M, Li J, et al. Association of hypertension with both occurrence and outcome of symptomatic patients with mild intracranial atherosclerotic stenosis: a prospective higher resolution magnetic resonance imaging study[J]. J Magn Reson Imaging, 2021, 54(1): 76-88.
[4]" "Leung TW, Wang L, Zou XY, et al. Plaque morphology in acute symptomatic intracranial atherosclerotic disease[J]. J Neurol Neurosurg Psychiatry, 2020, 92(4): 370-6.
[5]" "Wang YT, Liu XK, Wu X, et al. Culprit intracranial plaque without substantial stenosis in acute ischemic stroke on vessel wall MRI: a systematic review[J]. Atherosclerosis, 2019, 287: 112-21.
[6]" "Leao DJ, Agarwal A, Mohan S, et al. Intracranial vessel wall imaging: applications, interpretation, and pitfalls[J]. Clin Radiol, 2020, 75(10): 730-9.
[7]" "Zhang N, Zhang F, Deng ZX, et al. 3D whole‑brain vessel wall cardiovascular magnetic resonance imaging: a study on the reliability in the quantification of intracranial vessel dimensions[J]. J Cardiovasc Magn Reson, 2018, 20(1): 39.
[8]" "Tian X, Shi Z, Wang Z, et al. Characteristics of culprit intracranial plaque without substantial stenosis in ischemic stroke using three-dimensional high‑resolution vessel wall magnetic resonance imaging[J]. Front Neurosci, 2023, 17: 1160018.
[9]" "Lu SS, Ge S, Su CQ, et al. Plaque distribution and characteristics in low-grade middle cerebral artery stenosis and its clinical relevance: a 3-dimensional high-resolution magnetic resonance imaging study[J]. J Stroke Cerebrovasc Dis, 2018, 27(8): 2243-9.
[10] Chimowitz MI, Lynn MJ, Howlett-Smith H, et al. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis[J]. N Engl J Med, 2005, 352(13): 1305-16.
[11]" Ma N, Jiang WJ, Lou X, et al. Arterial remodeling of advanced basilar atherosclerosis: a 3-tesla MRI study[J]. Neurology, 2010, 75(3): 253-8.
[12]" Xu WH, Li ML, Gao S, et al. Plaque distribution of stenotic middle cerebral artery and its clinical relevance[J]. Stroke, 2011, 42(10): 2957-9.
[13]" Yang DH, Liu J, Yao WH, et al. The MRI enhancement ratio and plaque steepness may be more accurate for predicting recurrent ischemic cerebrovascular events in patients with intracranial atherosclerosis[J]. Eur Radiol, 2022, 32(10): 7004-13.
[14]" Wu F, Song HQ, Ma QF, et al. Hyperintense plaque on intracranial vessel wall magnetic resonance imaging as a predictor of artery-to-artery embolic infarction[J]. Stroke, 2018, 49(4): 905-11.
[15] Cheng XQ, Liu J, Li HX, et al. Incremental value of enhanced plaque length for identifying intracranial atherosclerotic culprit plaques: a high-resolution magnetic resonance imaging study[J]." Insights Imaging, 2023, 14(1): 99.
[16]" Kim HJ, Choi EH, Chung JW, et al. Luminal and wall changes in intracranial arterial lesions for predicting stroke occurrence[J]." Stroke, 2020, 51(8): 2495-504.
[17] Ren KX, Jiang HY, Li TT, et al. Predictive value of the combination between the intracranial arterial culprit plaque characteristics and the Essen Stroke Risk Score for short-term stroke recurrence[J]. J Stroke Cerebrovasc Dis, 2022, 31(9): 106624.
[18]" Li RY, Zhao DL, Yu JW, et al. Intracranial plaque characteristics on high‑resolution MRI and high-sensitivity C-reactive protein levels: association and clinical relevance in acute cerebral infarction[J]." Clin Radiol, 2023, 78(5): e442-e450.
[19]Phillippi JA. On Vasa vasorum: a history of advances in understanding the vessels of vessels[J]. Sci Adv, 2022, 8(16): eabl6364.
[20]" 刘源源, 李" 胜, 敖" 锋. 高分辨MRI成像对基底动脉狭窄患者斑块分布 、成分及相关特征分析[J]. 分子影像学杂志, 2021, 7(4): 706-9.
[21]" Song XY, Li S, Du H, et al. Association of plaque morphology with stroke mechanism in patients with symptomatic posterior circulation ICAD[J]. Neurology, 2022, 99(24): e2708-e2717.
[22]" Shi MC, Wang SC, Zhou HW, et al. Compensatory remodeling in symptomatic middle cerebral artery atherosclerotic stenosis: a high-resolution MRI and microemboli monitoring study[J]. Neurol Res, 2012, 34(2): 153-8.
[23]" Zhang DF, Wu XY, Tang J, et al. Hemodynamics is associated with vessel wall remodeling in patients with middle cerebral artery stenosis[J]. Eur Radiol, 2021, 31(7): 5234-42.
[24] Wang Y, Qiu JH, Luo SS, et al. High shear stress induces atherosclerotic vulnerable plaque formation through angiogenesis[J]. Regen Biomater, 2016, 3(4): 257-67.
[25]" Leng XY, Lan LF, Ip HL, et al. Hemodynamics and stroke risk in intracranial atherosclerotic disease[J]. Ann Neurol, 2019, 85(5): 752-64.
[26]" Woo HG, Kim HG, Lee KM, et al. Wall shear stress associated with stroke occurrence and mechanisms in middle cerebral artery atherosclerosis[J]. J Stroke, 2023, 25(1): 132-40.
[27]" 戴迎桂, 张娴娴, 董从松, 等. HR-MRI分析MCAS患者管壁特征和斑块与卒中风险的关系[J]. 中国CT和MRI杂志, 2023, 9(10): 53-5.
[28] Wu G, Wang H, Zhao C, et al. Large culprit plaque and more intracranial plaques are associated with recurrent stroke: a case-control study using vessel wall imaging[J]. AJNR Am J Neuroradiol, 2022, 43(2): 207-15.
[29]" Xiao JY, Padrick MM, Jiang T, et al. Acute ischemic stroke versus transient ischemic attack: differential plaque morphological features in symptomatic intracranial atherosclerotic lesions[J]. Atherosclerosis, 2021, 319: 72-8.
(编辑:郎" 朗)
