光谱CT多参数定量成像在评估浸润性肺腺癌病理分级中的诊断价值
2024-10-30朱紫瑞申磊磊刘梦琦薛志强陈志晔
摘要:目的" 探讨光谱CT多参数定量成像评价浸润性肺腺癌(ILA)病理分级的价值。方法" 回顾性分析2019年7月~2022年7月在解放军总医院海南医院经手术病理诊断并在术前行光谱增强CT扫描的61例实性ILA患者资料,并根据2020年国际肺癌研究协会提出的ILA病理分级系统进行分组,G1、G2级为低级别组(n=31),G3级为高级别组(n=30)。比较低级别组与高级别组的临床特征(性别、年龄、吸烟史、分期)、形态学参数(肿瘤大小、分叶征、毛刺征、胸膜凹陷征及空泡征),测量动脉期及静脉期病灶的光谱参数[碘浓度(IC)、标准化碘浓度(NIC)、有效原子序数(Zeff)、单能量CT值(CT40keV、CT70keV)、曲线斜率K值(40~70 keV)],利用Multiphase软件生成细胞外容积(ECV)图,测量ECV值。采用Logistic回归分析后建立动脉期参数及静脉期参数联合模型,绘制列线图。采用ROC曲线计算曲线下面积分析各参数及模型鉴别ILA病理分级的效能。采用决策曲线分析评估模型的临床净获益。结果 低级别组ILA的形态学参数与高级别组的差异无统计学意义(Pgt;0.05)。低级别组IC、NIC、Zeff、ECV值在动脉期及静脉期均高于高级别组(Plt;0.05),ROC分析提示动脉期IC、NIC、Zeff、ECV值诊断效能优于静脉期,动脉期曲线下面积为0.734~0.831,静脉期曲线下面积为0.702~0.749;动脉期联合参数诊断效能优于单独参数,曲线下面积、特异度、敏感度分别为0.855、83.3%、83.9%,决策曲线分析表明以动脉期联合模型构建的列线图较静脉期联合参数模型临床获益率更高。结论 光谱CT动脉期联合参数可以做为ILA病理分级诊断的影像学标志物,光谱CT多参数定量成像可以作为ILA诊断简单、有效、无创的诊断工具。
关键词:肺腺癌;病理分级;光谱CT;光谱成像;细胞外容积;列线图
Diagnostic value of spectral CT multiparametric quantitative imaging in assessing pathological grading of invasive lung adenocarcinoma
ZHU Zirui1, SHEN Leilei1, LIU Mengqi3, XUE Zhiqiang2, CHEN Zhiye2
1Department of Thoracic Surgery, 2Department of Radiology, Hainan Hospital of PLA General Hospital, Sanya 572013, China; 3Departmen of Thoracic Surgery, the First Medical Center of PLA General Hospital, Beijing 100853, China
Abstract: Objective To investigate the value of spectral CT multi‑parametric quantitative imaging for evaluating the pathological grading of invasive lung adenocarcinoma (ILA). Methods A total of 61 patients with pathologically confirmed pulmonary invasive adenocarcinoma at Hainan Hospital of the PLA General Hospital from July 2019 to July 2022 were retrospectively enrolled, which preoperatively scanned by spectral enhanced CT. Patients were divided into two groups according to the pathological grading system of ILA proposed by the International Association for the Study of Lung Cancer in 2020, with grades G1 and G2 as the low‑grade group (n=31) and grade G3 as the high-grade group (n=30). The clinical characteristics (gender, age, smoking history, stage) and morphological parameters (tumor size, lobulation sign, spicule sign, pleural depression sign, vacuole sign) were analyzed. Spectral parameters [iodine concentration (IC), normalised iodine concentration (NIC), effective atomic number (Zeff), single energy CT values (CT40keV, CT70keV), slope of the curve K values (40-70 keV)] in both the arterial phase and venous phase were measured. Multiphase software was used to construct extracellular volume fraction (ECV) maps to measure the ECV values of the lesions. Logistic regression analysis was used to construct the combined models of arterial phase parameters and venous phase parameters, which expressed in a nomogram. AUC was used to assess the performance of each parameter and model to identify the pathological grade of ILA. Decision curves analysis was used to assess the clinical net benefit of the models. Results The morphological parameters of ILA in the low-grade and high-grade groups were not substantially different (Pgt;0.05). The IC, NIC, Zeff and ECV values of the low-grade group were higher than those of the high-grade group in both arterial and venous phases (Plt;0.05). ROC curve analysis revealed that the IC, NIC, Zeff, ECV in the arterial phase had better diagnostic efficacy than the venous phase, AUC of arterial phase: 0.734-0.831, AUC of venous phase: 0.702-0.749. The combined arterial phase parameter in the arterial phase had better diagnostic efficacy than the parameters alone, with AUCs of 0.855, 83.3%, 83.9%, respectively. Decision curves analysis demonstrated that the model of combined arterial phase parameters had higher clinical net benefit than the venous combined parameters model. Conclusion Spectral CT arterial phase combined parameter can be used as an imaging marker for pathology grading diagnosis of ILA, and spectral CT multiparametric quantitative imaging can be used as a simple, effective and non-invasive diagnostic tool for ILA diagnosis.
Keywords: lung adenocarcinoma; pathological grading; spectral CT; spectrum imaging; extracellular volume; Nomogram
肺癌目前是世界上发病率及死亡率最高的恶性肿瘤之一[1] 。相比于原位癌及微浸润性肺腺癌接近100%的术后10年无复发生存率,浸润性肺腺癌(ILA)的复发风险明显增高,即使是经手术切除的I期ILA,也因复发和转移导致5年生存率降至约80%[2] 。由于ILA生长模式呈异质性,组织学亚型和构成比例呈多样化,以往研究常根据主要组织学亚型进行预后分组[3] 。但随着研究进展,更多的复杂腺体结构(如筛状腺体、融合腺体)被证明与高级别生长模式有相似的不良预后[4] ,而且高级别亚型不是主要生长模式时,即使所占比例小于5%,仍是患者预后的独立影响因素[5] 。2020年国际肺癌研究协会提出了最新的ILA分级系统,正式将复杂腺体结构纳入高级别生长模式,以主要组织学生长模式和以20%为阈值的高级别生长模式相结合进行分级,表现出更佳的术后复发预测价值和预后分层价值[6] 。而且在术中快速冰冻病理中应用,表现出同样良好的预后判断,使该分级系统有望为选择肺叶切除还是亚肺叶切除提供一定的依据[7] 。一项纳入950例患者ILA的回顾性研究显示,按2020年版国际肺癌研究协会分级系统对2008~2016年病理结果进行重新分级,有近60%患者存在病理分级提升,提示相关研究亟待更新[8] 。
与常规CT相比,双层探测器的光谱CT利用先进的成像方式,实现同源、同时、同向成像,能提供更多的定量参数信息[9, 10] 。光谱CT不仅能提高CT值相近的实性肺结节鉴别诊断能力,在ILA病理分型与分化程度等方面有着良好诊断价值[11, 12] 。基于光谱CT碘浓度(IC)计算的细胞外容积(ECV)是对肿瘤细胞外基质进行量化的一种手段,以往研究发现其在多种恶性肿瘤的病理分化及分型鉴别中有较高的诊断价值[13-16] ,目前仅有少量研究证实ECV可应用于肺部肿瘤鉴别[15] ,鲜有肺癌病理分级相关研究。本研究旨在通过定量分析光谱CT的多参数定量成像,评估其在ILA病理分级中的诊断价值,以期为临床提供更准确、有效的诊断工具。
1" 资料与方法
1.1nbsp; 一般资料
回顾性选取2019年7月~2022年7月解放军总医院海南医院胸外科收治并经术后病理证实为ILA的患者。纳入标准:术前 2周内接受光谱 CT增强检查明确为实性肺结节;由手术病理诊断为ILA;CT检查前未接受抗肿瘤治疗;临床及影像学资料完整;图像质量满意;无其他癌症病史。排除标准:CT显示为磨玻璃结节;对造影剂过敏。最终纳入61例ILA患者,其中男29例,女32例,年龄34~95(60.07±10.82)岁;有吸烟史18例。本研究经中国人民解放军总医院医学伦理委员会审批通过(审批号:S2021-701-01)。
1.2" 仪器与方法
1.2.1" 光谱CT检查方法" "检查仪器为Philips IQon Spectral CT扫描仪,检查前对患者进行呼吸屏气训练,检查时患者平躺,双臂自然上举,保持呼吸平稳,行胸部平扫、动脉期和静脉期增强扫描,扫描范围由肺尖扫描至肺底。采用高压注射器经肘正中静脉注射非离子碘对比剂碘佛醇 1.2 mL/kg(IC: 320 mg/mL),流率3.0 mL/s,注射对比剂后25 s采集动脉期、55 s采集静脉期。主要参数设置:管电压120 kVp,管电流采用200 mAs,转速0.75 s/周,重建层厚0.67 mm。
1.2.2" 图像重建及评估" "扫描后将图像自动生成光谱基数据,所有数据传入飞利浦星云工作站(Intelli Space Portal V12.0),基于光谱基数据重建出单能量CT图、IC及有效原子序数(Zeff)图,并将动脉期、静脉期光谱基数据导入Multiphase Analysis软件生成ECV图。由1位具有30年工作经验的副主任医师和1位具有15年工作经验的主管技师进行测量分析,若有异议则协商决定。在重建图像的横断面上选取肿瘤最大层面实质区域勾画感兴趣区域(ROI),保证在同一患者保持ROI基本一致,其范围包括病灶所在层面的 1/2~2/3,避开非肿瘤部位、水肿区及血管伪影。观察并记录常规CT信息:肿瘤大小(长、短径)、分叶征、毛刺征、胸膜凹陷征及空泡征。测量增强后动脉期及静脉期光谱CT信息:IC、标准化碘浓度(NIC),其中NIC=ICROI/IC动脉,动脉为相同层面主动脉或颈动脉;Zeff值;单能量CT值(CT40 keV、CT70 keV)及光谱曲线斜率K值=(CT40 keV-CT70 keV)/30;ECV,ECV(%)=(1-红细胞压积)×(ICROI/IC动脉)×100,其中红细胞压积于检查前3 d内采集;APall为动脉期联合模型 (IC+NIC+Zeff+ECV);VPall为静脉期联合模型(IC+NIC+Zeff+ECV)。
1.2.3" 病理分级" "按照2020年版国际肺癌研究协会分级系统:G1级,肿瘤主要以贴壁样生长,无或少于20%高级别生长模式;G2级,肿瘤主要以腺泡状、乳头状生长为主,无或少于20%高级别生长模式;G3级,高级别生长模式占20%或以上。将G1~G2级划分为低级别组,共31例;G3为高级别组,共30例。
1.3" 数据统计与分析
所有数据均通过SPSS26.0软件进行分析。符合正态分布的计量资料表示为均数±标准差,不符合则以中位数(上下四分位数)表示,两组比较采用独立样本t检验或Mann-Whitney U检验进行检验。计数资料以n(%)表示,组间比较采用χ2检验。对动、静脉期差异均有统计学意义的定量参数,纳入Logistic回归分析,构建动脉期及静脉期联合模型,绘制ROC曲线,计算AUC检验各参数的诊断效能,并使用约登指数确定各参数的最佳阈值。使用 “rms”程序包将动脉期联合模型以列线图形式可视化,并用 HosmerLemeshow 检验和校准曲线评估列线图的拟合优度和校准度。最后采用决策曲线分析(DCA)评估列线图的临床实用性。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 两组间临床特征和肿瘤形态学参数比较
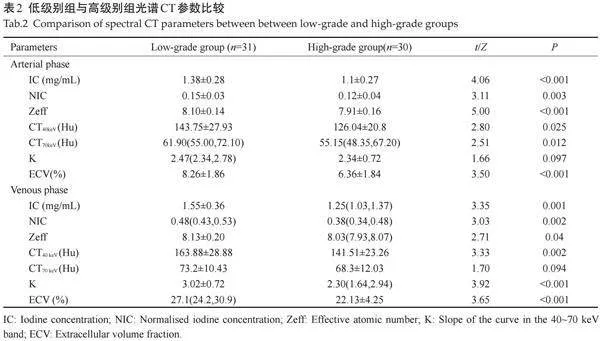
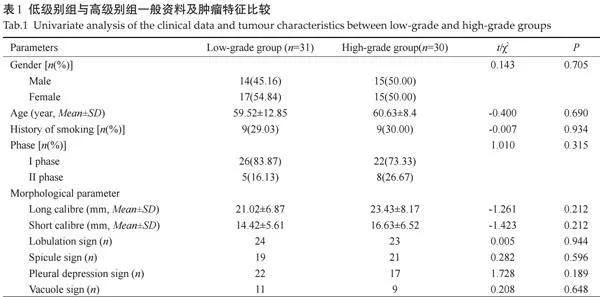
低级别组与高级别组在临床特征(性别、年龄、吸烟史、分期)及形态学参数(分叶征、毛刺征、胸膜凹陷征及空泡征)方面的差异均无统计学意义(Pgt;0.05);高级别组肿瘤长径及短径与低级别组的差异无统计学意义(Pgt;0.05,表1)。
2.2" 两组间光谱定量参数比较
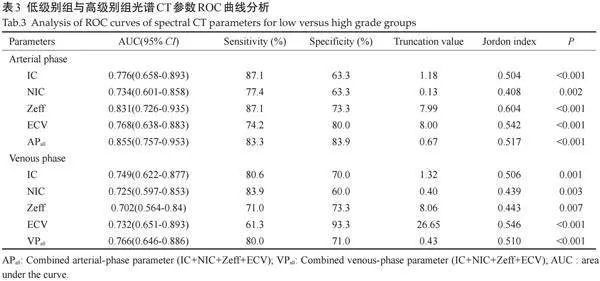
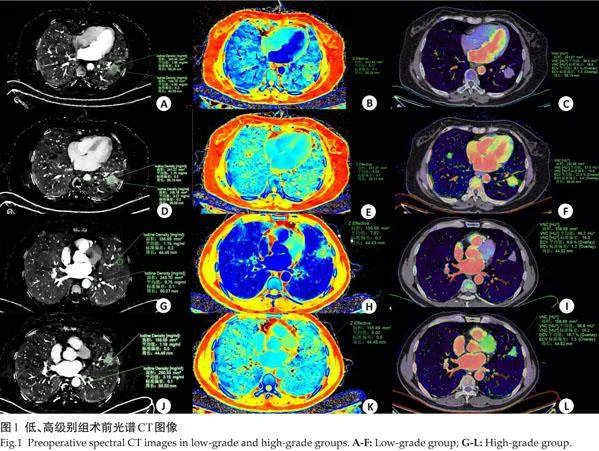
低级别组动脉期CT40keV、CT70keV、IC、NIC、Zeff、 ECV值高于高级别组(Plt;0.05);低级别组静脉期CT40keV、K值、IC、NIC、Zeff、ECV值高于高级别组(Plt;0.05,表2、图1)。
2.3" 光谱CT对高级别组/低级别组ILA的诊断效能分析
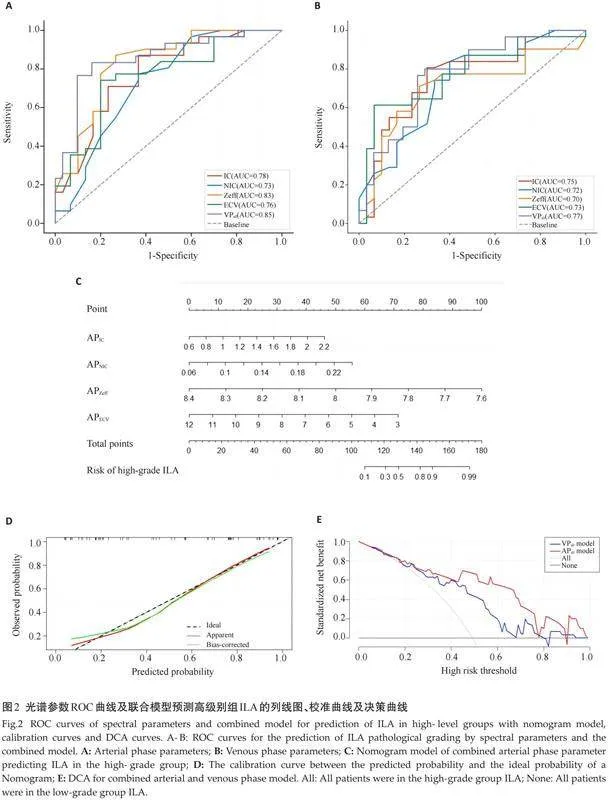
ROC 曲线分析示,动脉期IC、NIC、Zeff、ECV值诊断效能均高于静脉期,并以动脉期 Zeff的区别效能最好(AUC=0.831),当Zeff 阈值为7.99时,其敏感度、特异度分别为87.1%、73.3%。以单因素分析中动脉期及静脉期差异均有统计学意义的光谱参数为自变量构建Logistic模型,结果提示动脉期联合模型诊断效能良好,AUC为0.855,敏感度为83.33%,特异度为83.90%(表3、图2A~B)。以动脉期联合模型绘制列线图(图2C)。HosmerLemeshow检验提示该模型无过度拟合(χ2=9.799,P=0.279)。校准曲线显示动脉期联合模型列线图鉴别高低级别组概率与实际概率之间一致性良好,平均绝对误差为0.032(图2D)。DCA显示动脉期联合模型较静脉期联合模型临床获益率更高(图2E)。
3" 讨论
肺癌属临床上最常见的恶性肿瘤之一,而肺腺癌作为最常见的非小细胞肺癌,一直是研究的热点[1] 。不同于磨玻璃成为为主的肺腺癌,影像学表现为实性结节的肺腺癌在病理组成上有很强的异质性,更容易表现为多种生长模式并存[11] 。既往研究显示,肺腺癌中G3级病理亚型的预后比G1~2级差,更容易发生淋巴结转移和局部复发,导致远期生存率明显降低[12] 。肺癌的正确诊断与分级是提高预后的关键,但治疗前穿刺活检不能完全代表病变的性质,还有气胸、出血、活检失败等风险。光谱CT不仅能无创地对肺结节进行定性评估,还能通过单能量成像及物质分离成像技术,提供更多定量参数信息,提高诊断的准确性[10, 11] 。因此,在治疗前运用光谱CT准确评估ILA的病理分级在临床上具有重要意义。
本研究结果显示,高级别组与低级别组在形态学表现的差异并无统计学意义,与以往研究结果不一致[11, 12, 17] 。原因可能是:本研究的样本量较小;本研究大部分为I期ILA(26/31、22/30),直径多小于2 cm,相比以往类似研究多为进展期且大于3 cm肺癌,影像学特征尚不典型。本研究中低级别组的部分光谱参数(动脉期CT40 keV、CT70 keV以及静脉期CT40 keV、K值)均高于高级别组,可能的原因是高级别组生长模式如实性型,具有更多的肿瘤实质成分与更高的组织坏死率[11] ,同时其内部实质成分较为丰富,肿瘤结构相对致密;相对地,低级别组生长模式如贴壁型,则具有更丰富的间质,其内部结构相对松散[18, 19] ,形成不同的光谱曲线,说明光谱参数可以对其进行较好的区分。
Zeff为化合物或各种物质混合物的平均原子序数,通过定量分析可以将在CT值相近而原子序数不同的物质进行有效区分[20] 。本研究显示,Zeff在低级别组ILA中显著高于高级别组,可能是高级别组中实体型及微乳头型肺腺癌生长速度较快,其内部更容易出现组织坏死,所以物质含量相对较少,与以往研究一致[21, 22] 。此外,在增强期中,肿瘤内微血管网络可充盈碘剂,而碘的有效原子序数大于人体内大部分组织,高级别组碘浓度显著低于低级别组,所以这也可能是造成Zeff也低于低级别组的原因。而在光谱CT图像测量的碘浓度,其主要受病灶的微血管形成及分布影响,不易受到其他因素干扰,准确性较高[23] 。以往研究证实,碘浓度在肺癌诊断中和预后预测有重要作用,被证实为评估肿瘤血管生成和预后的有效指标[24, 25] ,如有研究使用IC及NIC识别肿瘤细胞含量≥20%区域,可以指导临床更有效地获取穿刺病理[30] 。本研究结果显示,病理分级越低的ILA,其IC与NIC越高,同时还发现IC比NIC诊断效能更高,提示IC能更准确地反映肿瘤的微循环情况,进而更好地区分ILA病理分级,可能是因为实性结节中坏死区域血供不佳,并且NIC更易受到主动脉IC变化的影响。
细胞外基质是细胞外微环境的重要部分,在肺癌中发挥着促进血管生成、激活肿瘤增殖等关键作用[26] ,基于光谱CT碘图及红细胞压积的量化方法是目前较为可靠的无创性ECV测量方法[27] 。既往研究发现ECV值与肝癌、宫颈癌、肾癌的病理分级及预后相关[13-16] ,在肺癌淋巴结转移评估有良好表现[28] 。有研究发现ECV值与肺结节纤维化的程度相关,进而可用于鉴别肺癌与良性病变[15] 。本研究对ECV值在肺腺癌的应用中进行了探索,发现高级别组动脉期及静脉期ECV值均低于低级别组,提示低级别组ILA细胞外基质量更多,可能与高级别恶性肿瘤其内部更容易出现组织坏死有关,而坏死可导致其内部纤维成分减少[21, 26] 。
本研究还发现动脉期及静脉期低级别组IC、NIC、Zeff、ECV值均高于高级别组(Plt;0.05),且都具有较高的区分ILA病理分级的价值(AUC:0.702~0.831),这与以往研究[11] 结果类似。本研究结果显示,动脉期中上述参数的诊断效能中比静脉期高,这与既往研究结果相似[12] 。一般来说,肿瘤恶性程度越高,肿瘤血管生长越快,微血管数量越多,血液供应越充足[22] ,可能是因为肺癌微血管网络迂曲、曲折,碘剂的流速往往较慢,导致低级别组中肺腺癌细胞中微血管充盈不良在动脉期更显著[31] ,随着注射时间的增加,高级别组肿瘤细胞内在静脉期扫描时滞留的碘剂也相对增加,导致在静脉期不同病理分级肺腺癌之间的差异减小,因而认为动脉期光谱参数可以更好地反映肿瘤微循环,更准确地指导肺腺癌病理分级。本研究将上述光谱参数在相应分期构建联合模型,结果同样显示动脉期联合模型相较于静脉期诊断效能提高;基于预测模型建立的列线图,通过相关参数进行评分,可以较为准确地判断高级别组ILA,且矫正曲线及决策曲线提示该模型拟合程度及精准度较好,具有良好的临床应用价值。
本研究的局限性:研究结果受到相对较小的样本量限制,由于G1级ILA非常少,所有患者仅分为两组,在G1级和G2级ILA之间是否存在差异同样需要进一步扩大样本量研究;只分析了肿瘤最大层面的图像,有限的图像可能不能完全描述整个肿瘤,截面的选择也可能影响结果;由于设备引进时间较短,缺乏随访数据,无法验证患者预后和研究结果之间的相关性。未来,光谱CT定量参数与影像组学、人工智能的结合,有望对ILA分级和预后进行更精准预测,ECV值作为其衍生参数,在肺部肿瘤中的应用同样是十分有潜力的。
综上所述,光谱CT多参数定量成像分析为区分ILA病理分级提供了一种可靠且无创的方法,从而指导术前治疗选择合适的方案,具有较高临床应用价值。
参考文献:
[1]" "Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2]" "Travis WD, Brambilla E, Noguchi M, et al. International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society: international multidisciplinary classification of lung adenocarcinoma: executive summary[J]. Proc Am Thorac Soc, 2011, 8(5): 381-5.
[3]" "Travis WD, Brambilla E, Burke AP, et al. WHO classification of tumours of the lung, pleura, thymus and heart(4th edition)[M]. IARC: Lyon, 2015:1-151.
[4]" "Rokutan-Kurata M, Yoshizawa A, Nakajima N, et al. Discohesive growth pattern (Disco-p) as an unfavorable prognostic factor in lung adenocarcinoma: an analysis of 1062 Japanese patients with resected lung adenocarcinoma[J]. Mod Pathol, 2020, 33: 1722-31.
[5]" "Lee G, Lee HY, Jeong JY, et al. Clinical impact of minimal micropapillary pattern in invasive lung adenocarcinoma: prognostic significance and survival outcomes[J]. Am J Surg Pathol, 2015, 39(5): 660-6.
[6]" "Moreira AL, Ocampo PSS, Xia YH, et al. A grading system for invasive pulmonary adenocarcinoma: a proposal from the international association for the study of lung cancer pathology committee[J]. J Thorac Oncol, 2020, 15(10): 1599-610.
[7]" "Fan JQ, Yao J, Si HJ, et al. Frozen sections accurately predict the IASLC proposed grading system and prognosis in patients with invasive lung adenocarcinomas[J]. Lung Cancer, 2023, 178: 123-30.
[8]" "Deng CQ, Zheng Q, Zhang Y, et al. Validation of the novel international association for the study of lung cancer grading system for invasive pulmonary adenocarcinoma and association with common driver mutations[J]. J Thorac Oncol, 2021, 16(10): 1684-93.
[9]" "Greffier J, Villani N, Defez D, et al. Spectral CT imaging: technical principles of dual-energy CT and multi-energy photon-counting CT[J]. Diagn Interv Imaging, 2023, 104(4): 167-77.
[10]" Rassouli N, Etesami M, Dhanantwari A, et al. Detector-based spectral CT with a novel dual-layer technology: principles and applications[J]." Insights Imaging, 2017, 8(6): 589-98.
[11]" Li Q, Li X, Li XY, et al. Histological subtypes of solid-dominant invasive lung adenocarcinoma: differentiation using dual-energy spectral CT[J]. Clin Radiol, 2021, 76(1): 77.e1-77.e7.
[12]" Mu RH, Meng ZN, Guo ZX, et al. Dual-layer spectral detector computed tomography parameters can improve diagnostic efficiency of lung adenocarcinoma grading[J]. Quant Imaging Med Surg, 2022, 12(9): 4601-11.
[13]" Adams LC, Jurmeister P, Ralla B, et al. Assessment of the extracellular volume fraction for the grading of clear cell renal cell carcinoma: first results and histopathological findings[J]. Eur Radiol, 2019, 29(11): 5832-43.
[14]" 崔凤娇, 李" 琳, 罗娅红, 等. 应用细胞外体积分数评估肝细胞癌分化程度的初步探索[J]." 肿瘤影像学, 2020, 29(3): 303-7.
[15]" Jiang XA, Ma QY, Zhou TH, et al. Extracellular volume fraction as a potential predictor to differentiate lung cancer from benign lung lesions with dual-layer detector spectral CT[J]. Quant Imaging Med Surg, 2023, 13(12): 8121-31.
[16]" Wang W, Fan XF, Yang J, et al. Preliminary MRI study of extracellular volume fraction for identification of lymphovascular space invasion of cervical cancer[J]. J Magn Reson Imaging, 2023, 57(2): 587-97.
[17]" 张" 莹, 傅奕铖, 余" 烨, 等. 基于2011及2020年版病理分级系统双层探测器光谱CT评估实性肺腺癌病理分级的价值[J]. 中华放射学杂志, 2022, 56(6): 623-30.
[18] Cohen JG, Reymond E, Jankowski A, et al. Lung adenocarcinomas: correlation of computed tomography and pathology findings[J]. Diagn Interv Imaging, 2016, 97(10): 955-63.
[19]" Travis WD, Brambilla E, Noguchi M, et al. Diagnosis of lung adenocarcinoma in resected specimens: implications of the 2011 international association for the study of lung cancer/american thoracic society/european respiratory society classification[J]. Arch Pathol Lab Med, 2013, 137(5): 685-705.
[20]" Lin LY, Zhang Y, Suo ST, et al. Correlation between dual-energy spectral CT imaging parameters and pathological grades of non-small cell lung cancer[J]. Clin Radiol, 2018, 73(4): 412.e1-412.e7.
[21]" Hong JH, Park S, Kim H, et al. Volume and mass doubling time of lung adenocarcinoma according to WHO histologic classification[J]. Korean J Radiol, 2021, 22(3): 464-75.
[22]" Satoh A, Shuto K, Okazumi S, et al. Role of perfusion CT in assessing tumor blood flow and malignancy level of gastric cancer[J]. Dig Surg, 2010, 27(4): 253-60.
[23]" Li Q, Li X, Li XY, et al. Spectral CT in lung cancer: usefulness of iodine concentration for evaluation of tumor angiogenesis and prognosis[J]. AJR Am J Roentgenol, 2020, 215(3): 595-602.
[24]" Deng LN, Yang JJ, Zhang MT, et al. Whole-lesion iodine map histogram analysis versus single-slice spectral CT parameters for determining novel International Association for the Study of Lung Cancer grade of invasive non-mucinous pulmonary adenocarcinomas[J]. Diagn Interv Imaging, 2023: S2211-S5684(23)00238-3.
[25]" Iwano S, Ito R, Umakoshi H, et al. Evaluation of lung cancer by enhanced dual-energy CT: association between three-dimensional iodine concentration and tumour differentiation[J]. Br J Radiol, 2015, 88(1055): 20150224.
[26]" Götte M, Kovalszky I. Extracellular matrix functions in lung cancer[J]. Matrix Biol, 2018, 73: 105-21.
[27]" Treibel TA, Fontana M, Steeden JA, et al. Automatic quantification of the myocardial extracellular volume by cardiac computed tomography: synthetic ECV by CCT[J]. J Cardiovasc Comput Tomogr, 2017, 11(3): 221-6.
[28]" Guo WX, Lv BL, Yang T, et al. Role of dynamic contrast-enhanced magnetic resonance imaging parameters and extracellular volume fraction as predictors of lung cancer subtypes and lymph node status in non-small-cell lung cancer patients[J]. J Cancer, 2023, 14(16): 3108-16.
[29]" Yu YX, Wang XM, Shi C, et al. Spectral computed tomography imaging in the differential diagnosis of lung cancer and inflammatory myofibroblastic tumor[J]. J Comput Assist Tomogr, 2019, 43(2): 338-44.
[30]" Ma YQ, Li SL, Huang G, et al. Role of iodine density value on dual-energy CT for detection of high tumor cell proportion region in lung cancer during CT-guided transthoracic biopsy[J]. Eur J Radiol, 2023, 160: 110689.
[31]" 李慎江, 刘士远, 肖湘生. CT、MR动态增强在评价孤立性肺结节血流模式中的作用[J]. 中华放射学杂志, 2005, 39(1): 9-10.
(编辑:林" 萍)
作者简介:朱紫瑞,在读硕士研究生,E-mail: zzr15692537801@163.com
通信作者:陈志晔,副主任医师,副教授,硕士生导师,Email: yyqf@hotmail.com
