基于影像组学预测肝细胞癌诊疗及预后评估的研究进展
2024-10-30朱莉杉唐大伟蔡晓钧李菁
摘要:作为全球最普遍的癌症之一的肝细胞癌(HCC),存在着复发率高、预后较差等问题。影像组学是一种拥有巨大潜力的新兴交叉学科,因其能无创获取肿瘤异质性信息而在HCC等癌症的诊疗及预后评估上具有广阔的应用前景。本文将从影像组学的工作流程,以及其在HCC的鉴别诊断、病理分级、免疫组化标记物的术前预测、预后预测和疗效评估等方面展开综述,并总结影像组学技术尚存在的局限及未来的发展方向,通过梳理影像组学在HCC诊疗及预后评估上的最新研究进展,旨在为未来HCC的诊治提供新的参考和思路。
关键词:肝细胞癌;影像组学;鉴别诊断;预后评估
Research progress in predicting the diagnosis, treatment and prognosis of hepatocellular carcinoma based on radiomics
ZHU Lishan1, TANG Dawei1, CAI Xiaojun2, LI Jing3
1Medical College, Hunan University of Chinese Medicine, Changsha 410000, China; 2First Clinical College of Traditional Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410007, China; 3Department of Oncology, the First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha 410007, China
Abstract: Hepatocellular carcinoma (HCC), as one of the most prevalent cancers globally, confronts challenges such as a high recurrence rate and poor prognosis. Radiomics is an emerging interdisciplinary discipline with significant potential, showing broad applications in the diagnosis, treatment, and prognosis evaluation of HCC and other cancers. This is attributed to its capacity to noninvasively acquire tumor heterogeneity information. In this paper, we comprehensively examined the workflow of radiomics, exploring its applications in the differential diagnosis, pathological grading, preoperative prediction of immunohistochemical markers, prognosis prediction, and efficacy evaluation of HCC. Additionally, we summarized the limitations and outlined future directions for the development of radiomics technology, with the aim of providing a comprehensive overview of the latest research progress in the diagnosis and prognosis of HCC. This review also introduces novel references and ideas for the future diagnosis and treatment of HCC.
Keywords: hepatocellular carcinoma; radiomics; differential diagnosis; prognostic evaluation
原发性肝癌是我国常见的恶性肿瘤之一。其中,HCC是原发性肝癌最常见的类型,同时也是全球第三大常见癌症相关死亡原因[1]。由于基因学、分子生物学和病理学的发展,近年来人们对于HCC的发病机制的认识得到显著提高[2]。但是HCC具有显著的异质性和高复发率的特点,预防HCC发生的危险因素是降低死亡率的最佳策略[3]。因此精准的术前诊断和预后疗效评估就显得尤为重要。影像组学是对标准医学影像的定量分析,利用先进的图像分析工具,结合统计学分析,高通量的从CT、MR和PET中提取隐藏在医学图像中的生物学本质,并以此提供临床决策支持,以创建诊断、分期,治疗反应预测和预后模型[4]。传统上,医学影像的诊断都是通过主观定性的方式进行评估,并且极大多数情况下,医生的经验是诊断的关键。相较于肉眼所获得的信息,影像组学可通过自动或半自动挖掘获得更多信息[5]。近年来,影像组学获得了空前的进展,其实现的无侵袭病变的准确定量评估,对HCC的诊断、治疗和预后具有重要价值[6]。
1" 影像组学流程
1.1" 图像采集与分割
开展影像组学的第一步是图像采集。增强CT、MRI和超声是常见的图像采集方法。通过影像学方法采集临床图像后进行图像分割。图像分割指研究者对经过筛选后的影像图像进行感兴趣区(ROI)勾画。它依赖于大量的医学图像以及相应的临床数据来进行。ROI分割是开展影像组学的基础步骤,分为手动、半自动以及自动3种分割方法[7]。 有经验的影像科医生可通过手动分割精准勾画肿瘤范围,但这也带来了耗时且存在观察者之间和观察者内部的可变性以及缺乏可重复性等局限[8]。有研究通过比较半自动分割和手动分割的影像组学特征在20例非小细胞肺癌肿瘤中的不同表现,发现与手动分割相比,半自动分割生成的影像组学特征具有更强的稳定性和更高的可重复性[9]。近些年来,人工智能(AI)的迅速发展缩短了肿瘤分割时间的同时也减小了误差[10]。尽管如此,由于目前肿瘤分割并没有一个统一的金标准,所以无论是自动、半自动或是手动的分割方法都仍面临一定的挑战。在未来,我们期望基于AI的影像组学能够在图像分割上得到更广泛的应用,并逐渐实现图像采集的标准化,以应对图像采集具有异质性的难题。
1.2" 图像特征提取与选择
影像组学特征可以大致分为5大类:直方图特征、纹理特征、基于模型的特征、基于变换的特征以及形状特征。对特征进行分类并熟悉有利于开展图像特征的提取与选择。常用的特征选择方法包括相关性分析、信息增益、主成分分析等[11]。同时,由于从图像中提取出来的许多特征较为冗余,若直接将其应用建模会导致过度拟合,所以需要根据实际需求对大量的特征候选项进行移除或变换,这个过程称之为降维[12]。近年来,深度学习(DL)和机器学习(ML)技术正逐渐成为实现更准确的特征提取与选择的有用工具[13]。DL算法可被用于完全自动化的特征提取和建模步骤,而不需要进一步的人工干预[14]。尽管如此,由于标准化定义及统一的图像处理过程的缺乏,因此给处理结果的可重复性和可比性带来了挑战。基于此,有学者于2017年提出了PyRadiomics平台,旨在建立影像组学分析的参考标准,提升了开展特征提取与选择工作的便利性及不同数据之间的整合力[15]。
1.3" 建模
在影像组学分析中,单因素分析往往不能得到可靠的结果,通常需要通过ML算法,利用多变量模式来建立分类或预测模型,以测得目标变量[16]。 关于影像组学建模的方法,逻辑回归模型因其简单易行,成为最受欢迎且常用的监督分类器[17]。另外,常用的ML模型还有随机森林、支持向量机、AdaBoost、XGBoost、K邻近算法等。在理想的情况下,应采用多种ML方法,实现多重建模模式。为获得更佳的模型效能,可将影像组学标签与临床数据相结合,将基因组学、病理组学、免疫分子标志物、肿瘤微环境等纳入模型建立的特征范畴,充分利用大数据算法,如DL、AI等。DL是一个广阔的、技术性的、动态发展的领域。有研究表示,提供足够的训练数据,DL所应用的卷积神经网络和全卷积神经网络所构建的模型性能优于特征选择模型性能,因其不是从有限的特征集合中选择特征,而是从图像数据本身构建最优特征[18]。至于其训练特征的来源限制,也通过最近的迁移学习等策略成功解决。
1.4" 模型验证
在对预测模型的性能进行评估时,可以采用ROC曲线和曲线下面积(AUC)、预测模型的准确性、敏感度、特异度、阳性预测值和阴性预测值等方式[19]。有研究在2017年提出创建一个数据库,将数百万患者的影像数据联系起来,形成庞大的快速学习医疗网络,并提出影像组学质量评分以评估模型的效能[20],目前影像组学质量评分在影像组学模型评估上已有应用,但其提出的快速学习医疗网络具有相当大的数据管理障碍,必须实现数据共享化、软件代码的公开化。此外,校准曲线被用于评估模型结果和观察结果间的一致性,有研究提出的决策曲线分析被用于评估临床预测模型[21],传统的诊断指标如敏感度、特异度和AUC仅测量预测模型的诊断准确性,未能考虑特定模型的临床效用,而决策曲线这种理念的提出满足了临床决策的实际需要,在临床分析中的应用日益广泛[22]。一个未经验证的模型,其价值是有限的,验证是完整的影像组学分析中不可缺少的组成部分。模型必须经过内部验证,最好是经过外部验证。然而,外部验证的数据集面临着图像扫描参数、扫描仪器、ROI勾画等的不一致。要解决模型的可重复性难题,需要实现检测的标准化。此外,建议发表影像组学结果的未来出版物应提供以下数据:成像方案、分析扫描参数、VOIs的分割、提取特征的详细说明(包括公式)以及使用的建模方法(含有代码数据)。但分享、存储和管理数据需要多中心的合作与努力,此方面,癌症成像档案、定量成像网络、定量成像生物标志物联盟等做出了一定贡献。尽管影像组学的各个流程仍然存在着一些缺陷,但目前已有越来越多的研究者投身其中,不断提出更多更新的解决方案。
2" 诊疗及预后疗效评估
2.1" 影像组学在HCC鉴别诊断上的研究进展
由于HCC的预后在很大程度上取决于患者肿瘤筛查阶段,因此早期对癌症的准确鉴别诊断和评估于患者而言至关重要[23]。尽管HCC的诊断可以根据动态多相CT或MRI的特征增强模式建立且无需进一步的病理学证实,但仍然存在诸如肝细胞腺瘤或混合型肝内胆管细胞癌等恶性肿瘤因其与HCC在常规影像学上的相似性[24],使得HCC的准确鉴别诊断带来了一定的困难和挑战。由此,影像组学应运而生,并在HCC的鉴别诊断上发挥了不可替代的作用。一项针对85例患者的回顾性研究通过采用MRI影像组学的分析方法,对病患的临床图像采集并进行ROI分割后,利用PyRadiomics平台提取1419个影像组学特征并进行降维,最后采用支持向量机进行特征分类评估,结果显示基于MRI的影像组学特征分析对HCC、胆管细胞癌和混合型肝内胆管细胞癌的鉴别诊断具有良好的预测效果[25]。有研究通过将85例HCC和46例肝细胞腺瘤病患随机分为训练集和测试集,同时行CT检查和临床分析且提取影像组学特征后,构建了影像组学列线图,并通过AUC置信区间的比较,认为基于CT的影像组学诺如图是在非肝硬化肝脏中鉴别HCC和肝细胞腺瘤的有力工具[26]。有学者利用多变量 Logistic 回归模型对经手术或穿刺病理证实的124 例原发性肝癌进行比较,并分析ROC曲线面积和肿瘤异质性信息,说明了灰阶超声影像组学的方法对于HCC和肿块型胆管细胞癌的鉴别中有较高的应用诊断价值[27]。故不论是基于MRI、CT或超声的影像组学均有利于HCC的鉴别诊断。
2.2" 影像组学在HCC病理分级上的研究进展
既往研究表明,代表肿瘤生物学行为的组织学分级是与术后HCC复发相关的重要预后指标之一[28]。对于没有门静脉肿瘤血栓形成的HCC患者,Edmondson-Steiner分级I~II和III~IV级的5年肿瘤特异性生存率分别为81%和18%,与高分化的HCC相比,低分化的HCC通常代表着低生存率、高风险率、高随访率、高复发率[29]。近年来,CT纹理特征、非增强MRI影像组学特征和Gd-DTPA 造影增强 MRI 影像组学已被潜在地应用于术前HCC组织学分级的预测,有望在一定程度上取代具有侵入性与采样误差的活检[30]。有研究基于门静脉影像组学特征的造影剂增强CT于术前区分HCC分级,AUC为0.904~0.937,诊断效能高于基于Gd-DTPA增强MRI图像的纹理特征所构建的模型,但该研究仅考虑门静脉期,且未将临床因素与影像组学标签结合训练模型,也未实现多模态影像组学模型[31]。有研究基于钆-乙氧基苄基二乙烯三胺五乙酸(Gd-EOB-DTPA)增强MRI预测HCC的组织学分级[30]。Gd-EOB-DTPA是一种肝细胞特异性造影剂,多应用于HCC复发预测。该研究训练集AUC为0.805~0.975,测试集AUC为0.777~0.944,并实现了与临床参数的结合。目前,影像组学与多因素结合应用于HCC的病理分级,取得了较好的成效,但多为单中心研究,且研究结果仅局限于区分高级别HCC与低级别HCC,并不能实现E-S级别区分。
2.3" 影像组学在HCC免疫组化标记物上的术前预测
研究表明,影像组学不仅可以对HCC进行鉴别诊断,还可以对如Ki-67、CK19等免疫组化标记物进行术前预测,从而更好地有助于患者的治疗[32]。HCC患者中Ki-67的高表达被认为是该恶性疾病快速发展和不良预后的标志[33]。有研究分析了57例使用3 T MR扫描仪进行治疗前MRI的HCC患者的直观图参数,发现了表观扩散系数图和MRI的全肿瘤直方图衍生参数可能有助于预测HCC的Ki-67标记指数[34]。CK19表达是经证实的HCC的独立预后预测因子之一[35]。有研究从227例单发HCC患者的多序列MR图像中提取647个影像组学特征,得出融合影像组学标签在训练和验证集中的AUC分别为0.951和0.822,认为基于钆塞酸增强MR图像的影像组学模型有利于预测 HCC 的 CK19状态;但该研究也存在CK19阳性HCC的样本量相对较小等局限[36]。也有学者认为基于多序列MRI影像组学特征的组合模型对HCC的CK19状态具有良好的预测效果[37],该研究为超过250例患者的多中心研究,验证了结果的可信度。PI3K是人类癌症中最常见的突变基因[38]。有学者通过对接受二代测序和术前造影增强CT的HCC患者进行模型训练和验证,分析其AUC下的面积表征模型性能,认为基于CT的影像组学模型有可能表征HCC中PI3K信号传导的改变[39]。综上所述,影像组学可以综合纳入多种免疫组化标记物,并促进有价值的术前预测和模型验证,以指导HCC的临床决策。
2.4" 影像组学在HCC上的预后预测和疗效评估
2.4.1" 微血管侵犯预测" "微血管侵犯是肿瘤细胞在由内皮组成的血管间隙内的侵袭,是HCC早期复发的重要指标,其存在预示着强侵袭性和低生存率,且仅在术后显微镜下的病理切片上可见[40]。年龄、肿瘤大小、血清甲胎蛋白、非平滑边缘、瘤周强化、影像组学标签为 微血管侵犯的独立预测因子[41-45]。有研究结合临床因素和从肝胆期图像得出的影像标签,建立预测模型,AUC为0.850~0.943 ,取得了较好的临床效应[46]。有研究开发了18F-FDG PET/CT的影像组学列线图来预测极早期和早期(BCLC 0、BCLC A)HCC患者的微血管侵犯状态,其M-PET/CT模型(0.891, 95% CI: 0.799~0.984)表现出与增强CT模型(0.909, 95% CI: 0.869~0.928)相似的性能,但相较于钆塞酸增强MRI模型性能还是稍有逊色[47]。也有研究通过整合来自临床、实验室、成像和组织病理学指标的多模态大规模数据的概念,开发了用于HCC和TACE预后危险因素的多任务DL算法;但其并未进一步研究从多参数MRI中提取信息[48]。就目前,影像组学在HCC微血管侵犯的术前预测上取得了较好的成效。未来,多中心验证、基因组信息与模型相结合的实现也定会推动该研究的进一步发展。
2.4.2" 复发及生存期预测" "临床上,肝切除术是保留肝功能的早期HCC患者的治疗首选[49]。然而,肝切除术后的长期预后仍然不容乐观,5年生存率仅为25%~55%,5年复发率为60%~100%[50-53]。多发性肿瘤、显微镜下血管浸润、浆膜浸润、肿瘤标志物、HCC高分级是影响早期复发的已知临床病理因素。影像学特征,如肿瘤周围增强,肿瘤周围低信号,不规则肿瘤边缘和动脉边缘增强,也与HCC的早期复发有关。然而,晚期复发与潜在的肝脏疾病有关,例如肝硬化等[54]。有研究通过COX回归分析影像组学特征,并比较不同阶段(动脉期、门静脉期和双期)和ROI区域(肿瘤、肿瘤周围3 mm、肿瘤周围5 mm)的预测潜力,构建CR模型,预测肝切除术后患者的总生存期;然而该模型的实用性不足,无法自动勾勒ROI[55]。有研究基于多任务DL网络构建影像组学模型,结合临床因素,预测大血管浸润,取得较好成效[56]。有学者整合MRI影像组学特征和术前临床危险因素,预测HCC患者的5年生存率,该研究对比了4个序列,认为DCEIgt;DWIgt;T2WIgt;T1WI[57]。还有研究者基于DL分析对比增强超声(CEUS)预测无进展生存期,另一些人纳入低骨骼肌质量和脂肪组织作为影像组学标签,也取得了不错的成效[58, 59]。目前,临床因素、基因组学与影像组学相结合,采用多种成像模式,在预测HCC的复发及生存上取得了出色效应。
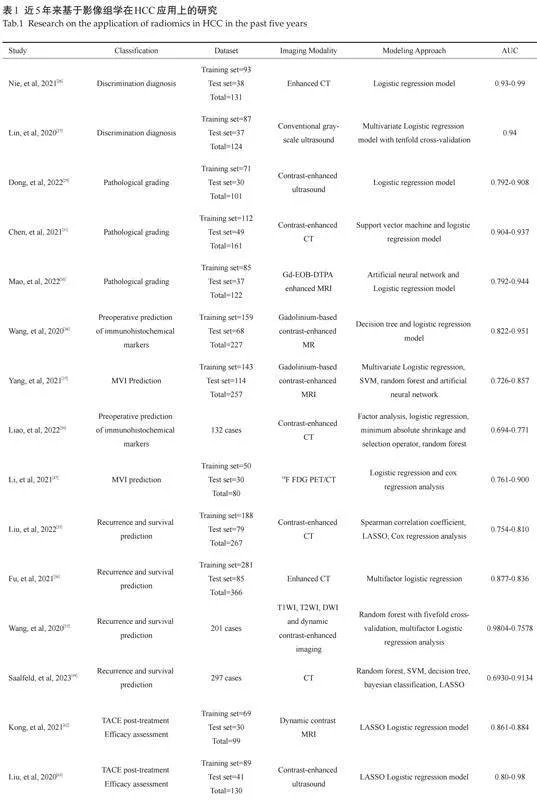
2.4.3" TACE术后疗效评估" "尽管早期HCC治疗推荐采用移植、切除、消融等治疗方法,但相当一部分HCC患者确诊时已处于中期。截至目前,经导管动脉化疗栓塞(TACE)为代表的局部治疗已成为中晚期HCC患者的重要治疗方法。与此同时,由于HCC的生物学行为具有高度的异质性,这给TACE术后的精准疗效评估带来了一定的局限[60]。由此,基于影像组学的分析模型逐渐架起了精准评估TACE术后疗效的桥梁。一项回顾性研究分析了88例接受TACE治疗的HCC患者,并提取了预处理CT的116个影像组学特征,同时采用使用Kaplan-Meier分析和Log-rank检验进行模型间的对比,认为基于影像组学特征和临床因素的联合评分模型能够更好地预测TACE术后疗效[61]。有研究分析了69例接受TACE治疗的中晚期HCC患者的TACE术前MRI图像,并通过对所有术前T2加权图像进行纹理特征提取、影像组学特征的选择和构建以及R分析,认为基于影像组学评分和临床预测因子的影像组学定量列线图预测模型可作为预测TACE术后疗效评估的有力工具[62]。有研究通过对89例HCC患者的TACE术前超声检查,分别构建和验证基于DL影像组学的造影剂增强超声模型(R-DLCEUS)、基于ML影像组学的CEUS模型时间强度曲线(R-TIC)和ML基于影像组学的B模图像模型(R-BMode),并采用DeLong检验比较不同的AUC,结果显示基于DL影像组学的CEUS模型可以准确且有效地预测TACE的术后疗效[63]。相比于传统的影像学方法,融合了影像组学的TACE疗法在术后疗效评估上显得更为精准。但目前影像组学模型尚处在初级阶段,仍需要大样本量和多中心验证来提高结果的准确性等问题,近些年来不断有学者采用影像组学模型方式,尝试解决临床问题(表1)。
3" 讨论与总结
影像组学在HCC的诊疗和预后评估中具有广阔的前景,包括诊断鉴别、病理分级、预后预测以及疗效评估等。但是,在临床实践之前,仍有需要克服的挑战与局限。第一,几乎所有的研究都是回顾性研究,且样本量少,缺乏外部多中心验证。第二,由于成像采集的异质性,分割策略、图像处理以及特征选择的不同,预测模型在临床实践中的可重复性有限。第三,AI计算算法需要专门的软件包,导致医疗成本增加。大多数工程硬编码特征很难被临床医生理解。工作流程包括成像采集、分割、特征提取、分析和建模,使其复杂多样,进一步限制了其临床应用;且尽管影像组学和AI已经被证明于HCC的临床应用有效,但其潜在的应用机制并不清楚,例如从高级分析中获得的纹理特征的相关性。第四,当模型在训练集中结果泛化有限时,会发生过度拟合,影响模型效能。
对此,我们提出一些改善策略来应对这些挑战:第一,要实现影像组学的标准化。基于影像组学的分析所涉及的每个步骤都需要优化和标准化,包括成像方案和参数的调整、(半)自动分割方法的开发以及算法和高通量分析建模方法的改进。第二,建立和推广成像和临床数据采集协议,确保学术界能够获得高质量的影像学特征和临床数据,进行多中心外部验证。第三,联合影像科医生、临床医生、肿瘤学家、统计学家和数据科学家,开发集成模型以推进临床应用,例如多组学数据集成(基因组学、DL、AI等),推动临床转化。第四,还应关注到影像组学在HCC的中医辨证分型当中的促进作用,为HCC的中医辨证论治提供更加客观化、标准化、深度化的新影像学工具[64]。
参考文献:
[1]" "Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2]" "Sartoris R, Gregory J, Dioguardi Burgio M, et al. HCC advances in diagnosis and prognosis: digital and Imaging[J]. Liver Int, 2021, 41(Suppl 1): 73-7.
[3]" "Forner A, Reig M, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-14.
[4]" "Guiot J, Vaidyanathan A, Deprez L, et al. A review in radiomics: making personalized medicine a reality via routine imaging[J]. Med Res Rev, 2022, 42(1): 426-40.
[5]" "Peng ZY, Wang YM, Wang YX, et al. Application of radiomics and machine learning in head and neck cancers[J]. Int J Biol Sci, 2021, 17(2): 475-86.
[6]" "Jiang C, Cai YQ, Yang JJ, et al. Radiomics in the diagnosis and treatment of hepatocellular carcinoma[J]. Hepatobiliary Pancreat Dis Int, 2023, 22(4): 346-51.
[7]" "Liu ZY, Wang S, Dong D, et al. The applications of radiomics in precision diagnosis and treatment of oncology: opportunities and challenges[J]. Theranostics, 2019, 9(5): 1303-22.
[8]" "Castaldo A, De Lucia DR, Pontillo G, et al. State of the art in artificial intelligence and radiomics in hepatocellular carcinoma[J]. Diagnostics, 2021, 11(7): 1194.
[9]" "Parmar C, Rios Velazquez E, Leijenaar R, et al. Robust Radiomics feature quantification using semiautomatic volumetric segmentation[J]. PLoS One, 2014, 9(7): e102107.
[10] Marschner S, Datar M, Gaasch A, et al. A deep image-to-image network organ segmentation algorithm for radiation treatment planning: principles and evaluation[J]. Radiat Oncol, 2022, 17(1): 129.
[11]" Zhu M, Li SJ, Kuang Y, et al. Artificial intelligence in the radiomic analysis of glioblastomas: a review, taxonomy, and perspective[J]." Front Oncol, 2022, 12: 924245.
[12] Mayerhoefer ME, Materka A, Langs G, et al. Introduction to radiomics[J]. J Nucl Med, 2020, 61(4): 488-95.
[13] Miranda J, Horvat N, Fonseca GM, et al. Current status and future perspectives of radiomics in hepatocellular carcinoma[J]. World J Gastroenterol, 2023, 29(1): 43-60.
[14] Park T, Yoon MA, Cho YC, et al. Automated segmentation of the fractured vertebrae on CT and its applicability in a radiomics model to predict fracture malignancy[J]. Sci Rep, 2022, 12(1): 6735.
[15] Mu W, Schabath MB, Gillies RJ. Images are data: challenges and opportunities in the clinical translation of radiomics[J]. Cancer Res, 2022, 82(11): 2066-8.
[16]" 李双双, 侯" 震, 刘" 娟, 等. 影像组学分析与建模工具综述[J]. 中国医学物理学杂志, 2018, 35(9): 1043-9.
[17] Tseng PY, Chen YT, Wang CH, et al. Prediction of the development of acute kidney injury following cardiac surgery by machine learning[J]. Crit Care, 2020, 24(1): 478.
[18] Bera K, Braman N, Gupta A, et al. Predicting cancer outcomes with radiomics and artificial intelligence in radiology[J]. Nat Rev Clin Oncol, 2022, 19(2): 132-46.
[19] Ren S, Zhang JJ, Chen JY, et al. Evaluation of texture analysis for the differential diagnosis of mass‑forming pancreatitis from pancreatic ductal adenocarcinoma on contrast-enhanced CT images[J]. Front Oncol, 2019, 9: 1171.
[20] Lambin P, Leijenaar RTH, Deist TM, et al. Radiomics: the bridge between medical imaging and personalized medicine[J]. Nat Rev Clin Oncol, 2017, 14(12): 749-62.
[21] Vickers AJ, Elkin EB. Decision curve analysis: a novel method for evaluating prediction models[J]. Med Decis Making, 2006, 26(6): 565-74.
[22] Yang T, Wu YH, Zuo Y, et al. Development and validation of prognostic nomograms and a web-based survival rate calculator for sarcomatoid renal cell carcinoma in pre- and post-treatment patients[J]. Transl Androl Urol, 2021, 10(2): 754-64.
[23]Jiang HY, Chen J, Xia CC, et al. Noninvasive imaging of hepatocellular carcinoma: from diagnosis to prognosis[J]. World J Gastroenterol, 2018, 24(22): 2348-62.
[24] 韩玉齐, 魏靖伟, 蒋涵羽, 等. 影像组学研究进展及其在肝癌中的临床应用[J]. 中国科学: 生命科学, 2020, 50(11): 1309-20.
[25] Liu XY, Khalvati F, Namdar K, et al. Can machine learning radiomics provide pre-operative differentiation of combined hepatocellular cholangiocarcinoma from hepatocellular carcinoma and cholangiocarcinoma to inform optimal treatment planning?[J]. Eur Radiol, 2021, 31(1): 244-55.
[26] Nie P, Wang N, Pang J, et al. CT-based radiomics nomogram: a potential tool for differentiating hepatocellular adenoma from hepatocellular carcinoma in the noncirrhotic liver[J]. Acad Radiol, 2021, 28(6): 799-807.
[27] 林" 莹, 冯" 湛, 蒋国平. 灰阶超声影像组学鉴别肝细胞肝癌与肿块型肝内胆管细胞癌的价值[J]. 中国医学影像学杂志, 2020, 28(4): 269-72.
[28] Zhou L, Rui JG, Zhou WX, et al. Edmondson‑Steiner grade: a crucial predictor of recurrence and survival in hepatocellular carcinoma without microvascular invasio[J]. Pathol Res Pract, 2017, 213(7): 824-30.
[29] Dong Y, Zuo D, Qiu YJ, et al. Prediction of histological grades and ki-67 expression of hepatocellular carcinoma based on sonazoid contrast enhanced ultrasound radiomics signatures[J]. Diagnostics, 2022, 12(9): 2175.
[30] Mao YF, Wang JC, Zhu Y, et al. Gd-EOB-DTPA-enhanced MRI radiomic features for predicting histological grade of hepatocellular carcinoma[J]. Hepatobiliary Surg Nutr, 2022, 11(1): 13-24.
[31] Chen W, Zhang T, Xu L, et al. Radiomics analysis of contrast-enhanced CT for hepatocellular carcinoma grading[J]. Front Oncol, 2021, 11: 660509.
[32]" Hectors SJ, Lewis S, Besa C, et al. MRI radiomics features predict immuno-oncological characteristics of hepatocellular carcinoma[J]. Eur Radiol, 2020, 30(7): 3759-69.
[33]Maruyama H, Yamaguchi T, Nagamatsu H, et al. AI‑based radiological imaging for HCC: current status and future of ultrasound[J]. Diagnostics, 2021, 11(2): 292.
[34] Hu XX, Yang ZX, Liang HY, et al. Whole-tumor MRI histogram analyses of hepatocellular carcinoma: correlations with Ki-67 labeling index[J]. J Magn Reson Imaging, 2017, 46(2): 383-92.
[35] Zhuo JY, Lu D, Tan WY, et al. CK19-positive hepatocellular carcinoma is a characteristic subtype[J]. J Cancer, 2020, 11(17): 5069-77.
[36] Wang WT, Gu DS, Wei JW, et al. A radiomics-based biomarker for cytokeratin 19 status of hepatocellular carcinoma with gadoxetic acid-enhanced MRI[J]. Eur Radiol, 2020, 30(5): 3004-14.
[37] Yang F, Wan YD, Xu L, et al. MRI-radiomics prediction for cytokeratin 19-positive hepatocellular carcinoma: a multicenter study[J]. Front Oncol, 2021, 11: 672126.
[38] Yue XT, Zhao YH, Xu Y, et al. Mutant p53 in cancer: accumulation, gain-of-function, and therapy[J]. J Mol Biol, 2017, 429(11): 1595-606.
[39] Liao HT, Jiang HY, Chen YT, et al. Predicting genomic alterations of phosphatidylinositol‑3 kinase signaling in hepatocellular carcinoma: a radiogenomics study based on next‑generation sequencing and contrast-enhanced CT[J]. Ann Surg Oncol, 2022. doi: 10.1245/s10434-022-11505-4.
[40]" Hu HT, Wang Z, Huang XW, et al. Ultrasound-based radiomics score: a potential biomarker for the prediction of microvascular invasion in hepatocellular carcinoma[J]. Eur Radiol, 2019, 29(6): 2890-901.
[41] Lee S, Kim SH, Lee JE, et al. Preoperative gadoxetic acid-enhanced MRI for predicting microvascular invasion in patients with single hepatocellular carcinoma[J]. J Hepatol, 2017, 67(3): 526-34.
[42]" McHugh PP, Gilbert J, Vera S, et al. Alpha-fetoprotein and tumour size are associated with microvascular invasion in explanted livers of patients undergoing transplantation with hepatocellular carcinoma[J]. HPB, 2010, 12(1): 56-61.
[43]" Renzulli M, Brocchi S, Cucchetti A, et al. Can current preoperative imaging be used to detect microvascular invasion of hepatocellular carcinoma?[J]. Radiology, 2016, 279(2): 432-42.
[44]" Ahn SY, Lee JM, Joo I, et al. Prediction of microvascular invasion of hepatocellular carcinoma using gadoxetic acid-enhanced MR and 18F-FDG PET/CT[J]. Abdom Imag, 2015, 40(4): 843-51.
[45] Kaibori M, Ishizaki M, Matsui K, et al. Predictors of microvascular invasion before hepatectomy for hepatocellular carcinoma[J]. J Surg Oncol, 2010, 102(5): 462-8.
[46] Yang L, Gu DS, Wei JW, et al. A radiomics nomogram for preoperative prediction of microvascular invasion in hepatocellular carcinoma[J]. Liver Cancer, 2019, 8(5): 373-86.
[47]" Li YC, Zhang Y, Fang Q, et al. Radiomics analysis of 18F-FDG PET/CT for microvascular invasion and prognosis prediction in very-early‑and early-stage hepatocellular carcinoma[J]. Eur J Nucl Med Mol Imaging, 2021, 48(8): 2599-614.
[48]" Liu QP, Xu X, Zhu FP, et al. Prediction of prognostic risk factors in hepatocellular carcinoma with transarterial chemoembolization using multi-modal multi‑task deep learning[J]. EClinicalMedicine, 2020, 23: 100379.
[49]" Liu QQ, Li J, Liu F, et al. A radiomics nomogram for the prediction of overall survival in patients with hepatocellular carcinoma after hepatectomy[J]. Cancer Imaging, 2020, 20(1): 82.
[50]" Lacaze L, Scotté M. Surgical treatment of intra hepatic recurrence of hepatocellular carcinoma[J]. World J Hepatol, 2015, 7(13): 1755-60.
[51] Earl TM, Chapman WC. Hepatocellular carcinoma: resection versus transplantation[J]. Semin Liver Dis, 2013, 33(3): 282-92.
[52]" Poon RTP, Fan ST, Lo CM, et al. Long-term survival and pattern of recurrence after resection of small hepatocellular carcinoma in patients with preserved liver function: implications for a strategy of salvage transplantation[J]. Ann Surg, 2002, 235(3): 373-82.
[53]" Shah SA, Cleary SP, Wei AC, et al. Recurrence after liver resection for hepatocellular carcinoma: risk factors, treatment, and outcomes[J]. Surgery, 2007, 141(3): 330-9.
[54] Kim S, Shin J, Kim DY, et al. Radiomics on gadoxetic acid-enhanced magnetic resonance imaging for prediction of postoperative early and late recurrence of single hepatocellular carcinoma[J]. Clin Cancer Res, 2019, 25(13): 3847-55.
[55] Liu Y, Wei XQ, Zhang XR, et al. CT radiomics combined with clinical variables for predicting the overall survival of hepatocellular carcinoma patients after hepatectomy[J]. Transl Oncol, 2022, 26: 101536.
[56]" Fu SR, Lai HR, Huang MY, et al. Multi-task deep learning network to predict future macrovascular invasion in hepatocellular carcinoma[J]. EClinicalMedicine, 2021, 42: 101201.
[57] Wang XH, Long LH, Cui Y, et al. MRI-based radiomics model for preoperative prediction of 5-year survival in patients with hepatocellular carcinoma[J]. Br J Cancer, 2020, 122(7): 978-85.
[58] Saalfeld S, Kreher R, Hille G, et al. Prognostic role of radiomics-based body composition analysis for the 1‑year survival for hepatocellular carcinoma patients[J]. J Cachexia Sarcopenia Muscle, 2023, 14(5): 2301-9.
[59] Liu F, Liu D, Wang K, et al. Deep learning radiomics based on contrast-enhanced ultrasound might optimize curative treatments for very-early or early-stage hepatocellular carcinoma patients[J]. Liver Cancer, 2020, 9(4): 397-413.
[60] 刘一萍, 李新平, 陈" 磊, 等. 基于人工智能的肝细胞癌精准影像学诊断和复发预测[J]. 临床肝胆病杂志, 2022, 38(3): 521-7.
[61] Kim J, Choi SJ, Lee SH, et al. Predicting survival using pretreatment CT for patients with hepatocellular carcinoma treated with transarterial chemoembolization: comparison of models using radiomics[J]. AJR Am J Roentgenol, 2018, 211(5): 1026-34.
[62] Kong CL, Zhao ZW, Chen WY, et al. Prediction of tumor response via a pretreatment MRI radiomics-based nomogram in HCC treated with TACE[J]. Eur Radiol, 2021, 31(10): 7500-11.
[63] Liu D, Liu F, Xie XY, et al. Accurate prediction of responses to transarterial chemoembolization for patients with hepatocellular carcinoma by using artificial intelligence in contrast-enhanced ultrasound[J]. Eur Radiol, 2020, 30(4): 2365-76.
[64]" 李嘉颖, 丁洪蕾, 张华妮, 等. 原发性肝癌DWI影像组学特征与中医证型的相关性研究[J]. 中国中西医结合影像学杂志, 2022, 20(2): 146-50.
(编辑:孙昌朋)
基金项目:湖南省自然科学青年基金(2023JJ40503);湖南省中医肿瘤临床医学研究中心项目(2021SK4023);湖南省临床医疗技术创新引导项目(2021SK51410);湖南省卫生健康委科研重点项目(C202203108338);湖南省教育厅优秀青年项目(21B0365);长沙市自然科学基金项目(kq2202453)
作者简介:朱莉杉,在读本科生,E-mail: 2258611285@qq.com
通信作者:李" "菁,博士,副主任医师,副教授,E-mail: lileekim_495@hnucm.edu.cn
