分子影像探针在肺癌诊疗中的应用进展
2024-10-30高雅儒王雪梅
摘要:肺癌作为全球第二高发的癌症类型,占所有新发病例的11.4%,致死率高达所有癌症相关死亡的18.0%。早期发现、诊断与及时治疗对于降低肺癌死亡率至关重要。得益于分子影像学的持续进步,多种分子影像探针在肺癌的早期筛查、诊疗和预后评估中得到了广泛运用,且取得了显著成效。本文重点探讨了当前应用最广泛的18F-FDG探针以及新型非FDG分子影像探针的作用机理、靶点及其在临床实践中的应用,旨在为分子探针在肺癌诊疗领域的未来发展与应用提供参考。
关键词:肺癌;分子影像探针;PET/CT
Application of molecular imaging probe in diagnosis and treatment of lung cancer
GAO Yaru1, WANG Xuemei2
1The First Clinical Medicine College of Inner Mongolia Medical University, Hohhot 010050, China; 2Department of Nuclear Medicine, Affiliated Hospital of Inner Mongolia Medical University, Key Laboratory of Molecular Imaging of Inner Mongolia Autonomous Region, Hohhot 010050, China
Abstract: Lung cancer is the second most common type of cancer worldwide, accounting for 11.4% of all new cases and 18.0% of all cancer-related deaths. Early detection, diagnosis and timely treatment are essential to reduce the mortality rate of lung cancer. Thanks to the continuous progress of molecular imaging, a variety of molecular imaging probes have been widely used in the early screening, diagnosis, treatment and prognosis assessment of lung cancer, and remarkable results have been achieved. This review focuses on the mechanism, target and application of 18F-FDG, the most widely used molecular imaging probe, and the novel non-FDG molecular imaging probe in clinical practice, aiming to provide valuable reference for the future development and application of molecular probes in the diagnosis and treatment of lung cancer.
Keywords: lung cancer; molecular image probe; PET/CT
肺癌是全球癌症相关死亡的主要原因之一,占所有癌症相关死亡的近17%[1]。肺癌组织学上分为小细胞肺癌(SCLC)、非小细胞肺癌(NSCLC)、肺神经内分泌肿瘤(pNET)及其他[2]。肺癌患者的影像学检查通常包括常规影像学检查(胸部X线、增强CT)和18F-FDG PET/CT。18F-FDG根据肿瘤细胞高摄取葡萄糖的特性,作为葡萄糖类似物被摄取并在肿瘤细胞内并聚集;PET/CT通过显示18F-FDG的分布即可灵敏显示机体中具有较高糖酵解水平的肿瘤组织,提供代谢和解剖信息[3]。然而,正常器官中脑、肌肉、唾液腺、心肌、胃肠道、泌尿系统、棕色脂肪组织、甲状腺和性腺组织等“生理性摄取”及感染炎症过程中的非特异性摄取为肺癌判别增加挑战[4] 。此外,18F-FDG PET/CT对lt;1 cm的肺结节敏感度较低,对较小的肺癌病灶无法早期甄别[5] 。这些缺陷使肺癌的分期、复发评估和不同治疗方案的疗效评估复杂化,亟需具有更高敏感度和特异度的分子影像探针。目前已有几种示踪剂针对与其他肿瘤特征和“癌症标志”相关的特定特征以改善肺癌患者的PET成像。靶向成纤维细胞激活蛋白(FAP)的成纤维细胞激活蛋白抑制剂(FAPI)探针在肺癌脑转移及淋巴转移中有独特优势,并且在未来肺癌治疗中的应用具有良好的潜力;靶向整合素αvβ3的RGD探针可以实现血管成像;靶向前列腺特异膜抗原(PSMA)的探针已证实在肺癌中具有良好的图像对比度;靶向生长抑素受体(SSTR)的生长抑素类似物(SSA)探针对诊断pNET有高度特异度。新型分子探针不仅弥补了18F-FDG敏感度低、特异度差的缺点,更有助于提高肺癌诊断的准确性,为患者提供更加精准的治疗方案和预后评估。本文针对当前应用最广泛的18F-FDG探针以及新型非FDG分子影像探针的作用机理、靶点及其在临床实践中的应用作一综述,旨在为分子探针在肺癌诊疗领域的未来发展与应用提供参考。
1" 18F-FDG
18F-FDG是目前评估肺癌最常用的放射性显像剂,已广泛用于肺癌全程管理,成为肺癌诊断、临床分期、疗效评估的关键方法,已逐渐被纳入指南和共识文件[6] 。作为一种高度敏感的全身显像技术,18F-FDG PET/CT可以更准确地识别纵膈和胸外疾病,对骨转移的敏感度和特异度均高于骨显像,是评估远端转移(中枢神经系统外)的首选方式[7] 。随着癌症治疗的进步,单纯的解剖和功能成像无法全面的对肺癌患者进行治疗后监测,以18F-FDG PET/CT为代表的功能成像被用来评估治疗反应[8]。一项关于肺癌患者治疗后监测的研究中,101例接受根治手术的NSCLC患者,每年进行1次18F-FDG PET/CT随访,其中有18例患者出现复发,18F-FDG PET/CT正确诊断 17例[9]。另一项关于评估治疗反应的对比研究中,35例早期NSCLC患者接受全身放射治疗,并进行18F-FDG PET/CT和胸部CT随访,18F-FDG PET/CT发现10例复发,而诊断性CT未发现复发[10]。也有研究显示18F-FDG PET/CT评估局部晚期NSCLC(特别是IIIa期)患者对新辅助放化疗反应的敏感度、特异度和阴性预测值分别为83%、84%和91%[11]。
近几年NSCLC患者的免疫检查点抑制剂(ICI)治疗迅速发展[12],与传统化疗不同,ICI具有增强免疫系统的独特作用,可出现假进展、超进展和游离反应等非典型反应模式及免疫相关不良事件的发生,如何对接受ICI治疗的患者进行全面评估成为了新的挑战。一项临床研究结果提示:对接受ICI治疗的患者进行18F-FDG PET/CT扫描,肿瘤代谢体积和肿瘤糖酵解总量等指标可以预测哪些患者将从ICI中获益最多, 18F-FDG PET/CT仍然是追踪治疗不可或缺的技术手段[13]。
随着计算机技术特别是大数据挖掘技术的广泛应用,18F-FDG PET/CT 影像组学在肺癌方面的研究逐渐增多,不仅改变了医学成像的定量评估,也揭示了图像中超出视觉解释的数据。有研究证实,基于18F-FDG PET/CT衍生的影像组学可以无创的区分良性和恶性孤立性肺结节,并准确性区分NSCLC亚型[14]。一项针对151例手术治疗的NSCLC患者回顾性研究显示,对手术治疗后患者进行18F-FDG PET/CT检查并使用工具从PET和CT图像中提取特征,对其基因变异、融合转录物和基因表达进行检测,通过广义线性模型和机器学习算法预测组织学和肿瘤复发。结果证实由18F-FDG PET/CT衍生的影像基因组学数据可以为NSCLC患者提供有关组织类型、侵袭性和进展的临床相关信息[15]。
18F-FDG PET/CT对于肺原发病灶的诊断有较大的局限性。低级别疾病、微创腺癌、粘液腺癌和高分化类癌可能出现假阴性,而炎性假瘤、肺结核等炎症性病变可能出现假阳性。此外对于肺癌患者治疗后的评估,虽然理论上FDG摄取量的多少反映了肿瘤的代谢活动的高低,可以对癌症的复发或持续存在进行判定,但病灶近期的放疗可能造成与炎症相关的假阳性结果,对肺癌患者病情的准确的评估存在一定限制[16]。
2" 非18F-FDG显像剂
2.1" 靶向FAP显像剂
FAP是一种Ⅱ型跨膜糖蛋白,在肿瘤微环境中激活的成纤维细胞表面高度表达,通过参与细胞外基质重塑、肿瘤细胞增殖调节和肿瘤免疫抑制等过程促进肿瘤的生长和侵袭[17]。放射性标记的FAP抑制剂FAPI可以在肿瘤微环境中与FAP结合用于肿瘤成像。有机构对68Ga-FAPI在28种不同癌症的摄取进行量化研究,其中肺癌患者的肿瘤组织表现出对显像剂的极高摄取[18]。也有研究证实FAP在肺癌中广泛表达,尤其是在鳞状细胞癌和腺癌中[19]。在12例早期腺癌病例中,18F-FDG PET/CT只观察到3个阳性病变,而12例患者中10例患者肿瘤标本FAPI免疫组化阳性。上述研究表明放射性标记的FAPI比18F-FDG在肺癌诊疗中更具独特优势。
有学者对18F-FAPI 和18F-FDG 两种显像剂在肺癌患者中进行对比研究,68例病理证实肺癌的患者在间隔7 d内接受了两种显像剂成像,以组织病理学和临床随访结果作为最终诊断的参考标准。结果发现与18F-FDG PET/CT相比,18F-FAPI PET/CT对肺原发肿瘤具有更高的敏感度(99% vs 87%)、特异度(93% vs 79%)、准确性(97% vs 85%)和阴性预测值(97% vs 70%),表明在肺癌患者中使用18F-FAPI比使用18F-FDG可能具有更高的价值[20]。
另一项关于68Ga-FAPI和18F-FDG两种显像剂的对比研究显示,肺癌患者68Ga-FAPI" PET/CT和18F-FDG PET/CT在肺、肝和肾上腺的原发肿瘤的描绘和疑似转移的检测方面表现相似[21]。然而, 68Ga-FAPI PET/CT在淋巴结、脑、骨和胸膜中显示了更多的可疑转移灶,对原发或复发肿瘤、阳性淋巴结、骨病变、胸膜病变的SUVmax均高于18F-FDG PET/CT,因此68Ga-FAPI PET/CT在肺癌分期方面优于18F-FDG PET/CT,特别是在淋巴结、骨和胸膜转移的检测方面。
一项晚期肺癌患者68Ga-FAPI与 18F-FDG成像的对比研究显示,68Ga-FAP对转移病灶的摄取明显高于18F-FDG,而背景组织的摄取较低,图像对比度较高[22]。此后,有学者发表了多例使用68Ga -FAPI PET/CT检测肺癌转移灶的病例报告。
有研究报道1例64岁女性患者,临床表现为持续性头痛、呕吐和意识改变,使用18F-FDG PET/CT发现肺结节后,采用68Ga-FAPI" PET/CT检查明确肺癌脑转移[23]。另1例通过68Ga-FAPI PET/CT检测到肺癌脑转移的病例显示,18F-FDG PET/CT因 “生理性摄取”对脑部病变的判别困难,68Ga-FAPI PET/CT显示脑内2个阳性病灶,后增强脑MRI证实为脑转移[23]。
68Ga-FAPI PET/CT在检测淋巴转移方面也有突出价值[24]。1例SCLC患者基于18F-FDG PET/CT分期为T1bN2M0,而进行68Ga-FAPI" PET/CT在可疑淋巴结中未检测到FAPI摄取增加,随后组织学证实这些淋巴结未见转移,修正TNM分期为T1bN0M0。
由此可见,靶向FAPI的分子探针不仅在肺原发肿瘤成像中表现不俗,在远处转移尤其是肺癌脑转移具有独特的优势。18F-FDG成像时大脑的生理性高摄取,因此在评估时候存在脑转移是往往需要额外的脑部影像评估,放射性标记的FAPI分子探针弥补了这一缺陷,可以在一次成像中完整评估全身,代替18F-FDG实现更加精确便捷的临床分期。此外,FAPI可以标记为治疗性放射性核素,如Lu-177、Y-90等,具有作为治疗性化合物的潜力。目前未见使用FAPI标记治疗性放射性核素治疗原发性肺癌的记录,但基于放射性标记的FAPI探针在肺癌诊断中的强劲表现,提示靶向FAP的放射性药物在未来肺癌治疗中的应用具有良好的潜力[25]。
2.2" 靶向整合素αvβ3显像剂
整合素αvβ3是在肿瘤微环境中的血管内皮细胞表面高度表达的跨膜糖蛋白,在肿瘤血管生成中起重要作用。作为整合素αvβ3的配体,RGD已被开发用于靶向整合素αvβ3。肺癌是典型的血管依赖性病变,血管的生成与肺癌的发生、生长及转移密切相关[26]。通过放射性标记的RGD探针对肺癌进行分子成像,可以早期发现和非侵入性地监测肺癌血管生成的状态,达到早期诊断和治疗目的[27]。
目前常见的用于PET成像的RGD探针是由18F及68Ga标记,此外还包括几种99mTc和111In标记的RGD用于SPECT显像。18F-Galacto-RGD是第1个在人体内测试的RGD PET显像剂,已证明可以量化肺癌患者中整合素αvβ3的表达进行血管成像。但放射标记复杂、肿瘤摄取低、放射合成的成本高及难度大等因素限制了其临床应用[28]。此后通过ALF标记技术开发了一种冻干试剂盒,用于标记RGD肽(即18F-Alfatide),大大简化了标记程序。一项在9例诊断肺癌的患者中进行静态和动态18F-Alfatide PET/CT检查的研究结果显示,18F-Alfatide显像具有理想的图像对比度,可以对肺癌患者血管进行成像[29]。另一项关于18F-Alfatide的研究表明,对疑似肺癌的患者进行18F-Alfatide显像,可以成功地区分恶性病变和错构瘤,但很难明确区分炎性或炎性假瘤与恶性病变[30]。肿瘤血管成像不仅可以用于癌症的早期发现,还可以用于监测治疗结果[31]。有学者发现,18F-Alfatide PET/CT可用于晚期NSCLC患者同步放化疗的短期预后评估,其扫描参数可对患者进行筛查,确保哪些患者可以从治疗中获益,避免不必要的治疗[31]。随后该团队继续对18F-Alfatide" PET/CT关于晚期NSCLC患者同步放化疗预测价值进行研究,进一步发现18F-Alfatide PET/CT可以对患者无进展生存期和总生存期进行预测[32]。此外有研究显示[33],18F-Alfatide PET/CT在诊断NSCLC患者淋巴结转移方面的敏感度(83.9%~100%)、特异度(78.6%~96.7%)和准确性(81.7%~96.9%),并不亚于传统的18F-FDG成像,表明其在诊断NSCLC患者的淋巴结转移方面有很高的价值。
18F标记RGD需要昂贵的回旋加速器进行生产,而68Ge-68Ga发生器易于标记和获取,合适的螯合剂也为68Ga标记RGD的提供条件,因此目前68Ga标记的RGD在血管成像中更受欢迎。已有研究证实了68Ga-RGD PET/CT在肺癌患者中的适用性[34]。近期一项针对91例肺癌患者的临床研究显示,68Ga-NOTA-PRGD2 PET/CT对纵膈淋巴结转移的阳性预测值和阴性预测值分别为90.0%和93.8%,而18F-FDG PET/CT对纵膈淋巴结转移的阳性预测值和阴性预测值分别为30.2%和90.5%[35]。另一项对比研究显示[36],68Ga-NOTA-PRGD2在NSCLC原发病变及可疑淋巴结区分方面优于18F-FDG,且对脑转移的检测更敏感。
RGD分子探针成像是目前较为理想的血管成像,可实现无创、立体、动态的血管生成实时显像,不仅如此,通过对治疗效果评估监测进一步实现肺癌个体化治疗,对淋巴结转移和脑转移评估也更加精准全面,在肺癌诊疗中具有广阔的临床应用前景。
2.3" 靶向PSMA显像剂
PSMA是一种在前列腺癌及转移灶中高度表达的Ⅱ型跨膜糖蛋白[37],在前列腺癌诊疗中发挥着重要的临床作用,已被国内外多个指南推荐使用[38]。随着临床研究和应用的不断发展,PSMA PET/CT 在非前列腺癌肿瘤中的临床应用逐渐增多。既往多项关于68Ga-PSMA在肝细胞癌、肺癌、甲状腺癌、肾癌、中枢神经系统肿瘤显像的研究均表明其在诊断、分期和再分期、指导临床医师做出治疗决策、疗效评价等方面发挥重要作用;尤其是对于无18F-FDG摄取的肿瘤中,PSMA显像可作为传统肿瘤检测方法的有效补充,提高病变诊断的准确度[39]。
PSMA在正常肺组织中未见表达,而在肺癌的肿瘤上皮细胞以及新生血管内皮细胞均检测到PSMA表达,尤其是在肿瘤微环境中新生血管中高度表达,这有利于在肺癌PSMA靶向PET成像中获得高对比度图像和理想的靶本比[40]。有研究表明,NSCLC新生血管中PSMA表达与较高的组织学分级相关[41]。1例前列腺癌患者病例报告显示,治疗过程中行18F-PSMA PET/CT显像时偶然发现肺部的原发性和转移性病变[42]。有研究报告了1例73岁男性患者PSA水平升高的病例, 68Ga-PSMA PET/CT显示出局灶性肺病变,随后组织学证实肺腺癌[43]。虽然在肺癌中检测到PSMA表达,但目前关于靶向PSMA的新型分子探针在肺癌诊疗中的应用研究样本量偏少,甚至仅为个案报道,根据其在肺肿瘤微环境高度表达的特征联合已报道的几个病例,推测其在肺癌分子成像中有广阔前景,需大样本数据进行系统性证实。
2.4" 靶向SSTR显像剂
pNET占所有肺癌的25%,支气管类癌(BC)是pNET的重要组成部分[43]。近年来, SSA被用来靶向pNET细胞表面高度表达的SSTR,实现了靶向SSTR的PET成像。目前68Ga-DOTA-TOC、68Ga-DOTA-TATE和68Ga-DOTA-NOC 3种68Ga标记的SSA均已获批上市[38]。
一项关于pNET患者的68Ga-DOTA-TATE和18F-FDG PET/CT对比研究显示,在13例BC患者均显示68Ga-DOTA-TATE的高摄取(SUVmax≥8.2),但11例中有6例表现出18F-FDG低摄取(SUVmax:1.7~2.9),未发现68Ga-DOTA-TATE假阳性摄取病例,但有3个继发于炎症的18F-FDG摄取的假阳性病例[45]。
有学者使用68Ga-DOTA-TOC PET/CT对20例BC患者进行了评估,结果显示68Ga-DOTA-TOC PET/CT诊断BC的总体敏感度、特异度和准确性分别为96%、100%和97%[46]。另有研究显示传统的18F-FDG PET/CT诊断BC的敏感度 、特异度和准确性仅为 78%、11%和 59%[47]。
靶向SSTR分子探针的应用不仅局限于BC的诊断,多个研究显示在疑似pNET的患者成像时,68Ga-DOTA-TATE 表现出比18F-FDG PET/CT更好的特异度、敏感度和准确性[40-41]。有研究建议对疑似pNET患者进行初步评估时,应首选68Ga-DOTA-TATE,若评估结果阴性,再进行18F-FDG PET/CT检查[43]。
68Ga标记的SSA探针在BC中的检出率极高,与传统成像技术相比,新的分子影像探针可以提供更多额外的信息,弥补了18F-FDG成像在BC诊疗中敏感度、特异度及准确率低的不足。不仅如此,在疑似pNET患者中使用SSA探针分子成像较传统的18F-FDG PET/CT具有更高的价值。
2.5" 双靶向显像剂
由于多价效应,异二聚体相对于相应单体的优势已在大量临床前研究和临床研究中得到证实,不仅可以提高亲和力,还增加了有效受体的数量[48]。有研究设计并开发一种靶向FAP和RGD整合素的异二聚体FAPI-RGD,体外和体内均表现出良好的结合亲和力和特异度,与单特异性显像剂相比,具有显著提高肿瘤摄取、延长肿瘤滞留时间、肿瘤靶向效率和药代动力学[49]。随后在6例癌症患者(包括肺癌2例、鼻咽癌1例、乳腺癌1例、肾癌1例、口腔癌1例)的人体生物分布研究中也显示出高诊断性能和良好的显像剂动力学,具有潜在的应用价值。对3名健康志愿者进行68Ga-FAPI-RGD有效剂量测定,显像剂耐受性良好,所有健康志愿者和患者均无不良事件发生[50]。后续一项关于51例疑似肺恶性肿瘤患者的初步探索性研究,参与者均接受了68Ga-FAPI-RGD PET/CT扫描,其中44例在2周内还接受了18F-FDG PET/CT扫描,9例接受了68Ga-FAPI PET/CT扫描,10例接受了68Ga-RGD PET/CT扫描。最终诊断基于组织病理学分析和临床随访报告。结果显示,68Ga-FAPI-RGD PET/CT与18F-FDG PET/CT相比具有更高的原发肿瘤检出率、更高的显像剂摄取量和更好的转移灶检出率,并且68Ga-FAPI- RGD 也优于68Ga-RGD,并不逊色于68Ga-FAPI[51]。上述研究为使用68Ga-FAPI-RGD PET/CT诊断肺癌提供了概念验证,双靶向FAPI-RGD也应在未来的研究中探索其治疗应用。
有研究开发了靶向SSTR和整合素RGD的异源二聚体,并选取具有代表性的H69(SSTR阳性)、A549(整合素αvβ3阳性)肺癌细胞系和荷瘤小鼠模型,在体外和体内检测其分配系数、血清蛋白结合活性、稳定性测定和细胞摄取动力学测定。结果显示与单体的TATE和RGD相比,68Ga-3PTATE-RGD具有更强、更广泛的肿瘤靶向作用,值得进一步研究其在肺癌中的应用[52]。
2.6" 其他
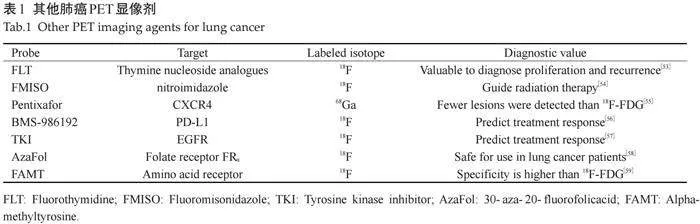
除上述显像剂外,还有许多新开发的用于肺癌PET显像的显像剂(表1)。
3" 总结与展望
18F-FDG PET/CT作为目前肺癌分期和治疗计划的首选成像方式,虽然具有一定的价值,但仍存在假阴性、假阳性及特异度低等问题,对肺癌诊疗的精确性造成一定限制。新型分子探针的出现,为肺癌诊疗带来了新的希望。新型分子探针针对肺癌的不同位点,如肿瘤微环境中的成纤维细胞、血管内皮细胞等进行成像,具有高对比度和高敏感度的特点。与传统的18F-FDG PET/CT相比,新型分子探针在肺原发病灶、淋巴结转移和脑转移的诊断中表现出更高的敏感度和特异度。即使在无或低18F-FDG摄取的肺癌中,新型分子探针仍然能够精准地对病灶进行成像,极大地扩展了其在肺癌诊疗中的应用范围,为临床医生提供了更为丰富和准确的肺癌信息,提高了医生在制定治疗方案、评估治疗效果以及预测患者预后等方面的准确性。
尽管新型分子探针在肺癌诊疗中展现出巨大的潜力,但仍需在更大规模的临床试验中进行验证和研究。此外,新型分子探针的成本效益以及与其他探针成像兼容性等问题也需要进一步探讨。
参考文献:
[1]" Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Zhonghua Zhong Liu Za Zhi, 2019, 41(1): 19-28.
[2]" Brennan P, Hainaut P, Boffetta P. Genetics of lung-cancer susceptibility[J]. Lancet Oncol, 2011, 12(4): 399-408.
[3]" "Duclos V, Iep A, Gomez L, et al. PET molecular imaging: a holistic review of current practice and emerging perspectives for diagnosis, therapeutic evaluation and prognosis in clinical oncology[J]. Int J Mol Sci, 2021, 22(8): 4159.
[4]" "Boellaard R, Delgado-Bolton R, Oyen WJG, et al. FDG PET/CT: EANM procedure guidelines for tumour imaging: version 2.0[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2): 328-54.
[5]" "Cuaron J, Dunphy M, Rimner A. Role of FDG-PET scans in staging, response assessment, and follow-up care for non-small cell lung cancer[J]. Front Oncol, 2012, 2: 208.
[6]" "Fernández-Pérez G, Sánchez-Escribano R, García-Vicente AM, et al. SEOM-SERAM-SEMNIM guidelines on the use of functional and molecular imaging techniques in advanced non-small-cell lung cancer[J]. Clin Transl Oncol, 2018, 20(7): 837-52.
[7]" "Taira AV, Herfkens RJ, Gambhir SS, et al. Detection of bone metastases: assessment of integrated FDG PET/CT imaging[J]. Radiology, 2007, 243(1): 204-11.
[8]" "van Timmeren JE, Leijenaar RTH, van Elmpt W, et al. Survival prediction of non-small cell lung cancer patients using radiomics analyses of cone-beam CT images[J]. Radiother Oncol, 2017, 123(3): 363-9.
[9]" "Toba H, Sakiyama S, Otsuka H, et al. 18F-fluorodeoxyglucose positron emission tomography/computed tomography is useful in postoperative follow‑up of asymptomatic non‑small‑cell lung cancer patients[J]. Interact CardioVasc Thorac Surg, 2012, 15(5): 859-64.
[10]Ebright MI, Russo GA, Gupta A, et al. Positron emission tomography combined with diagnostic chest computed tomography enhances detection of regional recurrence after stereotactic body radiation therapy for early stage non-small cell lung cancer[J]. J Thorac Cardiovasc Surg, 2013, 145(3): 709-15.
[11]" Zhang CP, Liu JJ, Tong JL, et al. 18F-FDG-PET evaluation of pathological tumour response to neoadjuvant therapy in patients with NSCLC[J]. Nucl Med Commun, 2013, 34(1): 71-7.
[12] Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-30.
[13]" Fredrickson J, Callahan J, Funke R, et al. Utility of FDG-PET in immunotherapy: results from a Phase II study of NSCLC patients undergoing therapy with the PD‑L1 inhibitor, atezolizumab (MPDL3280A)[J]. 2016, 57(s2): 134.
[14]" Léger MA, Routy B, Juneau D. FDG PET/CT for evaluation of immunotherapy response in lung cancer patients[J]. Semin Nucl Med, 2022, 52(6): 707-19.
[15] Kirienko M, Sollini M, Corbetta M, et al. Radiomics and gene expression profile to characterise the disease and predict outcome in patients with lung cancer[J]. Eur J Nucl Med Mol Imaging, 2021, 48(11): 3643-55.
[16]" Owens C, Hindocha S, Lee R, et al. The lung cancers: staging and response, CT, 18F-FDG PET/CT, MRI, DWI: review and new perspectives[J]. Br J Radiol, 2023, 96(1148): 20220339.
[17]" Chen XM, Song EW. Turning foes to friends: targeting cancer-associated fibroblasts[J]. Nat Rev Drug Discov, 2019, 18(2): 99-115.
[18] Hathi DK, Jones EF. 68Ga FAPI PET/CT: tracer uptake in 28 different kinds of cancer[J]. Radiol Imaging Cancer, 2019, 1(1): e194003.
[19] Chen XH, Liu XR, Wang LJ, et al. Expression of fibroblast activation protein in lung cancer and its correlation with tumor glucose metabolism and histopathology[J]. Eur J Nucl Med Mol Imaging, 2022, 49(8): 2938-48.
[20]" Wei YC, Ma L, Li P, et al. FAPI compared with FDG PET/CT for diagnosis of primary and metastatic lung cancer[J]. Radiology, 2023, 308(2): e222785.
[21]" Wang LJ, Tang GH, Hu KZ, et al. Comparison of 68Ga-FAPI and 18F-FDG PET/CT in the evaluation of advanced lung cancer[J]. Radiology, 2022, 303(1): 191-9.
[22]" Loktev A, Lindner T, Mier W, et al. A tumor-imaging method targeting cancer-associated fibroblasts[J]. J Nucl Med, 2018, 59(9): 1423-9.
[23]" Hao B, Wu JX, Pang YZ, et al. 68Ga-FAPI PET/CT in assessment of leptomeningeal metastases in a patient with lung adenocarcinoma[J]. Clin Nucl Med, 2020, 45(10): 784-6.
[24]" Shang QH, Zhao L, Pang YZ, et al. Differentiation of reactive lymph nodes and tumor metastatic lymph nodes with 68Ga-FAPI PET/CT in a patient with squamous cell lung cancer[J]. Clin Nucl Med, 2022, 47(5): 458-61.
[25]" Assadi M, Rekabpour SJ, Jafari E, et al. Feasibility and therapeutic potential of 177Lu-fibroblast activation protein inhibitor‑46 for patients with relapsed or refractory cancers: a preliminary study[J]. Clin Nucl Med, 2021, 46(11): e523-e530.
[26]" St Croix B, Rago C, Velculescu V, et al. Genes expressed in human tumor endothelium[J]." Science, 2000, 289(5482): 1197-202.
[27] Hood JD, Cheresh DA. Role of integrins in cell invasion and migration[J]." Nat Rev Cancer, 2002, 2(2): 91-100.
[28] Ludwig BS, Kessler H, Kossatz S, et al. RGD-binding integrins revisited: how recently discovered functions and novel synthetic ligands (Re-) shape an ever-evolving field[J]. Cancers, 2021, 13(7): 1711.
[29] Wan W, Guo N, Pan D, et al. First experience of 18F-alfatide in lung cancer patients using a new lyophilized kit for rapid radiofluorination[J]. J Nucl Med, 2013, 54(5): 691-8.
[30]" Gao S, Wu HH, Li WW, et al. A pilot study imaging integrin αvβ3 with RGD PET/CT in suspected lung cancer patients[J]. Eur J Nucl Med Mol Imaging, 2015, 42(13): 2029-37.
[31]" Chen HJ, Niu G, Wu H, et al. Clinical application of radiolabeled RGD peptides for PET imaging of integrin αvβ3[J]. Theranostics, 2016, 6(1): 78-92.
[32]" Wei YC, Qin XT, Liu XL, et al. Tumor angiogenesis at baseline identified by 18F-Alfatide II PET/CT may predict survival among patients with locally advanced non-small cell lung cancer treated with concurrent chemoradiotherapy[J]. J Transl Med, 2022, 20(1): 63.
[33]" Zhou Y, Gao S, Huang Y, et al. A pilot study of 18F-alfatide PET/CT imaging for detecting lymph node metastases in patients with non-small cell lung cancer[J]. Sci Rep, 2017, 7(1): 2877.
[34]" Kang F, Wang Z, Li GQ, et al. Inter-heterogeneity and intra-heterogeneity of αvβ3 in non-small cell lung cancer and small cell lung cancer patients as revealed by 68Ga-RGD2 PET imaging[J]." Eur J Nucl Med Mol Imaging, 2017, 44(9): 1520-8.
[35]" Zheng K, Liang N, Zhang J, et al. 68Ga-NOTA-PRGD2 PET/CT for integrin imaging in patients with lung cancer[J]. J Nucl Med, 2015, 56(12): 1823-7.
[36]" Kang F, Wang SJ, Tian F, et al. Comparing the diagnostic potential of 68Ga-alfatide II and 18F-FDG in differentiating between non-small cell lung cancer and tuberculosis[J]. J Nucl Med, 2016, 57(5): 672-7.
[37]" Hofman MS, Lawrentschuk N, Francis RJ, et al. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study[J]. Lancet, 2020, 395(10231): 1208-16.
[38]" Gandaglia G, Leni R, Fossati N, et al. Prostate-specific membrane antigen imaging in clinical guidelines: European association of urology, national comprehensive cancer network, and beyond[J]. Eur Urol Focus, 2021, 7(2): 245-9.
[39]" 张召奇, 赵新明. 68Ga/18F标记PSMA在非前列腺癌肿瘤诊疗中的应用进展[J]. 肿瘤影像学, 2023, 32(3): 213-25.
[40]" Salas Fragomeni RA, Amir T, Sheikhbahaei S, et al. Imaging of nonprostate cancers using PSMA-targeted radiotracers: rationale, current state of the field, and a call to arms[J]. J Nucl Med, 2018, 59(6): 871-7.
[41] Schmidt LH, Heitkötter B, Schulze AB, et al. Prostate specific membrane antigen (PSMA) expression in non-small cell lung cancer[J]. PLoS One, 2017, 12(10): e0186280.
[42]" Dall'Armellina S, Cauda S, Duca S, et al. Can PSMA-targeting PET/CT be a valuable instrument to assess the presence of brain metastases in lung cancer patients?[J]. Clin Nucl Med, 2023, 48(6): e304-6.
[43]" Usmani S, Sadeq A, Marafi F, et al. 68Ga-PMSA uptake in the lung: metastatic versus primary lung tumor[J]. Clin Nucl Med, 2020, 45(2): e80-e82.
[44]Fink G, Krelbaum T, Yellin A, et al. Pulmonary carcinoid: presentation, diagnosis, and outcome in 142 cases in Israel and review of 640 cases from the literature[J]. Chest, 2001, 119(6): 1647-51.
[45]" Kayani I, Conry BG, Groves AM, et al. A comparison of 68Ga-DOTATATE and 18F-FDG PET/CT in pulmonary neuroendocrine tumors[J]. J Nucl Med, 2009, 50(12): 1927-32.
[46] Jindal T, Kumar A, Venkitaraman B, et al. Role of" 68Ga-DOTATOC PET/CT in the evaluation of primary pulmonary carcinoids[J]. Korean J Intern Med, 2010, 25(4): 386-91.
[47]" Treglia G, Giovanella L, Lococo F. Evolving role of PET/CT with different tracers in the evaluation of pulmonary neuroendocrine tumours[J]. Eur J Nucl Med Mol Imag, 2014, 41(5): 853-5.
[48] Judmann B, Braun D, Wängler B, et al. Current state of radiolabeled heterobivalent peptidic ligands in tumor imaging and therapy[J]. Pharmaceuticals, 2020, 13(8): 173.
[49]" Zang J, Wen XJ, Lin R, et al. Synthesis, preclinical evaluation and radiation dosimetry of a dual targeting PET tracer 68Ga-FAPI-RGD[J]. Theranostics, 2022, 12(16): 7180-90.
[50]" Zhao L, Wen XJ, Xu WZ, et al. Clinical evaluation of 68 for imaging of fibroblast activation protein and integrin αvβ3 in various cancer types[J]. J Nucl Med, 2023, 64(8): 1210-7.
[51]" Wang RX, Jakobsson V, Wang JR, et al. Dual targeting PET tracer 68Ga-FAPI-RGD in patients with lung neoplasms: a pilot exploratory study[J]. Theranostics, 2023, 13(9): 2979-92.
[52]" Liu BN, Zhang ZZ, Wang H, et al. Preclinical evaluation of a dual sstr2 and integrin αvβ3-targeted heterodimer 68Ga-NOTA-3PEG4-TATE-RGD[J]. Bioorg Med Chem, 2019, 27(21): 115094.
[53]" Johnbeck CB, Munk Jensen M, Haagen Nielsen C, et al. 18F-FDG and 18F-FLT-PET imaging for monitoring everolimus effect on tumor-growth in neuroendocrine tumors: studies in human tumor xenografts in mice[J]. PLoS One, 2014, 9(3): e91387.
[54]Thureau S, Modzelewski R, Bohn P, et al. Comparison of hypermetabolic and hypoxic volumes delineated on 18F-FDG and 18F-fluoromisonidazole PET/CT in non-small-cell lung cancer patients[J]. Mol Imaging Biol, 2020, 22(3): 764-71.
[55] Vag T, Gerngross C, Herhaus P, et al. First experience with chemokine receptor CXCR4-targeted PET imaging of patients with solid cancers[J]. J Nucl Med, 2016, 57(5): 741-6.
[56] Niemeijer AN, Leung D, Huisman MC, et al. Whole body PD-1 and PD-L1 positron emission tomography in patients with non-small-cell lung cancer[J]. Nat Commun, 2018, 9(1): 4664.
[57]" van de Stadt EA, Yaqub M, Lammertsma AA, et al. Quantification of" 18F-Fafatinib using PET/CT in NSCLC patients: a feasibility study[J]. EJNMMI Res, 2020, 10(1): 97.
[58]" Gnesin S, Müller J, Burger IA, et al. Radiation dosimetry of 18F-AzaFol: a first in-human use of a folate receptor PET tracer[J]. EJNMMI Res, 2020, 10(1): 32.
[59]Kaira K, Higuchi T, Sunaga N, et al. Usefulness of 18F-α-methyltyrosine PET for therapeutic monitoring of patients with advanced lung cancer[J]. Anticancer Res, 2016, 36(12): 6481-90.
(编辑:林" 萍)
基金项目:内蒙古自治区自然科学基金项目(2018ZD11)
作者简介:高雅儒,硕士,医师,E-mail: 2571119396@qq.com
通信作者:王雪梅,博士,主任医师,E-mail: wangxuemei20100@163.com
