超声特征及免疫组化标志物对乳腺癌新辅助治疗后腋窝淋巴结病理完全缓解的预测价值
2024-10-30杨春林冒玉香王珏孙春娟张晴
摘要:目的" 探讨超声特征及免疫组化标志物对乳腺癌新辅助治疗(NAT)后腋窝淋巴结病理完全缓解(pCR)的预测价值。方法 回顾性分析2020年1月~2023年9月南通市肿瘤医院收治的伴腋窝淋巴结转移(ALNM)的140例乳腺癌患者的临床资料,所有患者均接受NAT+手术切除+腋窝淋巴清扫。根据腋窝淋巴结病理结果将患者分为pCR组(n=53)和非pCR组(n=87),比较两组NAT前乳腺癌原发灶及腋窝淋巴结超声特征及免疫组化标志物,采用Logistic回归分析确立乳腺癌NAT后腋窝淋巴结pCR的独立预测因素,并采用ROC曲线验证其预测效能。结果 两组原发灶纵横比、Adler血流分级,腋窝淋巴结短径、长短径比值、皮髓质分界、形态、彩色多普勒血流成像血流信号,HER-2及Ki-67的差异有统计学意义(Plt;0.05)。Logistic回归分析显示,腋窝淋巴结长短径比值≥2、腋窝淋巴结形态Ⅰ~Ⅱ型、腋窝淋巴结无彩色多普勒血流成像血流信号、HER-2阳性及Ki-67高表达是乳腺癌NAT后腋窝淋巴结pCR的独立预测因素(Plt;0.05)。ROC曲线显示,联合诊断的预测效能最高,曲线下面积为0.739(95% CI:0.643~0.812),敏感度为68.42%,特异度为75.34%。结论 超声特征及免疫组化标志物对乳腺癌NAT后腋窝淋巴结pCR具有一定的预测价值。
关键词:乳腺癌;腋窝淋巴结转移;新辅助化疗;超声;免疫组化
Predictive value of ultrasonographic features and immunohistochemical markers for pathological complete response of axillary lymph nodes after neoadjuvant therapy for breast cancer
YANG Chunlin, MAO Yuxiang, WANG Jue, SUN Chunjuan, ZHANG Qing
Department of Ultrasound, Nantong Tumor Hospital, Nantong 226001, China
Abstract: Objective To investigate the predictive value of ultrasound features and immunohistochemical markers for axillary lymph node pathological complete response (pCR) after neoadjuvant therapy (NAT) for breast cancer. Methods The clinical data of 140 breast cancer patients with axillary lymph node metastasis (ALNM) admitted to Nantong Tumor Hospital from January 2020 to September 2023 were retrospectively analyzed. All patients underwent NAT+surgical resection+axillary lymph node dissection. According to the pathological results of axillary lymph nodes, the patients were divided into pCR group (n=53) and non-pCR group (n=87). The ultrasonic features and immunohistochemical markers of primary breast cancer and axillary lymph nodes before NAT were compared between the two groups. Logistic regression analysis was used to establish the independent predictors of pCR of axillary lymph nodes after NAT of breast cancer, and ROC curve was used to verify its predictive efficacy. Results There were significant differences in the aspect ratio of primary tumor, Adler blood flow grading, short diameter of axillary lymph nodes, ratio of long and short diameter, cortical and medullary boundary, morphology, CDFI blood flow signal, HER-2 and Ki-67 between the two groups (Plt;0.05). Logistic regression analysis showed that the ratio of long and short diameter of axillary lymph nodes≥2, axillary lymph node morphology type I-II, no CDFI blood flow signal in axillary lymph nodes, HER-2 positive and Ki-67 high expression were independent predictors of pCR of axillary lymph nodes after NAT in breast cancer (Plt;0.05). ROC curve showed that the combined diagnosis had the highest predictive efficiency, with AUC of 0.739 (95 %CI 0.643-0.812), sensitivity of 68.42% and specificity of 75.34%. Conclusion Ultrasound features and immunohistochemical markers have certain predictive value for pCR of axillary lymph nodes after NAT in breast cancer.
Keywords: breast cancer; axillary lymph node metastasis; neoadjuvant chemotherapy; ultrasound; immunohistochemistry
乳腺癌是严重威胁女性健康的恶性肿瘤,腋窝淋巴结转移(ALNM)是其最早且最常见的转移方式[1] ;ALNM与患者预后密切相关,其可早期反映患者无病生存期及总生存期[2] 。新辅助治疗(NAT)是乳腺癌腋窝淋巴结阳性患者的标准治疗方式,其是指在手术前使用紫杉醇、表柔比星等化疗药物来降低乳腺癌分期,缩小瘤体[3] 。通过NAT治疗,部分患者可达到减瘤或降期的效果,进而可避免腋窝淋巴结过度清扫以减少患者不必要损伤,提高患者生命质量[4] 。腋窝淋巴结阳性患者在接受NAT获得临床病理完全缓解(pCR)后,用前哨淋巴结活检术代替腋窝淋巴结清扫术的有效性和安全性已被证实[5, 6] 。但错误的前哨淋巴结活检术代替腋窝淋巴结清扫术则会导致局部淋巴结残留,增加转移、复发几率,给患者带来严重后果。NAT后准确预测腋窝淋巴结状态对手术方案制定及患者预后具有重要意义。超声检查因其简单、快捷,价格低廉且无辐射被广泛应用于乳腺癌及其腋窝淋巴结早期检查中,超声特征可辅助诊断和评估腋窝淋巴结状态,但其特征性不高使其应用受限[7] 。分子生物学研究发现,乳腺癌发生发展与免疫组化标志物表达水平密切相关[8] 。另有研究发现,免疫组化标志物表达水平与超声图像特征存在一定关联性[9, 10] ,但不同研究结果存在差异,超声特征及免疫组化标志物对乳腺癌患者ALNM的预测价值需进一步确认。本研究首次将超声特征与免疫组化标志物结合起来预测乳腺癌NAT治疗后腋窝淋巴结pCR状态,以期在术前辅助临床医师更准确评估患者腋窝淋巴结状态,为NAT后乳腺癌患者腋窝处理方式提供更多临床参考。
1" 资料与方法
1.1" 一般资料
回顾性分析2020年1月~2023年9月南通市肿瘤医院收治的乳腺癌患者的临床资料。纳入标准:女性患者,单侧发病;年龄≥18岁;初诊,符合乳腺癌诊断标准[11] ,经乳腺穿刺活检确诊,且伴ALNM,但无远处转移;术前行常规超声检查;接受≥2个周期NAT治疗,治疗后行手术切除+腋窝淋巴结清扫术;临床病理资料完整,并有完善免疫组化标志物检测。排除标准:接受过其他抗肿瘤治疗者;乳腺癌复发或合并其他恶性肿瘤者;合并远处转移者;既往有乳腺或腋窝手术史者;任一免疫组化指标缺失者。最终共纳入140例患者,年龄27~73(53.48±10.47)岁;根据术后病理检查结果将其分为pCR组(n=53)和非pCR组(n=87)。本研究通过本院医学伦理审批(审批号:LW2024008)。
1.2" 研究方法
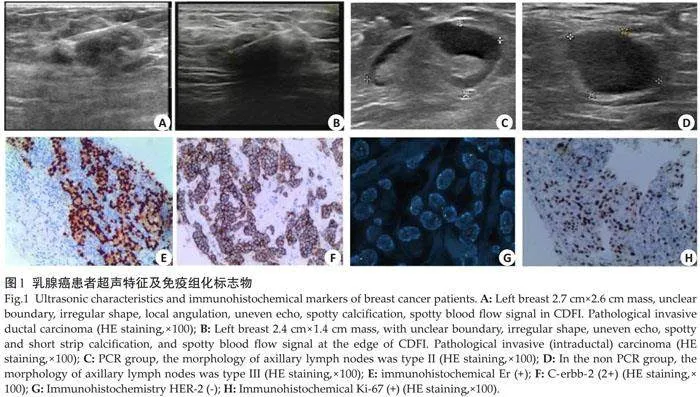
所有患者均于NAT前进行超声检查及超声图像分析。超声检查采用飞利浦EPIQ5、IU22超声诊断仪,L12-5高频线阵探头和L3-12A三星探头,频率5~12 MHz。患者采取仰卧位或侧卧位,充分暴露乳腺及腋窝,依次扫查双侧乳腺及腋窝区域,对病灶区域进行详细观察。图像分析由2位7年以上工作经验的超声科医师进行,当2位医师意见不统一时,由上级医师参与讨论并确定最终结果,记录原发病灶大小、病灶象限、纵横比、内部回声、边界、边缘、形态、有无钙化、血流信号(图1),腋窝淋巴结数目、长径、短径、皮髓质分界、最大皮质厚度、形态(参照《中国抗癌协会乳腺癌诊治指南与规范》2015版[12] ,Ⅰ型:淋巴结形态规则,皮质厚度lt;0.3 cm,门结构位于中央;Ⅱ型:皮质厚度≥0.3 cm,门结构居中或偏心;Ⅲ型:皮质厚度gt;0.3 cm,门结构消失)、血流信号,并计算长短径比值。
免疫组化标志物:收集患者NAT前穿刺活检肿瘤组织,经石蜡包埋、切片、抗原修复、封闭、加一抗、二抗、显色、封固等操作制成切片。由2位7年以上病理医师进行阅片,每张切片随机抽取5个视野,观察雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER-2)及增殖细胞核抗原(Ki-67)的表达情况。ER与PR表达情况根据细胞核棕黄色颗粒占比来判断,比值≥1%定义为ER/PR阳性;HER-2表达情况根据细胞膜中出现棕色颗粒的多少来判断,其中(-)~(+)定义为HER-2阴性,(+++)定义为HER-2阳性,(++)则需进一步行荧光原位杂交检测;Ki-67根据细胞核出现棕黄色颗粒着色数来判断,≥14%定义为高表达,<14%定义为低表达(图1)。
1.3" 统计学分析
采用SPSS24.0软件进行数据分析。计量资料以均数±标准差表示,组间对比采用独立样本t检验,组内前后对比采取配对t检验;计数资料以n(%)表示,组间对比采用χ2检验;以术后病理结果为“金标准”,依据Logistic回归分析各指标与NAT后腋窝淋巴结pCR的关系。绘制ROC曲线,计算曲线下面积分析各参数的诊断效能。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 患者基本资料分析
140例患者的肿块直径0.5~9.8 (2.52±0.78) cm;获得腋窝淋巴结pCR 53例(37.86%)。病理分型:浸润导管癌104例(74.28%),导管原位癌16例(11.43%),浸润小叶癌6例(4.29%)、粘液癌8例(5.71%)及乳头状癌6例(4.29%)。
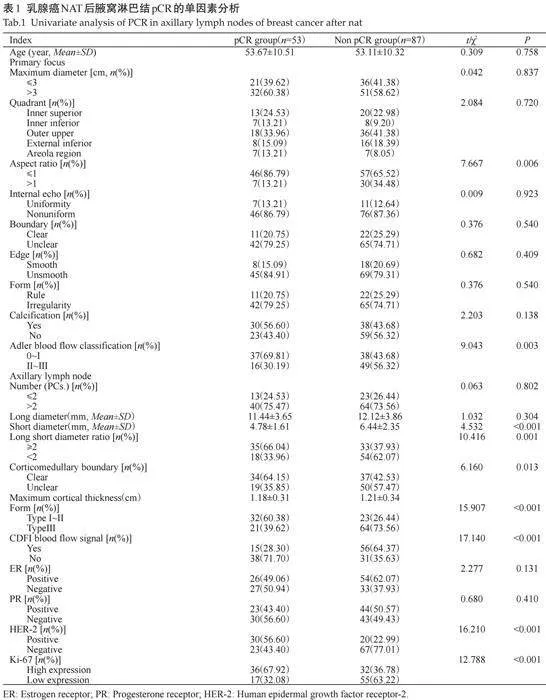
2.2" 乳腺癌NAT后腋窝淋巴结pCR的单因素分析
两组原发灶纵横比、Adler血流分级,腋窝淋巴结短径、长短径比值、皮髓质分界、形态、彩色多普勒血流成像(CDFI)血流信号、HER-2及Ki-67的差异有统计学意义(Plt;0.05,表1)。
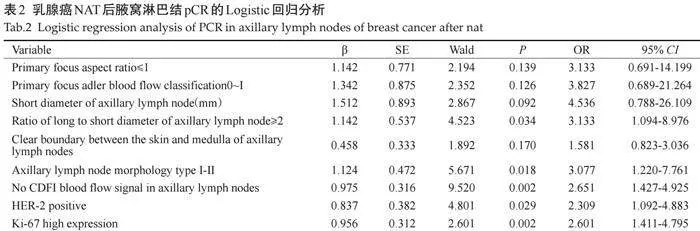
2.3" 乳腺癌NAT后腋窝淋巴结pCR的Logistic回归分析
结果显示,腋窝淋巴结长短径比值≥2、腋窝淋巴结形态Ⅰ~Ⅱ型、腋窝淋巴结无CDFI血流信号、HER-2阳性及Ki-67高表达是乳腺癌NAT后腋窝淋巴结pCR的独立预测因素(Plt;0.05,表2)。
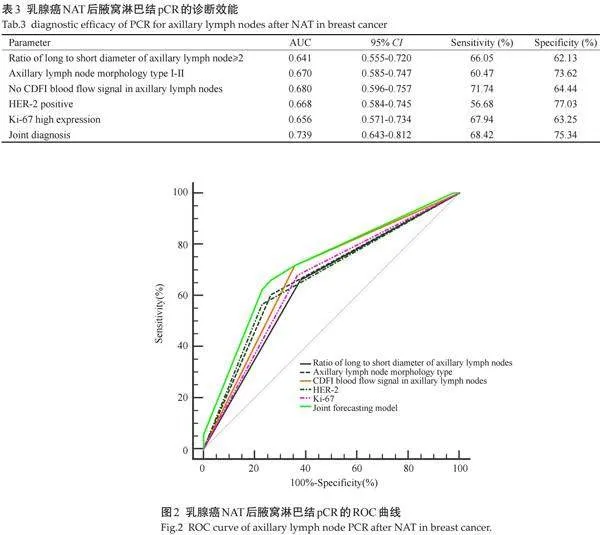
2.4" 乳腺癌NAT后腋窝淋巴结pCR的ROC曲线分析及诊断效能
ROC曲线显示,联合诊断的预测效能最高,曲线下面积为0.739(95% CI:0.643~0.812),敏感度为68.42%,特异度为75.34%(表3、图2)。
3" 讨论
乳腺癌是全球高发的恶性肿瘤,乳腺癌患者腋窝淋巴结的转移率较高。腋窝淋巴结清扫术可最大限度减少腋窝淋巴结复发,既往术前无论腋窝淋巴结状态如何均采取此类方式手术[13] 。但采取此类方式治疗后,患者并发症较高,给术后患者日常生活带来诸多不便,严重时威胁患者生命。文献报道,40%ALNM患者通过NAT治疗能够达到pCR,此类患者通过常规腋窝淋巴结清扫获益不大,仅通过前哨淋巴结活检术即可满足治疗需要[14] 。术前腋窝淋巴结阳性患者经过NAT后能否用前哨淋巴结活检术代替腋窝淋巴结清扫的关键在于术前准确评估腋窝淋巴结状态[15] 。目前,超声是NAT治疗后临床判断腋窝淋巴结状态的常用方式,但单纯超声检查作用有限。随着分子生物学的发展,免疫组化标志物在乳腺癌诊断和治疗中被广泛关注[16] 。本研究收集我院乳腺癌患者NAT治疗前原发灶及腋窝淋巴结超声特征,获取肿瘤免疫组化标志物,并探讨超声特征及免疫组化标志物对乳腺癌NAT后腋窝淋巴结pCR的预测价值,以指导临床诊疗。
本研究结果显示,140例患者中有53例患者获得腋窝淋巴结pCR,发生率为37.86%,此与既往研究数据一致[17, 18] 。通过单因素及Logistic多因素分析结果显示:腋窝淋巴结长短径比值≥2、腋窝淋巴结形态Ⅰ~Ⅱ型、腋窝淋巴结无CDFI血流信号、HER-2阳性及Ki-67高表达是乳腺癌患者NAT治疗后腋窝淋巴结pCR独立预测因素。既往研究显示,腋窝淋巴结纵横比gt;2是NAC后腋窝pCR的独立预测因素[19, 20] ,这与本研究结果一致。分析原因是,正常淋巴结呈椭圆形形或蚕豆形,长径明显大于短径,此时淋巴结长短径一般≥2;随着病情发展,淋巴结会变大变圆,淋巴结形态发生变化,淋巴结纵横比变小。因此,淋巴结长短径比值≥2,表明淋巴结正常状态,此时患者更易获得腋窝淋巴结pCR。
淋巴结形态分型从淋巴结形态、皮质厚度及淋巴结门结构3个方面进行评价。淋巴结形态不规则、皮质厚度gt;3 mm及淋巴结门结构偏移或消失是淋巴结异常的标志[21, 22] 。本研究显示,腋窝淋巴结形态Ⅰ~Ⅱ型是乳腺癌患者NAT治疗后腋窝pCR的独立预测因素,此与既往研究[23] 结果相似。分析原因是,正常淋巴结形态为圆形、椭圆形或肾形,皮质无突起、增厚,淋巴门结构位于中央,当肿瘤细胞侵入淋巴结时,首先种植于局部皮质的淋巴窦,表现为皮质局部突起、增厚;随着时间延长,肿瘤累及皮质局部小梁旁窦和髓窦,但此时超声表现为Ⅰ~Ⅱ型淋巴结;当病情进一步发展累及淋巴门处淋巴管时,此时淋巴结皮质进一步增厚,髓质消失,淋巴门结构偏移或消失,表现Ⅲ型淋巴结形态。通常来讲,Ⅰ~Ⅱ型淋巴结形态是淋巴结早期受累表现,而Ⅲ型淋巴结形态是淋巴结晚期表现[24] 。因此,相对Ⅲ型淋巴结,Ⅰ~Ⅱ型淋巴结形态患者病情较轻,NAT治疗后更易出现腋窝淋巴结pCR。腋窝淋巴结有CDFI血流信号则表明淋巴结内部有新生血管形成,有转移的可能。也有研究表明,腋窝淋巴结内血管数量、形态及灌注是反应肿瘤细胞生长的重要因素[25] 。一般来说,血流信号越丰富,肿瘤细胞生长越快,病情越重,越易发生转移。因此,腋窝淋巴结无CDFI血流信号,提示转移的可能性低,患者通过NAT治疗越易获得腋窝淋巴结pCR,亦有研究[26] 证实了这一观点。
乳腺癌患者NAT后腋窝淋巴结pCR与HER-2及Ki-67密切相关。数据显示,乳腺癌患者NAT后达到腋窝淋巴结pCR的分子分型中,HER-2阳性患者占50%以上[27] 。HER-2是乳腺癌重要的驱动基因和预后指标,HER-2阳性表达病灶对化疗药物比较敏感。2021中国肿瘤学会乳腺癌诊疗指南中明确指出,HER-2阳性是NAT的适应人群[28] 。有研究显示,HER-2阴性可能是NAT治疗后腋窝残留转移性淋巴结的预测指标[29] ,这与本研究结果相似。Ki-67是与细胞有丝分裂相关的增殖细胞相关抗原,其表达水平与患者疗效密切相关。相关研究表明,NAT前Ki-67表达水平是预测患者预后的有力指标,Ki-67高表达常表明较高的pCR率;NAT后Ki-67明显降低,提示患者无病生存期较长[30] 。因此,Ki-67高表达患者对NAT较敏感,具有较好的疗效,患者获得腋窝淋巴结pCR的几率较高。
本研究基于上述独立预测因素构建乳腺癌患者NAT后腋窝淋巴结pCR的曲线下面积为0.739,高于各项单独预测,可较好预测NAT治疗后腋窝淋巴结状态,辅助临床医师进行淋巴结清扫,让患者获得最佳收益。
综上所述,腋窝淋巴结长短径比值≥2、腋窝淋巴结形态Ⅰ~Ⅱ型、腋窝淋巴结无CDFI血流信号、HER-2阳性及Ki-67高表达是预测乳腺癌NAT后患者腋窝淋巴结pCR的独立预测因素,基于上述因素构建的预测模型具有较好的预测效能。
参考文献:
[1]" "Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA A Cancer J Clin, 2022, 72(1): 7-33.
[2]" " 胡林巧, 王" 伟, 权" 毅, 等. 双侧原发性乳腺癌腋窝淋巴结转移特点及其与预后的相关性分析[J]. 四川医学, 2023, 44(5): 492-500.
[3]" " 杨" 蔚, 李正正, 刘开惠, 等. 临床-病理-影像联合模型构建列线图预测乳腺癌新辅助治疗达病理完全缓解[J]. 中国医学影像学杂志, 2023, 31(7): 734-42.
[4]" "Shien T, Iwata H. Adjuvant and neoadjuvant therapy for breast cancer[J]. Jpn J Clin Oncol, 2020, 50(3): 225-9.
[5]" " 樊庆达, 丛斌斌, 陈玉光, 等. 临床淋巴结阳性新辅助治疗后腋窝降阶处理的研究进展[J]. 中国癌症杂志, 2023, 33(2): 174-80.
[6]" "荚从正, 章荣贵, 夏亚琳, 等. 前哨淋巴结活检与腋窝淋巴结清扫术对早期乳腺癌患者术后恢复、并发症及免疫功能的影响[J]. 临床和实验医学杂志, 2021, 20(8): 866-9.
[7]" "Li B, Zhao X, Zhang L, et al. Differences in ultrasonographic features between males and females with breast cancer of the luminal A and luminal B molecular subtypes[J]. Asia Pac J Clin Oncol, 2022, 18(5): 255-62.
[8]" "Shuai YJ, Ma L. Prognostic value of pathologic complete response and the alteration of breast cancer immunohistochemical biomarkers after neoadjuvant chemotherapy[J]. Pathol Res Pract, 2019, 215(1): 29-33.
[9]" "桑" 田, 刘" 文, 黄" 磊, 等. 乳腺癌超声特征与免疫组化指标的相关性[J]. 分子影像学杂志, 2021, 44(4): 583-88.
[10]" 李鑫焱, 李" 栋, 吴" 萌, 等. 超声特征联合免疫组化构建列线图预测乳腺癌新辅助化疗疗效[J]. 中国超声医学杂志, 2023, 39(7): 745-9.
[11]" 中华人民共和国国家卫生健康委员会. 乳腺癌诊疗指南(2022年版)[J]. 中国合理用药探索, 2022, 19(10): 1-26.
[12]" 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2015版)[J]. 中国癌症杂志, 2015, 25(9): 692-754.
[13]" 户" 庄, 周振宇, 李文龙. 乳腺癌改良根治术与乳腺区段切除联合腋窝淋巴结清扫术治疗早期乳腺癌患者的临床疗效[J]. 癌症进展, 2023, 21(16): 1847-50.
[14]" Damin AP, Zancan M, Melo MP, et al. Sentinel lymph node biopsy after neoadjuvant chemotherapy in patients with node‑positive breast cancer: guiding a more selective axillary approach[J]. Breast Cancer Res Treat, 2021, 186(2): 527-34.
[15]" Cao SY, Liu X, Cui JW, et al. Feasibility and reliability of sentinel lymph node biopsy after neoadjuvant chemotherapy in breast cancer patients with positive axillary nodes at initial diagnosis: an up-to-date meta-analysis of 3, 578 patients[J]. Breast, 2021, 59: 256-69.
[16] Bonacho T, Rodrigues F, Liberal J. Immunohistochemistry for diagnosis and prognosis of breast cancer: a review[J]. Biotech Histochem, 2020, 95(2): 71-91.
[17]" 毕" 钊, 宋现让, 陈" 鹏, 等. 中性粒细胞与淋巴细胞比值预测乳腺癌新辅助治疗后腋窝淋巴结病理学完全缓解的研究[J]. 中国癌症杂志, 2021, 31(1): 63-8.
[18] Samiei S, Simons JM, Engelen SME, et al. Axillary pathologic complete response after neoadjuvant systemic therapy by breast cancer subtype in patients with initially clinically node-positive disease[J]. JAMA Surg, 2021, 156(6): e210891.
[19]" 章" 晋, 徐" 栋, 周玲燕, 等. 超声结合临床特征基于166例乳腺癌新辅助化疗后腋窝淋巴结评估中的预测价值分析[J]." 肿瘤学杂志, 2023, 29(3): 203-7.
[20]" 王" 贝, 钱" 瑶, 徐" 琪, 等. 结合超声特征的腋窝淋巴结阳性乳腺癌新辅助化疗后腋窝病理完全缓解的预测模型[J]. 肿瘤学杂志, 2021, 27(7): 536-41.
[21]" Liang XY, Li ZY, Zhang L, et al. Application of contrast-enhanced ultrasound in the differential diagnosis of different molecular subtypes of breast cancer[J]. Ultrason Imaging, 2020, 42(6): 261-70.
[22]" 刘芙芸, 赵丽丽, 刘富霞, 等. 多模态超声特征与乳腺癌新辅助化疗患者术后病理缓解程度及BCL-2表达的相关性[J]. 中华内分泌外科杂志, 2021, 15(5): 483-7.
[23]" 苏泽珍, 李蔓英, 黄彩欣, 等. 超声联合免疫组织化学指标预测新辅助化疗后乳腺癌转移性腋窝淋巴结病理完全缓解[J]. 中国医学影像技术, 2022, 38(3): 379-83.
[24]" Zhu T, Huang YH, Li W, et al. Multifactor artificial intelligence model assists axillary lymph node surgery in breast cancer after neoadjuvant chemotherapy: multicenter retrospective cohort study[J]. Int J Surg, 2023, 109(11): 3383-94.
[25]" 姜" 倩, 吴晓恬, 葛" 舒. 超声结合临床特征对乳腺癌新辅助化疗后腋窝淋巴结状态的预测价值[J]. 中外医学研究, 2022, 20(31): 89-93.
[26]" 张鹏飞, 王" 茂, 余" 湛. 彩色多普勒血流成像联合超声弹性成像在乳腺癌临床诊断、新辅助化疗疗效评估中的应用价值[J]. 癌症进展, 2022, 20(11): 1133-6.
[27]" 黄丹凤, 陈琬萍, 陈轶洁, 等. 乳腺癌患者新辅助化疗后淋巴结转移病理完全缓解预测模型的建立[J]. 中国超声医学杂志, 2022, 38(6): 637-41.
[28]" 李健斌, 江泽飞. 2021年中国临床肿瘤学会乳腺癌诊疗指南更新要点解读[J]. 中华医学杂志, 2021, 101(24): 1835-8.
[29]" 王小娇. 不同HER-2表达强度的三阴性乳腺癌Ki-67表达与腋窝淋巴结转移的相关性研究[D]. 长春: 吉林大学, 2021.
[30]" 李" 晶, 欧阳取长. 新辅助化疗对乳腺癌疗效和雌激素受体孕激素受体Ki-67和人表皮生长因子受体2表达的影响分析[J]. 中国肿瘤临床与康复, 2011, 18(5): 407-10.
(编辑:林" 萍)
基金项目:江苏省卫生健康委重点项目(K2019021)
作者简介:杨春林,主治医师,E-mail: douni120@163.com
通信作者:张" 晴,副主任医师,E-mail: elizazq@126.com
