厚皮甜瓜‘SN-1’组培再生和遗传转化体系的建立
2024-10-29赵欣冉孙科新王建全胡宗霞郭永杰史庆华杨晓玉





关键词:厚皮甜瓜;组培再生;遗传转化
甜瓜为葫芦科瓜类蔬菜,因其果实味甜多汁、香气浓郁、且富含多种维生素和有机酸等营养成分,深受消费者喜爱,是我国重要的经济作物之一。然而,目前我国甜瓜产业仍存在品种单一、趋同性高,高端、优质、特色品种匮乏等问题,亟待通过持续的种源创新,推动育种工作高质量发展[1,2]。组培再生和遗传转化是开展功能基因组学研究的前提条件之一。前人对甜瓜的组培再生体系展开研究,成功诱导出多个品种的愈伤组织并获得再生植株[1,3-5];由于其类型多样,遗传背景差异较大,因此组培再生和遗传转化体系仍不成熟,存在不定芽和根系分化困难、转化效率低等问题。
影响甜瓜组培再生的因素包括基因型、苗龄、外植体类型、培养基组分、激素种类和配比等[6-9]。研究表明,不同类型甜瓜间再生效果差异明显,且薄皮类型再生效率高于厚皮类型[6],不同品种甜瓜外植体的最佳取样的时间为播种后2~6d[9,10]。培养基成分、特别是激素种类和配比对外植体再生影响显著。甜瓜组培中常用的生长调节剂包括6-苄氨基腺嘌呤(6-BA)、吲哚-3-乙酸(IAA)、吲哚丁酸(IBA)等,其中6-BA为愈伤和不定芽诱导所必需,使用浓度一般在0.5~2.0mg·L-1,适量添加IAA或ABA可平衡内源激素水平,抑制玻璃化的发生[11]。同时,遗传转化过程亦受到农杆菌菌株种类、侵染和共培养时间等因素影响,导致不同材料间转化效率差异显著[12]。课题组前期构建了薄皮甜瓜‘YJM’的组培再生和遗传转化体系[13],但厚皮甜瓜如‘SN-1’在该体系条件下极易出现不定芽玻璃化和生根困难等问题。针对这些难点,本研究通过筛选和优化种子处理方法、外植体处理条件、共培养时间、培养基成分、激素配比等,建立了适于‘SN-1’的组培再生和遗传转化体系,为厚皮甜瓜种源创制和分子设计育种奠定了基础。
1 材料与方法
1.1 材料
1.1.1 供试甜瓜材料 供试材料为厚皮甜瓜(CucumismeloL.ssp.melo)自交系‘SN-1’,试验地点为山东农业大学农业农村部黄淮地区园艺作物生物学与种质创制重点实验室。
1.1.2 菌株及载体 双元表达载体pFGC5941-CRISPR_CmPMI1由本实验室构建;大肠杆菌菌株Trans1-T1和农杆菌菌株EHA105分别购自北京全式金生物技术股份有限公司和上海唯地生物有限公司。
1.2 方法
1.2.1 种子萌发和消毒条件的筛选 选取饱满均一的甜瓜种子,灭菌后置于Agar、1/2MS+Agar和MS+Agar3种萌发培养基,28℃、暗培养2d后统计萌发率和整齐度;随后配制3种浓度NaClO消毒液(2%、3%和4%,v/v),对种子分别进行10、15、20和25min处理,28℃、暗培养2d后统计萌发率和整齐度。试验设置3次重复,每组30粒种子。
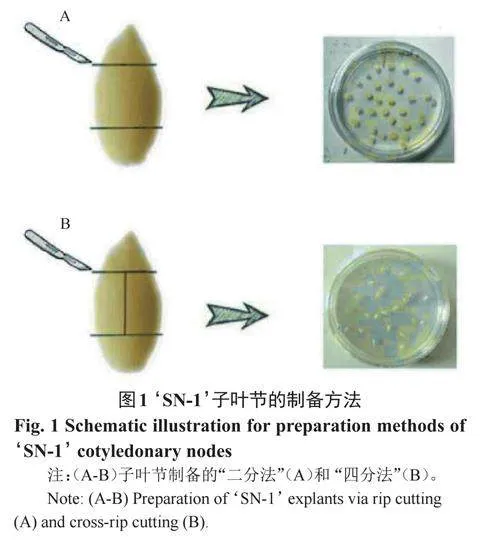
1.2.2 外植体收集时间和方法的筛选 在播种后24、32、40、48和56h收集子叶节,置于诱导培养基[13],在28℃、光周期16h/8h、光强8000lx条件下培养4周,统计不定芽分化情况。进一步以“二分法”和“四分法”切取外植体(图1),置于诱导培养基、相同环境条件下培养3d后,统计外植体转绿时间、污染率和不定芽分化情况。试验设置3次重复,每组15粒种子。
1.2.3 诱导和生根培养基激素配比的筛选 收集子叶节,置于含不同浓度6-BA(0.25、0.5、1和2mg·L-1)的诱导培养基[13],环境条件同1.2.2,28d后统计不定芽分化和玻璃化情况;在此基础上进一步添加不同浓度IAA和ABA(表1,IM-1~IM-16),培养4周后统计不定芽分化和玻璃化情况。切取长度3cm左右的不定芽,转至含不同浓度IAA的生根培养基(表1,RM-1~RM-5),环境条件同1.2.2,10d后统计生根率。试验设置3次重复,每组20个子叶节或不定芽。
1.2.4 共培养条件的筛选 将农杆菌侵染后的子叶节置于共培养培养基,28℃、暗培养1~4d,统计外植体污染情况;进一步配制不同激素配比共培养培养基(表1,CM-1~CM-5),28℃、暗培养3d后,统计外植体褐化和污染情况。试验设置3次重复,每组20个子叶节。
1.2.5 转基因阳性苗的鉴定 取适量叶片充分研磨,随后将PAT/BAR金标免疫快速检测试纸条浸入组织匀浆,室温静置5min,观察显色结果以确定再生植株Basta抗性;进一步利用CTAB法提取基因组DNA,PCR扩增、Sanger测序分析靶位点突变情况。
2 结果与分析
2.1 不同萌发培养基对‘SN-1’种子萌发的影响
如图2所示,Agar、1/2MS+Agar和MS+Agar三种培养基上种子萌发率虽无显著差异,但在萌发整齐度和时间方面却差异明显,其中Agar组两指标(86%和40h)均优于1/2MS+Agar(78%和45h)和MS+Agar组(70%和55h),故选择其为‘SN-1’的萌发培养基。
2.2 消毒剂配比和处理时间对‘SN-1’种子萌发的影响
以不同浓度NaClO溶液对种子进行消毒处理,28℃、暗培养2d后统计其萌发率和整齐度,结果如图3A~B所示,三组种子萌发率虽无显著差异,但整齐度指标差异明显,其中2%和3%两组均在85%以上,而4%组仅为60%,显著低于前两组;进一步分析发现3%组种子萌发率和整齐度均值分别为95.3%和88.9%,略高于2%组两指标的均值(92%和72%),故选择该浓度消毒剂进行种子处理。随后比较不同消毒时间对种子萌发的影响,结果如图3C~D所示,随着处理时间的增加,种子萌发率和整齐度呈先上升后下降的趋势,其中15min处理的种子两指标分别为91%和88%,显著优于其他处理,因而确定其为最佳消毒时间。
2.3 外植体切取方式和时间对‘SN-1’子叶节组培再生的影响
如图4A~C所示,相较传统的“二分法”,“四分法”取样在不影响子叶节转绿时间、污染率和不定芽分化率的前提下,大幅度增加了外植体的获取数量和种子的利用率;进一步对子叶节取样时间进行筛选,结果如图4D~E所示,不同时期子叶节的不定芽诱导率差异明显,相较其他取样时期,以播后48h、胚根长度约5mm的种子为供体所收集的子叶节,不定芽分化率最高(75.3%),因此该时期为‘SN-1’外植体最佳取样时间。
2.4 不同激素浓度和配比对‘SN-1’子叶节组培再生的影响
如图5A~B所示,随着诱导培养基中6-BA浓度的增加,不定芽分化率呈先升高后降低的趋势,玻璃化率则逐渐升高,其中6-BA浓度0.5mg·L-1时子叶节的不定芽诱导率可达85%,显著优于其他处理,且不定芽玻璃化率较低、大多可分化为正常植株;在此6-BA浓度基础上添加IAA和ABA,分析不同激素配比对不定芽分化和玻璃化的影响,结果如图5C~D所示,相较其他激素组合,IM-10不定芽分化率最佳,达到90%以上,且玻璃化率较低,因此诱导培养基的激素配比确定为0.5mg·L-16-BA+0.05mg·L-1IAA+1mg·L-1ABA。进一步分析IAA对‘SN-1’生根的影响,结果如图6所示,再生苗在不同IAA浓度生根培养基上均可产生不定根,但所需时间存在差异,当IAA浓度为0.4mg·L-1时生根率最高、且生根时间最短,因此该浓度为最佳。
2.5 共培养条件对‘SN-1’子叶节组培再生的影响和转基因材料的获得
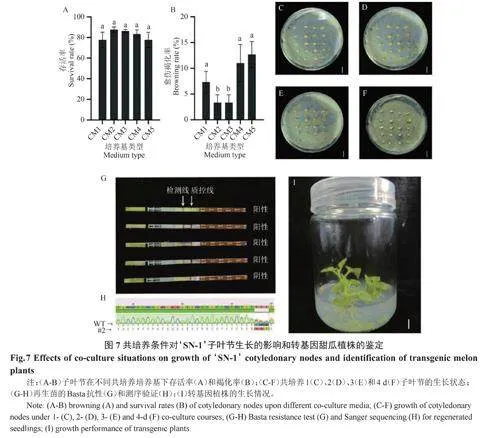
共培养是农杆菌介导植物遗传转化过程中的关键步骤之一[14]。对共培养培养基的激素组成进行筛选,结果如图7A~B所示,CM-2(MS+0.5mg·L-16-BA+0.1mg·L-1IAA+9g·L-1Agar)子叶节的存活率和褐化率较CM-1、CM-3~CM-5四组为优,故确定该激素组合为最佳;进一步比较共培养时间对子叶节生长的影响,结果如图7C~F所示,子叶节随着时间延长逐渐膨大、至3d时达到最佳,当4d时因农杆菌大量出现而使其生长受到抑制,因此确定暗处理3d为本研究所用共培养时间;随后对再生苗的进行Basta抗性和测序验证,鉴定到具有Basta抗性、且目标基因发生两个碱基缺失的植株,表明‘SN-1’的组培再生和遗传转化体系已成功建立。
3 讨论
前人研究表明,种子生长状态对不定芽诱导效率至关重要[15]。本试验通过对甜瓜种子消毒条件、外植体收收集时间和制备方法等进行筛选优化,显著提高了种子利用率和不定芽分化率(图2-3)。甜瓜组培再生与激素浓度和配比关系密切[16,17],添加不同激素会直接影响外植体生长状态和不定芽诱导效果[18]。本试验对诱导培养基的激素配比进行了筛选,发现随着6-BA浓度的升高,甜瓜愈伤组织和不定芽的玻璃化迅速加重,进而影响不定芽的分化和伸长;当添加了IAA和ABA两种激素后,不定芽玻璃化程度显著减轻、分化率显著提高。这与高宁宁等[1]和王果等[19]研究结果类似。
有报道指出,IAA对侧根的形成和发育有显著影响[19],低浓度时可促进叶菜型甘薯不定根生长,而高浓度抑制其生长[20]。据此,我们在生根培养基中添加了IAA,并对其适宜浓度进行了筛选,发现在一定范围内IAA浓度的增加可显著缩短不定芽的生根时间,但当其浓度超过0.8mg·L-1时,会导致再生苗早衰、生长受抑等(图6)。
遗传转化效率受多种因素的影响。李娟等在西瓜研究中发现,农杆菌在外植体切口处需保持至少16h,才有可能诱导外植体产生愈伤组织并启动侵染过程,因此建议共培养时间应超过16h[21]。本研究对‘SN-1’共培养时间进行了筛选,发现处理时间3d效果最佳,若时间过短,外植体无法完全膨大,影响后续不定芽分化,但时间过长则会导致农杆菌过度侵染,外植体出现死亡、褐化等(图7C~F),这与刘丽峰等[22]结果一致。随后对激素配比进行了筛选,发现共培养培养基中添加ABA极易导致外植体褐化、死亡,因此‘SN-1’共培养所用培养基仅添加了适宜浓度6-BA和IAA,这与万丽丽等[12]研究结果有所差异,可能是由甜瓜品种间差异所致。
4 结论
本研究建立了厚皮甜瓜‘SN-1’的组培再生和遗传转化体系,发现以3%NaClO溶液处理种子15min、Agar培养基作为萌发培养基,灭菌和萌发效果最佳;播种后48h、胚根长度约5mm时,所收集子叶节的不定芽分化效果最优;最佳诱导培养基和生根培养基配方分别为(MS+0.5mg·L-16-BA+0.05mg·L-1IAA+1mg·L-1ABA+9g·L-1Agar)和(MS+0.4mg·L-1IAA+9g·L-1Agar);农杆菌侵染的子叶节置于含0.5mg·L-16-BA和0.1mg·L-1IAA的MS固体培养基、共培养3d,其生长均一、污染率最低、且后期愈伤诱导和不定芽分化最好。
