黄瓜FtsZs基因家族鉴定及分析
2024-10-29陈琳杰常婧姝张宇颜爽任仲海王丽娜



关键词:黄瓜;FtsZs基因;生物信息学分析;非生物胁迫反应;生物胁迫反应
黄瓜(CucumissativusL.)是世界性的十大蔬菜作物之一,而我国是黄瓜的主产国。2022年,我国黄瓜种植面积为131.15万hm2,总产量为7730.73万吨,分别占全球的60.32%和81.62%,均居世界第一位。
FtsZ(FilamentingtemperaturesensitiveZ)蛋白作为一种可溶性的胞质蛋白,是微管蛋白的结构同系物。FtsZ在离体条件下经诱导可通过多聚化作用组装成线形排列的有序结构,而这些由FtsZ蛋白组成的结构则与tubulin形成的原纤丝非常类似[1],暗示了其功能的相似性。FtsZ蛋白多定位于质体或叶绿体,并作为质体分裂复合体的基本组成部分,组装成FtsZ环并招募至少二十多种蛋白质介导胞质分裂[2]。FtsZ可直接或间接地调控叶绿体分裂环中蛋白质的组装和定位,并驱动叶绿体的分裂。有研究表明,拟南芥FtsZ1、FtsZ2-1和FtsZ2-2定位于叶绿体的基质和类囊体上,可以通过影响叶绿体分裂,使叶绿体变大[3-5]。水稻(Oryzasativa)OsFtsZ1和OsFtsZ2-1过表达和敲低都会抑制淀粉体分裂,产生多形性淀粉颗粒[6]。与野生型相比,马铃薯ftsz1敲除突变体块茎中淀粉颗粒增大或淀粉粒黏度增加[7]。在小立碗藓中,利用基因编辑技术获得了ftsz2-1突变体,研究发现,ftsz2-1突变体的叶绿体分裂受到显著影响,甚至在其少数细胞中能观察到单个不分裂的丝状叶绿体[8]。在烟草中敲低FtsZ基因会干扰叶绿体的正常分裂过程,引起叶绿体发育的异常,并导致叶绿体数目的减少和体积的增加[9]。
目前黄瓜FtsZs家族的研究还未见报道,其功能尚不清楚。为了解析黄瓜FtsZs基因的功能,本文对黄瓜FtsZs家族成员进行了鉴定,分析了其基因结构及在染色体上的分布,研究了黄瓜FtsZs与拟南芥、番茄、甜瓜FtsZs的亲缘关系,确定了其组织表达特性及对生物和非生物胁迫的响应情况,研究结果可为探明黄瓜FtsZs作用机制提供数据支撑。
1 材料与方法
1.1 FtsZs家族基因的鉴定
分别从葫芦科基因组网站(http://CucurbitGenomicsDatabase(CuGenDB)、拟南芥基因组网站(https://www.arabidopsis.org)和番茄基因组网站(https://solgenomics.net)下载黄瓜、甜瓜、拟南芥和番茄gff、cds、pep、fasta文件,获得黄瓜、甜瓜、拟南芥和番茄所有注释基因信息。随后从Pfam数据库(http://www.example.com)下载FtsZ保守域(PF12327)的HMM配置文件,在所下载注释基因信息中筛选黄瓜、甜瓜、拟南芥和番茄的FtsZs基因(默认参数和截止值为0.01)。使用Pfam工具(http://www.example.com)和SMART(http://www.example.com)对筛选获得的黄瓜、甜瓜、拟南芥和番茄FtsZ保守域进行鉴定,并根据其与拟南芥FtsZs的亲缘关系进行命名;使用ExPasy(htps:/web.ExPasy.org/computepI/)计算FtsZs的相对分子量(Mw)、氨基酸数量(AA)和等电点(pI);使用Plant-mPLoc(http://www.csbio.situ.edu.cn/bioinf/plant-multi/)预测FtsZs的亚细胞定位情况。
1.2 黄瓜、甜瓜、拟南芥和番茄FtsZs进化关系分析
利用MEGA7软件中的ClustalX对所有FtsZs蛋白序列进行对比,随后采用邻接法(Neighbor-Joiningmethod,NJ)构建系统进化树,并用Bootstrap法(重复次数设定为1000)评估系统进化树,最终使用MEGA7呈现进化树。
1.3 黄瓜FtsZs基因及蛋白结构的分析
从黄瓜基因组网站(http://CucurbitGenomicsDatabase(CuGenDB))获得FtsZs的内含子和外显子信息,并利用TBtools生成基因结构;使用MEME(htps://www.omicsclass.com/article/432)在线网站分析黄瓜FtsZs的保守motif(设置基序数为10,基序的最小长度为6个氨基酸,基序的最大长度为10个氨基酸),并用TBtools可视化[10];从黄瓜基因组网站(http://CucurbitGenomicsDatabase(CuGenDB))获得FtsZs的蛋白序列,从SMART网站获得Tubulindomain和FtsZ-Cdomain两个保守结构域的蛋白序列,利用DNAMAN生成FtsZs蛋白序列并分析蛋白序列的差异。
1.4 黄瓜FtsZs组织表达特性分析
基于已有的RNA-seq数据(SRA046916)[11],分析了黄瓜FtsZs在根、茎、叶、雌花、雄花、子房、未受精子房、已受精子房和卷须等九个组织的表达情况。并基于FPKM值使用TBtools软件(v2.086)可视化。
1.5 实时荧光定量PCR分析黄瓜FtsZs表达特性
将华北型黄瓜“9930”种于山东农业大学园艺实验站9号温室,并按照常规栽培方法进行管理。在结果期取根、茎、叶、雌花、雄花、卷须和果实等组织,采用TRIzol(湖南艾科瑞生物工程有限公司)提取RNA,并用EvoM-MLV反转录预混型试剂盒Ver.2(t湖南艾科瑞生物工程有限公司)逆转录成cDNA。使用PrimerPremier5.0设计引物,并以黄瓜肌动蛋白基因作为内参(引物序列见附表S1)。采用SYBRGreenProTaqHS预混型qPCR试剂盒(湖南艾科瑞生物工程有限公司)在CFXOpus96实时PCR检测系统(Bio-Rad,Hercules,CA,USA)进行实时荧光定量PCR检测。采用2-ΔΔCt方法计算所选基因的相对表达水平[12]。对每个基因进行3次生物学和3次技术重复。
1.6 黄瓜FtsZs响应非生物和生物胁迫分析
从NCBI(https://www.ncbi.nlm.nih.gov/)下载了盐胁迫(GSE116265)[13]、高温胁迫(GSE151055)[14]、冷处理(GSE210703)[15]和白粉病菌侵染(GSE81234)[16]的转录组数据,以分析黄瓜FtsZs的响应情况,并用TBtools可视化。
2 结果与分析
2.1 黄瓜、甜瓜、拟南芥和番茄FtsZs的鉴定
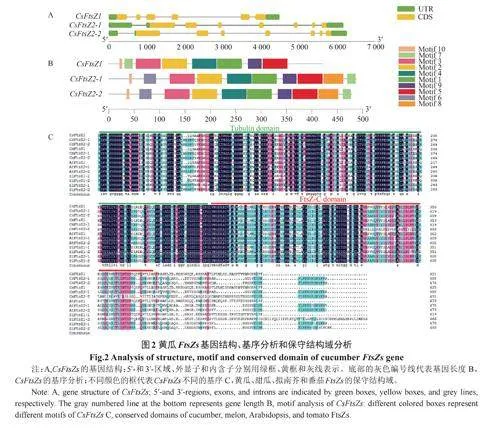
本文在黄瓜、甜瓜、拟南芥和番茄中分别鉴定到了3个、3个、3个和4个FtsZs基因,并按亲缘关系对其进行命名(见表1)。通过比对基因结构发现,基因间的长度相差很大,介于2050和17560bp之间,其中最短的基因为AtFtsZ1(2050bp),最长的基因为SlFtsZ2-1(17560bp);它们的外显子数目介于6和8之间,黄瓜FtsZs基因的外显子多为7个,拟南芥FtsZs基因的外显子多为6个,番茄FtsZs基因的外显子多为7个。蛋白结构分析发现,氨基酸长度介于419和491AA之间;大部分基因偏酸性(AtFtsZ1,AtFtsZ2-1,AtFtsZ2-2,CsFtsZ1,CsFtsZ2-1,CsFtsZ2-2,SlFtsZ1-1,SlFtsZ2-1,SlFtsZ2-2,CmFtsZ1,CmFtsZ2-1,CmFtsZ2-2),只有1个基因偏碱性(SlFtsZ1-2)。黄瓜FtsZs基因长度与其他物种的差异较大,暗示FtsZs在不同物种中可能发挥不同的功能。
亚细胞定位预测结果显示,所有的FtsZ1s基因都在叶绿体和细胞质中有定位信号(AtFtsZ1,CsFtsZ1,SlFtsZ1-1,SlFtsZ1-2,CmFtsZ1),黄瓜和甜瓜的FtsZ2s基因都有细胞质定位信号(CsFtsZ2-1,CsFtsZ2-2,CmFtsZ2-1,CmFtsZ2-2),而拟南芥和番茄的FtsZ2s基因都有叶绿体定位信号(AtFtsZ2-2,SlFtsZ2-1,SlFtsZ2-2)。
2.2 黄瓜、甜瓜、拟南芥和番茄FtsZs进化关系分析
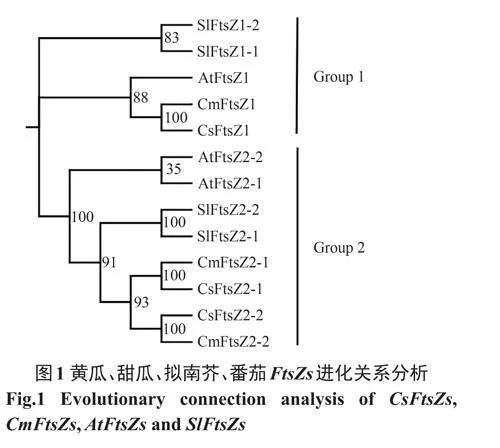
根据亲缘关系的远近,我们可以将FtsZs基因分为2个组。第一组包括1个黄瓜FtsZ基因(CsFtsZ1),1个甜瓜FtsZ基因(CmFtsZ1),1个拟南芥FtsZ基因(AtFtsZ1)和2个番茄FtsZs基因(SlFtsZ1-1,SlFtsZ1-2),其中黄瓜FtsZ基因和甜瓜FtsZ基因的亲缘关系最近,其次是拟南芥和番茄。第二个组包括2个黄瓜FtsZs基因(CsFtsZ2-1,CsFtsZ2-2),2个番茄FtsZs基因(SlFtsZ2-1,SlFtsZ2-2),2个拟南芥FtsZs基因(AtFtsZ2-1,AtFtsZ2-2),2个甜FtsZs基因瓜(CmFtsZ2-1,CmFtsZ2-2),其中黄瓜FtsZs基因和甜瓜FtsZs基因的亲缘关系最近,其次是拟南芥FtsZs基因和番茄FtsZs基因(图1)。
2.3 黄瓜FtsZs基因结构分析
研究发现,CsFtsZ1有6个外显子,氨基酸长度为421AA;CsFtsZ2-1有7个外显子,氨基酸长度为488AA;CsFtsZ2-2有7个外显子,氨基酸长度为479AA。CsFtsZ1与CsFtsZ2-1、CsFtsZ2-2在外显子数目和氨基酸长度上存在差异,CsFtsZ2-1与CsFtsZ2-2在基因结构上差异不大。
保守motif基序分析发现,黄瓜3个FtsZs基因均含有M1、M2、M3、M4、M5、M7、M9、M10这8个基序,而M6和M8这2个基序只存在CsFtsZ2-1和CsFtsZ2-2中。
保守结构域分析发现,黄瓜、甜瓜、拟南芥和番茄的FtsZs都含有Tubulindomain和FtsZ-Cdomain结构域,暗示了基因进化上的保守性。
2.4 黄瓜FtsZs基因的组织表达模式
RNA-seq数据显示(图3),3个黄瓜FtsZs基因在叶、茎、子房和雌花中表达量较高,推测其参与了叶、茎、子房和雌花的生长发育。其中,CsFtsZ2-1和CsFtsZ2-2在雌花和未受精子房中的表达量差异较大,暗示其在雌花和子房生长发育中发挥不同的功能。
荧光定量PCR结果显示,黄瓜CsFtsZ2-1基因在华北型黄瓜“9930”叶片、雄花和雌花中的表达量较高。
2.5 黄瓜FtsZs基因在生物胁迫和非生物胁迫下的表达谱
利用盐胁迫、高温处理、冷胁迫和白粉病菌侵染RNA-seq数据,分析了黄瓜FtsZs基因在胁迫下的响应情况。首先,我们分析了黄瓜FtsZs基因在盐胁迫下的表达情况,结果显示,NaCl处理后,黄瓜CsFtsZ2-1基因下调,表明该基因可响应盐胁迫;硅(Si)被认为是植物的第四大基本元素,可增强抗逆性并促进植物的生长发育。在仅用Si处理的条件下和外源盐加硅(NaSi)处理下,黄瓜FtsZs的表达量差异不大(图4)。
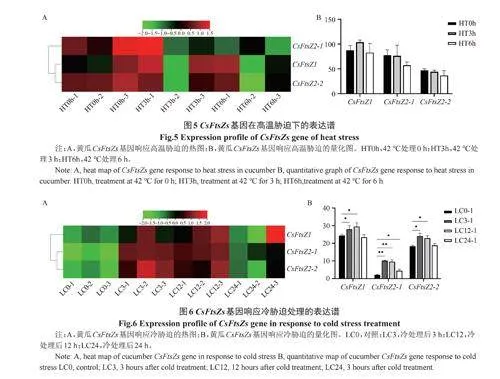
黄瓜FtsZs基因对高温处理响应结果表明(图5),高温处理3h和高温处理6h后,黄瓜中的3个FtsZs基因表达水平没有明显变化,这表明黄瓜中的3个FtsZs基因不响应高温胁迫。
黄瓜FtsZs基因对冷胁迫响应结果表明(图6),冷处理3h和12h后,黄瓜中3个FtsZs基因表达均上调,而冷处理24h后只有CsFtsZ2-1基因上调,这表明黄瓜中的3个FtsZs基因均可响应冷胁迫。
分析了黄瓜FtsZs基因对白粉病的响应情况,结果显示,在白粉病敏感株系D8中,接种白粉病后,CsFtsZ1和CsFtsZ2-1的表达量显著提高,表明两者可响应白粉病病原菌侵染;在白粉病抗性株系SSL508-28中,接种白粉菌前后,黄瓜FtsZs的表达量差异不大(图7)。
3 讨论
迄今为止,在大多数的原核生物中均发现了FtsZ基因,并对其功能进行了深入的研究。相较于原核生物,真核生物中FtsZs基因的报道较少。本文在黄瓜、甜瓜、拟南芥和番茄中分别鉴定到了3~4个FtsZs基因,暗示了FtsZs基因数目在不同物种间具有高度的保守性。拟南芥3个FtsZs基因中最长的为3269bp,最短的为2050bp;黄瓜3个FtsZs基因中最长的为6264bp,最短的为4493bp;甜瓜3个FtsZs基因中最长的为13038bp,最短的为4410bp;番茄4个FtsZs基因中最长的为17560bp,最短的为6365bp,暗示着在不同物种之间FtsZs基因的结构存在差异性(表1)。本文鉴定到的13个FtsZs基因都含有Tubulindomain和FtsZ-Cdomain两个保守的结构域,但是不同物种之间保守结构域的基序是有差异的,即使是同属于葫芦科的黄瓜和甜瓜,它们保守结构域的基序也不完全相同(图2),这就暗示了该基因在进化上既有保守性又存在差异性,进一步说明不同物种之间FtsZs基因功能可能不尽相同。
有研究发现,木薯中的MeFtsZ2-1和MeFtsZ2-2定位于叶绿体内[17]。将MeFtsZ2-1和MeFtsZ2-2在拟南芥中异源表达,可影响拟南芥叶肉细胞中的叶绿体分裂进而使叶绿体数量减少[17];在拟南芥中抑制AtFtsZ1-1或AtFtsZ2-1的表达也会通过影响叶绿体分裂使成熟叶细胞中叶绿体的数量减少[18]。我们利用在线网站预测了黄瓜中3个FtsZs基因的亚细胞定位情况,发现它们在叶绿体或细胞质中有定位信号,推测它们在黄瓜的叶绿体中起作用(表1)。
已有的研究表明,在木薯中过表达MeFtsZ2-1基因会使木薯植株早开花,顶端分支明显增多,叶片变小且数量增多[17]。我们利用RNS-seq数据和荧光定量PCR技术分析发现,黄瓜中3个FtsZs基因在叶中都有较高表达,推测其在黄瓜叶中发挥重要功能(图3)。我们利用荧光定量PCR技术研究发现,CsFtsZ2-1在雄花和雌花中表达量也较高,推测CsFtsZ2-1也会影响花的发育(图3),但其具体作用机制还需要做深入的研究。
前人研究表明,在300mMNaCl胁迫下,木薯FtsZ2-1的转录水平先降低后升高,在NaCl胁迫4h时达到最低水平,在NaCl胁迫48h时达到最高水平[19]。本文结果显示,黄瓜FtsZ2-1基因在75mM盐处理下表达下调。除此之外,我们还发现黄瓜CsFtsZ1、CsFtsZ2-1和CsFtsZ2-1基因可响应冷胁迫,CsFtsZ1和CsFtsZ2-1可响应白粉病菌侵染,暗示着黄瓜FtsZs基因在盐胁迫、冷胁迫和白粉病抗性中发挥作用。
4 结论
本文在黄瓜中鉴定到3个FtsZs基因,基因结构分析发现黄瓜FtsZs基因长度为1266~1467bp,外显子数目为6~7个,氨基酸长度为421~488AA;保守结构域分析发现它们都含有Tubulindomain和FtsZ-Cdomain两个保守的结构域。组织表达特异性分析发现,FtsZs在黄瓜叶、茎、子房和雌花组织中表达量较高;CsFtsZ2-1基因可响应盐胁迫,CsFtsZ1、CsFtsZ2-1和CsFtsZ2-2可响应冷胁迫,CsFtsZ1和CsFtsZ2-1可响应白粉病病原菌侵染。
