鸭粪链球菌的分离与鉴定研究
2024-10-28徐础敏


摘 要:选择广东省惠东县某养鸭场内疑似粪链球菌感染的患病鸭分离培养病原菌,通过镜检、PCR检测、生化试验与药敏试验进行鉴定。经培养鉴定,该病原菌为鸭粪链球菌,为革兰氏阳性菌,PCR检测可扩增出大小为546 bp的特异性电泳条带;对木糖、阿拉伯糖、鼠李糖、β-半乳糖苷酶、卫矛醇、氧化酶、动力、硫化氢等生化反应试验结果呈阴性,蔗糖、乳糖、麦芽糖、葡萄糖、甘露糖、山梨糖、甘露醇、山梨醇、精氨酸水解、七叶苷水解、硝酸盐还原、水杨素等生化试验呈阳性;对环丙沙星、磷霉素、氨苄西林、头孢哌酮、诺氟沙星、左氧氟沙星、万古霉素等几种抗生素药物较敏感。本研究结果为今后本病的正确诊断和有效防治提供科学参考依据。
关键词:分离;鉴定;鸭;粪链球菌
中图分类号:S858.32 文献标识码:B 文章编号:1673-1085(2024)10-0028-05
我国养鸭具有悠久的历史,最早的养鸭记录可追溯到公元前500年。目前,我国已成为主要养鸭生产国之一,肉鸭生产在世界上占据重要的地位。据相关数据统计显示,我国肉鸭饲养量占全世界总量的70%左右,年屠宰量已超过30亿只,鸭肉年产量超过500万吨,年总产值高达500亿元,是我国畜禽养殖业的主要经济支柱产业之一,对我国社会发展具有重要意义[1-2]。然而,随着养鸭规模的不断扩大和集约化发展,鸭粪链球菌、鸭浆膜炎、小鸭肝炎、大肠杆菌病、禽流感等疾病频繁发生,严重影响鸭的健康生产。粪链球菌是一种革兰氏阳性菌,又称粪肠球菌,是人和动物机体肠道内的一种主要菌,属于条件性致病菌,当机体免疫功能改变或年龄、饮食等因素变化时,常会感染动物而发病,并可大范围的水平传播,给养鸭业带来了极其严重的威胁[3]。因此,积极地分离、鉴定本病原菌,准确诊断该病,以便更好地防治鸭粪链球菌病。本研究选择广东省惠东县某养鸭场内发生的疑似鸭粪链球菌病的6只患病鸭作为试验对象,采集病料分离、鉴定病原菌,并进行药敏试验,旨在为本病的正确诊断和有效防治提供科学参考依据。
1 材料与方法
1.1 主要试剂
LB液体培养基、葡萄糖肉汤、普通琼脂培养板、麦康凯琼脂培养基,购自北京索莱宝科技有限公司;PCR引物、10 × PCR buffer、dNTPs、Taq DNA 聚合酶等,购自大连宝生物有限公司;生化试验鉴定试剂,购自杭州天和微生物试剂有限公司;药敏试验用纸片,购自天津利达医疗器材有限公司;细菌基因组DNA提取试剂盒,购自上海生工生物工程有限公司。
1.2 病料来源
广东省惠东县某养鸭场内疑似鸭粪链球菌病的6只患病鸭,分别无菌采集心脏血液、关节液和肝脏组织,作为待检病料。
1.3 病原菌的分离培养与显微镜检查
分别将上述采集的三种病料划线接种至普通琼脂培养基、麦康凯琼脂培养基上,37 ℃静置培养 24 h,观察细菌的生长状态。挑取具有典型特征的单克隆菌落接种于普通营养琼脂培养基上,37 ℃继续培养24 h,然后挑取单个菌落分别接种至LB液体培养基和葡萄糖肉汤培养基中,转移至37 ℃恒温震荡培养箱,继续培养24 h,观察病原菌的生长。将分离获得的病原菌进行涂片和革兰氏染色,光学显微镜下观察其形态特征。
1.4 PCR检测
按照细菌基因组DNA提取试剂盒说明书提取分离菌的基因组DNA,PCR检测。PCR反应体系为:2 μL 10×PCR buffer,1.0 μL上游引物,1.0 μL下游引物,模板2.0 μL,0.5 μL Taq聚合酶,添加灭菌双蒸水补充至20 μL体系。PCR反应参数设置为:95 ℃预变性5 min;94 ℃变性1 min,53 ℃退火45 s,72 ℃延伸1 min,共30个反应循环;72 ℃继续反应10 min,4 ℃保存。1%浓度的琼脂糖凝胶对PCR反应产物进行电泳鉴定,观察是否有特异性条带产生。
1.5 生化试验
按照细菌生化试验鉴定试剂操作说明书中规定的试验方法,将本试验中分离培养的病原菌进行相关生化试验鉴定,主要包括蔗糖、乳糖、麦芽糖、葡萄糖、甘露糖、木糖、阿拉伯糖、山梨糖、鼠李糖、β-半乳糖苷酶、甘露醇、山梨醇、卫矛醇、精氨酸水解、七叶苷水解、氧化酶、动力、硫化氢、硝酸盐还原、水杨素等生化反应试验。
1.6 药敏试验
采用药敏纸片扩散法,对分离菌进行药物敏感性试验,主要包括四环素、环丙沙星、奈米替星、磷霉素、青霉素、克拉霉素、阿奇霉素、红霉素、氨苄西林、头孢他啶、头孢噻吩、头孢哌酮、头孢唑林、头孢呋辛、诺氟沙星、左氧氟沙星、氧氟沙星、万古霉素等多种抗生素药物。
2 结果
2.1 细菌分离培养与镜检结果
从组织病料中分离出6株病原菌,在普通培养基和麦康凯培养基上均可见较一致的针尖大小、光滑湿润、半透明、灰白色、圆形凸起的露滴状菌落。显微镜下观察可见,革兰氏阳性菌,呈单个、成对或多个菌体连接成短链状排列,无芽孢。对照《伯杰氏鉴定细菌学手册》,初步鉴定这6株分离菌均为粪链球菌。
2.2 PCR鉴定结果
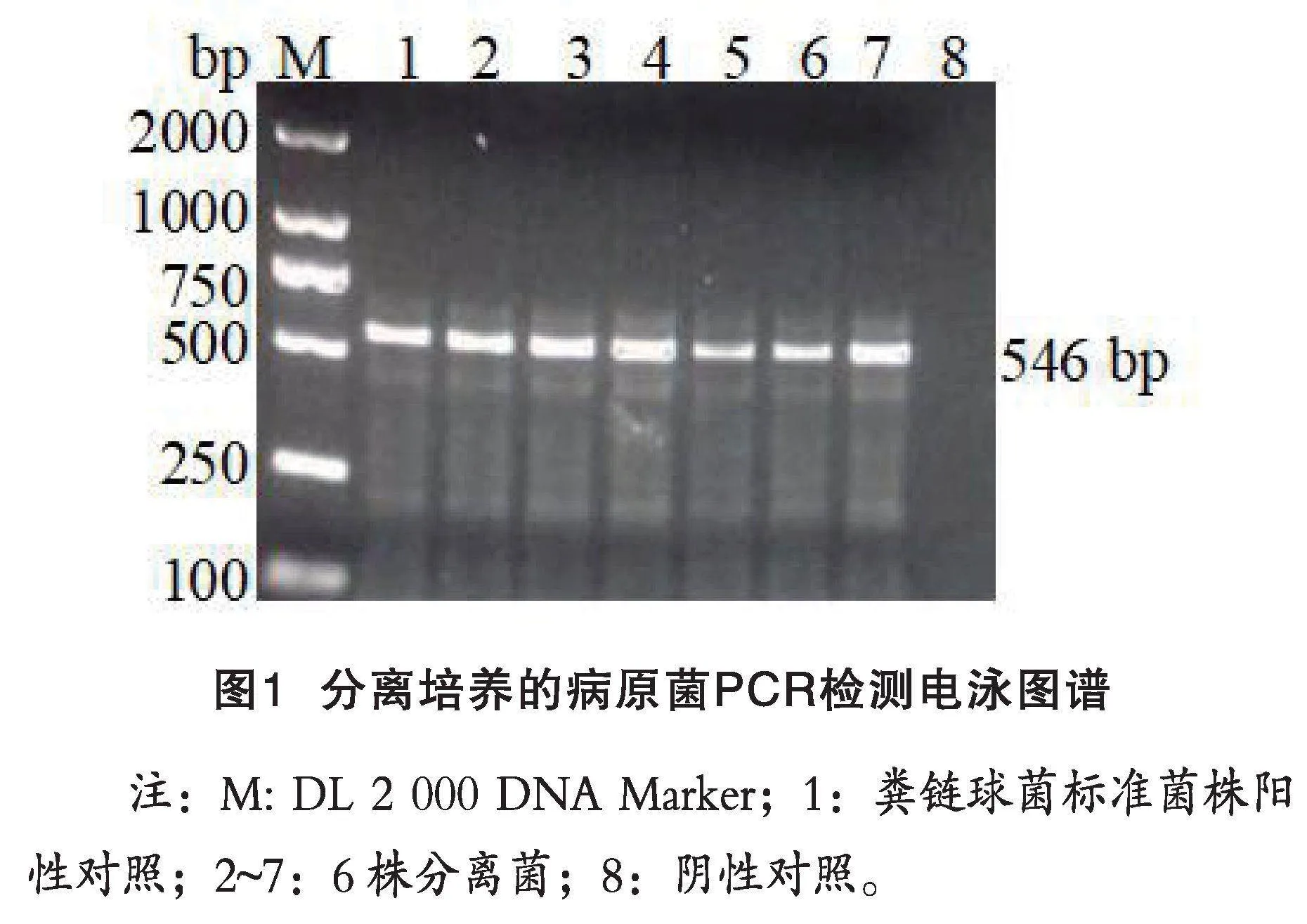
针对粪链球菌16S rRNA特异性基因片段设计、合成扩增上下游引物,上游引物序列为:5’-ATGGCTGATGCTCCATAAGCG-3’,下游引物序列为:5’-GGTTACCTTCTTACGAGCTCGA-3’,应用该引物对6株分离菌进行PCR扩增检测,均扩增出大小为546 bp的特异性电泳条带,如图1所示;这与预期的目的基因片段条带大小相一致,PCR扩增结果进一步鉴定分离的病原菌为粪链球菌。
2.3 生化鉴定结果
将分离菌进行生化试验鉴定,结果见表1。结果显示,蔗糖、乳糖、麦芽糖、葡萄糖、甘露糖、山梨糖、甘露醇、山梨醇、精氨酸水解、七叶苷水解、硝酸盐还原、水杨素等生化试验呈阳性,木糖、阿拉伯糖、鼠李糖、β-半乳糖苷酶、卫矛醇、氧化酶、动力、硫化氢等生化试验结果呈阴性。
2.4 药敏试验结果
分离菌的药敏试验抑菌情况见表2。分离菌对环丙沙星、磷霉素、氨苄西林、头孢哌酮、诺氟沙星、左氧氟沙星、万古霉素等几种抗生素药物较敏感,对克拉霉素、头孢唑林、氧氟沙星等中等敏感,对其余抗生素耐药。
3 讨论
近年来,随着科学规范化养鸭的不断发展,对鸭病的防控已成为健康养殖的关键环节,且得到养殖者的重视。粪链球菌感染是养鸭业中比较常见的疫病之一,发病率和死亡率一直居高不下,给养鸭业造成了严重的经济损失。因此,本试验通过对鸭粪链球菌的分离、鉴定,为后续正确诊断和防治鸭粪链球菌病具有重要意义。大量研究文献证明,鸭粪链球菌是一种革兰氏阳性菌,无芽孢,能够在各种培养基上形成针尖大小、光滑湿润、半透明、灰白色、圆形凸起的露滴状菌落,常呈单在、成对或多个菌体连接成短链状排列[4]。本试验从患病鸭的病料中分离获得6株病原菌,观察其培养和生长状态,与粪链球菌的形态特征基本一致,初步说明本试验分离的病原菌极有可能是粪链球菌。进一步结合PCR检测,选择粪链球菌高度保守基因序列16S rRNA作为靶标序列进行引物设计,应用该引物能够在分离菌的基因组DNA中扩增出大小为546 bp的特异性电泳条带,进一步证明了该6株分离菌为粪链球菌。
此外,生化试验是利用生物化学反应的原理来测试细菌的代谢方式、代谢条件及代谢产物等,以此来鉴别该微生物属于类别和种属[5]。蒋文灿等[4]通过对四川省某肉鸭养殖场感染粪链球菌的濒死鸭进行采集病料,分离培养后进行生化试验,结果表明该分离培养获得的鸭粪链球菌能够发酵D-半乳糖、纤维二糖、果糖、甘露醇、蔗糖、麦芽糖、乳糖和葡萄糖,且产酸不产气。本试验研究中分离菌的生化试验结果显示,蔗糖、乳糖、麦芽糖、葡萄糖、甘露糖、山梨糖、甘露醇、山梨醇、精氨酸水解、七叶苷水解、硝酸盐还原、水杨素等生化反应为阳性。这与该病原菌的其它相关生化试验研究报道结果相类似,表明本试验中分离的6株病原菌均为鸭粪链球菌。
药敏试验是指在体外环境下对各种抗生素药物杀菌或抑菌效果的一种检测方法,主要是了解特定病原菌对各种抗生素药物的敏感性和耐受程度,以便更好地指导临床科学选择适宜的抗生素,用于治疗病原菌感染类疾病[6]。目前,常用的药敏试验方法主要有稀释法、抗生素浓度梯度法、仪器分析法及药敏纸片扩散法[7]。本试验研究采用常规的药敏纸片扩散法,选择18种不同的抗生素药物纸片对分离的粪链球菌进行药敏试验,结果显示该粪链球菌对环丙沙星、磷霉素、氨苄西林、头孢哌酮、诺氟沙星、左氧氟沙星、万古霉素较敏感,对克拉霉素、头孢唑林、氧氟沙星中等敏感,这为后续临床合理用药治疗鸭粪链球菌病提供了科学依据。于泓洋等[8]从天津市某养牛场内感染粪链球菌的病牛中分离培养病原菌,进行药敏试验,其研究结果与本试验中的结果相一致,这均为后续合理选择抗生素、科学防治粪链球菌感染奠定了基础。
4 结论
本研究对广东省惠东县某养鸭场内疑似粪链球菌感染的患病鸭分离培养病原菌,经鉴定分离的6株病原菌均为鸭粪链球菌,且对环丙沙星、磷霉素、氨苄西林、头孢哌酮、诺氟沙星、左氧氟沙星、万古霉素较敏感,这为今后本病正确诊断和有效防治提供科学参考依据。
参考文献:
[1]刘徽.肉鸭场饲养管理与疾病防治分析[J].家禽科学,2023,45 (1): 52-53.
[2]周广驰.规模化养鸭常见疾病的诊断及防治[J].畜禽业,2021,32(9):129+131.
[3]周改玲,乔宏兴.番鸭感染粪肠球菌与沙门氏菌的分离鉴定、遗传进化及耐药基因检测分析[J].家畜生态学报,2023,44(10):82-88.
[4]蒋文灿,陈一资,王晓玉.商品肉鸭粪链球菌的分离鉴定[J].四川农业大学学报,1997(3): 92-94.
[5]肖正中,凌文卿,蔡秋香,等.猪粪肠球菌的分离鉴定与药物敏感性分析[J].韶关学院学报,2021,42(9):48-52.
[6]陈晓慧,徐淑琴,马祥兆,等.欧拉型藏羊源粪肠球菌的分离鉴定及药敏实验[J].食品工业科技,2021,42(22):133-139.
[7]吴兰,竹堃园,刘燕霏,等.多重耐药性粪肠球菌的分离与鉴定[J].黑龙江畜牧兽医,2019(9):85-87+90+181.
[8]于泓洋,刘燕霏,杨建德.粪链球菌的分离与鉴定[J].黑龙江畜牧兽医,2012(17): 97-98.
Isolation and Identification of Duck Fecal Streptococcal Faecalis
Abstract: A diseased duck suspected of being infected with fecal streptococcus in a duck farm in Huidong County, Guangdong Province was selected for isolation and cultivation of pathogenic bacteria. Identification was carried out through microscopy, PCR detection, biochemical testing, and drug sensitivity testing. The result showed that the pathogen was identified as Streptococcus faecalis which is Gram positive. PCR detection can amplify a specific electrophoresis band with a size of 546 bp, which can detect xylose, arabinose, rhamnose β- The biochemical reaction test results of galactosidase, celastrol, oxidase, kinetic, hydrogen sulfide, etc. were negative, and they were more sensitive to several antibiotics such as ciprofloxacin, fosfomycin, ampicillin, cefoperazone, norfloxacin, levofloxacin, vancomycin, etc. The results of this study provide scientific reference for the correct diagnosis and effective prevention and treatment of this disease in the future.
Keywords: Separation; Identification; Duck; Streptococcus faecalis