河南省确山县禽源沙门氏菌分离鉴定及其耐药性研究
2024-10-28王芳

摘 要:本研究旨在了解河南省确山县禽源沙门氏菌流行现状、血清型分布及其耐药性情况。采集来自不同家禽养殖场疑似沙门氏菌感染家禽的泄殖腔拭子、心血、肝等病料147份,通过细菌分离培养、生化鉴定、PCR扩增和血清分型试验进行鉴定,采用K-B纸片法对所有鉴定为沙门氏菌的菌株进行耐药性检测。结果显示:共获得53株沙门氏菌,检出率为36.05%,分属A、B、C1、D群7个血清型,其中鸡白痢沙门氏菌和鼠伤寒沙门氏菌分别占比41.59 %、28.30%;分离菌株对氨苄西林、阿莫西林、庆大霉素、阿米卡星、阿奇霉素、复方新诺明耐药性较高,分离菌株耐药种类介于1~10种之间,以4、5、6重耐药菌株最多,分别占比16.98%、22.64%、20.75%,多重耐药率为86.79%。试验结果表明,确山县禽源沙门氏菌血清型比较复杂,以鸡白痢沙门氏菌和鼠伤寒沙门氏菌为优势流行血清型。禽源沙门氏菌耐药性严重,建议加强监测,开展综合防控措施。
关键词:禽源沙门氏菌;分离鉴定;血清分型;耐药性
中图分类号:S852.61 文献标识码:A 文章编号:1673-1085(2024)10-0033-06
沙门氏菌(Salmonella)是属于肠杆菌科的革兰氏阴性兼性厌氧菌,可感染鸟类、爬行动物和哺乳动物,包括人类。该菌血清型众多,据报道,目前已发现2 600多种,且多数对人和动物具有致病性[1]。禽沙门氏菌病是由某些致病血清型沙门氏菌感染家禽的一类细菌性传染病总称,通常包括鸡白痢、禽伤寒、禽副伤寒等,临床表现出腹泻、输卵管炎、腹膜炎、败血症等多样性症状[2],发病迅速,病死率较高,降低家禽生产性能,给家禽业造成严重经济损失。耐药性是一个重大的全球性挑战,其迅速出现归因于人类、动物不恰当或过度使用抗菌药物。家禽养殖过程中抗生素的长期不科学使用导致耐药菌株不断增多和耐药性增强,严重限制了疾病的治疗和防控。沙门氏菌耐药性检测对于有效监测该病临床抗生素应用效果非常必要。
河南省确山县家禽业发展较快,但沙门氏菌病一直是危害当地家禽业的重要疫病之一,且目前未见沙门氏菌流行情况的报道。本研究对2023年来自不同家禽养殖场疑似沙门氏菌病的病料进行分离鉴定,并检测分离菌株的耐药性,以期为本地禽源沙门氏菌综合防控提供临床数据、资料支撑。
1 材料与方法
1.1 病料和质控菌株
2023年1~12月份,无菌采集自确山县不同规模养鸡、鸭、鹅场疑似感染沙门氏菌病(主要症状为腹泻、肠炎、败血症)的病死禽泄殖腔拭子、心血、肝、脾、肠道内容物等,共147份。质控菌株为大肠杆菌(CVCC3367)、肠炎沙门氏菌(CVCC3377),购自中国兽医药品监察所。
1.2 主要试剂
LB液体培养基、BS琼脂、XLD琼脂、亚硒酸盐胱氨酸增菌液,购自江西其云生物有限公司;法国科玛嘉沙门氏菌属显色培养基,购自HiMedia公司;沙门氏菌显色培养基,购自郑州博赛生物技术研究所;沙门氏菌属诊断血清,购自宁波天润生物药业有限公司;细菌基因组DNA提取试剂盒、DL 2000 DNA Marker、2×Probe PCR PreMix,购自宝日医生物技术(北京)有限公司;K-B药敏纸片(12种),购自杭州微生物试剂有限公司。
1.3 引物设计合成
根据GenBank公布的沙门氏菌特异性基因fimY(登录号:JQ665438.1)序列设计一对引物,引物序列为:fimY/F:5'-CGCCCAGCCATACGGATAACC-3′;fimY/R:5′-TACCACGCAGGGAAAGACACC-3′。目的条带约为427 bp,引物委托生工生物工程(上海)股份有限公司合成。
1.4 菌株分离培养
将采集的病料使用2 mL生理盐水稀释成液体,按1∶10比例加入亚硒酸盐胱氨酸增菌液,37 ℃培养24 h后,再取增菌液分别接种于SS培养基、麦康凯营养琼脂,37 ℃纯培养24 h,挑取典型菌落(半透明、灰白、表面光滑)接种于沙门氏菌显色培养基,37 ℃培养16 h。收集单个菌落,革兰氏染色、镜检,观察菌体形态。
1.5 生化试验
按照沙门氏菌生化鉴定试剂盒说明书操作,将纯化培养的菌落接种于包含靛基质、硫化氢、氰化钾、尿素、甘露醇、葡萄糖、山梨醇、赖氨酸、蔗糖、V-P试验10种生化试验项目的沙门氏菌生化鉴定条和鉴定管,37 ℃培养24 h,对照试剂盒说明书标准判定结果。
1.6 分离菌株PCR鉴定
典型菌落接种于LB液体培养基中,经纯化培养后,利用细菌基因组试剂盒,严格遵循说明书操作,分别提取分离菌株和质控菌株的基因组DNA。以提取的基因组DNA为模板,采用特异性引物进行PCR扩增。PCR反应体系如下:2×Probe PCR PreMix 12.5 μL,DNA模板0.5 μL,上下游引物各1 μL,双蒸水补足至总体积25 μL。PCR反应程序设定为:93 ℃预变性3 min,90 ℃变性30 s,45 ℃退火30 s,72 ℃延伸40 s,共运行35个循环;最后,72 ℃延伸8 min。同时设肠炎沙门氏菌标准株为阳性对照,大肠杆菌为阴性对照。PCR产物经1.0%琼脂糖凝胶电泳检测,利用凝胶成像仪记录结果。
1.7 分离菌株血清型鉴定
参考《GB 4789.4-2016沙门氏菌检验》[3]中公布的玻片凝集试验方法,待检分离菌首先用A~F 多价O血清鉴定分离菌株O抗原,必要时鉴定Vi抗原,属于A~F 各O群的菌型,依次用H因子血清检查H抗原的第1相和第2相。具体操作为:取10 μL沙门氏菌诊断血清滴于载玻片中央,再取经纯培养的单个菌落,使其与载玻片上的诊断血清混匀,1 min后观察结果;同时设无菌生理盐水为对照。出现凝集现象者为阳性,浑浊者为阴性。将鉴定出的O抗原和H抗原结构式,对照常见沙门氏菌抗原表,判断分离菌株的血清型。
1.8 耐药性试验
采用美国和临床实验室标准协会(CLSI)公布的K-B纸片扩散法检测所有分离菌株对12种抗菌药物的药敏性,肠炎沙门氏菌质控菌株为对照组。测量各抑菌圈直径,参考CLSI药敏标准判断结果。
2 结果
2.1 细菌分离培养
病料接种于各培养基,37 ℃培养16~24 h,BS琼脂培养基上可见棕褐色或灰绿色菌落,菌落四周培养基为黑色;XLD琼脂培养基上可见中心黑色的粉红色菌落,个别为黄色;法国科玛嘉沙门氏菌显色培养基上可见紫色菌落生长。革兰氏染色为阴性,镜检分离菌株呈两端稍微钝圆的短杆菌,单个或数个聚集排列在一起。参考《GB 4789.4-2016沙门氏菌检验》标准以及显色培养基说明书,初步判断分离菌株为沙门氏菌,分离的53株菌株,其中鸡源沙门氏菌为25株,鹅源和鸭源分别为12、16株。
2.2 生化试验
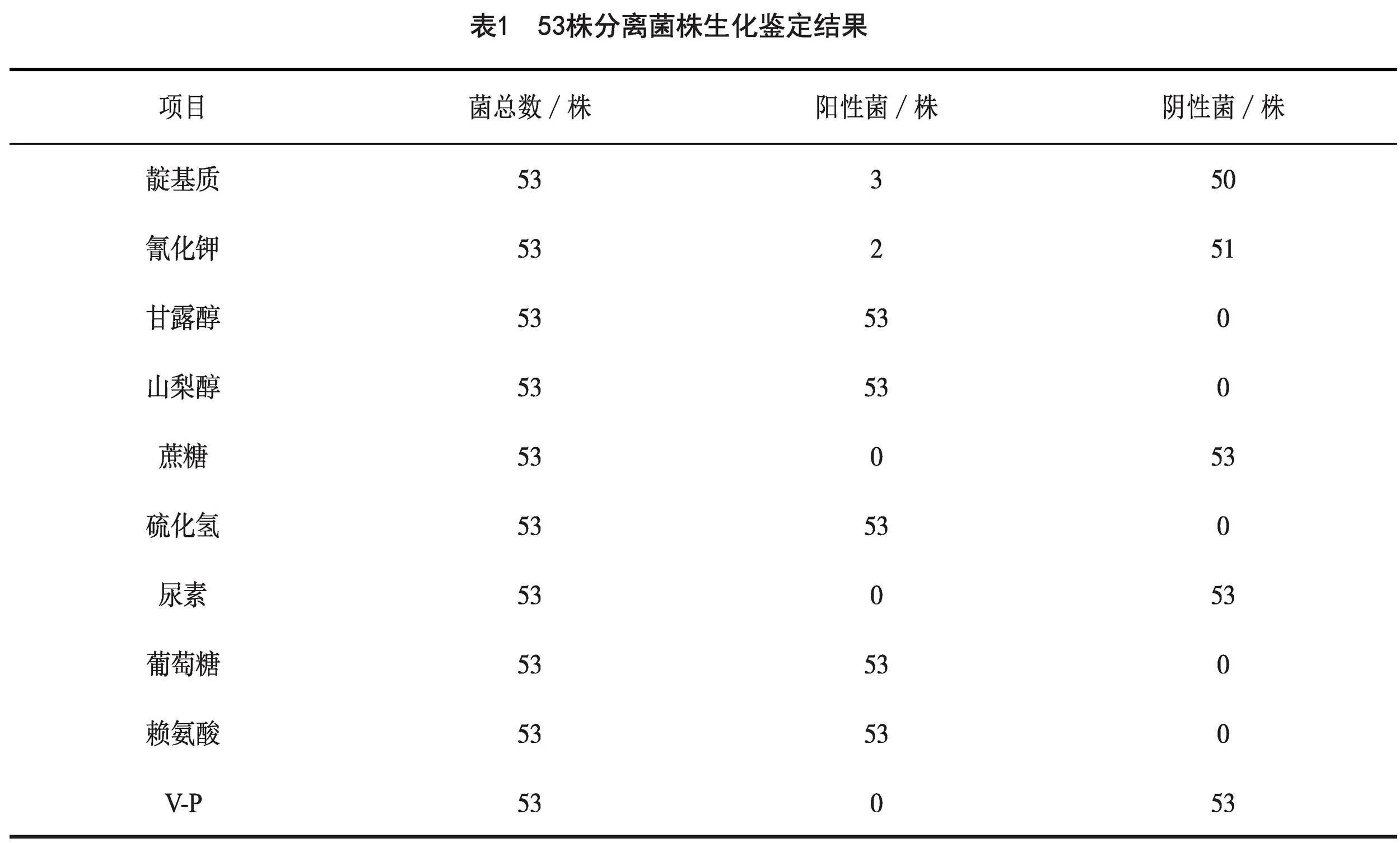
采用沙门氏菌生化鉴定试剂盒进一步对53株疑似沙门氏菌进行生化试验,结果见表1。结果显示,所有分离菌株对山梨醇、甘露醇、葡萄糖、硫化氢、赖氨酸试验为阳性,V-P试验为阴性;50株分离菌靛基质试验为阴性,3株为阳性,且这3株分离菌的血清凝集试验出现凝集现象,显示为阳性;同时发酵山梨醇、甘露醇;51株氰化钾试验阴性,而2株分离菌氰化钾、赖氨酸试验为阳性,尿素反应为阴性。参考《GB4789.4-2016 沙门氏菌检验》标准,判定3株分离菌为沙门氏菌靛基质阳性变体,2株分离菌与沙门氏菌Ⅳ或Ⅴ群生化特性一致[4],其余菌株生化特性均符合沙门氏菌生化特性。
2.3 分离菌株的PCR扩增反应
利用特异性引物fimY—F/R对53株分离菌进行PCR扩增,扩增产物用琼脂糖凝胶电泳检测,结果显示所有的分离菌在427 bp处有一条清晰的条带,与目的条带吻合,表明53株分离菌为沙门氏菌。部分扩增结果见图1。
2.4 血清分型鉴定
血清型鉴定结果显示,53株分离菌分属A、B、C1、D群7个血清型;22株血清型为鸡白痢沙门氏菌,占比41.59 %;15株为鼠伤寒沙门氏菌,占比28.30%;7株伤寒沙门氏菌,占比13.21%;3株乙型副伤寒,占比5.66%;圣保罗沙门氏菌、汤卜逊沙门氏菌和甲型副伤寒沙门氏菌各2株,分别占比3.77%。结果表明,确山县禽源沙门氏菌血清型比较复杂,以鸡白痢沙门氏菌和鼠伤寒沙门氏菌为优势流行血清型。
2.5 耐药性检测
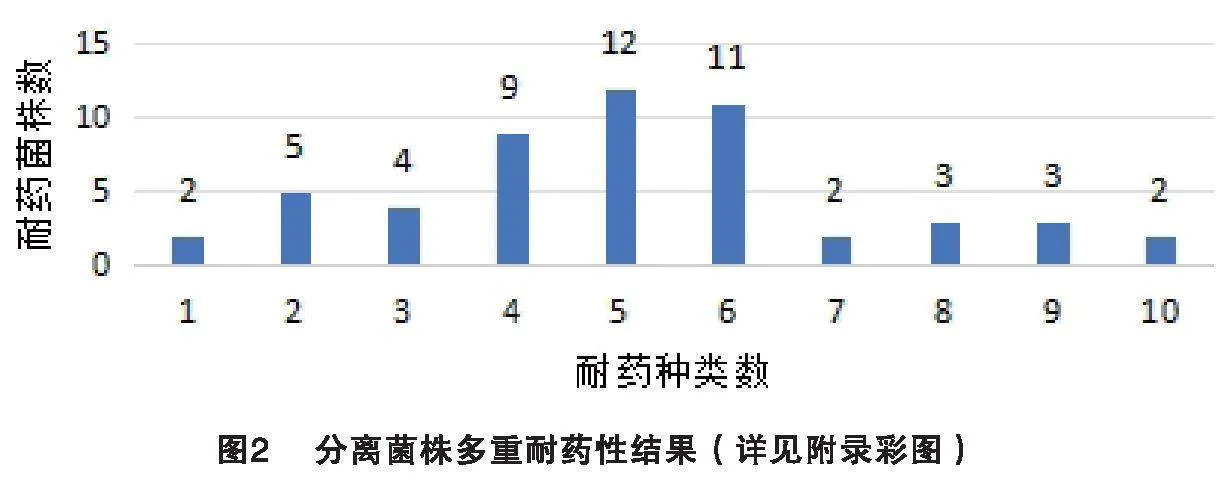
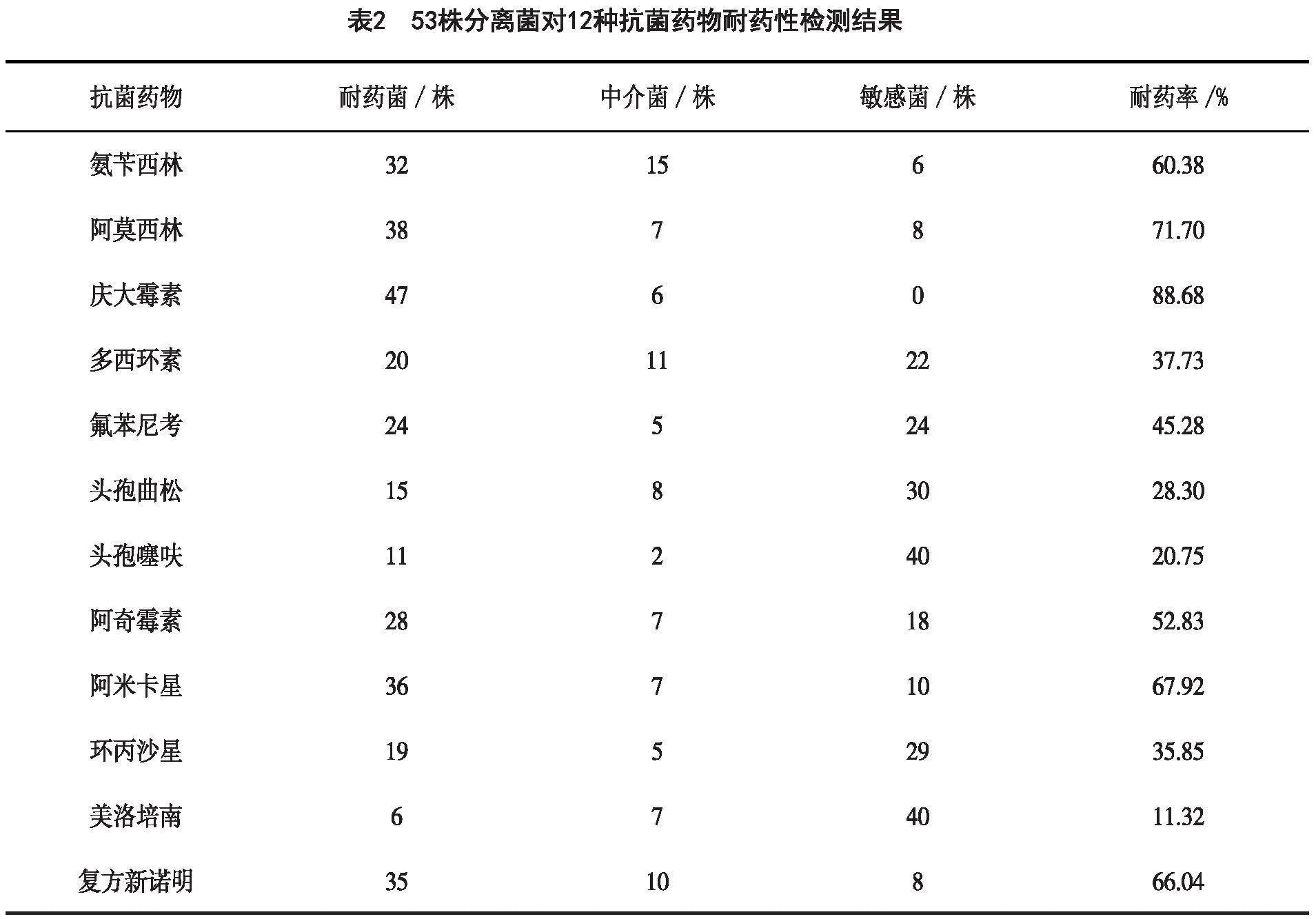
利用K-B纸片法进行抗菌药物检测,结果见表2。分离菌株对氨苄西林、阿莫西林、庆大霉素、阿米卡星、阿奇霉素、复方新诺明耐药性较高,耐药率介于52.83%~88.68%;其余抗菌药物耐药率相对较低,介于11.32~45.28%。多重耐药性分析结果见图2。分离菌株耐药种类介于1~10种之间,以4、5、6重耐药菌株最多,分别占比16.98%、22.64%、20.75%,多重耐药(耐药种类≥3)率为86.79%。
3 讨论
沙门氏菌病是一种在动物和人类之间传播的传染病,由多种沙门氏菌引起。沙门氏菌是兼性厌氧菌,可以在低氧、温暖和潮湿的环境中生存,在家禽中传播通常通过粪口途径,一旦被摄入,很容易在家禽肠道中定植,粘附在肠道上皮细胞上,导致肠道稳态破坏,引发肠道内的炎症反应并损害肠道屏障功能,从而导致感染禽腹泻和生长障碍[5],导致家禽业遭受重大经济损失,并对公众卫生健康构成风险。因此,开展沙门氏菌监测对于家禽养殖业的健康发展尤为重要。
血清分型是调查沙门氏菌感染流行病学状况的基本生物标志物[6]。此外,由于不同地区、环境、饲养管理、用药行为、用药时期等因素会影响沙门氏菌血清型的分布,并且血清型鉴定有利于选择候选疫苗株进行疫苗研制和应用。张若楠[7]报道,2020年7月—2021年6月,江苏和安徽部分地区的禽源沙门氏菌总体分离率为12.26%(76/620),以鼠伤寒沙门菌(56.58%)和鸡白痢沙门菌(34.21%)为优势流行菌株,与本研究中确山县禽源沙门氏菌优势血清型的结果一致。撒朗文朱[8]报道,2020年12月—2021年8月,四川部分地区的禽源沙门氏菌总分离率为10.60%(100/943),鉴定出7种血清型,其中鸡白痢沙门、鼠伤寒沙门菌、肠炎沙门菌为优势血清型。本研究对来自确山县不同规模养禽场疑似感染沙门氏菌的147份病料进行细菌培养、生化反应试验、分子生物学检测和血清型鉴定试验,分离鉴定出53株沙门氏菌,检出率为36.05%,表明该地区禽源沙门氏菌感染比较普遍。血清型鉴定结果显示,确山县禽源沙门氏菌血清型比较复杂,分属A、B、C1、D群7个血清型,其中优势血清型为鸡白痢沙门氏菌和鼠伤寒沙门氏菌,说明危害确山县家禽养殖业的沙门氏菌病主要为鸡白痢和禽副伤寒,这为研发疫苗候选菌株提供了方向。不同地区沙门氏菌流行程度存在差异,这是因为许多因素影响沙门氏菌感染的严重程度,包括宿主年龄、宿主免疫力、合并感染、感染剂量、管理问题、环境压力等[9]。本研究的试验结果丰富了沙门氏菌的研究资源,为今后预防和控制该病的流行提供了重要数据支持。
长期以来,抗菌药物广泛应用于兽医临床和养殖生产,对于控制畜禽疫病发生和提高生产性能发挥了积极作用,但是,无节制地使用抗菌药物破坏了家禽肠道菌群的平衡,导致抗菌药物耐药性不断增强、耐药谱进一步扩大,兽药残留问题已经成为人们关注的焦点。据报道,许多沙门氏菌存在抗生素耐药性,自然地表现出对多种抗生素的耐药性,包括氨基糖苷类、大环内酯类、头孢菌素类、四环素类、磺胺类和多粘菌素类[10-12]。这种广泛的自然耐药性使该疾病的抗生素治疗变得复杂。根据美国国家抗菌素耐药性监测系统 (NARMS) 的数据,2019 年从鸡肉和火鸡肉零售肉中分离出的所有沙门氏菌血清型中,分别有29% 和7%是多重耐药[13]。本研究对53株沙门氏菌抗菌药物耐药性检测,结果显示,所有菌株对氨苄西林、阿莫西林、庆大霉素、阿米卡星、阿奇霉素、复方新诺明耐药性较高。多重耐药性比较严重,分离菌株耐药种类介于1~10种之间,以4、5、6重耐药菌株最多,分别占比16.98%、22.64%、20.75%,多重耐药(耐药种类≥3)率高达86.79%。与温锦芳等[14]、王瑶等[15]报道的沙门氏菌耐药性研究结果存在差异,这是由于流行菌株、用药行为、饲养管理等导致细菌耐药性具有一定的差异性。本研究的耐药性检测分析表明,确山县禽源沙门氏菌普遍存在比较严重的耐药性。目前,益生菌、中草药等天然免疫增强剂因其环境友好、副作用小、无化学残留等优点,常被用作饲料添加剂来控制细菌性疾病。建议推广应用抗菌肽、益生菌、抗菌性中草药等作为饲料添加剂来控制沙门氏菌病流行,阻止耐药性菌株的进一步扩大。
参考文献:
[1] IBRAHIM S, WEI H L, LAI S Y, et al. Prevalence of Antimicrobial Resistance (AMR) Salmonella spp. and Escherichia coli Isolated from Broilers in the East Coast of Peninsular Malaysia[J]. Antibiotics, 2021, 10(5):579.
[2] 冯国军,郎咸增.禽沙门氏菌病的诊治[J].山东畜牧兽医,2016,37(9):35-36.
[3] 国家卫生和计划生育委员会,国家食品药品监督管理总局.沙门氏菌检验:GB 4789.4-2016[S].北京:中国标准出版社,2017.
[4] 沈学怀,张丹俊,潘孝成,等.安徽地区禽源沙门氏菌分离鉴定与耐药性研究[J].中国畜牧兽医,2017,44(12):3663-3669.
[5] SHEN J Q,LIU T G,QIAN Y L,et al.Therapeutic effect of probiotic-fermented herbal blend as antibiotic alternative on salmonellosis by multi-drug resistant Salmonella pullorum[J].Food Biosci,2024,57:103585.
[6] SHALABY A, ISMAIL M, EI-SHARKAWY H.Isolation, Identification, and Genetic Characterization of Antibiotic Resistance of Salmonella Species Isolated from Chicken Farms[J].J Trop Med-Us,2022:6065831.
[7] 张若楠.苏皖部分地区禽沙门菌的分离鉴定及基于O9和O12抗原单抗竞争ELISA方法的建立[D].扬州:扬州大学,2023.
[8] 撒朗文朱.四川部分地区禽沙门菌分离鉴定、耐药表型及全基因组序列分析[D].成都:西南民族大学,2023.
[9] S A D E ,M R O ,A A M , et al.An Alternative Approach Using Nano-garlic Emulsion and its Synergy with Antibiotics for Controlling Biofilm-Producing Multidrug-Resistant Salmonella in Chicken[J].Ind J Microbiol,2023,63(4):632-644.
[10] 吴萍萍,贺绍君.2019—2021年皖南地区地方品种鸡源沙门菌的血清型鉴定、毒力基因和耐药性检测[J].中国兽医杂志,2024,60(3):40-47.
[11] 刘科,周迪,李海忠,等.鸡源沙门氏菌流行病学调查及耐药性分析[J].畜牧兽医科技信息,2023(11): 65-68.
[12]王路才,撒朗文朱,张焕容.禽源肠炎沙门菌的分离鉴定及耐药性与致病性分析[J].中国畜牧兽医,2023,50(4):1663-1674.
[13]BEARSON D M S, MONSON S M, BEARSON L B, et al.Commercial vaccine provides cross-protection by reducing colonization of Salmonella enterica serovars Infantis and Hadar in turkeys[J].Vaccine,2024,42(4):727-731.
[14] 温锦芳,周慧,姚秋成,等.雷州半岛地区禽源致病性大肠杆菌和沙门氏菌分离鉴定及耐药分析[J].黑龙江畜牧兽医,2024(1):59-64.
[15] 王瑶,张焕容,罗薇.禽源沙门菌鉴定、分子分型及耐药性分析[J].动物医学进展,2020,41(11):53-57.
