蛋白提取工艺过程评价方法的研究
2024-10-10梁吉汪晨曦
摘 要 目的:建立一种快速、便捷、低成本的生物酶制剂生产工艺过程评价方法。方法:联用凝胶电泳法和BCA蛋白定量法进行计算,得到较为准确的目标蛋白定量数量数据。结果:以胰蛋白酶生产工艺为例,对不同工段样品进行SDS-PAGE和BCA测试,并计算得到对应的蛋白定量数据,其中组内样品数据RSD≤5%,说明了该方法的可重复性。结论:该方法可准确分析不同工段的蛋白浓度变化,并进行快速、灵敏地定量;同时发现原胰蛋白酶生产工艺中存在蛋白泄漏的缺陷,可为后续工艺改进提供理论依据。
关键词 SDS-PAGE BCA 标准曲线法 蛋白提取 中间体评价
中图分类号:TQ460.63; TQ464.8 文献标志码:A 文章编号:1006-1533(2024)15-0069-04
引用本文 梁吉, 汪晨曦. 蛋白提取工艺过程评价方法的研究[J]. 上海医药, 2024, 45(15): 69-72.
Study on the evaluation method for protein extraction process
LIANG Ji1, WANG Chenxi2
(1. Shanghai Pharmaceutical School, Shanghai 200135, China; 2. SPH NO.1 Biochemical & Pharmaceutical Co., Ltd., Shanghai 200240, China)
ABSTRACT Objective: To establish a rapid, convenient and low-cost evaluation method for the production process of biological enzyme preparations. Methods: Combined with gel electrophoresis and BCA protein quantitative method, more accurate quantitative data of target protein were obtained. Results: Taking the trypsin production process as an example, SDSPAGE and BCA tests were performed on samples from different sections, and the corresponding protein quantitative data were obtained by calculation. The RSD≤5 % of the sample data in the group indicated the repeatability of the method. Conclusion: This method can accurately analyze the changes of protein concentration in different sections and quickly and sensitively quantify the protein. It is found that there is a defect of protein leakage in original production process of trypsin, which provides a theoretical basis for subsequent process improvement.
KEY WORDS SDS-PAGE; BCA; standard curve method; protein extraction; intermediate evaluation
生物提取是酶制品工业化生产中重要的技术方法,具有产量大、成本低等优势。在化学制药中,酶制品原料药如胰蛋白酶、糜蛋白酶、玻璃酸酶和凝血酶等的生产,都广泛采用生物提取法[1-3]。该方法的起始原料往往是生物组织、酶原等,其纯度、质量会影响酶制品的产品收率、质量等工艺指标。同时各工段产物组份较为复杂,所以通常采用的性状判断等方法,不能进行有效的定性定量分析。这使得整个提取工艺处于不稳定、不可控的状态,影响生产工艺的稳定性,也掣肘了工艺优化的进行。
针对以上问题,本研究以生产中的胰蛋白酶产品为例[4-7],通过联合蛋白含量测定法与凝胶电泳技术,开发了一种便于操作、成本低廉的检测方法,用于监控、评估工艺过程。为后续的工艺技术改进、持续工艺验证和数据采集分析提供了数据支撑。
1 材料和方法
1.1 试剂和仪器
实验所用试剂、原料药品均购于商业公司,未经说明使用前均不需要二次纯化;胰蛋白酶工段产物、原料和成品均由上药第一生化药业有限公司提供;凝胶电泳试剂盒、BCA试剂盒均购于上海生物工程公司;配制溶液所需的原料试剂均购于国药试剂公司;Tanon model EPS300电泳仪购于上海天能科技有限公司;Mapada UV-3100紫外分光光度计购于上海美谱达仪器有限公司。
1.2 样品制备
1)工段产物1~5取样胰蛋白酶工艺过程中的工段产物(工段1~5),同时计量该工段产物的质量(液体样品计量体积)。将其溶于水后(样品为液体则稀释)用透析袋(截留Mr为3 500)在水中透析除盐,温度为0~8 ℃,透析时间为24 h。用冻干机冻干样品,计量备用。
2)待测样品 将上述样品用磷酸盐缓冲液(0.1 mol/L,pH 7.0)配制浓度为1 mg/mL的样品。
1.3 凝胶电泳SDS-PAGE检测
按试剂盒说明书制备浓度为15%的分离凝胶,组装凝胶电泳装置。在待测样品中加入非还原性上样缓冲液(保留蛋白二硫键),95 ℃煮沸变性后加样进行凝胶电泳分析,单孔泳道上样量约为20 mg。获取的胶条采用考马斯亮蓝染色1 h(摇床37 ℃、180 r/min),然后,用脱色液脱色2 h。胶条置于白背景、明亮白光下拍照,图片运用Image J软件处理为灰度图。最后,分别计算目标泳道区域总灰度、目标条带灰度及占比。
1.4 BCA蛋白含量测定法
1.4.1 采用牛血清蛋白(BSA)做BCA测定标准曲线
按试剂盒说明书配制BCA工作液,按照V工作液-VBSA=39∶1的比例加入不同浓度的BSA溶液,混合均匀后于37 ℃孵育30 min,测试在562 nm处的紫外吸收值。做吸光度-BSA浓度曲线,经过线性拟合得标准曲线回归方程。
1.4.2 待测样品测试
将待测样品和BCA工作液混合,37 ℃孵育30 min,测试在562 nm处的紫外吸收值。通过标准曲线测定待测样品的浓度x(mg/mL),如果样品对应工段产物为固体,则通过式1计算工段产物蛋白量;如果样品对应工段产物为液体,则通过式2计算工段产物蛋白量。

其中y固体为固体样品蛋白量(g),y液体为液体样品蛋白量(g)。x为待测样品实际蛋白浓度(mg/mL),m1为样品冻干后质量(g);M为工段产物质量(g),m为取样质量(g);V为工段产物体积(mL),v为取样体积(mL)。
1.5 样品中目标蛋白量的计算
以胰蛋白酶为例,其Mr为25 kDa蛋白,按照1.3计算电泳图像灰度值。按照1.4计算其样品蛋白量,即样品目标蛋白量=目标蛋白灰度占比×样品蛋白量;并按此计算各个待测样品中的目标蛋白量。
1.6 方法学评价
重复取样,按1.5计算同样品的目标蛋白量,考察同样品数据平行样品间的RSD。
2 结果与分析
由于胰蛋白酶生产工艺的中间工段取样处于不可控状态,不宜定量分析,因此我们设计了两种技术联用的方法对中间体进行评估。其中SDS-PAGE分析蛋白样品组成是一种快速且易于操作的方法,常用来分析样品的组成、纯度。通过Image J处理为灰度图后,可以通过灰度粗略判断目标条带的占比[8-12]。而BCA蛋白含量测定法是经典的药典方法,通过肽键还原Cu2+为Cu+,与BCA分子结合产生在562 nm处有紫外吸收的物质,其吸光度与蛋白浓度成线性关系[13]。BCA方法测定的结果是样品中总蛋白量,并不能区分杂蛋白与目标蛋白。分析以上数据,我们认为总蛋白量结合凝胶电泳的灰度占比结果,两者乘积可用来代表目标蛋白的实际量。
2.1 凝胶电泳法分析各工段蛋白量
结果显示,随着工段推进,样品中胰蛋白酶量占比逐渐增加,纯度逐步提升(图1)。在25 kDa附近的条带归属于胰蛋白酶,其中工段1产物中大Mr杂蛋白的占比达到了77%;而随着工序推进到工段产物2时,目标胰蛋白酶的占比提升到54%。工段3、4的结果相近,说明在这两步生产中主要目的是除盐而非目标蛋白的提纯。经过工段5的操作,胰蛋白酶获得进一步提纯,电泳条带的灰度分数占比达到了100%(图1),表明其可在一定程度上监测胰蛋白酶生产过程。为进一步评价该方法的重复性,我们重复采样4次分析样品间RSD。结果显示,不同工段样品间重复采样各RSD均小于5%(表1),说明采用凝胶电泳法检测胰蛋白酶样品的重复性良好,可满足对胰蛋白酶生产过程的分析需求。

2.2 BCA法分析各工段蛋白量
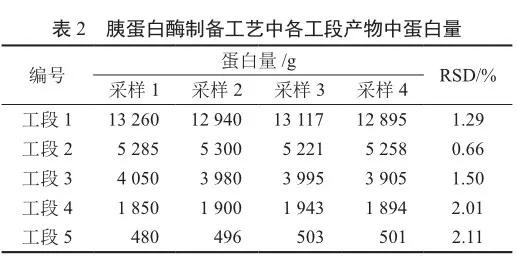
根据吸光度-BSA浓度曲线,经过线性拟合得标准曲线回归方程y=0.523x+0.148 1,进一步通过1.4.2计算得到各工段中的蛋白量(表2)。结果显示,工段1到工段2过程中蛋白量大幅度下降,工段4和5样品中的蛋白降低比例超过50%,从中可以监测胰蛋白酶生 产工艺中蛋白质量的变化。同时各工段重复采样样品的RSD均小于5%(表2),说明BCA方法测定胰蛋白酶工段产物的重复性良好。
2.3 联合凝胶电泳和BCA法分析各工段蛋白量
结果显示,各工段样品及重复样数据RSD均小于 5%(表3),说明本研究方法的重复性良好。通过两步工艺间胰蛋白酶量的差值与前一步量的比值计算胰蛋白酶的损耗率(图2)。

结合胰蛋白酶纯化的生产工艺流程,工段1处理后,杂蛋白被大量除去;工段2、3、4获取产物后,目标胰蛋白酶存在大量损失。其中,工段4采用了透析袋透析,经过进一步检测其截留Mr约为40 kDa,大于胰蛋白酶的25 kDa,说明胰蛋白酶在透析过程中可能发生泄漏。工段5获取的胰蛋白酶为480 g,与实际生产成品结果数据相近(470~510 g),说明本方法可以反应生产实际情况。从其中数据也可看出,工段4出现了更多的胰蛋白酶损失量,值得进一步分析。
工段4主要的生产操作是将工段产物3在透析袋内重结晶析出废物,留下液体进入后续工段,为此产生了结晶废物、透析废液。为进一步研究工段4的损耗情况,利用凝胶电泳法分析在工段4取样的起始物料(工段产物3)、废液和废物(图3)。结果显示,废液(泳道3)中于25 kDa处可以看到清晰的胰蛋白酶条带,灰度分数为30.5%,同时BCA测试显示该废液中总蛋白量为1 560 g,按本研究方法计算废液中胰蛋白酶量为476 g。废物(泳道2号)中灰度分数为95.6%,同时BCA法测得该废物样品中总蛋白量为680 g,计算得出废固物样品中胰蛋白酶量为650 g。按本方法计算,起始物料工段产物3( 泳道1)胰蛋白酶量为2 175 g,废液与废物中损失的胰蛋白酶总和为1 126 g(占比51.8%)。其中废物是重结晶必然产生的损耗无法避免,废液则来源于透析袋的截留渗漏。因此,工段4中胰蛋白酶产生损失近500 g,是采用了截留Mr过大的透析袋所致。经过以上进一步的分析,我们可以判断出该胰蛋白酶生产工艺过程中的工段4值得进一步优化改进。

3 讨论
本研究将经典的凝胶电泳法和BCA蛋白定量法进行联合,建立了一套适用于中间过程产物评价的方法,验证了该方法的可重复性。以胰蛋白酶生产工艺为例研究,发现其可用于简便、快速地监控生产过程,且技术门槛低,设备费用低廉,具有良好的应用前景。同时,在研究工作中发现,胰蛋白酶生产工段4存在严重的胰蛋白酶损耗,这为下一步该工艺改进提供一个方向。本方法也可以进一步用于其它蛋白质提取生产工艺的过程研究,对于优化生产工艺有较大的帮助。
参考文献
[1] 宋彦卓, 于明晓, 康春梅, 等. 水产胶原蛋白及其生物活性肽的研究进展[J]. 现代食品, 2022, 28(11): 1-3.
[2] 王邵熠, 赵俸艺, 吴文龙, 等. 植物种子蛋白提取、纯化及肽的生物活性研究进展[J/OL]. 食品与发酵工业, 2023-12-04 [2024-03-23]. https://doi.org/10.13995/j.cnki.11-1802/ ts.037478.
[3] 李越佳. 豆制品中胰蛋白酶抑制剂活性测定方法的改进[J]. 中国食品添加剂, 2022, 33(7): 212-218.
[4] 李晨, 高柳芳, 崔晓东, 等. 草鱼胰蛋白酶的亲和纯化及酶学性质[J]. 食品科学, 2021, 42(10): 178-183.
[5] 肖甜香. 理性设计提高胰蛋白酶的催化性能[D]. 武汉: 湖北工业大学, 2023.
[6] 赵新, 张颖欣, 李玉亮, 等. 重组胰蛋白酶在鸡胚细胞消化中的初步研究[J]. 国际生物制品学杂志, 2023, 46(6): 343-347.
[7] 冯婷婷, 闫姝竹, 马洪志, 等. 基于羧基化单壁碳纳米角的荧光传感体系检测胰蛋白酶[J]. 分析试验室, 2024, 43(1): 24-29.
[8] Wang C, Liu Y, Bao C, et al. Phototriggered labeling and crosslinking by 2-nitrobenzyl alcohol derivatives with amine selectivity[J]. Chem Commun (Camb), 2020, 56(15): 2264-2267.
[9] 时维娜. 凝胶电泳图像形变分析及校正算法研究[D]. 济南: 山东师范大学, 2015.
[10] 李汉芳, 黄珍, 路梦凡, 等. 乳及乳制品中乳铁蛋白含量的快速SDS-PAGE荧光检测方法[J]. 现代食品科技, 2024, 40(4): 296-302.
[11] 胡勇, 纪德铭, 詹骞, 等. 人血浆中纤维蛋白溶酶原纯化工艺样品蛋白含量改良BCA检测方法的建立及验证[J].中国生物制品学杂志, 2021, 34(5): 595-601.
[12] 张明. 凝胶图像蛋白点分割算法研究[D]. 济南: 山东师范大学, 2017.
[13] 国家药典委员会. 中华人民共和国药典2020年版四部[M].北京: 中国医药科技出版社, 2020: 108.
