一种溶瘤腺病毒抑制肿瘤细胞的作用机制及特异性研究
2024-10-10琚姝王爱霞
摘 要 研究重组人5型腺病毒(H101)抑制肿瘤细胞增殖的作用机制及特异性。采用体外细胞培养方法及TCID50检测病毒滴度法,发现H101对p53?的肿瘤细胞有显著的选择性复制作用,其活性可以对p53突变的肿瘤组织产生溶瘤作用从而达到治疗效果;采用体外药效学实验检测H101对10种肿瘤细胞株的抑增殖作用,通过计算IC50、IC90进一步得出小鼠肝癌细胞Hepa1-6、小鼠胰腺癌细胞Pan02、小鼠神经胶质瘤细胞GL261对H101较为敏感。研究结果表明H101对已获批的适应证之外的其他肿瘤细胞也有溶瘤作用,具有适应证扩展的潜力。本研究可为后续开展动物模型的体内药效实验和使用剂量的选择提供参考。
关键词 溶瘤腺病毒 肿瘤治疗 体外药效学 增殖抑制
中图分类号:R979.19; R730.54 文献标志码:A 文章编号:1006-1533(2024)15-0065-04
引用本文 琚姝, 王爱霞. 一种溶瘤腺病毒抑制肿瘤细胞的作用机制及特异性研究[J]. 上海医药, 2024, 45(15): 65-68.
Study on the mechanism and specificity of an oncolytic adenovirus (recombinant human adenovirus type 5) inhibiting the proliferation of tumor cells
JU Shu, WANG Aixia
(Shanghai Sunway Biotech Co., Ltd., Shanghai 201206, China)
ABSTRACT The mechanism and specificity of human adenovirus type 5 (H101) in inhibiting tumor cells were studied. By in vitro cell culturation and TCID50 virus titer test, it was found that the oncolytic adenovirus had a significant selective replication effect on p53- tumor cells and its replication ability could produce oncolytic effect on p53 mutated tumor tissue and achieved therapeutic effect. In vitro pharmacodynamic experiment was used to detect the inhibitory effect of H101 on ten tumor cell lines. By calculating IC50 and IC90, it was further concluded that H101 was sensitive to the mouse hepatoma cell Hepa1-6, the mouse pancreatic cancer cell Pan02 and the mouse glioma cell GL261. These results showed that H101 had oncolytic effects on other tumor cells beyond the approved indications and a potential for expanding indications. This study can also provide reference for the selection of animal models and dosage for subsequent in vivo pharmacological experiments.
KEY WORDS oncolytic adenovirus; tumor treatment; pharmacodynamic experiments in vitro; proliferation inhibition
溶瘤病毒(oncolytic virus)是一类重要的基因治疗药物,作为携带外源基因的载体,在感染细胞的同时,也能起到破坏肿瘤组织的作用,具有多重治疗功能。作为一类新型的具有生命体特征的药物,溶瘤病毒在世界范围内获批的药物还很少。目前已经获批上市的溶瘤病毒主要有4种,分别是重组人5型腺病毒(H101,中国,2006)、溶瘤单纯疱疹病毒药物talimogene laherparepvec(T-VEC,美国,2015)、teserpaturev(G47?,日本,2023)及溶瘤腺病毒药物nadofaragene firadenovec(rAdIFN-a2b-Syn3,美国,2024)。它们的获批标志着溶瘤病毒已成功进入主流临床。
溶瘤腺病毒既可作为抗癌制剂单独使用,同时又可以作为携带外源基因的载体,使外源基因随病毒复制而长效表达,因此,可发挥病毒和基因的双重疗效,并广泛应用于癌症的靶向基因-病毒治疗[1]。目前溶瘤病毒治疗常用的载体为人5型腺病毒(adenovirus type 5,Ad5),具有体积小、弥散能力强、致病力低的优点[2],所以腺病毒是目前研究进展最快的溶瘤病毒之一[3-7]。野生型腺病毒(WT Ad5)的基因改造以敲除与病毒在正常细胞中复制感染相关的基因为主,主要目的是为了安全性和在肿瘤细胞中的条件性复制。在目前的临床腺病毒载体中,有4种实现条件复制的一般策略:一种是用癌细胞特异性启动子替换或覆盖WT Ad5 E1启动子,其他3种涉及早期转录单元E1A和E1B的修饰。在许多构建体中,E1A修饰与肿瘤特异性启动子替换通常结合起来使用[8-9]。
H101的重组腺病毒改造主要涉及E1B缺失,在正常的体细胞内不能复制,并且病毒基因组存在于细胞染色体外,不整合到细胞染色体中,避免了因整合引起的基因突变及激活致癌基因,对人体生物安全性高。然而,有文献称同类Ad5-E1B删除的重组腺病毒药物(如Dl1520、ONYX-015)对肿瘤的选择性有限[10],因此需要对H101的作用机制和对肿瘤的选择性抑制进行研究。本研究采用体外细胞培养方法及TCID50检测病毒滴度法,研究了重组人5型腺病毒对p53-的肿瘤细胞的选择性复制作用,并采用体外药效学实验(MTS方法)检测了重组人5型腺病毒对10种肿瘤细胞系的增殖抑制作用,以期为后续开展动物模型的体内药效实验(如动物模型的选择和用药剂量),以及该溶瘤病毒药物在临床上更广泛的应用提供参考。
1 材料和方法
1.1 试剂
RPMI 1640培养基、DMEM高糖培养基(美国Corning公司);胎牛血清(美国Gibco公司);025%胰蛋白酶-EDTA消化液(北京Solarbio公司);CellTiter 96 AQueous One Solution(美国Promega公司)。
1.2 仪器
LD5-2B离心机(日本京立公司);3111 CO2培养箱、Varioskan Flash全波长扫描式多功能酶标仪(美国Thermo公司);QB-9001微孔板振荡器(海门市Qilinbeier公司);IX53倒置显微镜(日本Olympus公司);HR1500-Ⅱa2超净台(青岛海尔公司)。
1.3 细胞株及毒种
正常细胞:人成纤维细胞FC,人微血管内皮细胞MVEC;p53+肿瘤细胞株:舌癌TCA-8113,肺癌A549;p53-肿瘤细胞株:鼻咽癌CNE,子宫颈癌 C33A,结肠癌DLD-1,结肠癌HT-29。小鼠结直肠癌CT26.wt,小鼠结直肠癌MC38,小鼠黑色素瘤B16F10,小鼠肝癌Hepa1-6,小鼠肝癌H22,小鼠胰腺癌Pan02,人源胰腺癌MIApaca-2,人源肝癌MHCC97H,人源结直肠癌HT-29,小鼠神经胶质瘤GL261。上述细胞株均来源于中国典型培养物保藏中心(CCTCC)。
重组人5型腺病毒(安柯瑞,H101)来源于上海三维生物技术有限公司,是通过对野生型腺病毒基因序列的E1B区进行55 kD的删除和密码子的点突变,并删除E3区得到的重组腺病毒;野生型5型腺病毒(WT Ad5)来源于中国典型培养物保藏中心(CCTCC)。
1.4 方法
1.4.1 p53-、p53+肿瘤细胞株及正常细胞培养
采用体外细胞培养方法及TCID50检测病毒滴度法,测定H101在正常细胞、p53+和p53-肿瘤细胞中的复制活性。使用175 cm2细胞培养瓶分别制备A549、TCA-8113、MVEC、FC、HT-29、C33A、CNE、DLD-1细胞,当每个培养瓶内的细胞汇合率大于80%时,倾去培养瓶中培养液;然后,在每个培养瓶中加入2 mL胰蛋白酶消化液,盖好瓶盖后轻轻晃动培养瓶,使胰蛋白酶消化液完全覆盖瓶底细胞,并平置于CO2培养箱内进行消化;静置5 min后,取出培养瓶,晃动并轻拍培养瓶使细胞完全脱离瓶底;用移液管重悬细胞,使细胞悬浮混匀并计数。根据计数后的细胞密度加入适量测活培养基(DMEM+7% FBS),使细胞终浓度达到2.0×105个/mL。用移液器在96孔板中加入细胞悬液100 mL/孔,每个样品平行3块板。
1.4.2 肿瘤细胞株培养
使用96孔细胞培养板培养CT26.wt、MC38、B16F10、Hepa1-6、H22、Pan02、MIApaca-2、MHCC97H、HT-29和GL261。调整其生长状态,待处于对数生长期时收获细胞,取少量细胞用台盼蓝染色,保证细胞活力达98%以上。用生长培养基将细胞密度稀释到1.0×105个/mL(H22细胞密度为1.5×105个/mL),制备成细胞悬液。将上述细胞悬液接种到96孔细胞培养板中,50 μL/孔,使得每孔细胞数量达到5×103个(H22接种细胞数为7.5×103个/mL)。将上述细胞板置于37 ℃、5% CO2培养箱中孵育2 h。
1.4.3 TCID50和IC50测定
1)TCID50测定 每块板需做6个病毒稀释度,稀释度的选择根据供试品实际情况确定。将供试品用测活培养液做10倍系列稀释至所选择的最低稀释度(10?6),每个梯度终体积为2 700 mL。按照确定的感染梯度,在加好细胞悬液的96孔板上由低浓度到高浓度加入各梯度稀释液100 mL/孔,每个梯度重复8孔,每个样品平行加3块板。每块板上留8孔作为空白对照,即每孔加100 mL测活培养基和100 mL细胞悬液。将96孔板置于37 ℃、CO2体积分数为5%培养箱内培养14 d。当细胞病变作用(cytopathic effect,CPE)终点稳定时,将96孔板置于倒置显微镜下观察,计数相应稀释梯度的CPE阳性孔数,并按Karber公式计算lgTCID50。
Karber公式:lgTCID50=d(ΣS-0.5)-L。式中d=稀释对数之间的差,ΣS=阳性孔比率总和,L=最高稀释度的对数。
2)IC50测定 用RPMI 1640培养基对待测物做9个浓度点的10倍梯度稀释,取出细胞板,将2×浓度的病毒工作液加入,50 μL/孔,每个浓度做3个复孔,最终病毒浓度为0.5×(102~1010)vp/mL,将细胞板置于37 ℃、CO2体积分数为5%的培养箱中继续孵育72 h。孵育结束后,将CellTiter 96 AQueous One Solution试剂置于室温融化并平衡至室温,向细胞培养板中加入20 mL/孔的CellTiter 96 AQueous One Solution试剂。将细胞板置于CO2体积分数为5%的培养箱中于37 ℃继续孵育3 h。将酶标仪调至490 nm波长,放入细胞板,读取吸光度(OD值),采用GraphPad Prism 5.0软件对数据进行图形化处理计算IC50,匹配相适应的剂量-效应曲线。IC50可在GraphPad Prism 5.0中自动计算得出。
存活率计算公式:存活率=(OD待测孔-OD空白对照)/(OD阴性对照-OD空白对照)×100%。
2 结果
2.1 H101对p53-的肿瘤细胞有显著选择性复制作用
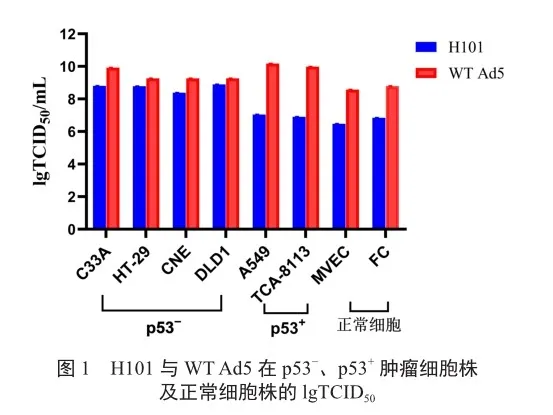
H101对肿瘤细胞的抑制作用有显著的选择性,其在p53-细胞中的抑制活性是p53+细胞和正常细胞的100倍左右。与WT Ad5相比,H101感染p53-的肿瘤细胞72 h,细胞内病毒滴度与WT Ad5相当;而感染正常细胞和p53+的肿瘤细胞其病毒滴度明显低于WT Ad5,表明H101能选择性地在p53?的肿瘤细胞中复制,而在p53+的细胞和正常人体细胞中则不能有效地复制(图1)。
2.2 H101对10种肿瘤细胞株的抑增殖作用
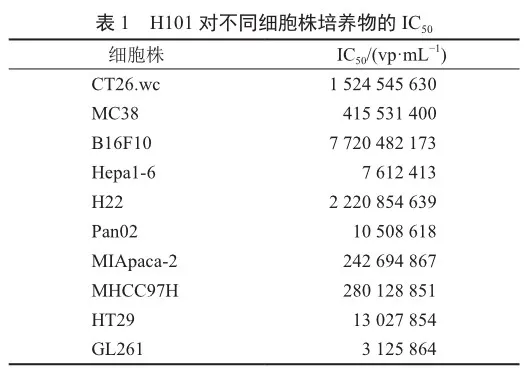
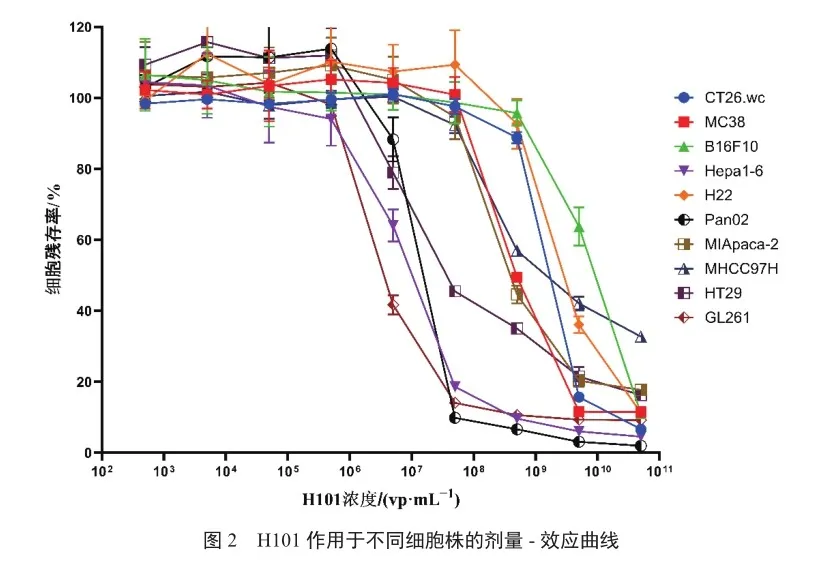
结果显示,与阳性细胞HT-29相比,小鼠肝癌细胞Hepa1-6、小鼠胰腺癌细胞Pan02、小鼠神经胶质瘤细胞GL261对H101更为敏感,IC50分别为7.61×106、1.05×107、3.13×106 vp/mL(表1),IC90分别为8.30×107、3.47×107、1.46×107 vp/mL;H101对阳性细胞HT29的IC50为1.30×107 vp/mL,IC90为3.34×108 vp/mL(图2)。据此,可选用上述3种小鼠模型开展体内药效实验。此外,H101对小鼠结直肠癌MC38的IC50为4.155×108 vp/mL,尽管较对阳性细胞的IC50高10倍,但该细胞免疫原性强,是目前肿瘤免疫新药研发应用最多的模型,亦可选取该小鼠模型开展体内药效实验。
3 讨论
H101已被中国批准用于常规放疗或放疗加化疗治疗无效的晚期鼻咽癌患者,临床研究中H101对鼻咽癌患者的有效率可以达到75.6%。美国上市的溶瘤腺病毒药物rAd-IFN-a2b-Syn3在临床上对高危非肌层浸润性膀胱癌患者显示出良好治疗活性。这些临床研究显示溶瘤腺病毒药物具有广阔的临床应用前景。本研究所述的H101在体外细胞活性实验中对Hepa1-6、Pan02和GL261细胞有选择性活性,提示H101可能对肝癌、胰腺癌和神经胶质瘤患者及肝癌/胰腺癌转移患者有益。
本研究仅对H101在细胞水平上的抑制活性进行了实验,在H101的体内活性研究中,还应考虑其对于肿瘤免疫的影响。有研究表明溶瘤病毒可以恢复肿瘤免疫逃逸[11]。H101在体内是否可以选择性抑制肿瘤生长,具有改善肿瘤组织微环境作用及能够产生肿瘤免疫治疗效果,这些都需要通过进行进一步的体内药效实验和临床试验来予以揭示。
参考文献
[1] 杨耿兵. 新型溶瘤腺病毒靶向治疗恶性肿瘤的研究[D]. 杭州: 浙江理工大学, 2011.
[2] Kulanayake S, Tikoo SK. Adenovirus core proteins: structure and function[J]. Viruses, 2021, 13(3): 388.
[3] 徐瑞华, 袁中玉, 管忠震, 等. 瘤内注射E1B缺失腺病毒(H101)与化疗联合治疗恶性肿瘤的Ⅱ期临床试验[J]. 癌症, 2003, 22(12): 1307-1310.
[4] 海明基·A, 卡内尔瓦·A, 切鲁洛·V, 等. 溶瘤性腺病毒载体及与其相关的方法和用途: CN102264760A[P]. 2011-11-30.
[5] 谭晓华. 溶瘤腺病毒肿瘤靶向治疗:从实验室到临床[J].中国肿瘤生物治疗杂志, 2012, 19(6): 569-576.
[6] 王爱霞、薛亮、胡国栋. 培养瓶制备腺病毒的收率研究[J].上海医药, 2020, 41(15): 83-85.
[7] Shaw AR, Suzuki M. Immunology of adenoviral vectors in cancer therapy[J]. Mol Ther Methods Clin Dev, 2019, 15: 418-429.
[8] Mantwill K, Klein FG, Wang D, et al. Concepts in oncolytic adenovirus therapy[J]. Int J Mol Sci, 2021, 22(19): 10522.
[9] Knudsen ES, Nambiar R, Rosario SR, et al. Pan-cancer molecular analysis of the RB tumor suppressor pathway[J]. Commun Biol, 2020, 3(1): 158.
[10] Harada JN, Berk AJ. p53-Independent and -dependent requirements for E1B-55K in adenovirus type 5 replication[J]. J Virol, 1999, 73(7): 5333-5344.
[11] Cervera-Carrascon V, Havunen R, Hemminki A. Oncolytic adenoviruses: a game changer approach in the battle between cancer and the immune system[J]. Expert Opin Biol Ther, 2019, 19(5): 443-455.
