AEX-HPLC法测定单纯疱疹病毒注射液中病毒颗粒数
2024-10-10孙名皓雷雨胡国栋
摘 要 目的:建立检测单纯疱疹病毒注射液病毒颗粒数(VP)的阴离子交换色谱法(AEX-HPLC)。方法:采用Resource Q分析柱和Agilent 1260Ⅱ高效液相色谱系统,以Tris缓冲溶液(20 mmol/L,pH 7.0)为流动相A和以含2.5 mol/L氯化钠的Tris缓冲溶液为流动相B进行梯度洗脱,并对方法进行验证。结果:空白溶剂无干扰峰出现;未经纯化的单纯疱疹病毒溶液中的疱疹病毒峰与其他杂质峰分离度大于1.5;该方法的定量限和检测限为5.0×107 VP/mL和2.0×107 VP/mL;疱疹病毒的进样量在5×107~1×109病毒颗粒范围内,浓度与吸收峰的线性关系良好(R2=0.998 2);整个精密度实验的RSD%为0.9%;回收率70%~130%之间。结论:AEX-HPLC法可用于检测单纯疱疹病毒注射液的病毒颗粒数。
关键词 单纯疱疹病毒 病毒颗粒 分析方法验证
中图分类号:O657.75; R927.2 文献标志码:A 文章编号:1006-1533(2024)15-0083-04
引用本文 孙名皓,雷雨, 胡国栋. AEX-HPLC法测定单纯疱疹病毒注射液的病毒颗粒数[J]. 上海医药, 2024, 45(15): 83-86.
Determination of viral particle in herpes simplex virus injection by AEX-HPLC
SUN Minghao, LEI Yu, HU Guodong
(Shanghai Pharma Sunway Biotech Co., Ltd., Shanghai 201206, China)
ABSTRACT Objective: To establish an assay method for the determination of viral particle (VP) in herpes simplex virus injection by AEX-HPLC. Methods: The HPLC was run on Resource Q column with gradient elution using Tris buffer (20 mmol/L, pH 7.0) as mobile phase A and Tris buffer containing 2.5 mol/L NaCl as mobile phase B. The assay method was subsequently validated. Results: There was no interference peak in the blank solvent and the resolution between peaks for herpes simplex virus and other impurities in the unpurified herpes simplex virus solution was greater than 1.5. The LOQ and the LOD of this assay were 5.0×107 and 2.0×107 VP/mL. The linearity relationship between the concentration and the absorption peak was good in the range of 5×107-1×109 VP/ mL with R2 0.998 2. RSD% in precision assay was 0.9% and recovery in accuracy assay was between 70%-130%. Conclusion: The AEX-HPLC assay can be applied to determine the viral particle in herpes simplex virus injection.
KEY WORDS herpes simplex virus; viral particle; analysis method validation
单纯疱疹病毒(herpes simplex virus,HSV)[1-2]是疱疹病毒的典型代表,由于感染急性期发生水疱性皮炎即单纯疱疹而得名。能引起人类多种疾病,如龈口炎、角膜结膜炎、脑炎以及生殖系统感染和新生儿的感染。HSV呈球形,有包膜,包膜表面有11种包膜糖蛋白;有明显的四层结构组成:一个双链DNA核心、核衣壳、间层和囊膜。单纯疱疹病毒治疗是当前肿瘤治疗技术的研究热点[2-3],在作为药品进行研发和生产的过程中,需要采用滴度测定的方法进行分析和控制。目前针对单纯疱疹病毒的滴度测定主流的方法是使用空斑法检测生物学滴度[4-6],不仅检测周期长(需要1周),对人员及环境的要求较高(须保持无菌),而且成本较高。此外还有荧光定量PCR法[7-8]、化学发光免疫法[9]、酶联免疫法[9]等检测病毒颗粒数,虽然这些方法灵敏度高,检测周期短,但是成本很高,须购买相对应的价格昂贵的检测试剂盒,且无法做到高通量的检测,满足不了在工艺纯化过程中实时监控。本研究建立了一种AEX-HPLC方法来检测单纯疱疹病毒注射液中的病毒颗粒数,具有高效、快速、低成本优势。
1 材料和方法
1.1 仪器
Agilent 1260Ⅱ型高效液相色谱仪(紫外检测器,OpenLab工作站软件;安捷伦公司);Resource Q色谱柱(6.4 × 30 mm,15 mm,Cytiva公司);ME3002TE电子天平、S400-K 型pH计(Mettler Toledo公司)。
1.2 试剂和样品
Tris-Base购自Promega公司;盐酸和氢氧化钠购自Merck公司;水为超纯水;单纯疱疹病毒注射液(通过qPCR对其进行标定,标定值2.1×109 VP/mL,作为工作标准品)、中间样品等均为上海三维生物技术有限公司研发平台生产,保存条件为-80 ℃。
1.3 色谱条件
1)空白溶液 以流动相A作为空白溶剂进样。
2)标准品溶液 从?80 ℃冰箱中取出单纯疱疹病毒注射液,解冻、平衡至室温后轻微涡旋后进样。
3)供试品溶液 取单纯疱疹病毒溶液中间样品进样。
4) 流动相 A:Tris溶液(20 mmol/L,pH 7.0,用0.45 mm的微孔滤膜抽滤);B:Tris溶液+2.5 mol/L氯化钠溶液。
流速1.0 mL/min,柱温25 ℃,样品池温度10 ℃,检测波长280 nm,进样量100 mL;进行梯度洗脱(表1)。
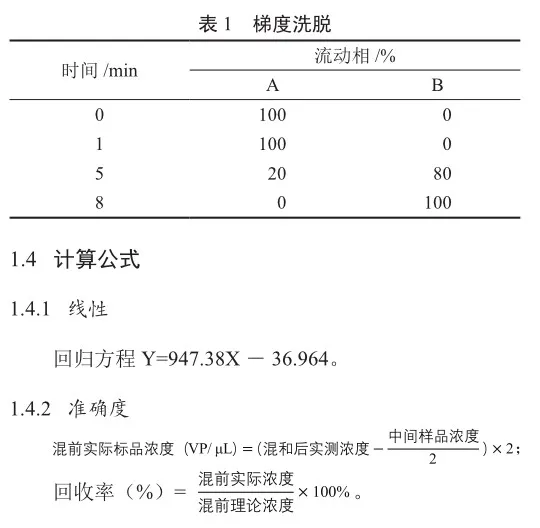
2 结果
2.1 专属性和系统适用性
空白溶液、标准品溶液、供试品溶液各100 mL进样,记录色谱图,结果见图1。标准品溶液中单纯疱疹病毒峰的保留时间在4.09 min;在空白溶液的出峰位置无干扰;供试品溶液中,单纯疱疹病毒峰与其他杂质峰的分离度大于1.5。结果表明,本方法的专属性和系统适用性良好。

2.2 定量限
取标准品溶液适量,用流动相A逐步稀释成不同浓度,在上述色谱条件下,基线噪音选择6.00~7.00 min,直至信噪比接近10。结果单纯疱疹病毒的定量限为5×107 VP/mL,可以满足测定要求。
2.3 检测限
取标准品溶液适量,用流动相A逐步稀释成不同浓度,在上述色谱条件下,基线噪音选择6.00~7.00 min,直至信噪比接近3。结果单纯疱疹病毒的检测限为2×107 VP/mL,可以满足测定要求。2.4 线性和范围
将定量限的浓度作为线性的最低浓度点,将高浓度的单纯疱疹病毒液用流动相A稀释至1×109、5×108、2×108、1×108及5×107 VP/mL,分别进样,测得各浓度相应的峰面积(表2),并对目标峰面积进行线性评估。以浓度为横坐标,峰面积为纵坐标作回归分析,得回归方程Y=947.38X-36.964,R2=0.998 2。结果表明,单纯疱疹病毒的进样浓度在(5×107)~(1×109)VP/mL之间,线性关系良好。

2.5 精密度
2.5.1 重复性
由分析员1取样品溶液,连续进样6次,测定单纯疱疹病毒的峰面积,结果峰面积的RSD%为1.0%,表明本方法的重da0b196f05a0d0536ca0f9dd59419bf12ef2bb1f76cffe7264e19d3cee273579复性良好。
2.5.2 中间精密度
由分析员2在不同日期取样品溶液,连续进样6次,测定单纯疱疹病毒峰面积,结果峰面积的RSD%为0.7%,表明本方法的中间精密度良好,综合重复性和中间精密度的数据,12针进样结果峰面积的RSD%为0.9%,表明本方法的精密度良好。
2.6 准确度
选取2×108、5×108、8×108 VP/mL为低、中、高3个已知浓度的标准品,分别与未知浓度的中间样品等体积混匀后进行检测,回收率在70%~130%之间(表3)。

3 讨论
病毒颗粒数一定程度上能够反映病毒滴度,在工艺开发过程中,需要对病毒颗粒数进行控制以确保工艺的稳定,和传统的检测方法相比较,通过高效液相色谱的方式,可以极大的缩短开发的进程,降低成本;同时在产品放行阶段,也可以和空斑法滴度相辅相成,共同反映该产品的病毒颗粒数。本研究采用的AEX-HPLC法,在分析未纯化的单纯疱疹病毒液时,可将单纯疱疹病毒峰和杂质峰实现很好的分离;此外单个样的检测时间为8 min,可以大通量地进行病毒检测,非常利于前期的细胞培养、筛选和纯化阶段的工作。
但是由于使用的流动相B中含有2.5 mol/L的氯化钠,盐浓度很高,在检测过程中须用10%的异丙醇进行泵头密封垫的清洗,每5 min “seal wash” 0.2 min;同时针对未纯化的样品,为了充分洗脱柱子上的残留样品,特地在5~8 min的时间段将梯度放缓(表1);为了能延长色谱柱的使用寿命,在每次检测样品后须对色谱柱进行较长时间的清洗、维护;如检测完成后,切换成1 mol/L氢氧化钠,以0.5 mL/min进行等度洗脱,之后再切换成超纯水进行冲洗2 h以上,同时在下一次检测前,需要对进样针进行10次“needle wash”,来清洗进样针中残留的样品,减小对下一次检测的干扰。考虑到维护的操作时间较长,步骤较多,后续会进一步研究,尝试在流动相中加入较少比例的有机相,在不改变原有检测灵敏度的情况下尽可地将色谱柱上的样品洗脱干净来减少维护色谱柱所需的时间。就本分析方法而言,不应仅仅局限于单纯疱疹病毒,在同一个液相条件下,对不同病毒的分离才是未来病毒颗粒数检测的趋势,这样不仅可以在前期开发中进行高通量检测,还可以在产品放行阶段对关键质量参数尤其是杂质部分进行一定程度上的控制。
在方法学验证方面,5×107~1×109 VP/mL的线性范围可以很好地满足工艺开发的需求,良好的精密度以及较高的回收率也是本方法的亮点之一。总之,本方法可以用于单纯疱疹病毒注射液中病毒颗粒数检测。
参考文献
[1] Bradley H, Markowitz LE, Gibson T, et al. Seroprevalence of herpes simplex virus types 1 and 2—United States, 1999-2010[J]. J Infect Dis, 2014, 209(3): 325-333.
[2] 田聆, 薛京伦, 贾韦国. 溶瘤单纯疱疹病毒治疗技术及其进展[J]. 生命科学, 2008(5): 734-741.
[3] 李倩, 徐祎春, 欧莹, 等. 溶瘤病毒在抗肿瘤临床治疗中的研究进展[J]. 肿瘤, 2022, 42(11): 778-789.
[4] Roizman B, Whitley RJ. The nine ages of herpes simplex virus[J]. Herpes, 2001, 8(1): 23-27.
[5] 蒋景仪, 刘玉珍. 单纯疱疹病毒空斑筛选方法的建立及其初步应用[J]. 抗生素, 1984, 9(3): 95-97.
[6] 何英, 殷启凯, 付士红, 等. 库蚊黄病毒的病毒滴度测定方法建立[J]. 中国媒介生物学及控制杂志, 2021, 32(4): 412-414.
[7] 王磊兰, 陈莹, 吴基良, 等. 重组溶瘤2型单纯疱疹病毒荧光定量PCR检测方法的建立与验证[J]. 湖北科技学院学报(医学版), 2020, 34(2): 102-104.
[8] 陈敬, 刘钰, 汤重发, 等. 小鼠胃组织中幽门螺杆菌SYBR Green Ⅱ实时定量PCR检测方法的建立及验证[J].中国生物制品学杂志, 2016, 29(12): 1308-1315.
[9] 展帮乐, 阮建波, 朱和玲, 等. 单纯疱疹病毒IgM抗体检测方法的比较[J]. 皮肤性病诊疗学杂志, 2019, 26(3): 160-162.
