丁酸氯维地平注射用乳剂商业化生产工艺研究
2024-10-10崔智睿陈辰
摘 要 目的:通过优化丁酸氯维地平注射用乳剂制备工艺,确保能够在商业化生产线上制备出质量稳定的良好产品。方法:通过对蛋黄卵磷脂加入方式、制备初乳方式、均质参数和pH调节步骤的考察,筛选出符合商业化的丁酸氯维地平注射用乳剂的制备工艺。结果:采取蛋黄卵磷脂加入油相,油水两相按固定比例混合的方式制备初乳,均质压力采用50~70 MPa,均质时药液温度控制在40~60 ℃,均质次数为5~12次,均质后调节药液的pH调节至7.0~8.0,可得到质量较好的丁酸氯维地平注射用乳剂。结论:采用优化后的工艺参数,能够在商业化生产线上制备出良好质量并稳定的丁酸氯维地平注射用乳剂。
关键词 丁酸氯维地平注射用乳剂 工艺优化 商业化生产
中图分类号:R944.17; R972.4 文献标志码:A 文章编号:1006-1533(2024)15-0073-05
引用本文 崔智睿, 陈辰. 丁酸氯维地平注射用乳剂商业化生产工艺研究[J]. 上海医药, 2024, 45(15): 73-77.
Study on commercial scale-up of the production process of clevidipine butyrate emulsion for injection
CUI Zhirui, CHEN Chen
(SPH NO.1 Biochemical & Pharmaceutical Co., Ltd., Shanghai 200240, China)
ABSTRACT Objective: To ensure that products with good quality and stability can be prepared on commercial production lines by optimizing the preparation process of clevidipine butyrate emulsion for injection. Methods: The preparation process of clevidipine butyrate emulsion for injection suitable for commercial production was screened out by the optimization of method for the addition of egg yolk lecithin, the investigation of the crude emulsion feeding sequence, homogenization parameters and pH adjustment steps. Results: A better quality clevidipine butyrate emulsion for injection could be obtained by adding egg yolk lecithin to the oil phase, mixing oil and water in a fixed proportion, setting the homogenization pressure at 50-70 MPa, maintaining the temperature of the liquid at 40-60 ℃, homogenizing the liquid for 5-12 times and adjusting the pH to 7.0-8.0. Conclusion: It is possible to prepare a good quality and stable clevidipine butyrate emulsion for injection using the optimized process parameters on a commercial production line.
KEY WORDS clevidipine butyrate emulsion for injection; process optimization; commercial production
丁酸氯维地平于2008年8月获准首次在美国上市,其作为一种超短效的二氢吡啶类钙离子通道阻滞剂,具有起效快、消除快、高度的动脉血管选择性等特点,在治疗围术期、急性和重症高血压方面,具有良好的临床优势[1]。
由于丁酸氯维地平几乎不溶于水,结构中含有酯基,易在血液和组织中相关酶的作用下发生水解,代谢成无活性的产物[2-3],因此制备成脂肪乳注射液,使丁酸氯维地平溶解于油相或磷脂界面膜中,与水相隔离来克服上述缺点。但乳剂作为复杂注射剂,其质量对生产工艺和设备具有高度的依赖性,往往特定的生产线需配备特定的生产工艺,即使小试工艺十分成熟,但在商业化生产线上放大生产时,始终存在放大效应,如性状、粒径和有关物质等指标异常,因此无法照搬小试工艺参数,甚至无法对小试工艺参数线性放大。本研究在小试工艺的基础上,对丁酸氯维地平注射用乳剂的商业化工艺进行研究,重点考察了影响性状、粒径和有关物质等指标的工艺步骤,确保在商业化生产线上(批量120 L)制备出具有良好质量的产品。
1 材料和方法
1.1 材料
ML3002T分析天平、S220-K pH计(梅特勒-托利多公司);乳剂配制系统(上海玉成医药成套设备有限公司);XASM-0.37D安瓿水浴灭菌器(山东新华医疗器械股份有限公司);NICOMP Z380、Z780粒径测定仪(美国Particle Sizing Systems公司);2695/2489高效液相色谱仪(美国Waters公司)。
丁酸氯维地平(批号Cb-191204,上海紫源制药有限公司);大豆油(批号19100102-2-02,辽宁新兴药业股份有限公司);甘油(批号100320190602,湖南尔康制药有限公司);蛋黄卵磷脂(批号EK19023,日本Kewpia株式会社);油酸(批号180406,西安立邦制药有限公司);依地酸二钠(批号20190101,成都华邑药用辅料制造有限责任公司);氢氧化钠(批号180901,四川金山制药有限公司)。
1.2 评价指标
基于对产品本身质量的风险评估,本研究主要评价指标包括:性状、pH、粒径[平均粒径和大乳粒(>5 mm乳粒)]、有关物质和含量[4]。
1.3 丁酸氯维地平注射用乳剂处方
乳剂处方(mg/mL):丁酸氯维地平0.5,大豆油200,甘油22.5,蛋黄卵磷脂12,油酸0.3,依地酸二钠0.05,适量氢氧化钠及注射用水[5]。
1.4 方法
依据我公司的丁酸氯维地平注射用乳剂质量标准(SNP-STP3704),对本品各指标进行检测。
1.4.1 丁酸氯维地平注射用乳剂的制备工艺
本品的制备工艺包括:配液(油相制备、水相制备、初乳制备、均质、调节pH)、灌装、压塞轧盖、灭菌。鉴于甘油和依地酸二钠为水溶性物质,配液时溶解于水相中。油酸为油溶性物质,而丁酸氯维地平在水中几乎不溶,故制备时溶解于油相中。蛋黄卵磷脂因其具有两亲性,既可加入油相也可溶于水相中[6-7]。
1.4.2 工艺优化
经分析评估,主要从配液工艺影响评价指标的步骤进行优化[8-10]。
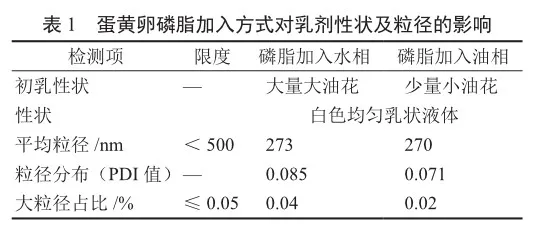
1)蛋黄卵磷脂加入方式的考察 蛋黄卵磷脂作为乳化剂,其加入方式对乳剂的稳定性至关重要,因其具有两亲性,故加入方式主要有两种:①加入水相形成混悬溶液;②加入油相形成真溶液。
2)初乳的制备方法的考察 商业化生产时初乳的制备方法主要有两种:①油水两相流量按固定比例(油相-水相=1∶4)混合形成初乳(工艺1);②油相直接加入水相中混合形成初乳(工艺2)。
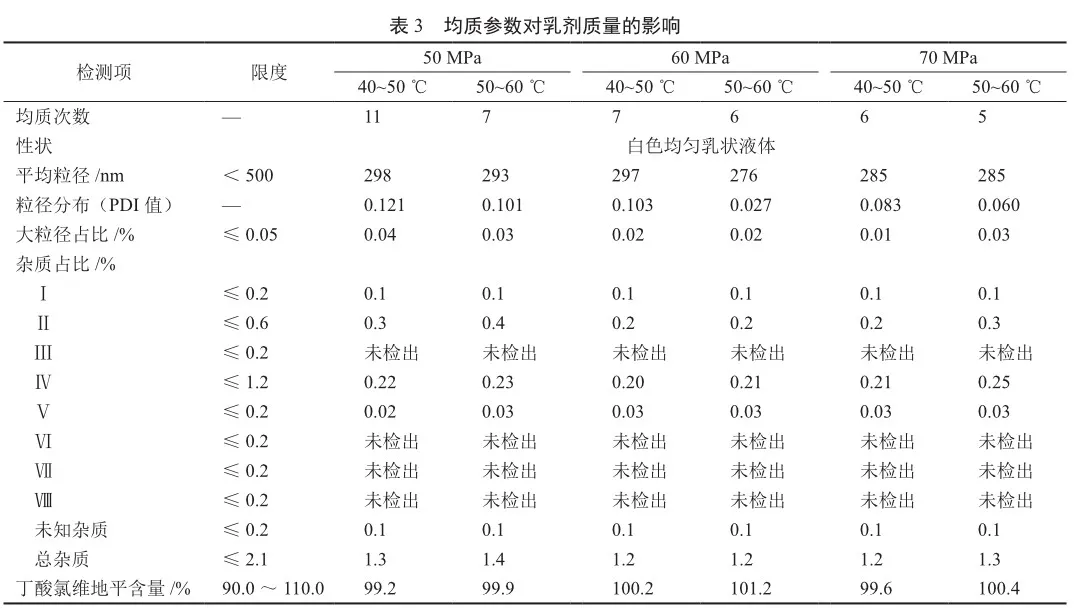
3)均质参数的考察 初乳平均粒径约在1~2 mm,需要进一步均质,将其降低至300 nm左右,故分别考察了3个均质压力50 、60和70 MPa,以及在相应均质压力下所需的均质次数,同时考虑到均质过程中药液的温度的升高,会影响产品的质量,故将均质过程中药液温度控制在40~60 ℃。
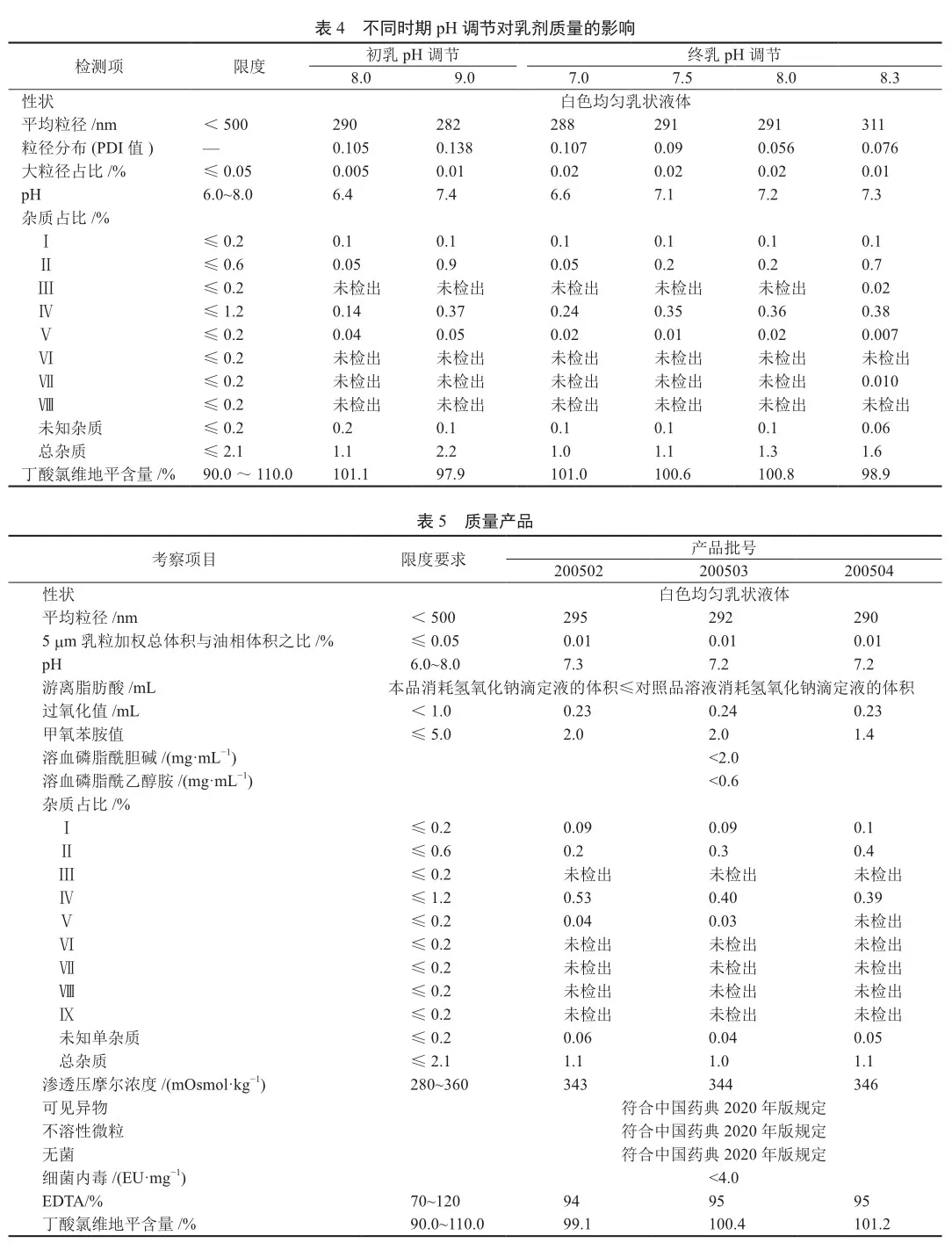
4)pH调节步骤的考察 因丁酸氯维地平结构中含有酯键,极易水解,而酸碱亦会促进水解发生,故重点考察了在初乳制备和均质阶段调节pH,对产品质量的影响。
2 结果
2.1 蛋黄卵磷脂加入方式的考察
蛋黄卵磷脂的不同加入方式所制得初乳性状不同(表1),结果显示蛋黄卵磷脂加入水相中所形成的混悬液,可能因为溶解不完全,会有部分吸附或残留在配液罐及管道内壁,导致乳化效果不佳,表明蛋黄卵磷脂应采用加入油相的方式溶解。
2.2 初乳的制备方法的考察
结果显示虽然两种初乳制备工艺所制备的制剂成品的性状和粒径无明显差异,但是采用工艺1时能减少初乳漂油的现象,获得更小的粒径(表2),减少了后续均质过程的难度,表明初乳的制备方法采用油水两相按固定比例混合。

2.3 均质参数的考察
结果显示均质压力在50~70 MPa,均质温度在40~60 ℃,均能够制备出满足要求的产品,但均质压力和均质温度共同影响乳剂达到目标粒径时所需的均质次数,当均质压力较大,温度较高时,所需的均质次数较少(表3),这一点有助于降低生产过程中的能耗。
2.4 调节pH步骤的考察
结果显示在初乳调节pH时,会引入更多的未知杂质,甚至超出限度范围;在终乳调节pH时,pH越低的产品,灭菌后杂质Ⅱ和杂质Ⅳ越小,总杂质越小,当终乳pH为8.3时,灭菌后产品的杂质Ⅱ已超出限度(表4),表明本品在终乳将pH调节至7.0~8.0时,可以得到较为稳定的产品。
2.5 最终确定的工艺
油相制备:称取处方量的大豆油,水浴加热,待其温度升至70~80 ℃后,加入丁酸氯维地平原料、蛋黄卵磷脂、油酸高速剪切使其完全溶解。
水相制备:称取处方量的注射用水,水浴加热,待其温度升至70~80 ℃后,加入依地酸二钠和甘油搅拌使其完全溶解。
初乳制备:油水两相采用特定比例(油相-水相= 1∶4)通过在线剪切机制备初乳。
均质:采用50~70 MPa的均质压力,控制均质过程中药液温度范围为40~60 ℃,均质5~12次。均质结束后,将药液的pH调节至7.0~8.0。
灌装、压塞、轧盖:将药液灌装至西林瓶中,加胶塞并轧盖密封。
灭菌:采用旋转高压水浴灭菌柜在121 ℃下灭菌15 min。
2.6 最终确定工艺的产品质量
采用最终确定的生产工艺,在商业化生产线(批量120 L)上进行了连续3批的工艺验证,结果显示优化后的工艺能够在商业化生产线上制备出符合要求的产品(表5)。
3 讨论
和普通注射剂不同,除了pH、含量和有关物质这些常见的理化指标外,还要关注微观形态(如性状和粒径)等,以及辅料的降解杂质,因此必须要严格控制各个工艺阶段的参数。
由于丁酸氯维地平结构中含有酯键,在偏酸或偏碱条件下不稳定,本研究发现丁酸氯维地平在较高pH条件下不稳定,易发生水解导致杂质水平升高,因此尝试了在不同阶段进行pH的调节。试验过程中发现,若在初乳阶段调节pH(8.0或9.0),则灭菌后药液的pH会降低约1.5,而在均质后调节pH,则灭菌后药液的pH会降低约0.5~1.0,呈现一种越靠近均质末端调节pH,其药液灭菌后的pH降低幅度越小的趋势。从有关物质的结果来看,药液的pH越低,其灭菌后有关物质(尤其是杂质Ⅱ和Ⅳ)增长越不显著,这可能是因为初乳时药液尚未完全乳化,仍有部分丁酸氯维地平溶解于油相中漂浮在乳剂表面,此时加入pH调节剂,会与丁酸氯维地平直接接触发生反应,促进了其的水解,导致药液pH降低以及有关物质的显著升高。而充分均质后,丁酸氯维地平包裹在脂肪乳中,有效的避免了这种情况。
乳剂在工艺放大时,不应该仅套用小试制剂工艺,需要充分理解其工艺的本质,即影响产品指标的各工艺参数,并结合商业化生产线的设备,对工艺进行调节和优化,以生产出良好质量并稳定的产品。
参考文献
[1] 郑伟. 丁酸氯维地平(Cleviprex)[J]. 中国药物化学杂志, 2009, 19(1): 79.
[2] Nguyen HM, Ma K, Pham DQ. Clevidipine for the treatment of severe hypertension in adults[J]. Clin Ther, 2010, 32(1): 11-17.
[3] Pollack CV, Varon J, Garrison NA, et al. Clevidipine, an intravenous dihydropyridine calcium channel blocker, is safe and effective for treatment of patients with acute severe hypertension[J]. Ann Emerg Med, 2009, 53(3): 329-338.
[4] 国家药典委员会. 中华人民共和国药典2020年版二部[M].北京: 中国医药科技出版社, 2020: 157-160.
[5] Cleviprex (clevidipine butyrate)[EB/OL]. [2023-10-24]. http://hk.ftfx.ink/article/2010/0915/22201.html.
[6] 荣景宏, 吴凡, 王芳, 等. 丁酸氯维地平脂微球注射液的制备及质量评价[J]. 沈阳药科大学学报, 2015, 32(7): 503-509.
[7] 杨丽霞, 全东琴, 王涛. 丁酸氯维地平静脉脂肪乳剂的质量评价[J]. 现代生物医学进展, 2013, 13(7): 1272-1277.
[8] 何海冰, 殷春阳, 徐丽双, 等. 丁酸氯维地平亚微乳注射液的制备与理化性质考察[J]. 沈阳药科大学学报, 2015, 32(10): 760-766.
[9] 李瑞强, 祖元刚, 王化, 等. 水中氧含量对脂肪乳氧化稳定性的影响[J]. 中国医院药学杂志, 2013, 33(13): 1065-1068; 1099.
[10] 吴燕, 李冬梅, 徐超斗, 等. 氟比洛芬酯脂微球注射液的制备及其质量评价[J]. 中国药学杂志, 2013, 48(21): 1847-1851.
