糖尿病与主动脉夹层发病的研究进展
2024-09-17邹明锐董圣军刘宝辉王傲韩曰信王玉玖
【摘要】 主动脉夹层是病情凶险、进展迅速、死亡率高的心血管疾病,但其具体的发病机制尚不明确。当前,主动脉夹层和糖尿病是国内外临床研究热点,糖尿病被认为是心血管疾病的危险因素之一,而笔者在诸多研究中发现,糖尿病与主动脉夹层发病呈负相关性,即糖尿病对主动脉夹层具有一定的保护作用,其中包括保护主动脉管壁结构、抑制炎症因子分泌、降低主动脉管壁应力等。为更好地了解糖尿病与主动脉夹层之间的相互作用机制,本文将目前关于糖尿病与主动脉夹层的临床研究及相关分子通路做一综述。
【关键词】 糖尿病 主动脉夹层 作用机制 炎症分子学 生物力学
Research Progress of Diabetes Mellitus and Aortic Dissection/ZOU Mingrui, DONG Shengjun, LIU Baohui, WANG Ao, HAN Yuexin, WANG Yujiu. //Medical Innovation of China, 2024, 21(25): -188
[Abstract] Aortic dissection is a cardiovascular disease with dangerous condition, rapid progress and high mortality, but its specific pathogenesis is still unclear. At present, aortic dissection and diabetes mellitus are the focus of clinical research at home and abroad. Diabetes mellitus is considered to be one of the risk factors for cardiovascular diseases, and authors have found in many studies that there is a negative correlation between diabetes mellitus and the incidence of aortic dissection, that is, diabetes mellitus has a certain protective effect on aortic dissection, including protecting the structure of the aortic wall, inhibiting the secretion of inflammatory factors, and reducing the stress of the aortic wall. In order to better understand the interaction mechanism between diabetes mellitus and aortic dissection, this article reviews the current clinical studies and related molecular pathways on diabetes mellitus and aortic dissection.
[Key words] Diabetes mellitus Aortic dissection Action mechanism Molecular inflammation Biomechanics
First-author's address: Department of Cardiovascular Surgery, Binzhou Medical University Hospital, Binzhou 256603, China
doi:10.3969/j.issn.1674-4985.2024.25.041
多种因素可引起主动脉夹层(aortic dissection,AD),如高血压、遗传疾病(如马方综合征)、主动脉炎性疾病、动脉粥样硬化及溃疡、动脉瘤、高龄、妊娠、创伤等[1]。糖尿病(diabetes mellitus,DM)被普遍认为是心血管疾病的主要危险因素,其能够导致血管管壁的内皮细胞损伤、炎症反应和氧化应激等,但大量的流行病学研究观点认为DM对AD的发病具有一定的保护作用[2-4]。本文就DM与AD发病的研究进展做一综述,侧重阐述DM对AD的保护作用,具体表现为影响主动脉管壁结构、炎症因子分泌、生物力学因素等,希望将来能在其预防和临床诊治实现新的突破。
1 AD
1.1 病理生理学
主动脉是人体最粗大的动脉血管,直接跟心脏相连,也是心脏中的血向外泵出的直接通道,可分为升主动脉、主动脉弓和降主动脉,其管壁可分为内层(血管内皮细胞)、中层[血管平滑肌细胞(vascular smooth muscle cell,VSMC)]和外层(成纤维细胞)[5]。AD病理生理学关键在于主动脉中层结构及功能的破坏。主动脉中层主要由VSMC及细胞外基质(extracellular matrix,ECM)构成[6]。VSMC对于保持血管张力、活性、构型有着重要作用[2],并且大多数的VSMC具有收缩表型,这对维持血管稳态及血管重塑都具有重要意义。然而在一系列致病因素(如氧化应激反应、高血压与炎症因子等)的作用下会诱导VSMC由收缩型向合成型转变,这种表型转化会促进蛋白水解酶[例如基质金属蛋白酶(matrix metalloproteinase,MMP)]的分泌,从而导致ECM中胶原蛋白和弹性蛋白的分解[5]。因此ECM降解被认为是管壁发生病变的主要原因,具体表现为收缩蛋白表达降低、弹性纤维断裂、MMP的表达增加及血管壁的钙化[7],从而加速AD发展进程。MMP是一类蛋白水解酶,主要通过内皮细胞和巨噬细胞分泌,其可被血管壁应力激活,并在组织的蛋白水解中表达其活性,MMP-2(通过VSMC释放)和MMP-9(通过巨噬细胞释放)都参与破坏ECM[8-9]。
1.2 炎症分子学
炎症因子是主动脉壁结构被破坏和重塑的关键因素之一[10]。有大量的证据表明,AD的发生与炎性细胞的浸润(即单核细胞和巨噬细胞)密不可分[11-13]。巨噬细胞来自单核细胞,后者来源于骨髓,根据不同组织或器官的需要分化为巨噬细胞,其分为M1型(促炎表型)和M2型(抗炎表型),不同的细胞表型展现出不同的代谢功能状态[14]。M1型巨噬细胞分泌促炎因子,如白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、一氧化氮合酶(NOS)及MMP等,从而破坏主动脉管壁结构;而M2型巨噬细胞则通过转化生长因子-β(TGF-β)及白介素-10(IL-10)的表达发挥抗炎作用,有助于管壁结构与功能的稳定[15]。对于炎症过程来说,一方面,IL-6是由趋化因子CXCL1募集的中性粒细胞产生,而巨噬细胞又是CXCL1的主要来源[16-17];另一方面,主动脉外膜的成纤维细胞产生IL-6和趋化因子配体2(CCL2)[18-19],启动单核细胞募集,进而分化为巨噬细胞促进成纤维细胞的增殖,从而形成恶性循环加速AD的进展[20]。此外,在AD患者中,主动脉的外膜、中膜及内膜均有巨噬细胞浸润,但其主要累及在外膜和腔内血栓中[21]。主动脉壁中M2型巨噬细胞的细胞密度高于M1型巨噬细胞,但M1型巨噬细胞主要分布在主动脉外膜,而M2型巨噬细胞多分布在腔内血栓[22],这表明这两种巨噬细胞亚型在疾病的发生发展中起到了不同的作用,也从侧面验证了夹层是“由外向内”发展的。
1.3 生物力学
近年来已有证据表明主动脉壁应力作为生物力学因素参与AD进展[23]。例如马方综合征患者的升主动脉近端和降主动脉近端上的壁面剪切力发生明显的改变。此外有研究还发现即使是低强度的壁面剪切力也能激活VSMC的增殖和迁移,使得VSMC由收缩表型向合成表型转变,从而破坏主动脉壁结构导致AD[24]。
2 DM对AD的影响
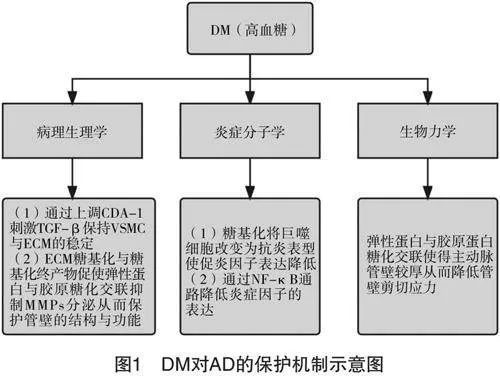
DM是一种以高血糖、胰岛素抵抗和/或缺乏(相对或绝对)为特征的慢性糖代谢紊乱疾病,是心血管和外周血管疾病的重要风险因素,然而流行病学研究证实DM和AD进展呈负相关性,表明其在AD的形成和进展中具有一定的保护作用[25]。见图1。
2.1 病理生理学
有证据表明,在诱导和维持VSMC稳态和分化过程中TGF-β信号通路起到了关键作用[26],而当机体处于高糖代谢状态下会通过影响细胞自身分化抗原-1(CDA-1)的上调对TGF-β信号通路起到更大的刺激作用,有助于保持VSMC和ECM的稳态与功能来发挥其对主动脉管壁的保护作用,进而降低AD发生风险[27]。ECM主要由弹性蛋白、基底膜、胶原和蛋白聚糖组成,其能够与位于主动脉壁的各种细胞相互作用共同维持管壁结构的稳定[28]。有研究表明,ECM糖基化与糖基化终产物可促使弹性蛋白与胶原糖化交联,进而可抑制MMP的分泌,有助于主动脉壁结构与功能的稳定[29]。同时也在临床研究中发现DM患者和非DM患者MMP活性存在差异,DM患者MMP-1、MMP-2和MMP-9的浓度较低[30]。因此,笔者推断或许是因为DM患者ECM糖基化程度相对较高,ECM糖基化及其终产物的相互作用通过抑制MMP的分泌减少了对主动脉管壁的破坏程度。Bossone等[31]的临床研究也证明了主动脉组织间的糖化交联发挥了其对管壁的保护作用。
2.2 炎症分子学
DM影响AD炎症的机制可能包括刺激胰岛素受体、单核细胞-巨噬细胞系统或C肽。C肽(C-peptide)又称连接肽,由胰岛β细胞分泌,它与胰岛素有一个共同的前体胰岛素原,因此C肽也就代表着体内胰岛素的含量[32]。2型糖尿病患者的C肽水平通常是升高的,然而在C肽的作用下,通过NF-κB介导的途径,多种促炎细胞因子的表达降低[30,33]。在DM小鼠模型中,低水平的IL-6能够限制AD进展,因此推断糖基化有可能将单核细胞-巨噬细胞功能改变为抗炎表型,从而降低IL-6的产生[34]。
2.3 生物力学
与其他动脉相比,主动脉壁承受更大的血流压力,主动脉壁应力增加也是AD的病因。然而,DM患者具有较大的基质体积,导致主动脉壁较厚,这降低了主动脉壁应力,其具体机制是通过主动脉壁介质中胶原蛋白的交联在稳定胶原蛋白网络中起重要作用[34],从而增强主动脉壁结构的稳定性。
3 降糖药对AD的影响
降糖药物主要包括双胍类、噻唑烷二酮类、二肽基肽酶-Ⅳ(DPP-Ⅳ)抑制剂、钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂、胰高血糖素样肽-1(GLP-1)受体激动剂和胰岛素。
3.1 口服降糖药
双胍类(如二甲双胍)的作用机制包括降低肝脏葡萄糖生成,以及改善组织对胰岛素的敏感性,具有多效抗炎和血管保护作用(限制主动脉炎症、减少ECM重塑和降低氧化应激等)。Vasamsetti等[35]在AngⅡ处理的小鼠中证明二甲双胍能够降低促炎因子的表达,表明其对夹层形成具有保护作用。体外及临床研究已表明二甲双胍能够降低人主动脉细胞中的MMP-2水平和VSMC增殖。此外,与未使用二甲双胍的DM患者相比,使用二甲双胍的DM患者中AD的发生率较低[36]。
噻唑烷二酮类(如罗格列酮)作为过氧化物酶体增殖物激活受体γ(PPARγ)激动剂,通过降低TNF-α水平发挥抗炎作用。Motoki等[37]研究了PPARγ激动剂对AD患者主动脉壁的影响,发现其可通过降低MMP-9和TNF-α的表达来预防或延缓AD的进展。
DPP-Ⅳ抑制剂(如阿格列汀)通过抑制蛋白水解酶DPP-Ⅳ,从而延长GLP-1的作用并延迟胃排空,增加膳食刺激的胰岛素分泌和抑制胰高血糖素释放。Bao等[38]发现阿格列汀通过抗氧化作用以剂量依赖性方式减弱管壁破坏程度。实验结果表明阿格列汀组大鼠的活性氧(ROS)活性及MMP-2和MMP-9水平均较低,从而保护主动脉管壁。肉眼观察发现:与对照组相比,DPP-4抑制剂治疗组大鼠的主动脉扩张显著减少。
SGLT-2抑制剂(恩格列净等)是一类较新的降血糖药物,主要是通过抑制肾脏中的SGLT-2,减少肾小球对葡萄糖的重吸收,增加尿糖和渗透性利尿从而降低血糖,同时改善胰岛B细胞的功能、增加胰岛素敏感性[39]。Ortega等[40]证实恩格列净可使促炎细胞因子(如MMP-2和MMP-9)下调,并减少动脉粥样硬化。
GLP-1受体激动剂(利司那肽等)可刺激餐后胰岛素分泌,降低胰高血糖素的分泌,从而延迟胃排空,进而引起饱腹感,减少餐后高血糖[39]。Yu等[41]证实了利司那肽通过减少ROS和巨噬细胞浸润发挥对主动脉管壁的保护作用。此外,利司那肽还可抑制大鼠主动脉壁中MMP-2、TNF-α和MMP-9等炎症因子的表达。由此可见,利司那肽能通过抗炎和抗氧化作用来维持管壁结构与功能的完整性。
3.2 胰岛素
为了评估胰岛素对AD的影响,已有科研团队在单独队列研究中开始胰岛素治疗。该研究显示高血糖与管壁新生血管形成减少、巨噬细胞浸润和中膜弹性蛋白溶解有关,但该研究最终结果显示胰岛素使血糖降低从而部分抵消了对AD的保护作用[42]。然而,口服降糖药却已显示对AD的发生和进展具有保护作用,这或许归因于口服降糖药对管壁本身的保护作用。
4 总结展望
随着我国人口结构逐渐趋于老龄化,DM被认为是心血管和外周血管疾病的高危因素,因为糖代谢异常会增加动脉粥样硬化、闭塞性动脉疾病和血管功能障碍的风险,进而引发一系列心血管和外周血管疾病。但流行病学和实验研究数据显示:就DM与AD发病的相关性而言,事实并非如此。国内外研究人员通过抽取一定数量的住院患者用来确定DM和AD之间的关联,其临床研究表明:DM与AD发病呈显著的负相关性。DM患者通过糖化交联改变主动脉组织结构与功能,有助于对主动脉稳定起到保护作用,进而防止夹层扩张、生长和破裂。并且,用于治疗DM的口服降糖药物已显示对夹层的形成和进展具有独立的保护作用,但胰岛素却部分抵消了高血糖对AD的保护作用,或许归因于口服降糖药本身对主动脉管壁的保护作用,这一点还需深入研究。虽然这些研究结果说明了DM对AD发病具有一定的保护作用,但该领域仍然需要更多的深入研究来揭示确切的机制和建立明确的因果关系,而证实和理解这些相互作用有助于制订更有效的预防和治疗策略,特别是对于那些同时患有DM和AD的患者。未来在AD的临床诊治中,或许可以把血糖水平纳入AD危险性的评判标准。还需进一步研究DM和AD的相互关联,寻找其有效的治疗靶点,为AD的预防和临床诊治提供新的治疗思路。
参考文献
[1]郭义山,丛超,杨宁,等.主动脉夹层发病机制的研究进展[J].医学综述,2017,23(12):2339-2343.
[2]李小好,尚桂莲,姜丹,等.细胞外基质成分对于平滑肌细胞表型及增殖的影响[J].中国现代医学杂志,2012,22(33):8-12.
[3] LIU H,SHI L,ZENG T,et al.Type 2 diabetes mellitus reduces clinical complications and mortality in Stanford type B aortic dissection after thoracic endovascular aortic repair: a 3-year follow-up study[J].Life Sci,2019,230:104-110.
[4] BOSSONE E,EAGLE K A.Epidemiology and management of aortic disease: aortic aneurysms and acute aortic syndromes[J].Nat Rev Cardiol,2021,18(5):331-348.
[5]高文博,余泓池,张瑶佳,等.胸主动脉夹层发病机制研究进展[J].四川大学学报(医学版),2023,54(3):699-704.
[6]赵雪敏,李骊华.高血压导致主动脉夹层发病机制的研究进展[J].心血管病学进展,2018,39(6):937-940.
[7] XU H,DU S,FANG B,et al.VSMC-specific EP4 deletion exacerbates angiotensin Ⅱ-induced aortic dissection by increasing vascular inflammation and blood pressure[J].Proc Natl Acad Sci USA,2019,116(17):8457-8462.
[8] ZHOU C,LIN Z,CAO H,et al.Anxa1 in smooth muscle cells protects against acute aortic dissection[J].Cardiovasc Res,2022,118(6):1564-1582.
[9] LIU J,YANG Y,LIU X,et al.Macrophage-biomimetic anti-inflammatory liposomes for homing and treating of aortic dissection[J].J Control Release,2021,337:224-235.
[10] RAFFORT J,LAREYRE F,CLEMENT M,et al.Monocytes and macrophages in abdominal aortic aneurysm[J].Nat Rev Cardiol,2017,14(8):457-471.
[11] CUI H,CHEN Y,LI K,et al.Untargeted metabolomics identifies succinate as a biomarker and therapeutic target in aortic aneurysm and dissection[J].Eur Heart J,2021,42(42):4373-4385.
[12] LIU X,CHEN W,ZHU G,et al.Single-cell RNA sequencing identifies an Il1rn+/Trem1+ macrophage subpopulation as a cellular target for mitigating the progression of thoracic aortic aneurysm and dissection[J].Cell Discov,2022,8(1):11.
[13]朱泓樵,李逸明,周建,等.炎症反应参与主动脉夹层临床转归的研究进展[J].中国普通外科杂志,2020,29(12):1509-1514.
[14]纳仁高娃,米焱,吕丽.IRF5通过MyD88/TGF-β1/Smads信号通路介导AngⅡ诱导巨噬细胞的极化和炎症反应[J].免疫学杂志,2022,38(10):846-853.
[15] MURRAY P J,ALLEN J E,BISWAS S K,et al.Macrophage activation and polarization: nomenclature and experimental guidelines[J].Immunity,2014,41(1):14-20.
[16] HOU S M,CHEN P C,LIN C M,et al.CXCL1 contributes to IL-6 expression in osteoarthritis and rheumatoid arthritis synovial fibroblasts by CXCR2, c-Raf, MAPK, and AP-1 pathway[J].Arthritis Res Ther,2020,22(1):251.
[17] KHAN S,SHAFIEI M S,LONGORIA C,et al.SARS-CoV-2 spike protein induces inflammation via TLR2-dependent activation of the NF-kappaB pathway[J/OL].Elife,2021,10:e68563.https://pubmed.ncbi.nlm.nih.gov/34866574/.
[18] ZHANG X,FAN L,WU J,et al.Macrophage p38α promotes nutritional steatohepatitis through M1 polarization[J].J Hepatol, 2019,71(1):163-174.
[19] CHENG N,KIM K H,LAU L F.Senescent hepatic stellate cells promote liver regeneration through IL-6 and ligands of CXCR2[J/OL].
JCI Insight,2022,7(14):e158207.https://pubmed.ncbi.nlm.nih.gov/35708907/.
[20] TIEU B C,JU X,LEE C,et al.Aortic adventitial fibroblasts participate in angiotensin-induced vascular wall inflammation and remodeling[J].J Vasc Res, 2011,48(3):261-272.
[21] RAO J,BROWN B N,WEINBAUM J S,et al.Distinct macrophage phenotype and collagen organization within the intraluminal thrombus of abdominal aortic aneurysm[J].J Vasc Surg,2015,62(3):585-593.
[22] BOYTARD L,SPEAR R,CHINETTI-GBAGUIDI G,et al.Role of proinflammatory CD68+ mannose receptor- macrophages in peroxiredoxin-1 expression and in abdominal aortic aneurysms in humans[J].Arterioscler Thromb Vasc Biol,2013,33(2):431-438.
[23]高文博,余泓池,张瑶佳,等.胸主动脉夹层发病机制研究进展[J].四川大学学报(医学版),2023,54(3):699-704.
[24] VAN Der PALEN R L,BARKER A J,BOLLACHE E,et al.
Altered aortic 3D hemodynamics and geometry in pediatric Marfan syndrome patients[J].J Cardiovasc Magn Reson,2017,19(1):30.
[25] CLIMENT E,BENAIGES D,CHILLARON J J,et al.Diabetes mellitus as a protective factor of abdominal aortic aneurysm: possible mechanisms[J].Clin Investig Arterioscler,2018,30(4):181-187.
[26] LI J,HUYNH P,DAI A,et al.Diabetes reduces severity of aortic aneurysms depending on the presence of cell division autoantigen 1 (CDA1)[J].Diabetes,2018,67(4):755-768.
[27] ARUN D,MUNIR W,SCHMITT L V,et al.Exploring the correlation and protective role of diabetes mellitus in aortic aneurysm disease[J].Front Cardiovasc Med,2021,8:769343.
[28] GURUNG R,CHOONG A M,WOO C C,et al.Genetic and epigenetic mechanisms underlying vascular smooth muscle cell phenotypic modulation in abdominal aortic aneurysm[J].Int J Mol Sci,2020,21(17):6334.
[29] RAFFORT J,LAREYRE F,CLEMENT M,et al.Diabetes and aortic aneurysm: current state of the art[J].Cardiovasc Res,2018,114(13):1702-1713.
[30] PORTIK-DOBOS V,ANSTADT M P,HUTCHINSON J,et al.
Evidence for a matrix metalloproteinase induction/activation system in arterial vasculature and decreased synthesis and activity in diabetes[J].Diabetes,2002,51(10):3063-3068.
[31] BOSSONE E,EAGLE K A.Epidemiology and management of aortic disease: aortic aneurysms and acute aortic syndromes[J].Nat Rev Cardiol,2021,18(5):331-348.
[32]张蕊.空腹血糖、血清C肽与HbA1c联合检测在2型糖尿病早期诊断中的应用价值[J].临床医学,2023,43(4):85-87.
[33] CIFARELLI V,LUPPI P,TSE H M,et al.Human proinsulin C-peptide reduces high glucose-induced proliferation and NF-kappaB activation in vascular smooth muscle cells[J].Atherosclerosis,2008,201(2):248-257.
[34] GOLLEDGE J,KARAN M,MORAN C S,et al.Reduced expansion rate of abdominal aortic aneurysms in patients with diabetes may be related to aberrant monocyte-matrix interactions[J].Eur Heart J,2008,29(5):665-672.
[35] VASAMSETTI S B,KARNEWAR S,KANUGULA A K,et al.
Metformin inhibits monocyte-to-macrophage differentiation via AMPK-mediated inhibition of STAT3 activation: potential role in atherosclerosis[J].Diabetes,2015,64(6):2028-2041.
[36] SHANTIKUMAR S,AJJAN R,PORTER K E,et al.Diabetes and the abdominal aortic aneurysm[J].Eur J Vasc Endovasc Surg,2010,39(2):200-207.
[37] MOTOKI T,KUROBE H,HIRATA Y,et al.PPAR-γ agonist attenuates inflammation in aortic aneurysm patients[J].Gen Thorac Cardiovasc Surg,2015,63(10):565-571.
[38] BAO W,MORIMOTO K,HASEGAWA T,et al.Orally administered dipeptidyl peptidase-4 inhibitor (alogliptin) prevents abdominal aortic aneurysm formation through an antioxidant effect in rats[J].J Vasc Surg,2014,59(4):1098-1108.
[39]郭凌波,王昱.SGLT2抑制剂和GLP-1受体激动剂对2型糖尿病患者心血管保护作用研究进展[J].心血管康复医学杂志,2023,32(3):290-294.
[40] ORTEGA R,COLLADO A,SELLES F,et al.SGLT-2 (sodium-glucose cotransporter 2) inhibition reduces AngⅡ (angiotensin Ⅱ)-induced dissecting abdominal aortic aneurysm in ApoE (apolipoprotein E) knockout mice[J].Arterioscler Thromb Vasc Biol,2019,39(8):1614-1628.
[41] YU J,MORIMOTO K,BAO W,et al.Glucagon-like peptide-1 prevented abdominal aortic aneurysm development in rats[J].Surg Today,2016,46(9):1099-1107.
[42] MIYAMA N,DUA M M,YEUNG J J,et al.Hyperglycemia limits experimental aortic aneurysm progression[J].J Vasc Surg,2010,52(4):975-983.
(本文编辑:陈韵)
*基金项目:山东省自然科学基金资助项目(ZR2020QH017)
