FBXW12在胰腺癌组织中的表达及其对胰腺癌细胞侵袭和迁移的影响
2024-08-18张金明谢永丰聂娇鲁临杜超




[摘要]目的探讨FBXW12在胰腺癌组织中的表达及其对胰腺癌细胞侵袭和迁移的影响。方法采用GEPIA2数据库分析FBXW12在胰腺癌组织及癌旁正常组织中的表达差异;收集2016年6月至2022年12月于临沂市人民医院行根治术治疗的31例胰腺癌患者的临床资料,对术中切除的癌组织及癌旁正常组织行免疫组化染色检测FBXW12的表达,并随访患者的生存预后情况。利用蛋白质印迹(Westernblot)与聚合酶链反应(polymerasechainreaction,PCR)研究胰腺癌细胞株内FBXW12蛋白的表达,并借助Transwell细胞侵袭试验及划痕试验评估FBXW12对胰腺癌细胞侵袭和迁移能力的影响。结果在癌旁正常组织中的FBXW12mRNA表达水平显著高于胰腺癌组织(P<0.05);胰腺癌组织的FBXW12蛋白阳性表达率为75.19%(23/31),癌旁正常组织的FBXW12蛋白阳性表达率为93.55%(29/31),FBXW12在胰腺癌及癌旁正常组织中的表达差异有统计学意义(P<0.05),且胰腺癌中FBXW12表达量与淋巴结转移密切相关(P<0.05),FBXW12低表达组患者预后更差(P<0.05);应用FBXW12过表达质粒转染后,胰腺癌细胞的侵袭和迁移能力均出现显著下降。结论FBXW12在胰腺癌中低表达且与胰腺癌的发生、发展相关。
[关键词]FBXW12;胰腺癌;预后;侵袭;迁移
[中图分类号]R576[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.21.018
ExpressionofFBXW12inpancreaticcancertissuesanditseffectontheinvasionandmigrationofpancreaticcancercells
ZHANGJinming1,2,XIEYongfeng1,NIEJiao2,LULin2,DUChao2
1.GraduateTrainingBaseofLinyiPeople’sHospital,JinzhouMedicalUniversity,Linyi276000,Shandong,China;2.DepartmentofGastroenterology,LinyiPeople’sHospital,Linyi276000,Shandong,China
[Abstract]ObjectiveToinvestigatetheexpressionofFBXW12inpancreaticcancerandelucidateitsimpactoncancercellmigrationandinvasion.MethodsThepresentstudyutilizedtheGEPIA2databasetoanalyzethedifferentialexpressionofFBXW12betweenpancreaticcancertissuesandnormaltissues.Clinicaldatafrom31pancreaticcancerpatientswhounderwentradicalresectionatLinyiPeople’sHospitalfromJune2016toDecember2022werecollected.ImmunohistochemicalstainingwasconductedtoassessFBXW12expressioninbothcancerousandadjacentnormaltissuesobtainedduringsurgery,withsubsequentfollow-upforsurvivalprognosis.Westernblotandpolymerasechainreaction(PCR)techniqueswereemployedtodetermineFBXW12proteinexpressionlevelsinpancreaticcancercelllines.TheimpactofFBXW12oncancercellinvasionandmigrationwasevaluatedusingTranswellcellinvasionandscratchtest.ResultsTheresultsfromtheanalysisoftheGEPIA2databaserevealedasignificantdownregulationofFBXW12mRNAexpressioninpancreaticcancertissuescomparedtonormalpancreatictissues(P<0.05).ImmunohistochemicalanalysisdemonstratedapositiveexpressionrateofFBXW12proteininpancreaticcancertissuesat75.19%(23/31),whereasadjacentnormaltissuesexhibitedahigherpositiveexpressionrateat93.55%(29/31),indicatingastatisticallysignificantdifferenceinFBXW12expressionbetweenpancreaticcancerandadjacentnormaltissues(P<0.05).Additionally,theexpressionlevelofFBXW12inpancreaticcancertissueswasfoundtobecloselyassociatedwithlymphnodemetastasis(P<0.05),patientswithlowexpressionofFBXW12haveaworseprognosis(P<0.05).Furthermore,transfectionwithFBXW12overexpressionplasmidresultedinasignificantdecreaseintheinvasionandmigrationabilitiesofpancreaticcancercells.ConclusionFBXW12islowexpressedinpancreaticcancerandisassociatedwiththeoccurrenceanddevelopmentofpancreaticcancer.
[Keywords]FBXW12;Pancreaticcancer;Prognosis;Cellinvasion;Migration
胰腺癌是人类最致命的恶性肿瘤之一,其发病率呈逐年上升趋势,在恶性肿瘤中死亡率排名第3位,具有诊断难度大、预后差、病死率高的特点[1-3]。胰腺癌的分子作用机制较复杂,通常涉及多个基因,泛素蛋白酶体系统(ubiquitin-proteasomesystem,UPS)参与癌症的进展并控制许多肿瘤抑制因子和癌基因的降解,维持体内稳态适应新的环境,防止外界持续性的损害[4-5]。泛素化是由3个组分酶组成的级联调控的关键翻译后修饰,是一种重要的通过选择性自噬实现底物特异性的方式。实现泛素化反应所需的3种酶为泛素活化酶E1、泛素结合酶E2和泛素连接酶E3。在参与降解过程中,FBXW家族是E3连接酶的重要组成部分。既往研究表明FBXW家族基因在调节参与细胞周期和肿瘤发生的蛋白质中发挥关键作用,并有助于判断治疗效果和疾病预后。FBXW家族表达的高低与多种癌症的预后相关,尤其是FBXW4、FBXW5、FBXW7、FBXW9、FBXW10[6];但对FBXW12的研究较少,FBXW12作为FBXW蛋白家族的一员,参与细胞内泛素化降解、转录调控、信号转导、细胞周期调控和细胞凋亡等多种生物活动,是一种抑癌基因[7]。既往研究发现卵巢癌患者的FBXW12表达明显降低,可能与卵巢癌发生、发展有关,但在消化系统癌症中的表达及意义尚无研究报道[8]。鉴于此,本研究探讨FBXW12在胰腺癌组织和细胞中的表达及对细胞功能的影响,并分析其与患者临床参数和生存预后的关系。
1资料与方法
1.1一般资料
选取2016年6月至2022年12月于临沂市人民医院行根治术治疗的31例胰腺癌患者的临床资料进行回顾性分析。其中男17例,女14例;年龄46~74岁,平均(60.62±8.18)岁。患者在接受手术治疗时均取标本用于病理学检查,并最终确诊为胰腺癌。纳入标准:①经病理学检查明确诊断为胰腺癌;②临床、病历资料完整;③术前无放化疗或其他辅助治疗。排除标准:①合并其他部位原发性肿瘤患者;②肿瘤复发患者;③伴有严重心、肺功能衰竭患者。患者均知情同意并签署知情同意书。本研究经临沂市人民医院伦理委员会批准(伦理审批号:YX200709)。
1.2GEPIA2数据库分析
在GEPIA2数据库中设定以下条件以研究FBXW12基因在胰腺癌组织与正常胰腺组织中的表达差异:“gene:FBXW12”“expressiondiy:boxplot”“cancertype:PAAD”。
1.3免疫组化检测FBXW12蛋白表达情况
实验标本取胰腺癌组织与癌旁正常组织,所有标本均采用4%中性甲醛固定,石蜡包埋,免疫组化染色采用链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法,按试剂盒说明书进行操作,兔抗人FBXW12抗体购自美国LSBio公司,工作浓度1:50,山羊抗兔免疫球蛋白(immunoglobulinG,IgG)二抗购自杭州华安生物技术有限公司,工作浓度1∶100。之后进行阅片,将胞核或胞质中出现浅黄色、黄色或棕褐色颗粒的细胞定为FBXW12表达阳性。根据FBXW12阳性细胞比例评分和染色强度评分进行分析:阳性细胞比例≤25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;无染色、浅黄色、黄色、棕褐色分别计0、1、2、3分;阳性细胞比例与染色强度得分相乘,积分≥4分为高表达,<4分为低表达[9]。根据FBXW12表达水平将31例胰腺癌组织及癌旁正常组织分为高表达组和低表达组。
1.4蛋白质印迹检测FBXW12蛋白的表达
根据蛋白提取试剂盒(购自北京索莱宝科技有限公司)说明提取细胞蛋白,并用二喹啉甲酸试剂盒酶标仪检测浓度。在十二烷基磺酸钠凝胶(浓缩胶4%,分离胶10%)上常规电泳等量的蛋白质,后转聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜(购自Millipore公司)2h,5%脱脂牛奶封闭并用Tris缓冲液-氯化钠-Tween-20(Tris-bufferedsaline-Tween-20,TBST)清洗后加入FBXW12一抗抗体(1∶1000;购自LSBio公司)。放置4℃孵育过夜,TBST洗膜,加入抗兔酶标记二抗(1∶5000;购自Huabio公司),摇床孵育1.5h,TBST洗膜3次,10min/次,采用超敏ECL化学发光试剂盒于PVDF膜上进行化学发光显影,最后计算FBXW12蛋白表达水平。
1.5细胞培养及转染
采用DMEN培养基培养胰腺癌细胞PANC-1、BxPC-3和SW1990,FBXW12过表达质粒pcDNA-FBXW12和pcDNA阴性对照(pcDNA-NC),用于转染PANC-1和SW1990细胞。转染48h后收集细胞用于下一步实验。
1.6实时定量聚合酶链反应鉴定FBXW12mRNA表达
根据操作指南,首先使用FastPure试剂盒(购自Vazyme公司)从样本中提取RNA;随后采用EvoM-MLVRTPremix反转录试剂盒(购自AccurateBiotechnology公司)将RNA反转录为cDNA;最后利用SYBRGreenPremixProTapHSqPCR(购自AccurateBiotechnology公司)进行实时定量聚合酶链反应(polymerasechainreaction,PCR),测定目标mRNA水平。使用引物:FBXW12正向:5'-ATGGAGATCCGATTGCCTGA-3',反向:5'-GCAGAAGATGATGCAAGGTCA-3';GAPDH正向:5'-GGAGCGAGATCCCTCCAAAAT-3',反向:5'-GGCTGTTGTCATACTTCTCATGG-3'。
1.7Transwell侵袭试验
将100µl(1×106个)PANC-1细胞悬浮于预先涂有基质胶(购自Corning公司)的上室中,含有10%磷酸缓冲盐溶液(phosphatebufferedsaline,PBS)的700µlDMEM培养基加至下室中。在37°C条件下孵育4h后,将腔室取出,并利用棉签清除膜表面残留的细胞。使用4%多聚甲醛固定侵入膜下表面的细胞,并进行0.1%结晶紫染色处理10min。随后使用PBS洗涤膜并使其干燥,最后使用倒置显微镜观察细胞并进行计数。
1.8细胞划痕试验
将胰腺癌细胞等量接种于6孔板中,待贴壁细胞达90%时,用200μl无菌移液器吸头划痕,加入无血清培养基DMEM,培养24h,在获取24h后的照片后,测量划痕距离,根据公式计算划痕愈合率:划痕愈合率(%)=(0h划痕宽度-24h划痕宽度)/0h划痕宽度×100%。
1.9统计学方法
采用GraphpadPrism8.4.3和SPSS6.0统计学软件对数据进行处理分析。计数资料以例数(百分率)[n(%)]表示,比较采用c2检验,计量资料以均数±标准差(![]() )表示,比较采用t检验。Fisher确切概率法检验FBXW12高表达组与低表达组在各类病理参数表达的差异。使用Kaplan-Meier方法分析FBXW12表达对胰腺癌患者生存预后的影响。P<0.05为差异有统计学意义。
)表示,比较采用t检验。Fisher确切概率法检验FBXW12高表达组与低表达组在各类病理参数表达的差异。使用Kaplan-Meier方法分析FBXW12表达对胰腺癌患者生存预后的影响。P<0.05为差异有统计学意义。
2结果
2.1GEPIA2数据库中FBXW12mRNA基因表达变化
GEPIA2数据库分析结果显示,胰腺癌组织中的FBXW12mRNA表达量显著低于其在正常胰腺组织中的表达水平,差异有统计学意义(P<0.05),见图1。
2.2胰腺癌及癌旁正常组织中的FBXW12表达
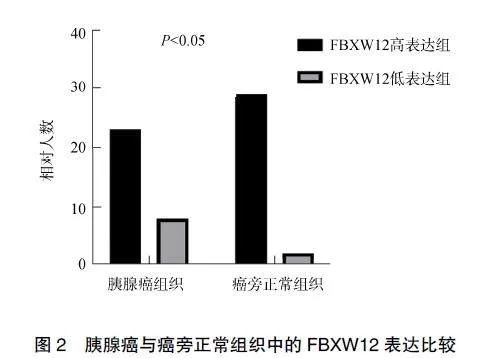
为高表达组和低表达组,在31例胰腺癌及31例癌旁正常组织中,FBXW12的阳性率分别为74.19%及93.55%,差异有统计学意义(P<0.05);免疫组化染色结果显示FBXW12阳性染色主要表现在细胞质中,与胰腺癌组织相比,FBXW12在癌旁正常组织中的表达明显增强,见图2和图3。
2.3不同临床病理特征胰腺癌患者的FBXW12表达水平比较
胰腺癌患者FBXW12的表达与性别、年龄、肿瘤分化程度和临床分期无显著相关性(P>0.05),与淋巴结转移存在相关性(P<0.05),见表1。
2.4FBXW12表达与胰腺癌患者生存期的关系
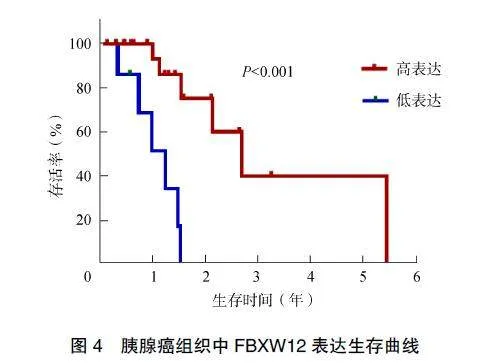
截至2023年10月,本研究中12例患者存活,19例死亡。根据随访年数及是否存活绘制生存曲线,结果显示FBXW12低表达患者的生存曲线快速下降(P<0.001),提示FBXW12低表达患者生存时间短、预后差,见图4。
2.5FBXW12在胰腺癌细胞中的表达情况
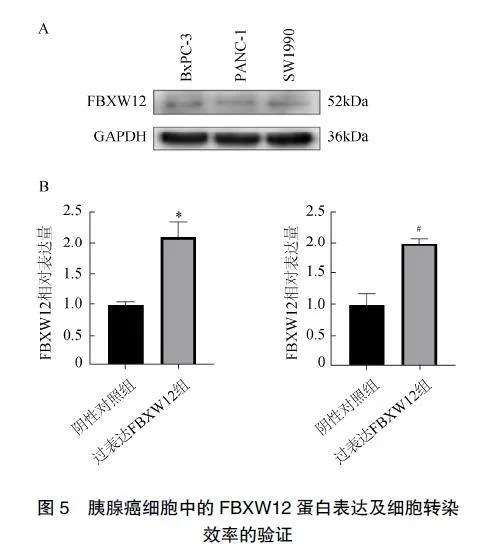
通过蛋白质印迹(Westernblot)分析3种不同胰腺癌细胞系(BxPC-3、PANC-1和SW1990)中FBXW12的表达,发现FBXW12在胰腺癌3种细胞株中均表达较低。为进一步分析加强FBXW12作用后对胰腺癌细胞功能的影响,本研究从中任选2株(PANC-1和SW1990),将靶向FBXW12的过表达质粒导入其中,并用PCR验证过表达效率,见图5。
2.6FBXW12对癌细胞侵袭和迁移能力的影响
侵袭和迁移是癌症转移的标志,可加速肿瘤发展并降低患者的生存率[10]。为评价FBXW12在胰腺癌细胞侵袭过程中的作用,本研究进行2种细胞的Transwell侵袭试验,结果发现,与对照组相比过表达FBXW12组侵袭的细胞数量明显减少,表现出较低的膜穿透能力。之后,本研究进行划痕愈合试验,探讨FBXW12对胰腺癌细胞迁移的影响,结果表明相较于0h,24h时对照组横向迁移距离较过表达FBXW12组明显缩短。因此,FABXW12在抑制胰腺癌细胞迁移和侵袭中发挥重要作用,见图6。
3讨论
胰腺癌是一种恶性程度极高的消化系统肿瘤,通常患者预后极差,5年生存率仅11%左右[10]。
早期胰腺癌缺乏特异性临床表现,导致大多数患者在就诊时已处于中晚期,错失最佳手术治疗时机。值得注意的是,即使在手术后,胰腺癌患者的生存时间也相对其他癌症患者较短,疾病的致命性极高[11]。肿瘤细胞的一个显著特征是出现非整倍体遗传和恶性增殖,人们对识别出在癌症发生和发展中起关键作用的新基因越来越感兴趣。随着分子生物学的快速发展,基因相关技术为筛选胰腺癌的诊治标志物提供便利[12]。因此迫切需要寻求胰腺癌新的有效诊治靶点,早发现、早治疗对抑制胰腺癌的发生、发展具有重要意义。
F-box蛋白家族是多聚体E3泛素连接酶复合物的关键识别亚基[13],根据C端二级结构的不同可分为FBXW、FBXL、FBXO3个亚类[14];通常与多个底物蛋白结合进行泛素化和降解,特定E3连接酶的活性和丰度可极大影响细胞生物学,参与肿瘤细胞的代谢和DNA的损伤修复[15]。参与降解的E3连接酶的重要成分包括FBXW家族,该家族有10个成员。尤其是FBXW1和FBXW7已被确定为可能的癌基因,其缺失或突变与多种形式的癌症有关[16]。FBXW12(含F-box和WD重复结构域12)也称为FBXO35、FBW12或FBXO12,靶向多种癌蛋白被认为是一种肿瘤抑制基因,并已被证明在控制许多生物过程中至关重要,包括细胞周期、细胞增殖、迁移、侵袭和凋亡[17]。FBXW12只在卵巢癌中作为抑癌基因被研究,在其他癌症中未见报道。本课题是首次研究FBXW12在胰腺癌中的作用,也是首次研究其在消化系统肿瘤中的作用。
本研究先通过GEPIA2数据库分析FBXW12在胰腺癌中的表达差异,后用免疫组织化学染色检测出FBXW12定位于细胞质且癌旁正常组织中FBXW12表达水平明显高于胰腺癌组织,癌中FBXW12表达与淋巴结转移存在显著相关性,之后分析FBXW12表达量与胰腺癌患者生存预后的关系,发现FBXW12高表达的胰腺癌患者的生存时间明显长于FBXW12低表达患者,将过表达质粒转入胰腺癌细胞,通过Transwell侵袭试验和划痕试验观察FBXW12对胰腺癌细胞生物学行为的影响,发现增强FBXW12作用后,癌细胞的侵袭和迁移能力明显下降,提示FBXW12可抑制胰腺癌细胞的相关功能。既往研究发现,F-box蛋白家族具有促癌或抑癌作用,如FBXW7和FBXW,FBXW9在肿瘤(如浸润性乳腺癌、结肠腺癌和膀胱尿路上皮癌等)中通常作为上调基因,与FBXW12作用相反[18]。FBXW7是该家族中典型的抑癌基因,FBXW7在胰腺癌、乳腺癌和血液系统肿瘤中起抑制作用[19];与本研究的FBXW12基因在胰腺癌中的结果一致,但FBXW7还影响细胞的增殖、凋亡、细胞分化和代谢[20]。本研究仅初步探讨FBXW12的作用,后续将继续研究其对胰腺癌细胞增殖、凋亡及相关分子通路的影响机制,以验证本研究的结果。
综上所述,FBXW12在胰腺癌中呈低表达且与患者淋巴结转移和生存预后相关,FBXW12蛋白过表达可显著抑制胰腺癌细胞的侵袭和迁移进程,提示FBXW12在胰腺癌的发生、发展中起重要作用,因此,FBXW12或可成为诊断和预测胰腺癌患者预后的重要肿瘤标志物和潜在的治疗靶点。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] HALBROOKC,LYSSIOTISC,PASCADIMAGLIANOM,etal.Pancreaticcancer:Advancesandchallenges[J].Cell,2023,186(8):1729–1754.
[2] 王鑫,刘也夫,尚海,等.胰腺癌组织中Survivin表达与临床意义研究[J].临床军医杂志,2019,47(12):1290–1292.
[3] 央茂,冯佳毅,刘颖斌.胰腺癌化疗中吉西他滨耐药机制研究进展[J].中国实用外科杂志,2022,42(2):225–229.
[4] HUSSAINS,DONGJ,MAX,etal.F-boxonlyprotein9anditsroleincancer[J].MolBiolRep,2022,49(2):1537–1544.
[5] WANGY,LEW.Autophagyandubiquitin-proteasomesystem[J].AdvExpMedBiol,2019,1206:527–550.
[6] YUS,LIANGZ,FANZ,etal.AcomprehensiveanalysisrevealingFBXW9asapotentialprognosticandimmunologicalbiomarkerinbreastcancer[J].IntJMolSci,2023,24(6):5262.
[7] CAOX,YANGY,ZHOUW,etal.AprepitantinhibitsthedevelopmentandmetastasisofgallbladdercancerviaROSandMAPKactivation[J].BMCCancer,2023,23(1):10954–10958.
[8] CHESNAYEEDL,MÉNDEZJP,LOPEZ-ROMEROR,etal.FBXW12,anovelFboxprotein-encodinggene,isdeletedormethylatedinsomecasesofepithelialovariancancer[J].IntJClinExpPathol,2015,8(9):10192–10203.
[9] 朱飞.甲基化CpG结合蛋白2在胃癌中的表达及其意义[J].中华消化杂志,2015,35(3):174–178.
[10] SIEGELR,MILLERK,FUCHSH,etal.Cancerstatistics,2022[J].CACancerJClin,2022,72(1):7–33.
[11] 侯丹阳,黑钰,徐向荣,等.敲低PRPF19对胰腺癌细胞增殖迁移和侵袭的影响[J].肿瘤防治研究,2023,50(2):119–125.
[12] 吴万波,王晓红,丁耘峰,等.肿瘤相关基因Gankyrin在胰腺癌组织中表达的临床意义[J].中华胰腺病杂志,2017,17(4):248–250.
[13] DíAZV,DEHERREROSA.F-boxproteins:Keepingtheepithelial-to-mesenchymaltransition(EMT)incheck[J].SeminCancerBiol,2016,36:71–79.
[14] 彭凯丽,陈宏辉.F-box蛋白家族及其与肿瘤相关问题的研究进展[J].实用医药杂志,2018,35(4):376–379.
[15] 冯家灵,黄海丽,何惠娟,等.F-box蛋白家族的肿瘤相关研究进展[J].广东医学,2017,38(19):3041–3044.
[16] HUANGG,XIANGZ,WUH,etal.ThelncRNABDNF-AS/WDR5/FBXW7axismediatesferroptosisingastriccancerperitonealmetastasisbyregulatingVDAC3ubiquitination[J].IntJBiolSci,2022,18(4):1415–1433.
[17] TEKCHAMD,CHEND,LIUY,etal.F-boxproteinsandcancer:Anupdatefromfunctionalandregulatorymechanismtotherapeuticclinicalprospects[J].Theranostics,2020,10(9):4150–4167.
[18] CHENS,LENGP,GUOJ,etal.FBXW7inbreastcancer:Mechanismofactionandtherapeuticpotential[J].JExpClinCancerRes,2023,42(1):226–227.
[19] ZHUQ,HUL,GUOY,etal.FBW7inhematologicaltumors[J].OncolLett,2020,19(3):1657–1664.
[20] JIANGJ,SUNC,TIANS,etal.TumorsuppressorFBXW7antagonizesWNTsignalingbytargetingβ-cateninfordegradationinpancreaticcancer[J].TumourBiol,2016,37(10):13893–13902.
(收稿日期:2024–01–30)
(修回日期:2024–07–12)
