lncRNA SNHG 15调控miR-95-3p对乳腺癌细胞增殖、凋亡的影响
2024-08-18孙凯廷池益利






[摘要]目的探究长链非编码RNA(longnon-codingRNA,lncRNA)核仁小RNA宿主基因15(smallnucleolarRNAhostgene15,SNHG15)调控微RNA95-3p(microRNA95-3p,miR-95-3p)对乳腺癌细胞增殖、凋亡的影响。方法将乳腺癌细胞分为对照组、敲减组、干扰组、共转染组,体外培养人乳腺癌细胞系MDA-MB-231。测定SNHG15mRNA、miR-95-3pmRNA相对表达量;使用噻唑兰(methylthiazolyldiphenyl-tetrazoliumbromide,MTT)法检测乳腺癌细胞增殖能力;流式细胞仪检测乳腺癌细胞凋亡情况;划痕试验检测乳腺癌细胞迁移能力;Transwell侵袭实验测定乳腺癌细胞侵袭个数;采用Westernblot法测定半胱氨酸蛋白酶3(caspase-3)、B淋巴细胞瘤-2(B-celllymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2associatedXprotein,Bax)相对表达量。结果与对照组比较,敲减组SNHG15mRNA、miR-95-3pmRNA相对表达量及增殖能力、增殖率、迁移能力、侵袭个数、Bcl-2蛋白表达下降;凋亡情况、凋亡率、caspase-3、Bax表达升高(P<0.05)。与敲减组、干扰组比较,共转染组SNHG15mRNA、miR-95-3pmRNA相对表达量及增殖能力、增殖率、迁移能力、侵袭个数、Bcl-2蛋白表达升高;凋亡情况、凋亡率、caspase-3、Bax表达降低(P<0.05)。与干扰组比较,共转染组SNHG15mRNA、miR-95-3pmRNA相对表达量及增殖能力、增殖率、迁移能力、侵袭个数、Bcl-2表达升高,凋亡情况、凋亡率、caspase-3、Bax蛋白表达降低(P<0.05)。结论lncRNASNHG15可通过调控miR-95-3p表达影响乳腺癌细胞的增殖与凋亡,与乳腺癌细胞的发生、发展呈正相关。
[关键词]长链非编码核仁小RNA宿主基因15;长链非编码RNA;微小RNA95-3p;乳腺癌;增殖;凋亡
[中图分类号]R737.9[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.21.013
EffectoflncRNASNHG15inregulatingmiR-95-3pontheproliferationandapoptosisofbreastcancercells
SUNKaiting,CHIYili
OncologyDepartment,WenzhouHospitalofIntegratedTraditonalChineseandWesternMedicine,Wenzhou325000,Zhejiang,China
[Abstract]ObjectiveToexploretheeffectoflongnon-codingRNA(longnon-codingRNA,lncRNA)smallRNAhostgene15(smallnucleolarRNAhostgene15,SNHG15)regulatingmicroRNA95-3p(miR-95-3p)onbreastcancercellproliferationandapoptosis.MethodsBreastcancercellsweredividedintocontrolgroup,knockdowngroup,interferencegroupandco-transfectiongroup.HumanbreastcancercelllineMDA-MB-231wasculturedinvitro.MeasuretherelativeexpressionlevelsofSNHG15mRNAandmiR-95-3pmRNA;Methylthiazolyldiphenyl-tetrazoliumbromide(MTT)wasusedtodme5kf1uzPyFZ9rWlD99Xwg==etecttheproliferationabilityofbreastcancercells;Theapoptosisofbreastcancercellswasdetectedbyflowcytometry;Themigrationabilityofbreastcancercellswasdetectedbyscratchtest;Transwellinvasiontestwasusedtomeasurethenumberofbreastcancercellsinvaded;Westernblotwasusedtodeterminetherelativeexpressionlevelsofcaspase-3,B-celllymphoma-2(Bcl-2),andBcl-2associatedXprotein(Bax).ResultsComparedwithcontrolgroup,therelativeexpressionlevelofSNHG15mRNAandmiR-95-3pmRNA,proliferationability,proliferationrate,migrationability,numberofinvasion,Bcl-2proteinexpressionweredecreased,buttheapoptosisstatus,apoptosisrate,caspase-3andBaxexpressionwereincreasedinknockdowngroup(P<0.05).Comparedwithknockdowngroupandinterferencegroup,therelativeexpressionlevelofSNHG15mRNAandmiR-95-3pmRNA,proliferationcapacity,proliferationrate,migrationcapacity,numberofinvasion,Bcl-2proteinexpressionwereincreased,butapoptosisstatus,apoptosisrate,caspase-3andBaxexpressionweredecreasedinco-transfectiongroup(P<0.05).Comparedwithinterferencegroup,therelativeexpressionlevelofSNHG15mRNAandmiR-95-3pmRNA,proliferationability,proliferationrate,migrationability,numberofinvasion,Bcl-2proteinexpressionwereincreased,butapoptosisstatus,apoptosisrate,caspase-3andBaxexpressionweredecreasedinco-transfectiongroup(P<0.05).ConclusionlncRNASNHG15canaffecttheproliferationandapoptosisofbreastcancercellsbyregulatingmiR-95-3pexpression,andispositivelyassociatedwiththeoccurrenceanddevelopmentofbreastcancercells.
[Keywords]Longnon-codingnucleolarsmallRNAhostgene15;Longnon-codingRNA;microRNA95-3p;Breastcancer;Proliferation;Apoptosi
乳腺癌是女性肿瘤中最常见的恶性肿瘤,发病率逐年上升,为现阶段严重威胁女性生命安全的疾病之一,因此,寻求治疗乳腺癌的有效靶点非常重要[1]。长链非编码RNA(longnon-codingRNA,lncRNA)核仁小RNA宿主基因15(smallnucleolarRNAhostgene15,SNHG15)在多种恶性肿瘤中呈高表达状态,具有一定的促癌作用,但目前对其在乳腺癌中的表达研究较少[2]。miRNA是一种新发现的微小单链RNA,通过转录调控基因表达[3]。研究表明miRNA对乳腺癌的发生发展起重要作用,微RNA95-3p(microRNA95-3p,miR-95-3p)在乳腺癌中呈高表达状态,具有促癌作用[4]。随着患者病情的加重,miR-95-3p表达量增高,下调表达后,可使瘤细胞的增殖侵袭能力下降,调控凋亡情况,但具体机制尚未明确[5]。基于此,本文将研究lncRNASNHG15调控miR-95-3p对乳腺癌细胞增殖、凋亡的影响。
1材料与方法
1.1材料
1.1.1研究对象人乳腺癌细胞系MDA-MB-231购自美国ATCC细胞库。本研究经温州市中西医结合医院伦理委员会审批通过(伦理审批号:2023-L087)。
1.1.2实验试剂SNHG15抑制剂、SNHG15、miR-95-3p转染试剂购自南通百奥迈科生物技术有限公司(批号:210823、220114、211216);胎牛血清RPMI1640培养液、Lipofectamine2000试剂盒、噻唑兰(Methylthiazolyldiphenyl-tetrazoliumbromide,MTT)溶液购自武汉普诺赛生命科技有限公司(批号:201225、211118、210412);TRIzol试剂盒、逆转录试剂盒购自上海恒远生物有限公司(批号:220826、210925);结晶紫染色液购自厦门海标科技有限公司(批号:211125);Matrigel凝胶购自上海钰博生物科技有限公司(批号:220112);BCA蛋白定量试剂盒购自上海酶联生物科技有限公司(批号:211215);半胱氨酸蛋白酶3(caspase-3)、B淋巴细胞瘤-2(B-celllymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2associatedXprotein,Bax)抗体、标记的免疫球蛋白(immunoglobulinG,IgG)购自美国GeneCopoeia公司(批号:210817、221105、201214、191214)。
1.1.3仪器设备CO2培养箱购自松下健康医疗器械(上海)有限公司;流式细胞仪购自常州必达科生物科技有限公司;PCR仪购自北京中西华达科技有限公司;光学显微镜购自上海广密公司;Transwell小室购自美国Corning公司。
1.2方法
1.2.1细胞培养分组转染方法将人乳腺癌细胞系MDA-MB-231复苏后,放置于含有10%胎牛血清RPMI1640培养液中,需在37℃、95%湿度饱和、5%体积分数CO2培养箱内常规培养。当MDA-MB-231进入对数生长期时,将其接种于6孔板内,观察细胞汇合度达到70%进行质粒转染。转染过程需严格按照Lipofectamine2000试剂盒说明书操作,转染过程中将其分为对照组、敲减组、干扰组、共转染组。对照组采用si-NC转染,敲减组采用si-SNHG15抑制剂转染,干扰组采用anti-NC+miR-95-3p转染,共转染组采用si-SNHG15+miR-95-3p转染。各组转染后进行24h的培养。后续所有试验均重复3次,取均值。
1.2.2SNHG15、miR-95-3pmRNA相对表达量检测使用TRIzol试剂盒提取MDA-MB-231细胞总RNA,采用紫外分光光度法检测提取后的总RNA浓度,检查RNA完整性,将总RNA通过逆转录试剂盒进行逆转录反应,得到cRNA,进行定量反转录聚合酶链反应(quantitativereversetranscriptase-mediatedpolymerasechainreaction,qRT-PCR)试验,将Rox、ddH2O、p1、p2、cRNA加入孔内,稀释cRNA,置于PCR仪,上机检测,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)为内参采用2-ΔΔCt方法计算SNHG15、miR-95-3p相对表达量。
1.2.3检测MDA-MB-231增殖能力MDA-MB-231细胞稳定转染后,使用MTT法进行检测,按照密度2×104个/ml放置于96孔板内,将细胞悬液接种于孔内,在CO2培养箱内常规培养,分别于24h、48h、72h时间点,在孔内加入MTT溶液培养4h后,使用DMSO进行显色,观察在波长450nm处的吸光度(opticaldensity,OD)值,以此判断细胞的增殖能力。细胞增殖率=(早期细胞增殖数+晚期细胞增殖数)/总细胞数×100%。
1.2.4检测MDA-MB-231凋亡情况MDA-MB-231细胞稳定转染后,采用流式细胞仪于24h、48h、72h时间点检测MDA-MB-231细胞凋亡情况,使用4%多聚甲醛固定MDA-MB-231细胞1h,在37℃条件下,于H2O2中孵育30min,磷酸缓冲盐溶液(phosphatebufferedsaline,PBS)洗涤,离心后进行细胞计数,调整细胞浓度,加入缓冲液、碘化丙啶(propyliodide,PI)、荧光异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)与膜联蛋白V(annexinV)标记后取细胞悬液,在摇床上避光孵育20min,上机检测。细胞凋亡率=(早期细胞凋亡数+晚期细胞凋亡数)/总细胞数×100%。
1.2.5检测MDA-MB-231迁移能力MDA-MB-231细胞稳定转染后,通过划痕试验检测其迁移能力。在6孔板内,取2×103个细胞培养过夜,移液枪垂直划线,冲洗,分别培养0h、24h取出,观察划痕愈合状态,在显微镜下观察并计算细胞迁移数值。
1.2.6检测MDA-MB-231侵袭个数MDA-MB-231细胞稳定转染后,进行Transwell侵袭实验。在每个Transwell小室底面均匀涂抹纤维连接蛋白,固化。将MDA-MB-231细胞在4℃条件下,于CO2培养箱内Matrigel凝胶过夜,在上、下室分别加入细胞悬液、10%胎牛血清的培养基,培养箱内恒温培养24h,将Transwell小室取出,使用PBS进行清洗,放入乙醇溶液中固定,结晶紫染色液中染色,拭去滤膜上层细胞后在显微镜下观察。
1.2.7测定caspase-3、Bcl-2、Bax蛋白相对表达量MDA-MB-231细胞稳定转染后,使用Westernblot法检测caspase-3、Bcl-2、Bax蛋白相对表达量。使用裂解液进行裂解,分离蛋白后,用BCA法检测蛋白浓度。蛋白经变性后转膜,封闭,加入稀释后的一抗,在4℃条件下,孵育过夜;加入二抗,孵育1h;使用增强化学发光法(enhancedchemiluminescence,ECL)发光显影,检测蛋白;以GAPDH为参照,计算蛋白表达量。
1.3统计学方法
采用SPSS19.0统计学软件对数据进行处理分析。用Kolmogorov-Smirnov检验数据是否符合正态分布,符合正态分布的计量资料以均数±标准差(![]() )表示,组间两两比较采用独立t检验,计量资料多组间比较采用F检验,P<0.05为差异有统计学意义。
)表示,组间两两比较采用独立t检验,计量资料多组间比较采用F检验,P<0.05为差异有统计学意义。
2结果
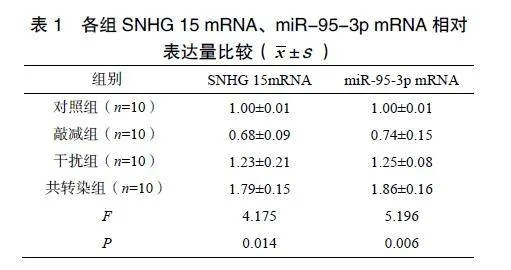
2.1各组SNHG15mRNA、miR-95-3pmRNA相对表达量比较
与对照组相比,敲减组SNHG15mRNA、miR-95-3pmRNA相对表达量降低,干扰组、共转染组SNHG15mRNA、miR-95-3pmRNA相对表达量升高,差异有统计学意义(P<0.05);与敲减组、干扰组相比,共转染组SNHG15mRNA、miR-95-3pmRNA相对表达量升高,差异有统计学意义(P<0.05),见表1。
2.2各组MDA-MB-231增殖能力比较
与对照组相比,敲减组增殖能力降低,干扰组、共转染组增殖能力升高,差异有统计学意义(P<0.05);与敲减组、干扰组相比,共转染组增殖能力升高,差异有统计学意义(P<0.05),见表2;各组细胞的增殖情况见图1。
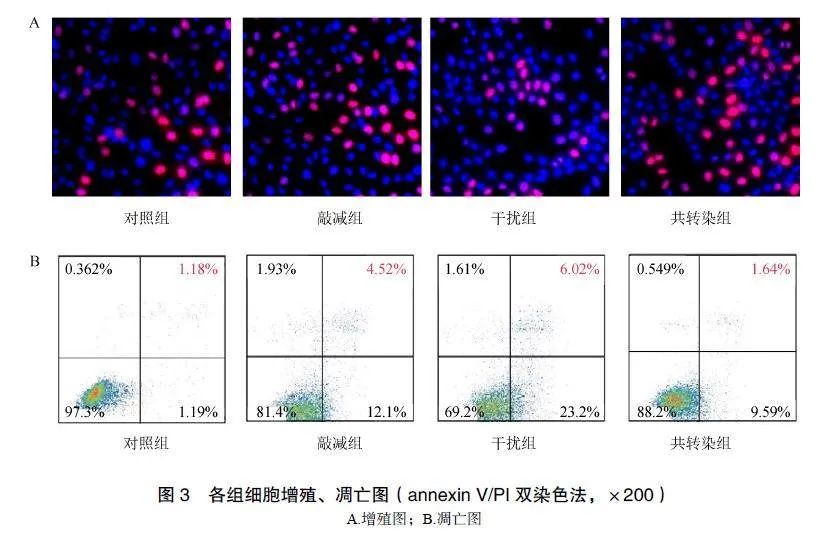
2.3各组MDA-MB-231细胞凋亡情况比较
与对照组相比,敲减组MDA-MB-231细胞凋亡数升高,干扰组、共转染组凋亡数降低,差异有统计学意义(P<0.05);与敲减组、干扰组相比,共转染组凋亡数降低,差异有统计学意义(P<0.05),见表3;各组细胞凋亡情况见图2。
2.4各组MDA-MB-231细胞增殖率、凋亡率比较
与对照组相比,敲减组MDA-MB-231细胞增殖率降低,凋亡率升高,干扰组、共转染组增殖率升高,凋亡率降低,差异有统计学意义(P<0.05);与敲减组、干扰组相比,共转染组增殖率升高,凋亡率降低,差异有统计学意义(P<0.05),见表4;各组细胞增殖、凋亡情况比较见图3。
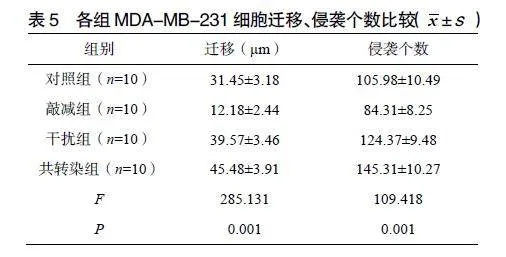
2.5各组MDA-MB-231细胞迁移、侵袭能力比较
与对照组相比,敲减组MDA-MB-231细胞迁移、侵袭个数降低,干扰组、共转染组迁移、侵袭个数升高,差异有统计学意义(P<0.05);与敲减组、干扰组相比,共转染组MDA-MB-231细胞迁移、侵袭个数升高,差异有统计学意义(P<0.05),见表5;各组细胞迁移、侵袭能力比较见图4。
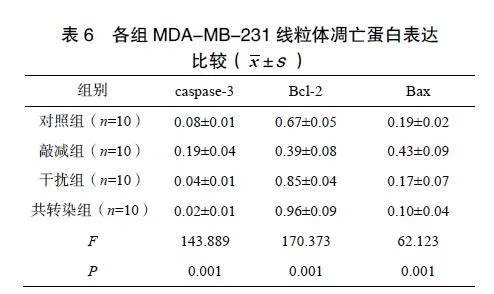
2.6各组MDA-MB-231线粒体凋亡蛋白表达比较
与对照组相比,敲减组caspase-3、Bax蛋白表达升高,Bcl-2蛋白表达降低,干扰组、共转染组caspase-3、Bax蛋白表达降低,Bcl-2蛋白表达升高,差异有统计学意义(P<0.05);与敲减组、干扰组相比,共转染组caspase-3、Bax蛋白表达降低,Bcl-2蛋白表达升高,差异有统计学意义(P<0.05),见表6、图5。
3讨论
乳腺癌是女性第一高发恶性肿瘤,随着生活水平的提高,其发病率逐年提高,其发生诱因多认为与基因、家族等因素有关[6]。但目前尚未明确影响其发展的分子机制,由于对理解乳腺癌的发生不够全面,临床治疗效果并不理想[7]。现已证实lncRNASNHG15与多种癌症的发生发展密切相关,在多种恶性肿瘤中表达异常,如结直肠癌、肺癌、乳腺癌等[8]。本研究认为lncRNASNHG15可能在乳腺癌中具有重要作用,但具体机制尚未阐明,因此,本文通过研究lncRNASNHG15调控miR-95-3p观察对乳腺癌细胞增殖、凋亡的影响,以便对乳腺癌防治进行更有效的临床指导,控制乳腺癌的复发率、致死率,提高预后效果。
目前miR-95-3p在肿瘤中的研究较少,但miR-95-3p在多种恶性肿瘤中表达处于异常状态[9]。miR-95-3p在乳腺癌机体内属于促癌因子,其表达增强可显著提高癌细胞的增殖转移,减少凋亡,增强癌细胞周期的发展[10]。在机体产生癌变时,miR-95-3p可对癌细胞的增长与凋亡进行调控,加快癌细胞的发展速度[11]。本研究进一步探究lncRNASNHG15对乳腺癌细胞增殖、凋亡的影响,结果显示SNHG15mRNA、miR-95-3pmRNA相对表达量出现上调,且对SNHG15mRNA、miR-95-3pmRNA的表达进行分组可知,抑制lncRNASNHG15含量,SNHG15mRNA、miR-95-3pmRNA表达均降低,上调lncRNASNHG15、miR-95-3p,其蛋白含量显著升高。本研究与岳成旭等[12]研究结果一致,表明抑制lncRNASNHG15可降低乳腺癌细胞的增殖能力,促进其凋亡发生。
相关研究指出,lncRNASNHG15可能在转录后发挥调控作用,通过影响下游基因表达,影响癌细胞的增殖与凋亡[13]。本研究发现,lncRNASNHG15与miR-95-3p存在明显的正相关关系,干扰lncRNASNHG15表达后,可显著降低miR-95-3p表达,降低增殖能力,加快癌细胞凋亡;提高lncRNASNHG15、miR-95-3p表达水平,可显著提高乳腺癌细胞增殖率,降低癌细胞凋亡率。由此得出,lncRNASNHG15可能存在对乳腺癌细胞增殖、凋亡的调控,可达到相关研究治疗效果[14]。本研究还证实通过控制lncRNASNHG15、miR-95-3p表达水平可有效调控癌细胞的侵袭、转移,lncRNASNHG15水平降低,乳腺癌细胞迁移能力降低、侵袭个数减少;lncRNASNHG15水平升高,其迁移能力升高、侵袭个数增多。在lncRNASNHG15高水平情况下,miR-95-3p含量也呈现高表达状态[15]。
caspase-3、Bax、Bcl-2参与癌细胞凋亡过程并发挥关键作用[16]。caspase-3表达水平升高可促进癌细胞凋亡[17];Bax促进癌细胞凋亡,Bcl-2抑制癌细胞凋亡,二者对癌细胞的生存发展具有重要作用[18-19]。研究结果显示caspase-3、Bax、Bcl-2蛋白在乳腺癌细胞中均呈现异常状态,敲减lncRNASNHG15水平可明显提高caspase-3、Bcl-2水平,降低Bax水平,加快癌细胞凋亡;提高lncRNASNHG15水平可导致caspase-3、Bcl-2水平降低,Bax水平升高,降低癌细胞凋亡,使癌细胞得以发展。本研究与吴坤琳等[20]研究具有一致性,表明caspase-3、Bax、Bcl-2可对乳腺癌细胞的增殖、凋亡产生重要影响。
综上,lncRNASNHG15通过调控miR-95-3p表达对乳腺癌细胞的增殖、凋亡产生影响,敲减lncRNASNHG15可降低乳腺癌细胞增殖能力、提高凋亡率,明确lncRNASNHG15、miR-95-3p与癌细胞的正相关关系,可进一步明确lncRNASNHG15在乳腺癌细胞中的作用,为临床治疗乳腺癌提供一定依据。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 赵国强,张彤,刘雅楠,等.基因检测技术在乳腺癌中的辅助治疗应用[J].分子诊断与治疗杂志,2023,15(6):909–912,917.
[2] 张文娟,戴婷丽,李沛.lncRNASNHG15通过调控miR-942-5p表达减轻Aβ25-35诱导的PC12细胞氧化应激和细胞凋亡的研究[J].国际检验医学杂志,2023,44(23):2880–2885.
[3] 尹阳,孙巨军,李越,等.基于TCGA数据库筛选微小RNA(miRNA)用于原发性乳腺癌早期诊断的生物信息学分析[J].现代检验医学杂志,2021,36(5):33–37.
[4] 张伟,彭燕琪,费思佳,等.miR-95-3p通过上调MAPK15调控三阴性乳腺癌的增殖及凋亡[J].西安交通大学学报(医学版),2020, S6LuNzbNH/TZj3KRiF7JZg==;41(6):896–900.
[5] 曾省都,钟斌,唐晓媛.Circ-WHSC1通过靶向miR-95-3p上调真核起始因子3B的表达促进非小细胞肺癌细胞增殖的机制研究[J].临床医药实践,2022,31(10):758–764.
[6] 孙天纬,谭启杏,韦长元.预测乳腺癌预后的免疫相关基因对特征的开发和验证[J].中国免疫学杂志,2023,39(4):816–821.
[7] 刘婧思,陈久安,孙洁,等.DNA损伤修复基因胚系突变乳腺癌新辅助化疗疗效分析[J].中国肿瘤临床,2023,50(10):497–503.
[8] TANYT,LINJF,LIT,etal.lncRNA-mediatedposttranslationalmodificationsandreprogrammingofenergymetabolismincancer[J].CancerCommun(Lond),2021,41(2):109–120.
[9] XIM,CHENGL,HUAW,etal.MicroRNA-95-3ppromotedthedevelopmentofprostaticcancerviaregulatingDKK3andactivatingWnt/β-cateninpathway[J].EurRevMedPharmacolSci,2019,23(3):1002–1011.
[10] NIQ,ZHANGY,TAOR,etal.MicroRNA-95-3pservesasacontributortocisplatinresistanceinhumangastriccancercellsbytargetingEMP1/PI3K/AKTsignaling[J].Aging(AlbanyNY),2021,13(6):8665–8687.
[11] FENGS,LUY,SUNL,etal.MiR-95-3pactsasaprognosticmarkerandpromotescervicalcancerprogressionbytargetingVCAM1[J].AnnTranslMed,2022,10(21):1171–1180.
[12] 岳成旭,王文锐,杨清玲,等.lncRNASNHG15通过调控miRNA-451a促进乳腺癌细胞的上皮间质转化研究[J].蚌埠医学院学报,2022,47(4):421–425.
[13] 吴超,王彩星,韩瑜娇,等.lncRNASNHG15靶向miR-153对乳腺癌细胞线粒体途径凋亡的影响[J].中国肿瘤生物治疗杂志,2020,27(10):1087–1092.
[14] 王韵,宋姗,彭斐,等.lncRNASNHG15通过miR-483-3p/DDIT4轴调节非小细胞肺癌细胞的顺铂敏感性和上皮间质转化[J].实用医学杂志,2023,39(5):557–563.
[15] 王秋宇,朱军义,许静,等.lncRNASNHG15对子宫内膜癌细胞增殖及去集蛋白-金属蛋白酶17表达的影响[J].解剖学杂志,2021,44(6):497–501.
[16] 龚飞,吴思明,徐磊,等.17-羟-岩大戟内酯B对人三阴性乳腺癌细胞增殖和凋亡的影响[J].中国药房, 2023,34(12):1415–1421.
[17] 孙颖,刘晓菲,王晓娜,等.阳和化岩汤对乳腺癌癌前病变细胞Fas、caspase-3和caspase-8表达的影响[J].现代中西医结合杂志,2020,29(17):1825–1829.
[18] 顾健坤,马伟斌,姚明,等.右美托咪定对人乳腺癌SKBR-3细胞株MAPK/JNK/Bcl-2信号通路及癌细胞转移、侵袭的影响[J].浙江临床医学,2022,24(2):171–175.
[19] 裴岩岩,李雅,闫春生,等.黄芪甲苷通过Bax/Bcl-2/caspase-3信号通路诱导人乳腺癌MCF-7细胞凋亡的机制研究[J].中药新药与临床药理,2019,30(9):1077–1082.
[20] 吴坤琳,严乾壹,王德星,等.敲减SATB2抑制乳腺癌细胞的增殖、迁移、侵袭和血管生成[J].中国病理生理杂志,2023,39(11):1994–2002.
(收稿日期:2023–12–01)
(修回日期:2024–07–08)
