神经肽S受体基因多态性与原发性失眠的相关性研究
2024-08-18范杰惠培林马薇王旭斌赵媛王金凤陈雪萍苏晓艳郭斌谢宇平




[摘要]目的探讨神经肽S受体(neuropeptideSreceptor,NPSR)基因单核苷酸多态性(singlenucleotidepolymorphism,SNP)位点(rs323917、rs323920、rs323922、rs2530547、rs324957)与原发性失眠(primaryinsomnia,PI)的相关性。方法选取2016年12月至2019年5月在甘肃省人民医院睡眠医学中心门诊就诊并确诊的PI患者157例作为PI组,选取同期133名健康体检者作为对照组。抽取受试者的静脉血标本,并提取DNA、聚合酶链反应(polymerasechainreaction,PCR)扩增、琼脂糖凝胶电泳,目标位点测序对rs323917、rs323920、rs323922、rs2530547、rs324957单核苷酸位点进行基因分型,同时行标准多导睡眠监测,分析基因多态性与PI的相关性。结果两组受试者的NPSRSNP位点(rs323917、rs323920、rs323922、rs2530547)基因型分布和等位基因频率及rs324957等位基因频率的差异均无统计学意义(P>0.05);rs324957位点基因型分布差异有统计学意义(P=0.034);两组受试者不同单倍型频率差异无统计学意义(P>0.05)。结论NPSRrs324957SNP位点基因型表达或与PI相关,且以AG基因型为主。
[关键词]神经肽S;原发性失眠;单核苷酸多肽性
[中图分类号]R749;R596[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.21.001
StudyonthecorrelationbetweenneuropeptideSreceptorgenepolymorphismandprimaryinsomnia
FANJie1,2,HUIPeilin1,2,MAWei1,2,WANGXubin1,2,ZHAOYuan1,2,WANGJinfeng1,2,CHENXueping1,2,SUXiaoyan1,2,GUOBin1,2,XIEYuping1,2
1.CenterofSleepMedicine,GansuProvincialPeople’sHospital,Lanzhou730000,Gansu,China;2.GansuClinicalSleepMedicineResearch Center,Lanzhou730000,Gansu,China
[Abstract]ObjectiveToinvestigatethecorrelationbetweenneuropeptideSreceptor(NPSR)singlenucleotidepolymorphism(SNP)(rs323917,rs323920,rs323922,rs2530547,rs324957)andprimaryinsomnia(PI).MethodsAtotalof157patientsdiagnosedwithPIintheoutpatientdepartmentofCenterofSleepMedicine,GansuProvincialPeople’sHospitalfromDecember2016toMay2019wereselectedasPIgroup,and133healthyphysicalexaminationsubjectsduringthesameperiodwereselectedascontrolgroup.VenousbloodsampleswerecollectedandDNA,polymerasechainreaction(PCR)amplificationandagarosegelelectrophoresiswereextracted.rs323917,rs323920,rs323922,rs2530547,rs324957singlenucleotidelociweregenotypizedbytargetsitesequencing.Meanwhile,standardpolysomnosismonitoringwasperformedtoanalyzethecorrelationbetweengenepolymorphismandPI.ResultsTherewerenosignificantdifferencesinthegenotypedistributionofNPSRSNPsites(rs323917,rs323920,rs323922,rs2530547)andallelefrequencyandrs324957allelefrequencybetweentwogroups(P>0.05).Therewassignificantdifferenceingenotypedistributionofrs324957(P=0.034).Therewasnosignificantdifferenceinthefrequencyofdifferenthaplotypesbetweentwogroups(P>0.05).ConclusionTheexpressionofrs324957SNPgenotypesinNPSRmayberelatedtoPI,andAGgenotypeisdominant.
[Keywords]NeuropeptideS;Primaryinsomnia;Singlenucleotidepolymorphism
失眠是一种常见的睡眠障碍,分为原发性失眠(primaryinsomnia,PI)和继发性失眠。PI几乎以睡眠障碍[难以进入睡眠和(或)难以维持或睡眠后精力不能恢复]为唯一的症状,尽管有足够的睡眠时间,但仍会出现睡眠问题,并导致至少一种相关的日间障碍,影响社交、工作或其他重要领域,每周至少发生3次,持续时间>3个月,并排除由其他心理/精神障碍及躯体疾病、药物或酒精等导致的失眠[1]。关于PI的成因,有研究发现PI患者有家族聚集现象[2]。Beaulieu-Bonneau等[3]对953例成人患者的调查显示,35%的患者至少有一个一级亲属曾罹患或正罹患失眠,提示PI具有遗传特征[4]。神经肽S(neuropeptideS,NPS)及神经肽S受体(neuropeptideSreceptor,NPSR)是最新发现的一种睡眠调节系统,它们可激活下丘脑后部组胺能、食欲素能神经元产生觉醒,这为深入研究失眠的发病机制提供新的思路[5-6]。
本研究通过选择NPSR基因的5个标签单核苷酸多态性(singlenucleotidepolymorphism,SNP)位点rs323917、rs323920、rs323922、rs324957及rs2530547进行基因分型,探讨PI与基因多态性的关系,为PI诊断和治疗提供一定的理论基础。
1资料与方法
1.1一般资料
选取2016年12月至2019年5月在甘肃省人民医院睡眠医学中心门诊就诊并确诊的PI患者157例作为PI组,选择年龄、性别与PI组相匹配且保证两组间无血缘关系的133名健康体检者作为对照组。对两组受试者进行红外线音视频同步记录整夜多导睡眠监测(audioandvideopolysomnosis,AV-PSG),受试者监测当晚不服用睡眠药物,按平时作息时间进入监测室,整夜多导睡眠监测(polysomnosis,PSG)记录的时间不低于7h。多导睡眠图指标包括清醒期(W期)、非快速眼动1期(N1期)、非快速眼动2期(N2期)、非快速眼动3期(N3期)、快速眼动期(R期)。本研究经甘肃省人民医院伦理委员会审批通过(伦理审批号:syll20150043)。所有受试者均签署知情同意书。
病例组纳入标准:①符合《精神障碍诊断与统计手册》[1]第5版的PI诊断标准,至少满足以下1项:a.入睡困难;b.维持睡眠困难,表现为频繁觉醒或醒后难以入睡;c.早醒且不能再入睡。②每周睡眠困难≥3次。③失眠不是因某种物质(如滥用毒品、药物)等导致的生理效应。排除标准:①由其他原因引起的继发性失眠,尤其是根据《中国失眠症诊断和治疗指南》[7]鉴别排除焦虑障碍所致失眠;②有其他严重躯体疾病者,如高血压病、心脏病、甲状腺功能异常、糖尿病等;③有其他明确的失眠原因,如近期有重大心理应激而致失眠者;④不适合量表评估的低龄和高龄人群;⑤PSG结果为主观性失眠患者;⑥PSG结果呼吸暂停低通气指数(apnea-hypopneaindex,AHI)>15次/h者;⑦有与国外种族联姻家族史者;⑧未签署知情同意书者。对照组纳入标准:①年龄、性别与PI组相匹配正常人群;②两组间无血缘关系。
1.2方法
1.2.1SNP位点的选择从美国国立生物技术信息中心(NationalCenterforBiotechnologyInformation,NCBI)SNP数据库及HapMap计划选择NPSR基因功能性SNP。纳入标准:①外显子区能改变氨基酸表达,在中国人群中最小等位基因频率>5%;②在非翻译区,中国人群中最小等位基因频率>5%;③在5'启动子2kb内,中国人群中最小等位基因频率>5%。共得到13个标签SNP,本研究选择5个标签SNP位点。
1.2.2标本采集和DNA提取采集受试者外周静脉血2ml用以提取DNA。
1.2.3引物设计及合成5个SNP位点的引物序列5个SNP位点的引物序列见表1。
1.2.4聚合酶链反应(polymerasechainreaction,PCR)扩增目的片段将扩增产物送往博淼生物科技(北京)有限公司进行测序,测序结果用chromas软件进行分析处理。
1.3统计学方法
采用SPSS22.0统计学软件对数据进行处理分析。符合正态分布的计量资料以均数±标准差(![]() )表示,组间比较采用t检验,计数资料以例数(百分率)[n(%)]表示,比较采用c2检验;采用SHEsis软件在线检测基因型频率是否符合Hardy-Weinberg平衡(Hardy-Weinbergequilibrium,HWE)检验,单倍型分析及连锁不平衡检验分析5个标签SNP是否具有独立代表意义;行×列表c2检验比较组间单个基因型及等位基因频率。P<0.05为差异有统计学意义。
)表示,组间比较采用t检验,计数资料以例数(百分率)[n(%)]表示,比较采用c2检验;采用SHEsis软件在线检测基因型频率是否符合Hardy-Weinberg平衡(Hardy-Weinbergequilibrium,HWE)检验,单倍型分析及连锁不平衡检验分析5个标签SNP是否具有独立代表意义;行×列表c2检验比较组间单个基因型及等位基因频率。P<0.05为差异有统计学意义。
2结果
2.1两组受试者的一般资料比较
两组受试者的性别、年龄、体质量指数(bodymassindex,BMI)比较,差异无统计学意义(P>0.05);睡眠效率、总睡眠时间、睡眠持续时间、睡眠觉醒次数、N1期占比、N2期占比、N3期占比、R期占比比较,差异有统计学意义(P<0.001),见表2。
2.2HWE检验
本研究所选取的5个标签SNP位点已在HapMap中国汉族人群基因数据库中进行连锁不平衡筛查,为防止偏倚,对入选的5个标签SNP再次进行HWE检验,结果显示P>0.05,5个SNP位点基因型符合HWE,样本具有群体代表性。
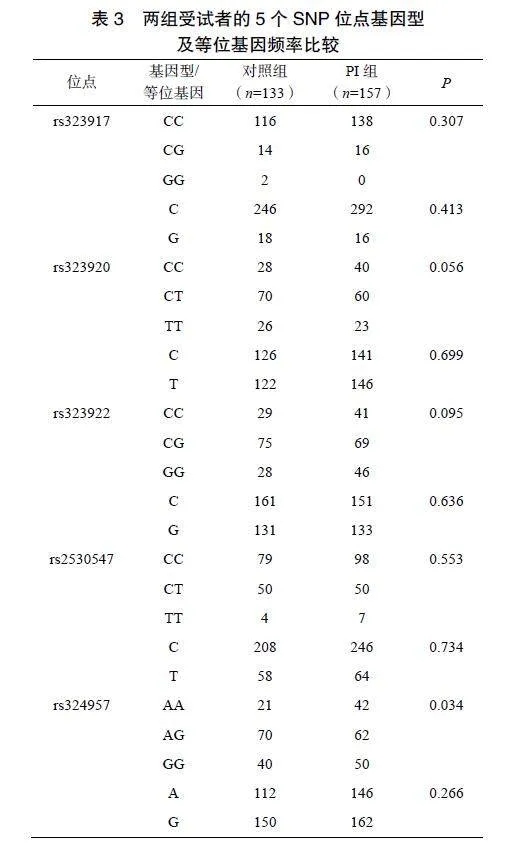
2.3两组受试者的5个SNP位点基因型和等位基因频率分布
两组受试者的rs323917、rs323920、rs323922、rs2530547位点基因型分布和等位基因频率及rs324957等位基因频率的差异均无统计学意义(P>0.05);rs324957位点基因型分布差异有统计学意义(P=0.034);两组受试者不同单倍型频率差异无统计学意义(P>0.05),见表3。
2.45个SNP位点连锁不平衡检验分析
应用基于最大似然算法的SHEsis软件进行连锁不平衡检验分析,发现由rs323920-rs323922构成的单倍型高度连锁(D'>0.9,r2>0.8),见图1和图2。
2.5两组受试者的5个SNP位点组成的常见单倍型频率比较
同样应用基于最大似然算法的SHEsis软件进行单倍型推断,比较两组受试者不同单倍型频率的差异。两组受试者5个标签SNP位点组成的常见单倍型(单倍型频率>5%)有7种,P>0.05,见表4。
3讨论
NPS是一种新型的20种氨基酸肽,主要在中枢神经系统和内分泌组织中表达,NPS与NPSR特异性结合,是一种G蛋白偶联受体[8]。NPSR前体mRNA在中枢神经系统中广泛表达,包括大鼠的运动皮质、梨状皮质、前嗅核、丘脑、下丘脑、杏仁核及海马结构下托复合体等[9]。NPSR的广泛分布暗示NPS-NPSR系统在多种生理活动中发挥重要的调节作用[10]。动物研究表明,NPS-NPSR系统具有明显的促觉醒作用,主要表现为延长睡眠潜伏期、减少觉醒向慢波睡眠的转换次数、相应增加觉醒时间、缩短慢波睡眠和快速眼动睡眠时间[11-12]。研究表明将NPS输注到双侧前下丘脑,包括腹外侧视前区(ventrolateralpreopticarea,VLPO)可显著增加清醒发作的持续时间,并特别减少非快速眼动睡眠,这表明NPS通过抑制VLPO中促进睡眠的神经元诱导清醒[13]。NPSR的基因突变抑制啮齿类动物的睡眠,然而,睡眠需求依然存在,这些动物没有表现出与睡眠障碍相关的记忆障碍[14]。以上结果表明NPS的促醒作用在不同物种之间是一致的。总之,基于NPS-NPSR与睡眠相关性基础研究结论已较为一致,但关于NPSR基因研究较少,目前关于研究多态性位点与PI的致病机制尚无统一定论,少量研究显示NPSR基因的突变可导致人类原发性失眠,SNP变异导致人类睡眠变化[15]。以往研究证明遗传因素是睡眠障碍的主要因素之一;双胞胎研究表明睡眠特征和失眠有遗传基础[17];PI患者的一级亲属患失眠的风险增加6.65倍[16-17];成人自我报告睡眠时间和失眠的遗传率分别为0.25%~0.44%和0.22%~0.59%[18-19]。尽管有证据表明存在相当大的遗传成分(遗传率为38%~59%),但迄今为止,只有少数遗传基因座可调节失眠的风险[20]。针对失眠主诉(n=113006)的全基因组关联研究证明其多基因结构,并涉及3个全基因组显著性基因座和7个基因[21-22]。
本研究团队前期关于NPSR基因多态性和原发性失眠之间关联的研究结果表明,两种不同的等位基因组合(CATGTC和GCCAAT)可能是原发性失眠的致病因素[23]。NPS基因多态性rs323920位点和rs324957位点可能是原发性失眠的易感基因位点,NPSR-SNP位点CACGGTCCCCAGC单倍型组合为原发性失眠人群的危险基因[24];而笔者通过对NPSR基因的5个SNP位点进一步研究,发现4个位点基因型分布和等位基因频率及rs324957等位基因频率差异均无统计学意义,但rs324957基因型分布差异有统计学意义,在PI患者中rs324957位点基因型以AG型为主,因此NPSR基因rs324957位点多态性可能与PI具有相关性,即本研究进一步证实NPSR基因多态性rs324957与汉族PI的关系,发现NPSR基因多态性rs324957的等位基因和基因型频率分布在PI组与对照组之间及两组不同性别间的显著差异,支持rs324957SNP是PI易感位点的假设。
综上所述,本研究在前期研究基础上进一步发现NPSR基因多态性SNP位点rs324957与PI之间的相关性,但仍需高质量、大样本量的研究进一步验证。未来通过增加样本量对NPSR基因位点进行筛选及研究,有望进一步丰富PI发生机制与基因多态性之间的关系,从而指导临床。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 美国精神医学学会.精神障碍诊断与统计手册[M].5版.张道龙译.北京:北京大学出版社,2014.
[2] STEINMB,MCCARTHYMJ,CHENCY,etal.Genome-wideanalysisofinsomniadisorder[J].MolPsychiatry,2018,3(11):2238–2250.
[3] BEAULIEU-BONNEAUS,LEBLANCM,MÉRETTEC,etal.Familyhistoryofinsomniainapopulation-basedsample[J].Sleep,2007,30(12):1739–1745.
[4] WATSONNF,GOLDBERGJ,ARGUELLESL,etal.Geneticandenvironmentalinfluencesoninsomnia,daytimesleepinessandobesityintwins[J].Sleep,2006,29(5):645–649.
[5] XUYL,REINSCHEIDRK,HUITRON-RESENDIZS,etal.NeuropeptideS:Aneuropeptidepromotingarousalandanxiolytic-likeeffects[J].Neuron,2004,43(4):487–497.
[6] 侯一平,王灿,谢宇平,等.神经肽S对睡眠觉醒的调节[J].兰州大学学报:医学版,2014,40(4):79–85,92.
[7] 中国睡眠研究会.中国失眠症诊断和治疗指南[J].中华医学杂志,2017,97(24):1844–1856.
- XINGL,ZOUX,YINC,etal.DiverserolesofpontineNPS-expressingneuronsinsleepregulation[J].ProcNatlAcadSciUSA,2024,121(9):e2320276121.
- SHENYC,SUNX,LIL,etal.Rolesofneuropeptidesinsleep-wakeregulation[J].IntJMolSci,2022,23(9):4599.
- SHAOYF,WANGC,XIEJF,etal.NeuropeptideSamelioratesolfactoryspatialmemoryimpairmentinducedbyscopolamineandMK801throughactivationofcognatereceptor-expressingneuronsinthesubiculumcomplex[J].BrainStructFunct,2016,221:3327–3336.
- CASELLOSM,FLORESRJ,YARURHE,etal.Neuropeptidesystemregulationofprefrontalcortexcircuitry:Implicationsforneuropsychiatricdisorders[J].FrontNeuralCircuits,2022,16:796443.
- ZHAOP,SHAOYF,ZHANGM,etal.NeuropeptideSpromoteswakefulnessthroughactivationoftheposteriorhypothalamichistaminergicandorexinergicneurons[J].Neuroscience,2012,207:218–226.
- CHAUVEAUF,CLAVERIED,LARDANTE,etal.NeuropeptideSpromoteswakefulnessthroughtheinhibitionofsleep-promotingventrolateralpreopticnucleusneurons[J].Sleep,2020,43(1):zsz189.
- AHNAOUA,DRINKENBURGWH.Neuropeptide-Sevokedarousalwithelectroencephalogramslow-wavecompensatorydriveinrats[J].Neuropsychobiology,2012,65(4):195–205.
- SPADAJ,SANDERC,BURKHARDTR,etal.GeneticassociationofobjectivesleepphenotypeswithafunctionalpolymorphismintheneuropeptideSreceptorgene[J].PLoSOne,2014,9(6):e98789.
- EHLENJC,JONESKA,PINCKNEYL,etal.MaternalUbe3alossdisruptssleephomeostasisbutleavescircadianrhythmicitylargelyintact[J].JNeurosci,2015,35:13587–13598.
- TICKB,BOLTONP,HAPPEF,etal.Heritabilityofautismspectrumdisorders:AMeta-analysisoftwinstudies[J].JChildPsycholPsychiatry,2016,57:585–595.
- LINDMJ,PHILIPRG.Geneticpathwaystoinsomnia[J].BrainSci,2016,6(4):64.
- YAMAZAKIEM,GOELN.Geneticsofcircadianandsleepmeasuresinadults:Implicationsforsleepmedicine[J].CurrSleepMedRep,2020,6(1):32–45.
