1株野生高效纤维素降解菌筛选、鉴定其酶活力测定
2024-08-14廖凯肖畑颜健红郑慧新敬媛蓉刘秀倪弦之金晨钟郭开发

摘 要:为从腐熟的土壤中分离出产纤维素酶的细菌,并进一步研究该菌株的纤维素降解能力。采用羧甲基纤维素 (CMC)-刚果红染色法,筛选出 1 株野生纤维素降解菌 ZG2-3,采用 16S rRNA 分子鉴定其种类,同时从促腐剂中筛选出 4 株商品纤维素降解菌,比较野生纤维素降解菌与商品纤维素降解菌的酶活差异。结果表明:从娄底市珠山公园桂花树林下腐熟的土壤中采集分离,通过羧甲基纤维素 (CMC)-刚果红染色法,筛选得到了纤维素降解能力较高的 1 株细菌 ZG2-3。经鉴定 ZG2-3为枯草芽孢杆菌 Bacillus subtilis。ZG2-3 的羧甲基纤维素酶 (CMCase) 活力和滤纸酶 (FPA) 活力分别为 0.054 IU·mL−1 和 0.02 IU·mL−1,其中 ZG2-3 的 CMCase 活力显著高于商品纤维素降解菌。
关键词:纤维素;枯草芽孢杆菌;筛选;鉴定;酶活力
中图分类号:S141.4 文献标志码:A
文章编号:0253−2301(2024)05−0016−04
DOI: 10.13651/j.cnki.fjnykj.2024.05.003
Screening and Identification of a Wild Cellulose-degrading Strain with High Efficiency and Determination of Its Enzyme Activity
LIAO Kai1,XIAO Tian1,YAN Jian-hong2,ZHENG Hui-xin1,JING Yuan-rong1,LIU Xiu1, NI Xian-zhi1,JIN Chen-zhong1,GUO Kai-fa1 *
(1. Key Laboratory of Green Prevention and Control for Pests, Hunan University of Humanities and Technology,Loudi, Hunan 417000, China; 2. Loudi Bureau of Agriculture and Rural Affairs, Loudi, Hunan 417000, China)
Abstract: In order to isolate cellulase-producing bacteria from the overrotten soil and further study the cellulose degradation ability of the strain, a wild cellulose-degrading strain ZG2-3 was screened by using the carboxymethyl cellulose (CMC) - congo red staining method. Then, the 16 S rRNA molecular identification was used to identify the species, and four commercial cellulose-degrading bacteria strains were screened from the promoting-decomposing agent. Last, the enzyme activity differences between the wild cellulose-degrading bacteria and the commercial cellulose-degrading bacteria were compared. The results showed that one strain of bacteria with high cellulose degradation ability, ZG2-3, was screened by using the carboxymethyl cellulose (CMC) - congo red staining method,which was collected and isolated from the overrotten soil under the osmanthus forest in Zhushan Park, Loudi City.ZG2-3 was identified as Bacillus subtilis. The carboxymethyl cellulase (CMCase) activity and filter paper enzyme(FPA) activity of ZG2-3 were 0.054 IU·mL−1and 0.02 IU·mL−1, respectively, and the CMCase activity of ZG2-3 was significantly higher than that of the commercial cellulose-degrading bacteria.
Key words: Cellulose;Bacillus subtilis;Screening;Identification;Enzyme activity
木质纤维素是一种广泛存在于自然界中的、由葡萄糖组成的天然多聚糖[1],在人类社会中主要以蔬菜渣、水果渣、农作物秸秆和中药渣等废弃物形式存在[2−5]。纤维素是一种分布广泛、存量巨大、可再生的物质资源,可以作为生产生物燃料和生物化学品的原材料[6],而纤维素的降解是其能够充分被利用的关键环节之一[7]。目前,运用微生物降解纤维素是一条有效的途径[8],虽然细菌的纤维素酶分泌能力普遍不及真菌、放线菌,但细菌繁殖快,具有很大的纤维素降解能力[9]。因而筛选高效纤维素降解细菌是微生物降解纤维素的关键。
本研究从娄底珠山公园土壤中,通过羧甲基纤维素 (CMC)-刚果红染色法,分离筛选高产纤维素酶的菌株,以革兰氏染色和 16S rRNA 生物学手段对其进行鉴定,并与促腐剂中商品纤维素降解菌的透明圈直径 (D) 和菌落直径 (d) 比值、羧甲基纤维素酶 (CMCase) 活力和滤纸酶 (FPA) 活力进行比较分析,为纤维素降解菌对纤维素类废弃物资源化利用研究提供了理论和参考价值。
1 材料与方法
1.1 试验材料
1.1.1菌种来源 野生纤维素降解菌采集于娄底市珠山公园多年自然生长桂花树林下腐熟的土壤。商品纤维素降解菌来源于促腐剂(鹤壁市人元生物技术发展有限公司)。
1.1.2培养基 (1)筛选培养基:羧甲基纤维素钠(CMC-Na)2.00 g·L−1、NaCl 0.50 g·L−1、(NH4)2SO43.00 g·L−1、 K2HPO40.50 g·L−1、 MgSO4·7H2O 0.50g·L−1、琼脂 20.00 g·L−1、蒸馏水 1 000 mL,121℃灭菌 30 min。(2)富集培养基:Whatman 滤纸条10g·L−1、 NaNO3 3.00 g·L−1、 CaCl2 0.20 g·L−1、K2HPO40.50 g·L−1、NaCl 0.20 g·L−1、MgSO4·7H2O0.50 g·L−1、蒸馏水 1 000 mL,121℃ 灭菌 30 min。(3)发酵产酶培养基:CaCl2 0.20 g·L−1、酵母粉1.00 g·L−1、(NH4)2SO4 1.50 g·L−1、蛋白胨 2.50g·L−1 、 KH2PO4 3.00 g·L−1、 MgSO4·7H2O 0.50g·L−1,蒸馏水 1 000 mL,121℃ 灭菌 30 min。
1.2 试验方法
1.2.1纤维素降解菌的富集、分离与纯化 将土壤样品粉碎除杂后,称量 2.00 g 土壤样品于无菌环境下放入富集培养基中, 37℃、180 r·min−1 培养。待富集培养基中滤纸条完全崩解,取培养后的富集培养基,加灭菌后的蒸馏水配成 10−4、10−5 、10−6 稀释液,取稀释液 150 μL 均匀涂布到筛选培养基上,37℃ 恒温培养,随机挑选长出的单菌落转接到新鲜的筛选培养基纯化 3 次。
商品纤维素降解菌的富集、分离与纯化方法同上。
1.2.2纤维素降解菌的筛选 将纯化后的菌株点接至筛选培养基平板,于 37℃ 恒温培养 3 d。用1.00% 的刚果红溶液染色长有菌株的筛选培养基平板 45 min,再用 1 mol·L−1NaCl 溶液脱色 45 min,观察染色并脱色后的透明圈大小[10]。采用十字交叉法测量透明圈直径 ( D)和菌落直径 ( d),并通过其比值(D/d)初步判定其纤维素降解能力[11],选取比值大的菌株进行斜面保存。
1.2.3纤维素降解菌株的鉴定 革兰氏染色:将纤维素降解菌株接种到筛选培养基,于 37℃ 培养2 d,观察菌落培养特征,进行革兰氏染色。
分子生物学鉴定:提取纤维素降解菌 DNA,利 用 细 菌 通 用 引 物 7F: 5'-C AGAGTTTGATCC TGGCT-3'和 1540R: 5'-AGGAGGTGATCCAGCC GCA-3'对菌株 16S rDNA 序列进行扩增。PCR 反应条件:95℃ 预变性 4 min;95℃ 变性 30 s,56℃退火 30 s,72℃ 延伸 90 s,循环 30 次后,于 72℃下最后延伸 10 min。将扩增产物送至生工生物工程(上海)股份有限公司进行测定,将测序结果在NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中进行 BLAST 比对分析,使用 MEGA7 软件构建系统发育树,确定菌株的种属。
1.2.4纤维素降解菌酶活的测定 纤维素酶活的测定:酶活力为在相应条件下,1 mL 粗酶液每分钟水解相应的底物,产生相当于 1 μmol 葡萄糖的还原糖量,定义为 1 个酶活力单位,表示为 IU·mL−1[12]。
粗酶液的制备:挑选透明圈直径 ( D)和菌落直径 ( d)比值大的菌株的单菌落接入发酵产酶培养基中,于摇床恒温 37℃、180 r·min−1 培养 2 d,最后 6 000 r·min−1 离心 15 min,得到粗酶液。
采用 DNS 比色法,分别测定纤维素降解菌粗酶 液 中 纤 维 素 内 切 酶 ( CMCase) 和 滤 纸 酶(FPA)的活性[13]。
1.3 数据分析
使用 Excel 2021 软件整理数据,使用 SPSS26.0 软件进行统计分析,采用单因素方差分析( ANOVA) 和 最 小 显 著 性 差 异 法 配 对 比 较(LSD 检验),试验结果以“平均数±标准差”的形式表示。
2 结果与分析
2.1 纤维素降解菌的富集、分离与纯化
土壤样品经富集培养基培养,将富集培养基稀释后涂布到筛选培养基上,纯化后共得到 7 株野生纤维素降解菌,从促腐剂共得到 4 株纤维素降解菌。
2.2 纤维素降解菌的筛选
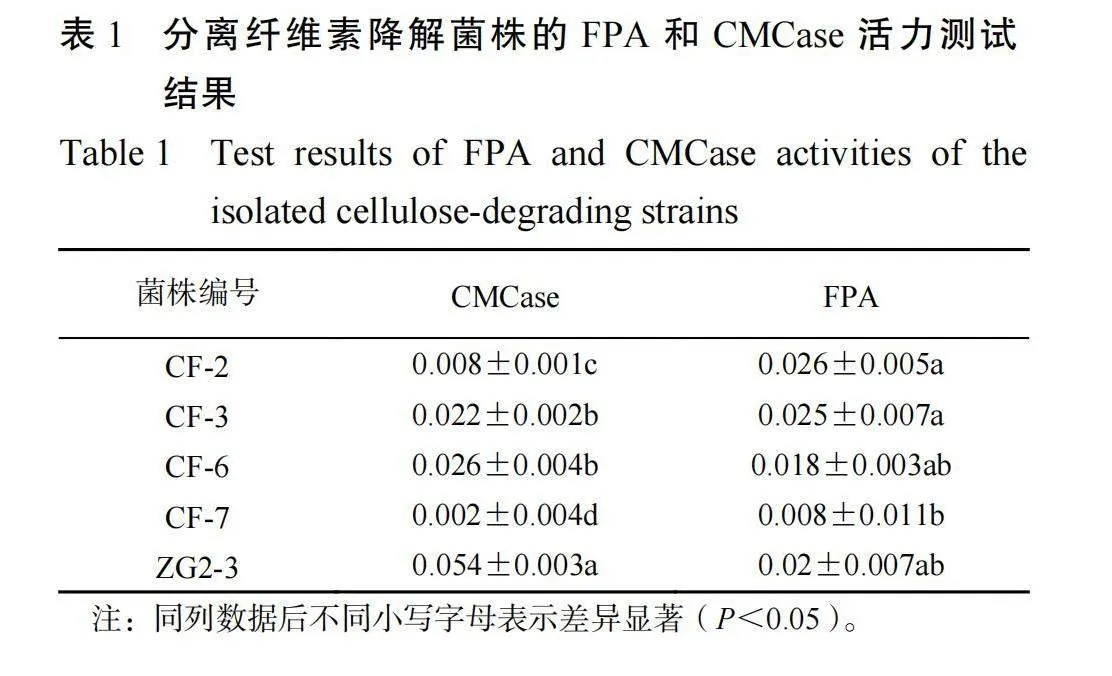
CMC−Na 为底物的培养基并结合刚果红染色-透明圈的方法对纤维素降解细菌进行筛选,经刚果红染色和 NaCl 脱色筛选出了 1 株野生纤维素降解菌 ZG2-3 ,D/d 值为 2.57±0.157,4 株商品纤维素降解菌 CF-2 、 CF-3 、 CF-6 和 CF-7 的 D/d 值依次为 3.223±0.857、3.223±0.857、2.517±0.276 和2.303±0.211,其中菌株 ZG2-3 D/d 值显著高于CF-7 ,与其他菌株无显著性差异(P<0.05)。
2.3 菌株 ZG2-3 的分子鉴定
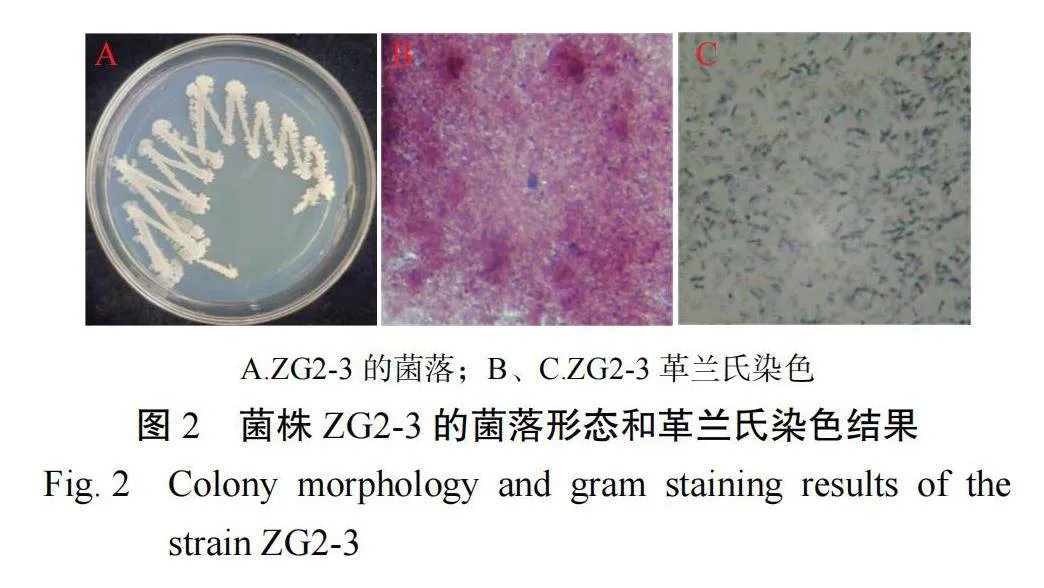
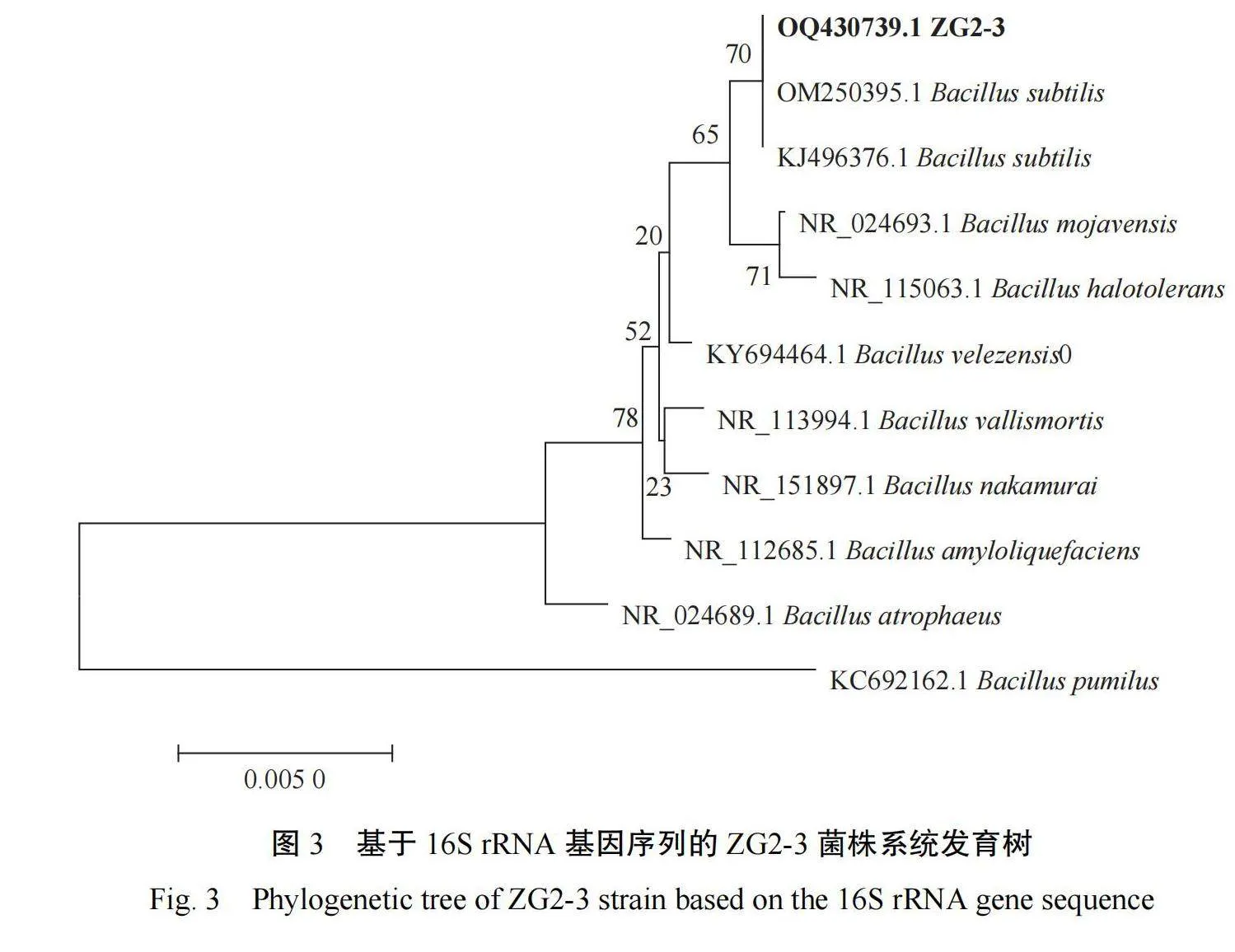
在筛选培养基上培养 2 d,菌株 ZG2-3 菌落呈灰白色,边缘锯齿状,表面较不光滑,干燥(图 1-A);经革兰氏染色后为紫红色,为革兰氏阳性杆菌 (图 2-B 和 2-C)。进一步 DNA 提取、PCR 扩增后获得长度为 1 000 bp 左右的 16S rRNA 基因片段。通过 BLAST 序列比对,菌株 ZG2-3 与枯草芽孢杆菌 Bacillus subtilis 相似度在 99% 以上,选择相似度>99.0% 的序列的代表菌株构建系统发育树(图 3),ZG2-3 与枯草芽孢杆菌的进化关系较近,可靠性较高,确定菌株 ZG2-3 为枯草芽孢杆菌 B. subtilis。
2.4 纤维素降解菌的酶活测定由表 1 可知,菌株 ZG2-3 的 CMCase 活力显著高于其他菌株,菌株 ZG2-3 的 FPA 活力显著高于 CF-7 ,与其他菌株无显著性差异(P<0.05)。
3 讨论与结论
运用微生物降解大自然中的纤维素,因其有对纤维素的高效利用率、绿色无污染特点,已受到人们的广泛关注[14]。纤维素降解菌的种类繁多,主要分为 3 大类:真菌、细菌和放线菌[15],其中,纤维素降解细菌在生长过程中能够产生大量的胞外酶,这些酶在促进纤维素降解方面发挥着重要作用。据报道,自然界纤维素的降解主要依赖于微生物产生的降解酶,如内切葡聚糖酶、外切葡聚糖酶和 β-葡萄糖苷酶等[16],这些酶相互协作,能够安全、无害地作用于纤维素分子的结晶区,最终将其分解成小分子寡糖和葡萄糖[17]。但梅新兰等[18]认为 CMCase 活力和木聚糖酶活力是复合菌系降解水稻秸秆的重要驱动力,江高飞等[19]认为纤维素 CM Case 活力是菌株降解玉米秸秆的主要驱动因素。
本研究从娄底珠山公园腐熟的土壤中筛选得到 1 株野生纤维素降解菌 ZG2-3,具有较强的产酶和降解纤维素能力。同时从促腐剂(鹤壁市人元生物技术发展有限公司)中筛选出 4 株商品纤维素降解菌。野生菌株 ZG2-3 的 D/d 值显著高于 CF-7 ,与其他菌株无显著性差异(P<0.05)。野生菌株ZG2-3 的 CMCase 活力显著高于 4 株商品纤维素降解菌,菌株 ZG2-3 的 FPA 活力显著高于菌株 CF-7 ,与其他菌株无显著性差异(P<0.05)。因此野生菌株 ZG2-3 具有较好的秸秆降解潜力,后续将进行相关试验的验证。
本研究通过羧甲基纤维素 (CMC)-刚果红染色法,筛选出野生纤维素降解菌 ZG2-3,结合革兰氏染色和 16S rRNA 序列测定,发现菌株 ZG2-3 与 B.subtilis 相似度高达 99%,选择相似度较高的代表菌株构建系统发育树,ZG2-3 与枯草芽孢杆菌的进化关系较近,可靠性较高,确定菌株 ZG2-3 为枯草芽孢杆菌 B. subtilis。并进一步测定野生纤维素降解菌 ZG2-3 的 CMCase 和 FPA 活力分别为 0.054IU·mL−1 和 0.020 IU·mL−1。
参考文献:
[1]佟硕秋 ,王嫱 ,林宗梅 ,等. 纤维素降解菌研究进展[J].山东化工,2020,49(3):67,91
[2]WUD,WEIZM,MOHAMEDTA,etal.Lignocellulosebiomassbioconversion during composting: mechanism of action oflignocellulase,pretreatmentmethodsandfutureperspectives[J] .,2022,286(Pt1):131635.
[3]安琪,员瑗,戴玉成,等. 木质纤维素降解真菌菌株筛选及对玉米秸秆的生物降解研究[J]. 菌物学报,2023,42(3):782−792.
[4]万文结 ,刘月 ,薛芷筠 ,等.纤维素降解菌 HW-17的纤维素降解特性及纤维素酶学性质[J].环境科学学报,2017,37(10):3679−3686.
[5]康永刚,廖云琼,昌莉丽. 发酵中药渣的营养价值及在动物生产中的应用研究进展[J].中国畜牧杂志,2023,59(11):83−88.
[6]潘润泽,牟璐,邱敏,等. 木质纤维素生物转化的技术研究和应用前景[J]. 能源环境保护,2024,38(2):94−104.
[7 ]凌新龙,阳辰峰 ,宁军霞. 纤维素的改性及应用研究进展[J].纺织科学与工程学报,2020,37(3):60−85.
[8]王得武,姚拓,杨巧丽,等.高效稳定纤维素分解菌群筛选及其分解特性研究[J]. 草业学报,2014,23(2):253−259.
[9]金裕华,康薇,郑进,等. 蝗虫肠道纤维素降解菌的筛选及复合菌系的构建[J]. 湖北理工学院学报,2022,38(1):47−52.
[10]刘童童,卢晨曦,原楚妍,等. 小熊猫粪便中纤维素降解菌株的筛选、基因改造及生物合成聚羟基丁酸酯条件的优化[J]. 天津师范大学学报( 自然科学版),2022,42(1):45−50.
[11]李乐,李明星,汤国雄,等. 一株纤维素酶产生菌的筛选与产酶特性研究[J]. 环境科技,2019,32(1):24−29.
[12]PANDEYBR, GHIMIRE S,BHATTARAI S,etal.Isolation,growth,enzymeassayandidentificationvia 16S rRNAfullsequencingof cellulolytic microbes from Nepal for biofuel production[J]. ,2019,132:515−526.
[13]杨波,邬慧慧,荆焕松,等. 鹿粪纤维素降解细菌的筛选及堆肥应用[J]. 经济动物学报,2022,26(2):138−145.
[14]黄岚,简倩楠,刘雪阳,等. 东北梅花鹿肠道纤维素降解微生物的分离筛选[J].北京师范大学学报(自然科学版![]() ),2021,57(4):477−484.
),2021,57(4):477−484.
[15]范宇欣,沈红英,梁雁宁,等. 产纤维素酶菌及其筛选改良方法研究进展[J]. 科技资讯,2019,17(18):187−188.
[16]李爽. 秸秆纤维素降解菌株的筛选鉴定及产酶条件的优化[D].哈尔滨:东北农业大学,2017.
[17]高双喜 ,王萱 ,任菁 ,等.羊源芽孢纤维素降解菌的筛选与H-
7 菌株鉴定[J]. 饲料工业,2019,40(14):52−57.
[18]梅新兰,郑海平,李水仙,等.降解水稻秸秆细菌-真菌复合菌系的构建与评价[J].农业环境科学学报,2021,40(10):2217−2225.
[19]江高飞,杨天杰,郑海平,等.降解玉米秸秆真菌复合菌系的构建及其 降解效果评 价[J] .植 物 营养 与 肥料 学报,2021,27(2):284−292.
(责任编辑:柯文辉)
