华南地区茄科作物青枯病发生与病原菌分布特性分析
2024-08-14郑雪芳林莹朱育菁刘欣车建美陈梅春刘波



郑雪芳,1977 年生,博士,研究员,主要从事作物细菌性病害生物防治研究。主持国家自然科学基金、国家重点研发计划子课题、福建省自然科学基金、福建省科技计划省属公益类项目等 20 多项;获神农中华农业科技奖一等奖 1 项(排名第 4)、三等奖 1 项(排名第 11)、福建省科技进步奖二等奖 2 项(排名第 4、7);获授权国家发明专利 5 件,制定并获得颁布福建省地方标准 2 项;在《Pest Management Science》《Biological Control》《Applied Soil Ecology》《微生物学报》等学术刊物上发表学术论文 80 余篇,与厦门大学、福州大学、福建师范大学和福建农林大学等联合培养研究生 9 名。
摘 要:调查我国华南地区番茄、茄子和辣椒等茄科作物青枯病害发病情况,采集健康植株和青枯病发病株及其根际土壤样本,进行病原菌的分离鉴定、致病力测定和分布特性分析。结果表明:番茄、茄子和辣椒发病率最高的地区分别是海南陵水、福建晋安和福建邵武,其生育期内平均发病率分别达 20.01%、5.24% 和 23.33%。从不同地理来源的茄科作物中,共分离鉴定出 86 株青枯菌。进一步利用弱化指数(Attenuation index,AI)对分离的青枯菌进行致病力划分,其中7 株为无致病力菌株(AI>0.75),13 株为过渡型菌株(0.65≤AI≤0.75),66 株为强致病力菌株(AI<0.65)。研究青枯菌的分布特性发现,对于不同寄主,青枯菌分布特性均是病株及其根际土壤分布数量显著多于健康植株及其根际土壤,且分布数量均是土>根>茎,此外,调查的茄科作物中,青枯病发病株土壤青枯菌分布数量均大于 106cfu·g−1,青枯病发病株根和茎青枯菌分布数量均大于 105cfu·g−1。
关键词:茄科作物;青枯病;青枯雷尔氏菌;致病力鉴定;华南地区
中图分类号:S332.2 文献标志码:A 文章编号:0253−2301(2024)05−0001−09
DOI: 10.13651/j.cnki.fjnykj.2024.05.001
Analysis of the Occurrence of Bacterial Wilt and Pathogen Distribution Characteristics for the Solanacae Crops in Southern China
ZHENG Xue-fang1,LIN Ying2,ZHU Yu-jing3,LIU Xin1,CHE Jian-mei1,CHEN Mei-chun1,LIU Bo1 *
(1. Institute of Resources, Environment and Soil Fertilizer, Fujian Academy of Agricultural Sciences,Fuzhou, Fujian 350013, China;2. Fujian Planting Technology Promotion Central Station, Fuzhou, Fujian 350003, China;3. Institute of Crops, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350013, China)
Abstract: In order to investigate the incidence of bacterial wilt in the solanaceae crops such as tomato, eggplant and pepper in South China, the samples were collected from the healthy plants, the plants infected bacterial wilt and their rhizosphere soil. Then, the isolation and identification of pathogenic bacteria, pathogenicity determination and distribution characteristics analysis were carried out. The results showed that: the areas with the highest incidence of bacterial wilt in tomato, eggplant and pepper were Lingshui in Hainan, Jin’ an in Fujian and Shaowu in Fujian,respectively. The average incidence rates during their growth period were 20.01%, 5.24% and 23.33%, respectively. A total of 86 strains of Ralstonia solanacearum were isolated and identified from the solanaceae crops with different geographical origins. The pathogenicity of the isolated Ralstonia solanacearum was further divided by using the Attenuation index (AI). Among them, 7 strains were non-pathogenic strains (AI larger than 0.75), 13 strains were transitional-type strains (0.65≤AI≤0.75), and 66 strains were high virulent strains (AI smaller than 0.65). The distribution characteristics of Ralstonia solanacearum were studied. It was found that for different hosts, the distribution characteristics of Ralstonia solanacearum were that the distribution number of Ralstonia solanacearum in the diseased plants and their rhizosphere soil was significantly higher than that in the healthy plants and their rhizosphere soil. Moreover, the distribution number in the tissue and soils ranged in the descending order of soil > root >stem. In addition, among the solanaceae crops investigated, the distribution number of Ralstonia solanacearum in the soil where the plants infected bacterial wilt was greater than 106cfu·g−1, and the distribution number of Ralstonia solanacearum in the roots and stems of the plants infected bacterial wilt was greater than 105cfu·g−1.
Key words: Solanacae crop;Bacterial wilt;Ralstonia solancearum;Pathogenicity identification;Southern China
青枯雷尔氏菌(Ralstonia solanacearum,简称青枯菌)可引起 450 多种植物毁灭性青枯病害[1],是世界上危害最大的植物病原菌之一[2]。青枯病称为植物的“癌症”,能使植物减产 30%~100%,在茄科作物中发病尤为严重[3],全球每年因该病害造成的直接经济损失高达数百亿美元。我国目前除西藏外,其他 30 个省(市、自治区)均有报道发生作物青枯病[4−5],其中广东、广西、海南、福建等南方省份是该病害的高发区[6]。
由于青枯菌的寄主范围广、侵染途径多,菌系复杂及其能在土壤中长期存活,使得青枯病发病重、防治困难[7−8]。关于青枯病的防治,轮作是非常有效的措施,但受地理环境的影响,难以大面积推广[9];抗病品种和化学防治目前还难以满足生产需求[10]。利用青枯菌无致病力菌株防治作物青枯病,具有重要的生防潜力,已有许多成功例子[11−13]。
本研究对我国华南不同区域的主要茄科作物种植区进行田间青枯病害调查,采集健康植株和青枯病株及其根际土壤样本,进行病原菌的分离鉴定、致病力测定和分布特性分析,从生态位角度初步探讨青枯菌与寄主之间的相互关系,为茄科作物青枯病有效控制提供依据。
1 材料与方法
1.1华南地区茄科作物田间青枯病害调查
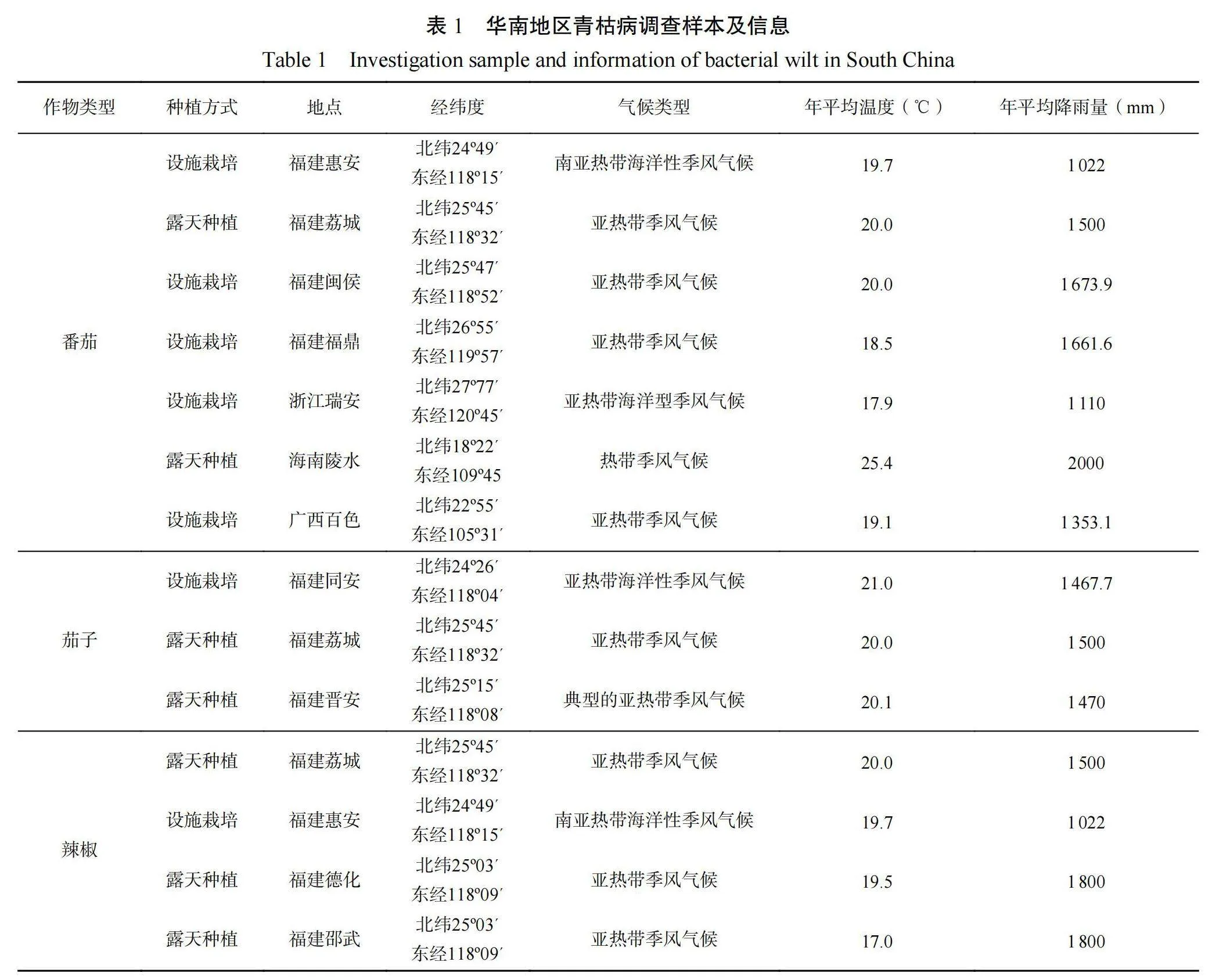
1.1.1调查大棚(田块)分布及其气候条件 以番茄、辣椒和茄子为调查对象,选取华南地区常年青枯病发生严重田块,进行青枯病害调查,调查地点、茄科作物种植方式、气候条件等具体信息见表 1。
1.1.2田间青枯病病情调查和样本采集 分别于苗期、开花结果期和采收期,对选址大棚和田块进行青枯病调查和样品采集。每块地选取 3 个大样方,每个样方 667 m2,采用平行跳跃法取样,每个样方抽样 400 株进行调查。记录田间青枯病症状和统计青枯病发病率(disease index,DI)。DI=发病植株/调查总株数×100%。
采集开花结果期调查田块病、健株根际土壤样本。采集方法:每个样方随机选取病株和健株各5 株,分别截取植株的根部和茎中部,并收集其根际土壤(去砂砾和植物残体,过 2 mm 筛选后),采集样本于 4℃ 冰箱保存备用。
1.2青枯菌的分离鉴定
植株样本冲洗干净后吸去水分,称取 1 g,用75% 乙醇浸 30~40 s,再转入 10% 次氯酸钠溶液中浸 5 min,无菌水漂洗 3 次,无菌滤纸吸干,加入 90 mL 无菌水后,研磨匀浆,用无菌水 10 倍系列梯度稀释;土壤样本称取 10 g,加入 90 mL 无菌水,充分振荡,用无菌水 10 倍系列梯度稀释;各取 100 μL 稀释液涂布于 2,3,5-氯化三苯基四氮唑( 2,3,5-triphenyltetrazolium chloride, TTC) 培 养基,参照 Kelman(1954)方法[14]配置,置于(30±1)℃ 人工气候箱内培养 48 h 后,观察菌落形态,计算活菌数及每克鲜重青枯菌数。
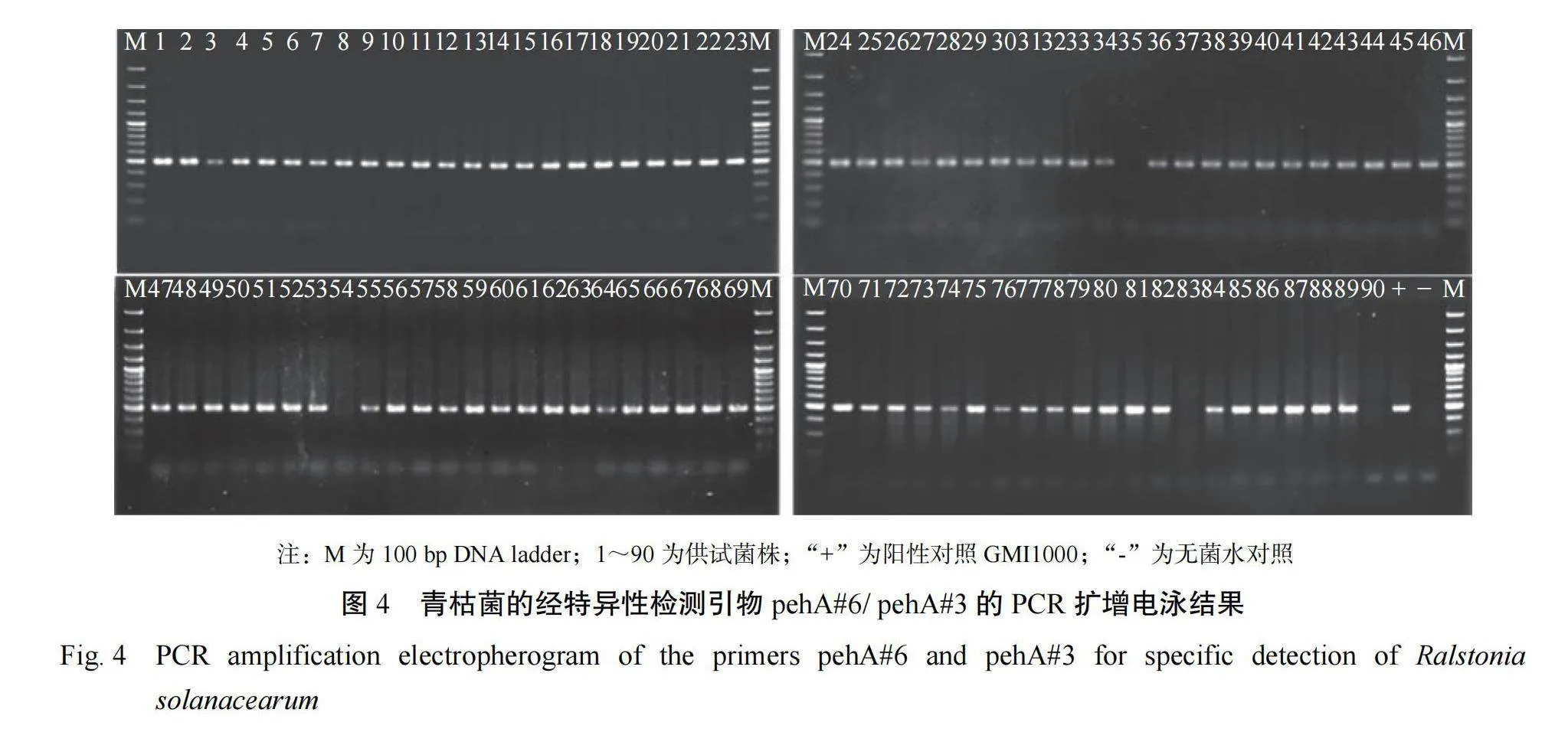
采 用 青 枯 菌 的 特 异 性 检 测 引 物 pehA#6 和pehA#3 对菌落形态鉴定为青枯菌的菌株进行进一步的分子检测,以参比菌株 GMI1000 为阳性对照,无菌水为阴性对照,引物设计参见文献[15],25 μL 的 PCR 反 应 体 系 中 包 括 : 10×Buffer 2.5μL,10 mmol·L−1dNTPs 0.5 μL,dH2O 18.7 μL 和10 mmol·L−1 引物对各 1 μL,2.5 U Taq 酶,25 ng DNA 模板。PCR 反应程序为:96℃ 预变性 1 min;96℃ 变性 30 s,70℃ 退火 30 s,72℃ 复性 1 min,重复 2 个循环;94℃ 变性 30 s、70℃ 退火 30 s、72℃ 复性 1 min,重复 33 个循环;最后 72℃ 下延伸 5 min。PCR 产物的检测:采用 1% 琼脂糖凝脉电泳检测 PCR 产物,上样量为 5 µL,最后在 Bio Rad 凝胶成像系统仪拍摄。
1.3青枯菌弱化指数测定
用弱化指数(Attenuation index,AI)作为青枯菌致病性分化指标[16],测定分离的青枯菌致病力。每个菌株随机选取在 TTC 平板上的 5 个单菌落,在 Leica M165FC 电动荧光体视显微镜测量并计算 AI。AI=菌落的红斑直径与菌落直径的比值,AI <0.65 为强致病力菌株,AI >0.75 为无致病力菌株,0.65≤AI≤0.75 为过渡型菌株。
1.4青枯菌的田间分布特性
以弱化指数和致病性鉴定结果为指标,分析不同地理来源、不同生育期植株不同部位(根和茎)及根际土壤中不同致病力类型的青枯菌分布数量,揭示不同致病力类型的青枯菌在茄科作物田间致病性变化规律及其与青枯病害发生的关系。
1.5数据统计
采用 DPS 7.0 软件对数据进行分析。
2 结果与分析
2.1茄科作物青枯病田间症状分析
茄科作物青枯病症状相似,表现为发病初期顶部叶片似缺水萎蔫,早晚尚能恢复,接着下部枝叶萎蔫,中部叶片最后萎蔫,有的一侧枝先萎蔫,有的整株萎蔫,萎蔫时病株仍保持绿色或浅绿色(图 1A-C)。病株根和茎基部褐变(图 1D),茎表皮粗糙(图 1E),将茎基部切开,维管束呈褐色(图 1F,G),且有白色菌脓流出(图 G,箭头指示)。
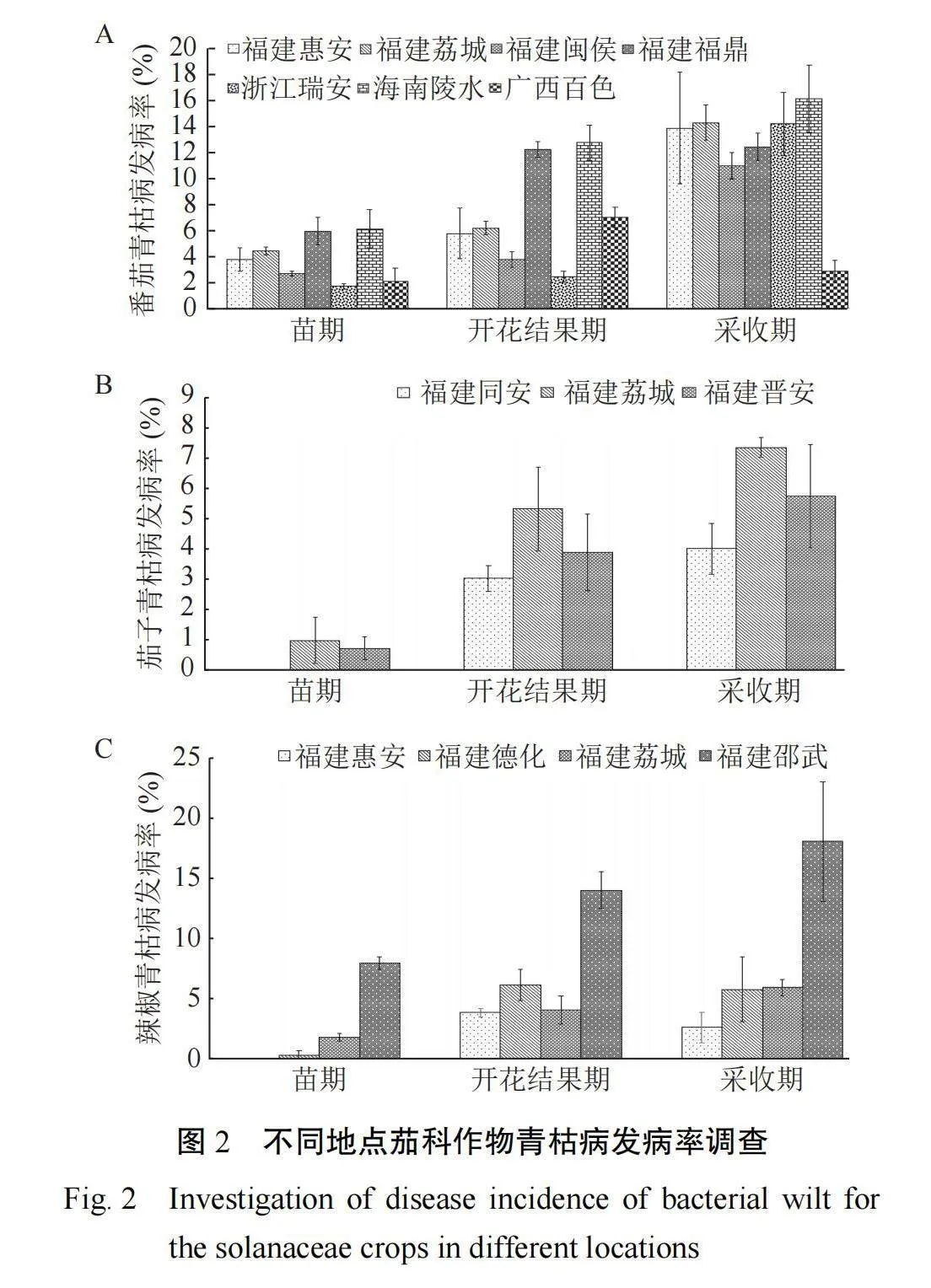
2.2茄科作物田间青枯发病率调查
调查结果表明,对于番茄,海南陵水番茄青枯病发病率最高,其苗期、开花结果期和采收期青枯发病率分别为 6.15%、18.89% 和 35.00%,其次是福建福鼎,各调查期青枯发病率分别为 5.97%、18.19% 和 30.62%,广西百色和浙江瑞安青枯发病率相对较低(图 2A)。对于茄子,苗期、开花结果期和采收期青枯病发病率表现为福建同安(分别为 0、3.03% 和 7.44%)低于福建荔城(分别为0.99%、6.31% 和 13.65%)和福建晋安(分别为0.74%、4.63% 和 10.37%)(图 2B)。对于辣椒,福建邵武青枯发病率最高,其苗期、开花结果期和采 收 期 青 枯 发 病 率 分 别 为 7.98%、 22.02% 和40.00%,泉州惠安青枯发病率最低,其苗期、开花结果期和采收期青枯发病率分别为 0、3.88% 和6.54%(图 2C)。
2.3青枯菌的分离鉴定
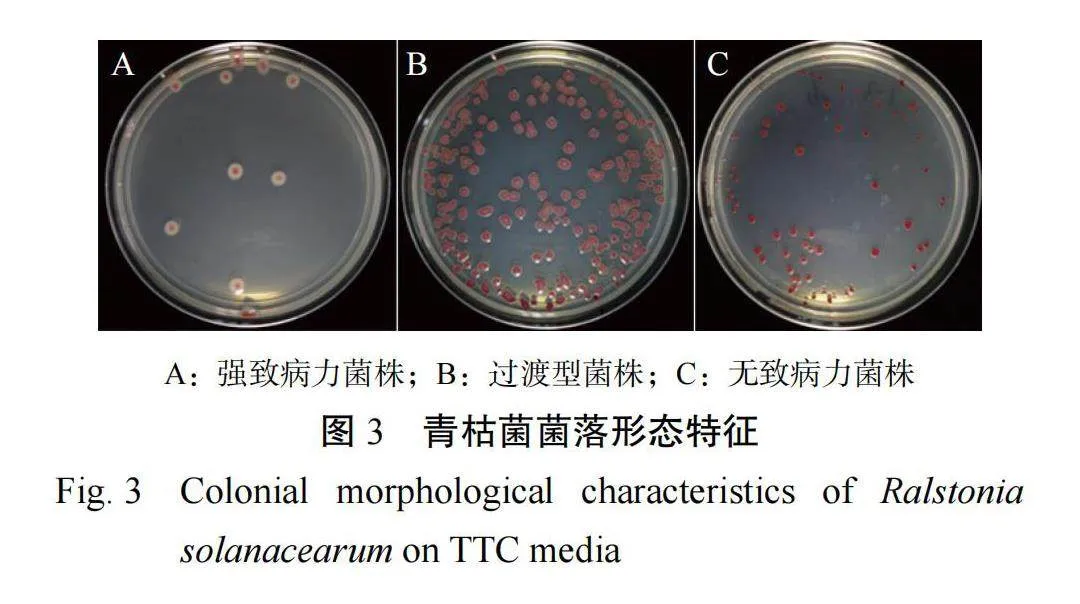
分离到的菌株在 TTC 培养基上呈现 3 种不同形状:类型Ⅰ,菌落呈不规则形状或近圆形,流动性强,中间为粉红色,白边较宽,菌落表面显润;类型Ⅱ,菌落圆形,表面湿润,无流动性,中间为暗红色,白边比较窄;类型Ⅲ,菌落为圆形,表面干燥,无流动性,中间为暗红色,白边窄或无白边(图 3)。根据刘波等[16]报道的青枯菌菌落形态与致病力菌株之间的关系,类型Ⅰ为强致病力菌株,类型Ⅱ为过渡型菌株,类型Ⅲ为无致病力菌株。
2.4青枯菌的分子鉴定
利 用 青 枯 菌 的 特 异 性 检 测 引 物 pehA#6/pehA#3 对形态初步鉴定为青枯菌的 90 个菌株进行分子鉴定,由图 4 可知,共有 86 株菌扩增出504 bp 的特异性靶带,验证为青枯氏菌,检测率为 95.56%。
2.5青枯菌弱化指数测定
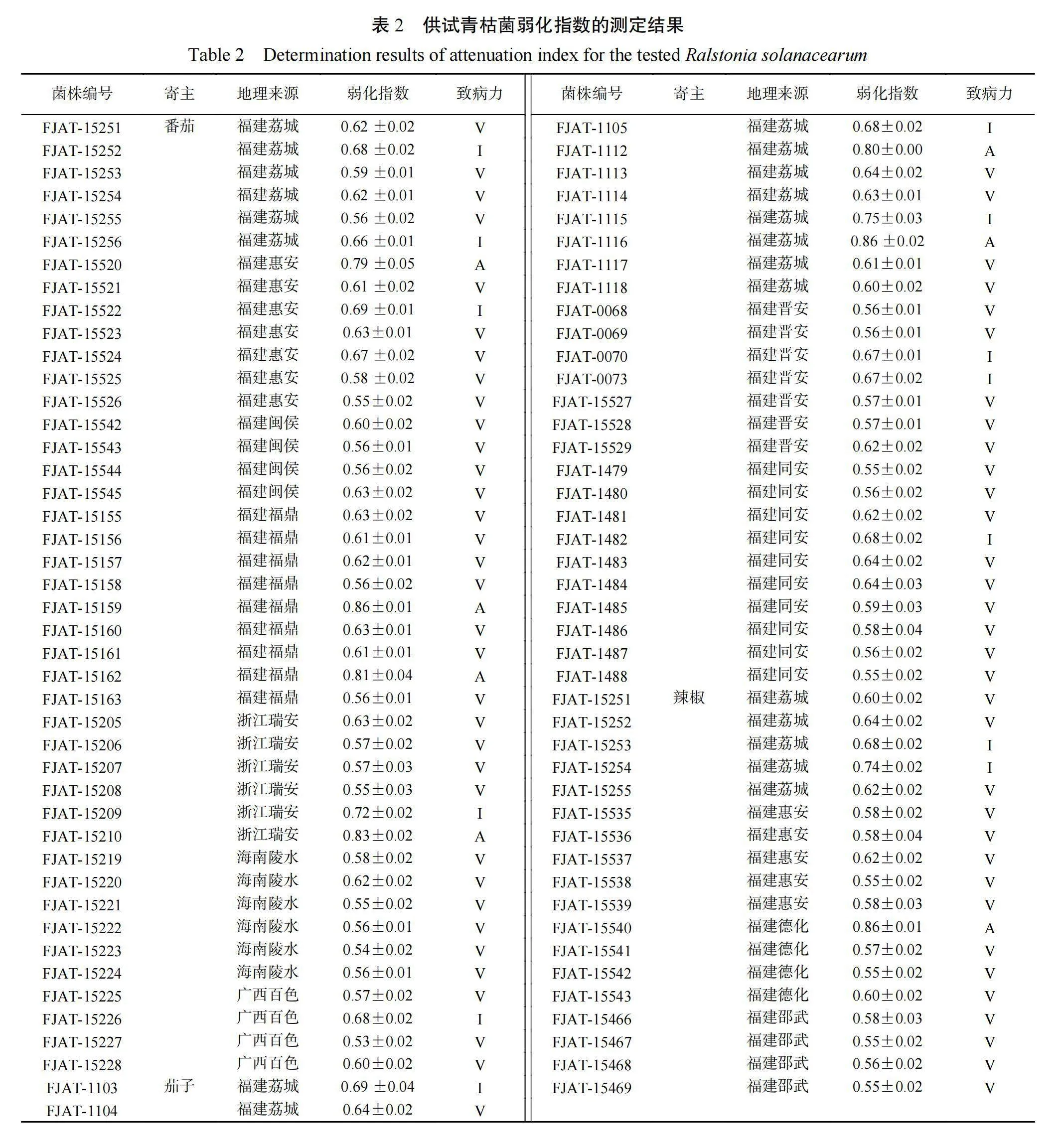
进一步对 86 株鉴定为青枯菌的菌株进行弱化指数(AI)测定(图 5)。结果表明,供试的86 株青枯菌 AI 值介于 0.53~0.86(表 2)。根据刘波等[16]对不同致病力青枯菌的划分:AI<0.65,为强致病力菌株;AI>0.75,为无致病力菌株;AI0.65~0.75 为过渡型菌株。供试的 86 株青枯菌可分为 3 个致病力类群,强致病力菌株共 66 株,占76.74%,无致病力菌株 7 株,占 8.14%,过渡型菌株 13 株,占 15.12%。
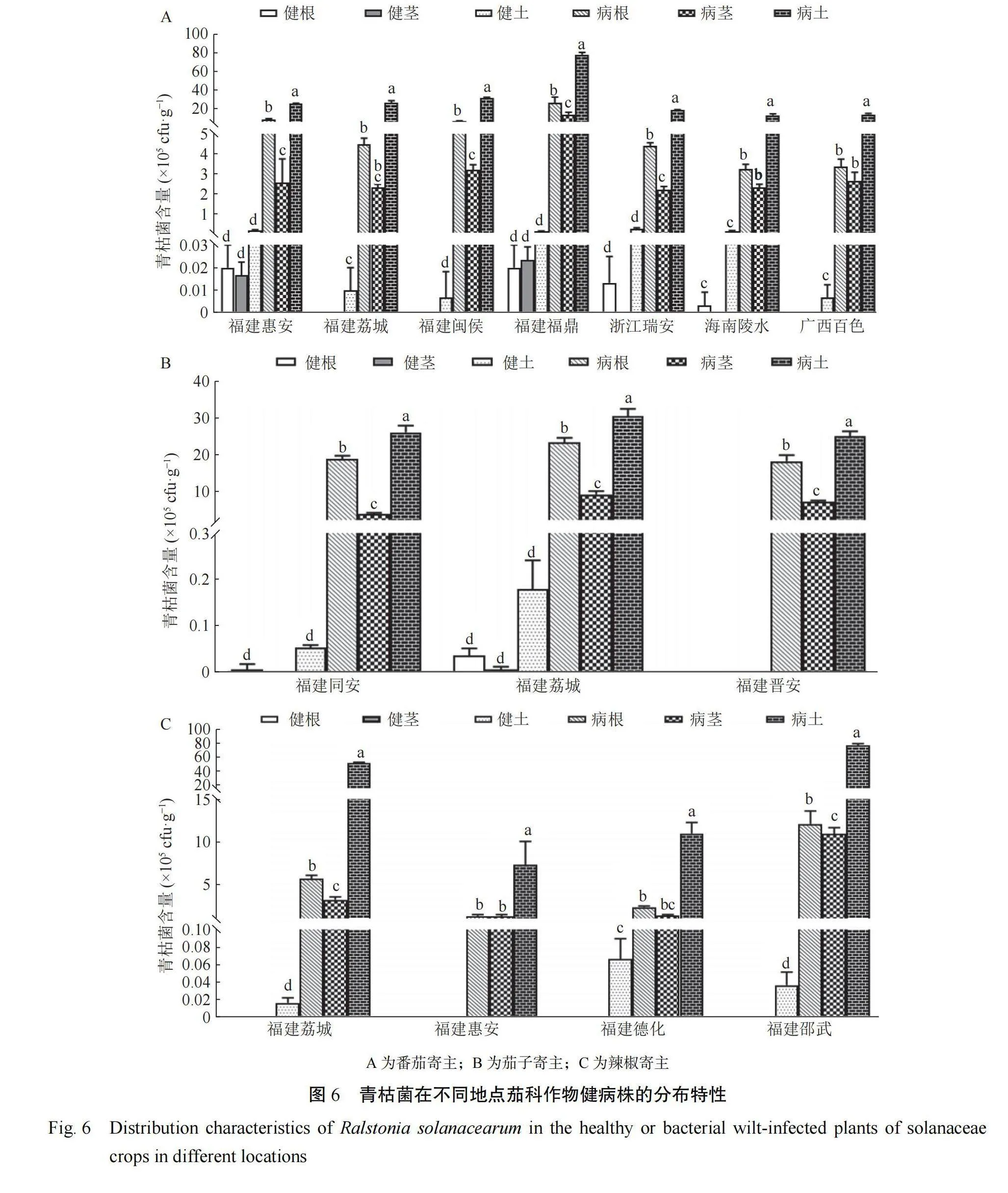
2.6青枯菌的分布特性
本研究表明不同地理来源的番茄青枯菌分布特性相似,均是健株及其根际土壤青枯菌分布数量显著低于病株及其根际土壤,以福建惠安分离的番茄青枯菌为例,其在健康植株根、茎和土壤中分布数量分别为 0.02×105、0.02×105 和 0.17×105cfu·g−1,显 著 低 于 发 病 植 株 根 ( 7.87×105cfu·g−1)、 茎(2.57×105cfu·g−1)及土壤(25.20×105cfu·g−1)的分布数量(图 6A)。此外,福建荔城、福建闽侯、海南陵水和广西百色采集的健康植株根和茎中均检测不到番茄青枯菌。健、病株中青枯菌分布量均在土>根>茎;番茄青枯菌在福鼎前岐病土分布数量最大,为 77.97×105cfu·g−1,其次是闽侯病土,分布数量为 30.97×105cfu·g−1。
茄子青枯菌分布特性与番茄青枯病相似,其在不同健康状态、不同植株部位及不同地理来源均存在差异。福建同安、福建荔城和福建晋安采集分离青枯菌总量分别为 48.69×105、63.36×105 和50.33×105cfu·g−1。福建同安健康植株茎和福建晋安健康植株根、茎和土壤中均测不到青枯菌。福建荔城的病土中青枯菌分布数量大,为 30.60×105cfu·g−1(图 6B)。
辣椒青枯菌分布特性为(图 6C):病株(土)显著大于健株(土)(P<0.05)。以福建荔城样本为例,青枯菌在病土(51.67×105cfu·g−1)、病根(5.67×105cfu·g−1)和病茎(3.2×105cfu·g−1)的分布数量,显著大于健土(0.02×105cfu·g−1)、健根(0)和健茎(0)(P<0.05)。
3 讨论与结论
本研究调查了我国华南地区番茄、辣椒和茄子作物田间青枯病发生情况,发现气温高、湿度大的区域青枯病发生较为严重。如海南陵水年平均温度 25.4℃,平均降雨量达 2 000 mm,该地区青枯发病率最高,各生长期青枯病平均发病率为20.01%,而气温和湿度较低的地区青枯病发病率相对较低,如浙江瑞安(平均温度 17.9℃,平均降雨量达 1 110 mm),其青枯发病率为 8.12%。此外,调查发现在青枯病发病田块,虽然病株分散分布在整块田,但仍然有许多健康植株的存在直至采收期,与刘波等[17]的报道相一致,这可能与植株间抗性差异有关。
许 多 研 究 表 明 青 枯 菌 存 在 致 病 力 分 化 现象[18−20],且其致病力类型与青枯病的发生密切相关[21]。刘波等[16]建立青枯菌的弱化指数 AI,用于判别其致病力类型。本研究对分离获得的 86 株青枯菌进行 AI 测定,发现存在 3 种致病类型:7 株为无致病力菌株,13 株为过渡型菌株,66 株为强致病力菌株,再次证实青枯菌存在致病力分化的现象。青枯菌致病力分化与其内在的基因变异及致病力调控因子密切相关[22−23]。后续研究将比较不同致病力菌株间的遗传差异。
前人研究表明作物青枯病的发生与其病原菌在植株体内的定殖数量有关[24]。本研究发现青枯菌在番茄、茄子和辣椒植株体内或根际土壤中均是病株及其根际土壤中分布数量显著大于病株及其根际土壤,且健、病株中青枯菌分布量均在土>根>茎,与刘波等[17]研究结果相吻合,即青枯菌在寄主分布从根到上部茎分布量逐渐降低。另外,有些健康植株仍有一定量的青枯菌分布,这可能是由于青枯菌分布数量未达到发病等级,暂时处于隐性状态,随时间推移青枯菌在植株体内繁殖并积累到一定数量,可能就会暴发青枯病,与车建美等[25]研究结果相一致,该研究发现青枯菌接种最低浓度达 104cfu·mL−1 时,番茄植株才会发生青枯病害。
青枯菌无致病力菌株具有重要生防潜能。王羽等[26]从番茄发病田块分离到青枯菌无致病力菌株,他们认为无致病力青枯菌的作用机制与其位点和营养竞争及诱导寄主抗性有关;董春等[27]认为无致病力青枯菌在番茄植株的定殖,可以减少病原菌侵入的几率,同时还起着交互保护和诱导寄主抗病性的作用;刘波等[28]指出,病原菌弱毒株侵入植株体内,能诱导植物产生类似“弱菌株免疫保护”的防病作用。本研究从番茄、茄子和辣椒青枯病田块均有分离到无致病力菌株,后续将研究这些菌株的生防能力和生防机制,为茄科作物青枯病的生物防治提供新的菌株资源和理论依据。
参考文献:
[1]HUQL,TANL,GUSS,etal.Networkanalysisinfersthewiltpathogen invasion associated with non-detrimental bacteria[J]. ,2020,6(1):1−8.
[2]JIANGG F,WEIZ,XU J,etal. Bacterialwilt in ;China:History,currentstatus,andfutureperspectives[J].,2017,8:1549.
[3]JOSE J,ÉVA C,BOZSÓZ,etal.Global transcriptomeandtargeted metabolite analyses ofroots reveal differentdefence
mechanismsagainstinfectionintworesistantpotatocultivars[J]. ,2023, 13:1065419.
[4]YEON J, LEN T, SIM S C. Assessment of temperature-independentresistanceagainstbacterialwiltusingmajorQTLin cultivated tomato(L.)[J] . ,2022,11(17):2223.
[5 ] 佘小漫 ,何自福.作物青枯病研究进展[J].广东农业科学,2020,47(12):82−89.
[6]佘小漫,李萍,蓝国兵,等. 假茄科雷尔氏菌引起向日葵青枯病在中国的首次报道[J]. 植物保护,2023,49(2):243−249.
[7]YULIAR,NION Y A,TOYATAK.Recenttrendsincontrolmethods for bacterialwiltdiseasescaused by [J]. ,2015,30(1):1−11.
[8]SINGH S, GAUTARN RK, SINGH D R, et al. Genetic
approachesfor mitigatinglossescaused by bacterialwiltof tomatointropicalislands[J].,2015,143:205−221.
[9]STRUCK C,RÜSCH S,STREHLOWB.Controlstrategiesofclubroot disease caused by [J] .,2022,10(3):620.
[10]WANG X F, WEI Z, YANG K M, etal.Phagecombinationtherapies for bacterial wilt disease in tomato[J] . ,2019,37(12):1513−1520.
[11]ZHENGXF, ZHUYJ, WANGJP, etal.Combineduseofamicrobialrestorationsubstrateandavirulentfor the control of tomato bacterial wilt[ J]. ,2019,9(1):20091.
[12]MOUSSAZ, RASHADEM, ELSHERBINYEA, etal.Newstrategyforinducingresistanceagainst bacterialwiltdisease usinganavirulentstrainof [J] .,2022,10(9):1814.
[13]CHEND,LICY,WUK,etal.A −marker-freemutantofaspotentialbiocontrolagentoftomato bacterial wilt[J]. ,2015,80:96−102.
[14]KELMAN A. The relationship ofpathogenicity in tocolonyappearanceonatetrazoliummedium[J].,1954,44 :693−695.
[15]GILLINGSM, FAHYP, DAVIESC.Restrictionanalysisofanamplifiedpolygalacturonasegenedifferentiatesstrainsofthe phytopathogenic bacterium [J]. ,1993,17(1):44−48.
[16] 刘波 ,林营志 ,朱育菁 ,等.生防菌对青枯雷尔氏菌的致弱特性[J]. 农业生物技术学报,2004,12(3):322−329.
[17]刘波,朱育菁,林抗美,等. 青枯雷尔氏菌在植株体内分布及其致病力 的异质性研究[J].中 国农业科学,2007,40(7):1559−1566.
[18]MORELA,PEETERSN,VAILLEAUF, et al.Plantpathogenicityphenotypingof strains[J] .,2018,1374:223−239.
[19]PRIOR P, AILLOUD F, DALSING B L,etal.Genomicandproteomicevidencesupportingthedivisionoftheplantpathogen intothree species[ J] .,2016,17:90.
[20]张长龄 ,华静月 ,王东 ,等.青枯菌的菌种保存[J].植物保护,1993,19(1):39−40.
[21]HAYWARDAC.Biologyandepidemiologyofbacterialwiltcausedby[J].,1991,29:65−87.
[22]DEMIRJIANC,RAZAVI N,DESAINTH,etal.Studyofnaturaldiversityinresponsetokeypathogenicityregulatorofreveals new susceptibility genes in Arabidopsisthaliana[J]. , 2022, 23(3):
321−338.
[23] 徐进 ,冯洁.植物青枯菌遗传多样性及致病基因组学研究进展[J]. 中国农业科学,2013,46(14):2902−2909.
[24]GRIMAULT V,PRIOR P, ANAÏSG. AmonogenicdominantresistanceoftomatotobacterialwiltinHawaii7996 isassociatedwith plantcolonizationby[J] .,1995,143(6):349−352.
[25]车建美,刘波,张彦,等. 青枯雷尔氏菌致病性生物测定方法的研究[J]. 福建农业学报,2011,26(5):804−807.
[26] 王羽, 肖崇刚.番茄青枯病病菌无致病力菌株的分离和控病研究[J]. 西南农业大学学报,2004,26(4):426−428.
[27] 董春,董成刚,赵青峰.利用拮抗细菌防治烟草青枯病初步研究[J]. 广西农业科学,1996(5):28−30.
[28]刘波 ,蓝江林 ,朱育菁 ,等. 植物免疫系统的研究与应用[J]. 中国农学通报,2007,23(S):163−172.
(责任编辑:柯文辉)
