含氟异喹啉二酮衍生物的合成及其抗马铃薯Y病毒活性分析
2024-08-14邓佑林张慧陆婷婷覃玥黄秀香


摘 要:为了探索更高抗植物病毒活性的新药物分子,采用较廉价的原料、较温和的反应条件合成了 12 个含氟基团异喹啉二酮衍生物,并采用半叶枯斑法对合成的目标化合物进行抗马铃薯 Y病毒(PVY)活性测定。结果表明:含氟异喹啉二酮衍生物对马铃薯 Y 病毒(PVY)具有较好的抑制活性,其中化合物 3e 的治疗活性(43.5%)、保护活性(47.1%)、钝化活性(51.9%)都表现出较好的效果,与阳性对照农用抗病毒药物病毒唑活性相当,在其结构基础上进行一定的结构修饰,有望得到具有更高抗病毒活性的化合物。
关键词:异喹啉二酮;抗病毒活性;马铃薯 Y 病毒;含氟化合物;生物活性
中图分类号:S435.32 文献标志码:A
文章编号:0253−2301(2024)05−0020−08
DOI: 10.13651/j.cnki.fjnykj.2024.05.004
Synthesis of Fluorinated Isoquinolindione Derivatives and Analysis of Its Antiviral Activity Against Potato Virus Y
DENG You-lin,ZHANG Hui,LU Ting-ting,QIN Yue,HUANG Xiu-xiang *
(College of Chemistry and Biological Engineering, Hechi University, Hechi, Guangxi 546300, China)
Abstract: In order to explore new drug molecules with higher antiviral activity against plant viruses, 12 fluorinated isoquinolinedione derivatives were synthesized by using cheaper raw materials and milder reaction conditions, and the anti-Potato virus Y (PVY) activity of the synthesized target compounds was determined by using the half-leaf necrosis method. The results showed that the fluorinated isoquinolinedione derivatives had good inhibitory activity against potato virus Y (PVY). Among them, the compound 3e showed good effects in the therapeutic activity (43.5%),protective activity (47.1%) and inactivate activity (51.9%), which was comparable to the positive control agricultural antiviral drug ribavirin. It was expected that the compounds with higher antiviral activity could be obtained by some structural modification on the basis of its structure.
Key words: Isoquinolinediones;Antiviral activity;Potato virus Y;Fluorinated compound;Biological activity
喹啉类化合物是重要的萘系含氮杂环化合物,因其具有广泛的生物活性,是许多农药的重要骨架,如抗生素、抗疟药、杀菌剂等[1−10]。例:由道化学公司开发的商品药苯氧喹啉(quioxyfen)是高效防治白粉病药剂,主要应用于禾谷类作物、蔬菜、甜菜等,对作物安全、对环境安全,是较理想的综合防治药剂;二氯喹啉酸是一种高效低毒选择性好的除草剂,可很好的防除稻田稗草且对高龄稗草有效,而且对水稻安全。
植物病毒病严重危害农作物的整个生长周期,素有“植物癌症”之称,可侵染粮食作物、经济作物等,使得作物产量下降和品质降低。马铃薯 Y病毒(PVY)是最具代表性的植物病毒之一,能够侵染多种农作物,包括茄科、豆科和藜科植物,给农业生产造成了严重的损失[1−5]。目前,用于防治马铃薯 Y 病毒病的药剂主要有病毒唑、宁南霉素、氨基寡糖素等,但是存在防治效果不理想和防治成本高以及农作物耐药性等问题。因此,迫切需要开发结构简单、活性优异的新型绿色抗病毒药物。
含氟化合物已在农药、医药和材料等领域得到广 泛 应 用 [11]。 据 统 计 , 目 前 约 30% 的 农 药 和20% 的医药分子中至少含有 1 个氟原子。由于含氟基团具有较高的溶解度和亲脂性,使含氟有机化合物有更好的细胞膜融合和渗透性,因此在功能有机分子中,特别是在一些杂环骨架中引入含氟基团(特别是 CF3 基团)的方法研究吸引了众多化学家的兴趣[12−14]。喹啉类化合物是含氮杂环中非常重要的一类化合物,通过课题组前期对含氟异喹啉二酮的合成研究基础[15],文献调研发现含氟异喹啉二酮在抗病毒活性方面的应用还未见报道。为寻找高效低毒的新型农药提供了新的途径,本研究合成了 12 种含氟异喹啉二酮衍生物,并测试了其抗马铃薯 Y 病毒(PVY)活性,以期探索出更高抗植物病毒活性的药物分子。
1 材料与方法
1.1 供试材料
供试病毒:马铃薯 Y 病毒(PVY),贵州大学精细化工研究开发中心;供试植株种子:苋色藜(PVY 寄主),贵州大学精细化工研究开发中心。
1.2 仪器与试剂
1.2.1试验仪器 AVANCE 400 MHz 型核磁共振波 谱 仪 ( NMR, 瑞 士 Bruker 公 司 ), GC-MS QP2010 型质谱仪(MS,日本岛津公司),RE-52AA 型旋转蒸发仪(上海亚荣生化仪器厂),VECTOR 22 红外光谱测定仪(德国布鲁克),AL104 电 子 分 析 天 平 ( 上 海 Mettler Toledo),SZCL-2 智能控温磁力搅拌器(巩义予华仪器有限公司),ZF-2 三用紫外仪(上海安亭科学仪器厂),GZX-9070 MBE 烘箱(上海博讯仪器有限公司)。
1.2.2试验材料 98% 病毒唑(海瑞华制药有限公司),芳基酰氯(阿拉丁试剂公司),烷基胺(阿拉丁试剂公司),全氟碘代试剂(百灵威试剂公司),α-甲基丙烯酸(上海久岭化工有限公司),二氯甲烷(天津市富宇精细化工有限公司),草酰氯(海门贝斯特精细化工有限公司),三乙胺(上海士瑞化工实业有限公司),300−400 目硅胶(青岛 海 洋 化 工 有 限 公 司 ), 二 叔 丁 基 过 氧 化 物(DTBP),乙腈,N,N-二甲基甲酰胺(DMF),K3PO4, K2CO3,Cs2CO3 等及其他试剂均为分析纯。
1.3 含氟异喹啉二酮衍生物的合成
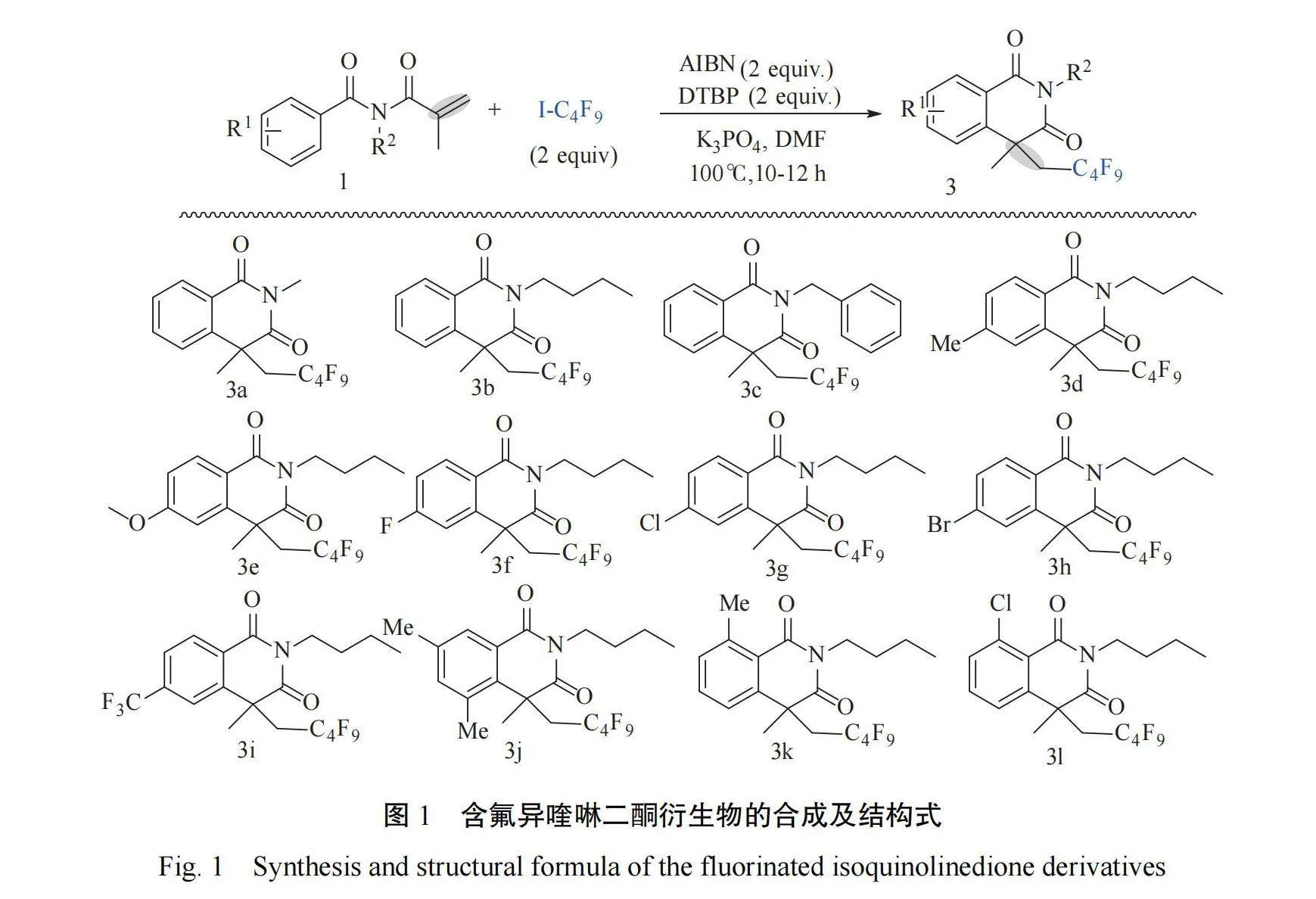
含氟异喹啉二酮衍生物的合成方法和结构见图 1,合成步骤和目标产物物性参考之前的报道[15],合成步骤如下:以产物 3a 合成为例,在带有活塞的 Schlenk 反应管中依次加入 N-丙烯酰基-N-甲基苯甲酰胺 1a(0.3 mmol)、偶氮二异丁腈(0.6 mmol)、二叔丁基过氧化物(0.6 mmol)、全氟碘代丁烷(0.6 mmol)、磷酸钾(0.6 mmol)、2 ml N,N-二甲基甲酰胺为反应溶剂,然后在 N2 保护下,在 100℃ 下搅拌反应 10~12 h。经 TLC 检测反应完全后,加入乙酸乙酯,然后利用食盐水洗,水相再用乙酸乙酯萃取。收集有机相,干燥,真空浓缩,利用柱层析法分离,石油醚-乙酸乙酯(V∶V = 10∶1)洗脱,得到最终目标产物 3a,为一种淡黄色油状液体;其他目标化合物通过类似方法合成得到。
1.4 含氟异喹啉二酮衍生物抗病毒活性测试
取干净的 15 mL 离心管置于小烧杯中,称取 2 mg的目标化合物将其震荡到离心管底部。然后用 100rAfBxsM9Th7FWuiW+o1HHgjb8npG6sTOxG2E21XLb6U=μL 移液枪向离心管中加入 25 μLDMSO,观察目标化合物是否充分溶解,若遇到未充分溶解的情况则用温热水加热使其充分溶解。最后加入二次蒸馏水 4 mL(内含 1% Tween 80)所得化合物溶液浓度即为 500 μg·mL−1。病毒唑采用同样的配置方法。采用半叶枯斑法[16],以病毒唑作为阳性对照药剂,测试了目标化合物对 PVY 抑制活性。采用相同试验方法,将供试浓度改为 500、250、125、62.5、31.25 μg·mL−1 进行相应的测试。分别计算出5 个浓度下的抑制率,然后根据 EC50 的计算公式求出每个待测化合物和对照药病毒唑的 EC50 值。
枯斑抑制率的计算:试验植株在温室培育2~4 d 待明显出现病斑后,记录下左右两半边叶子上的病斑数目,然后按照下列的公式计算化合物对病毒的抑制率。其中,每个处理组均以叶片的另一半对照。
抑制率(%)=[(空白对照枯斑数-药剂处理枯斑数)/空白对照枯斑数]×100
1.4.1化合物对 PVY 侵染植株的活体治疗活性测试 选取长势一致且较好的苋色藜,去除顶端和老叶,每株留 4~5 片大小相当的叶片,先在叶片表面上均匀地洒上一层金刚砂,然后用排笔蘸取病毒液,在下方垫有表面皿的叶面上沿其支脉方向全叶均匀接种病毒,1 h 后,冲洗掉叶片表面的金刚砂,自然晾干。用毛笔蘸取配制好的化合物溶液在叶片右侧轻轻涂抹,左半叶涂抹等剂量溶剂作为对照,将植株放在 30°C 的恒温光照温室中保湿培养,2~4 d 后待叶片出斑后统计枯斑数目。按此方法每个化合物进行 3 次重复,计算抑制率得到治疗活性。
1.4.2化合物对 PVY 侵染植株的活体保护活性测试 选取长势一致且较好的苋色藜,去除顶端和老叶,每株留 4~5 片大小相当的叶子,用毛笔蘸取配制好的化合物溶液均匀涂抹到叶片的右侧,左半叶涂抹等剂量溶剂作为对照,然后将施药后的植株置于 30℃ 温室中培养,24 h 后全叶接种马铃薯Y 病毒。首先在叶片上均匀洒上金刚砂,然后用排笔蘸取病毒汁液全叶接种病毒。1 h 后,冲洗掉叶片表面的金刚砂,自然晾干。将植株放在温度为30℃ 的光照温室中保湿培养,3~4 d 后待叶片出斑后统计枯斑数目。按此方法每个化合物进行 3 次重复,计算抑制率得到保护活性。
1.4.3化合物对 PVY 侵染植株的活体钝化活性测试 选取长势一致且较好的苋色藜,去除顶端和老叶,每株留 4~5 片左右叶片相当的叶子,在叶片表面上均匀地洒上一层金刚砂,然后将供试化合物溶液与等体积的病毒汁液混合钝化 30 min,然后用排笔蘸取混合液,在叶片右半叶表面沿其支脉方向均匀涂抹,左半叶沿其支脉方向涂抹等体积的对应溶剂与病毒液的混合液,在叶片下方用平整支持物支撑,使左右两半边的叶片受力均匀保持一致;1 h 后冲洗掉叶片表面的金刚砂。将植株放在30°C 的恒温光照温室中保湿培养,2~4 d 后待叶片出斑后统计枯斑数目。按此方法每个化合物进行 3 次重复,计算抑制率得到钝化活性。
1.5 化合物与 PVY-CP 的分子对接研究
马铃薯 Y 病毒的外壳蛋白(PVY-CP)在植物病毒的复制和自组装中有着重要作用,PVY-CP 的三维结构(PDB 编码为 6HXX)可从 RCSB PDB蛋白数据库中下载,下载网址为 https://www.rcsb.org/。利用 Chem3D 20.0 软件构建化合物 3e 和商品药剂病毒唑的三维结构,并通过完全最小化模块进行优化,获得能量最低的构象。通过几何互补、能量互补以及化学环境互补的原则来评估配体与PVY-CP 的相互作用,寻找最优的分子口袋进行对接。进行分子对接研究的一般步骤如下,通过数据库下载 PVY-CP 的晶体结构和通过晶体数据库或分子模拟方法构建药物分子三维结构,优化后的PVY-CP 结构被确定为受体,并导出为 pdbqt 文件。活性分子与 PVY-CP 蛋白的相互作用通过Autodock 4. 2. 6 程序进行研究,在对接过程中所有参数都是默认值。对接结果使用 Pymol 进行处理,输出可视化结果。
2 结果与分析
2.1 含氟异喹啉二酮衍生物的表征数据
产物(3a):淡黄色油状液体,收率:71%:1H NMR(400 MHz, CDCl3)δ: 8.30(d, J = 7.9 Hz,1H) , 7.67( t, J = 7.6 Hz, 1H) , 7.52−7.43( m,2H) , 3.51−3.35( m, 1H) , 3.42( s, 3H) , 2.78(ddd, J = 28.1, 15.3, 8.2 Hz, 1H), 1.69(s, 3H);13C NMR(101 MHz, CDCl3)δ:174.7, 163.8, 140.6,133.8, 129.3, 128.1, 125.7, 124.0, 120.5−106.1(m),43.3, 40.5(t, J = 19.6 Hz), 31.9, 27.5, 23.4; HRMS m/z( ESI−TOF) calcd for C16H13F9NO2 [M+H]+422.0798, found: 422.0796.
产物(3b):淡黄色油状液体,收率:73%:1H NMR(400 MHz, CDCl3)δ: 8.32(dd, J = 7.9,1.2 Hz, 1H), 7.66(td, J = 7.7, 1.4 Hz, 1H), 7.52−7.46(m, 1H), 7.43(d, J = 7.9 Hz, 1H), 4.12−3.98(m, 2H), 3.53(dd, J = 33.6, 15.3 Hz, 1H),2.94−2.70(m, 1H), 1.67(s, 3H), 1.63−1.57(m,2H) , 1.42−1.35( m, 2H) , 0.95( t, J = 7.3 Hz,3H).13C NMR(101 MHz, CDCl3)δ: 174.3, 163.5,140.7, 133.6, 129.4, 128.0, 125.7, 124.2, 120.9 −103.1(m), 43.3, 40.6, 40.4(t, J = 20.2 Hz), 32.1,29.6, 20.2, 13.7; 19F NMR( 376 MHz, CDCl3) δ:−81.1(t, J = 9.9 Hz, 3F), −108.0(d, JF−F = 273.4Hz, 1F) , −112.8( d, JF−F = 274.2 Hz, 1F) ,−124.9(br, 2F), −125.1~ −126.8(m,2F); HRMS m/z( ESI−TOF) calcd for C19H19F9NO2 [M+H]+464.1267, found: 464.1266.
产物(3c):淡黄色油状液体,收率: 57%:1H NMR(400 MHz, CDCl3)δ: 8.29(dd, J = 7.9,1.0 Hz, 1H), 7.66(td, J = 7.9, 1.3 Hz, 1H), 7.51−7.45(m, 1H), 7.44−7.39(m, 3H), 7.30−7.22(m,3H), 5.22(q, J = 13.9 Hz, 2H), 3.46(dd, J = 33.5,15.4 Hz, 1H) , 2.85−2.70( m, 1H) , 1.65( s,3H).13C NMR(101 MHz, CDCl3)δ: 174.4, 163.5,140.6, 136.8, 133.8, 129.5, 128.7, 128.4, 128.1, 127.5,125.8, 124.1, 119.1−115.1( m) , 77.4, 77.0, 76.7,43.9, 43.6, 40.2( t, J = 19.7 Hz) , 32.2;19F NMR(376 MHz, CDCl3)δ: −81.1(t, J = 9.9 Hz,3F), −107.4(d, J = 273.3 Hz, 1F), −112.5(d, J =273.9 Hz, 1F), −124.9~ −127.2(m, 2F); HRMS m/z( ESI−TOF) calcd for C22H17F9NO2 [M+H]+498.1111, found: 498.1109.
产物(3d):淡黄色油状液体,收率:75%:1H NMR(400 MHz, CDCl3)δ: 8.17(d, J = 8.1 Hz,1H), 7.28(d, J = 7.0 Hz, 1H), 7.21(s, 1H), 4.05−3.96(m, 2H), 3.43(dd, J = 33.6, 15.2 Hz, 1H),2.76( ddd, J = 27.6, 15.3, 8.6 Hz, 1H) , 2.46( s,3H) , 1.66( s, 3H) , 1.62−1.55( m, 2H) , 1.41−1.34(m, 2H), 0.95(t, J = 7.3 Hz, 3H).13C NMR( 101 MHz, CDCl3) δ: 174.4, 163.5, 144.5, 140.7,129.3, 129.1, 126.0, 121.7, 118.5−105.8(m), 43.3,40.5(t, J = 10.1 Hz), 32.1, 30.9, 29.6, 21.8, 20.2,13.7; 19F NMR(376 MHz, CDCl3)δ: −81.2(t, J =9.8 Hz, 3F) , −108.0( d, JF−F = 273.4 Hz, 1F) ,−112.8(d, JF−F = 274.1 Hz, 1F), −124.9(br, 2F),−125.1~ −126.9(m,2F); HRMS m/z(ESI−TOF)calcd for C20H21F9NO2 [M+H]+478.1424, found:478.1427.
产 物 ( 3e) :淡 黄 色 油 状 液 体 , 收 率 :72%:1H NMR(400 MHz, CDCl3)δ: 8.24(d, J = 8.8 Hz,1H), 7.00(dd, J = 8.8, 2.4 Hz, 1H), 6.85(d, J =2.0 Hz, 1H), 4.04−3.95(m, 2H), 3.90(s, 3H),3.43(dd, J = 33.4, 15.3 Hz, 1H), 2.79−2.65(m,1H) , 1.66( s, 3H) , 1.61−1.56( m, 2H) , 1.37(dd, J = 15.2, 7.5 Hz, 2H), 0.94(t, J = 7.3 Hz,3H);13C NMR(101 MHz, CDCl3)δ:174.3, 163.8,163.1, 142.9, 131.7, 121.0−105.5(m), 117.2, 113.5,111.2, 55.6, 43.5, 40.4(t, J = 19.7 Hz), 32.3, 29.6,23.4, 20.2, 13.7; 19F NMR( 376 MHz, CDCl3) δ:−81.0(t, J = 8.0 Hz, 3F), −108.8(d, JF−F = 268 Hz,1F), −114.9(d, JF−F = 273 Hz, 1F), −124.6(br,2F) , −125.2~ −126.3( m, 2F) ; HRMS m/z( ESI−TOF) calcd for C20H21F9NO3 [M+H]+494.1373, found: 494.1371.
产 物 ( 3f): 淡 黄 色 油 状 液 体 , 55%:1H NMR(400 MHz, CDCl3)δ: 8.33(dd, J = 8.8, 5.8Hz, 1H), 7.23−7.17(m, 1H), 7.13(dd, J = 9.2,2.1 Hz, 1H), 3.53−3.40(m, 4H), 2.72(ddd, J =28.1, 15.4, 8.1 Hz, 1H) , 1.69( s, 3H) ;13C NMR( 101 MHz, CDCl3) δ: 174.1, 166.7( d, J =257.0 Hz), 162.8, 143.6(d, J = 8.8 Hz), 132.4(d,J = 9.8 Hz) , 120.5, 116.1( d, J = 22.2 Hz) ,112.6( d, J = 6.4 Hz) , 109.8−105.1( m) , 43.5,40.6( t, J = 19.6 Hz) , 31.8, 27.4, 23.4; 19F NMR(376 MHz, CDCl3)δ: −81.2(t, J = 9.4 Hz,3F), −103.5(s, 1F), −107.3(d, JF−F = 273.2 Hz,1F), −112.7(d, JF−F = 273.7 Hz, 1F), −124.8(br,2F) , −125.1~ −126.9( m, 2F) ; HRMS m/z( ESI−TOF) calcd for C16H12F10NO2 [M+H]+440.0703, found: 440.0701.
产物(3g):淡黄色油状液体,收率:64%:1H NMR(400 MHz, CDCl3)δ: 8.24(d, J = 8.5 Hz,1H) , 7.47( dd, J = 8.5, 1.9 Hz, 1H) , 7.42( s,1H) , 4.06−3.94( m, 2H) , 3.53−3.39( m, 1H) ,2.81−2.65(m, 1H), 1.68(s, 3H), 1.63−1.55(m,2H), 1.38(dd, J = 15.1, 7.7 Hz, 2H), 0.95(t, J =7.3 Hz, 3H).13C NMR(126 MHz, CDCl3)δ: 173.6,162.6, 142.3, 140.3, 131.0, 128.7, 125.9(d, J = 2.4Hz) , 122.7, 118.3−105.5( m) , 43.3( d, J = 2.6Hz), 40.7, 40.5(t, J = 19.7 Hz), 31.9, 29.5, 20.1,13.7; 19F NMR(376 MHz, CDCl3)δ: −81.2(t, J =9.9 Hz, 3F) , −108.0( d, JF−F = 273.6 Hz, 1F) ,−112.8(d, JF−F = 274.3 Hz, 1F), −124.9(br, 2F),−125.1~ −126.9(m, 2F); HRMS m/z(ESI−TOF)calcd for C19H18ClF9NO2 [M+H]+498.0877, found:498.0874.
产物(3h):淡黄色油状液体,收率:57%:1H NMR(400 MHz, CDCl3)δ: 8.15(d, J = 8.5 Hz,1H) , 7.63( dd, J = 8.5, 1.5 Hz, 1H) , 7.57( s,1H), 4.07−3.93(m, 2H), 3.45(dd, J = 33.7, 15.2Hz, 1H) , 2.81−2.61( m, 1H) , 1.67( s, 3H) ,1.62−1.54( m, 2H) , 1.37( dd, J = 14.7, 7.4 Hz,2H) , 0.95( t, J = 7.3 Hz, 3H) ;13C NMR( 101MHz, CDCl3) δ:173.6, 162.8, 142.4, 131.6, 131.0,128.9, 123.1, 43.3, 40.5(t, J = 19.9 Hz), 32.0, 29.5,20.2, 13.7; 19F NMR(376 MHz, CDCl3)δ: −81.1(t,J = 9.8 Hz, 3F), −108.7(d, JF−F = 262.6 Hz, 1F),−113.9(d, JF−F = 269.3 Hz, 1F), −124.6(br, 2F),−125.1~ −126.9(m,2F); HRMS m/z(ESI−TOF)calcd for C19H18F9NO2 [M+H]+542.0372, found:542.0370.
产物(3i):淡黄色油状液体,收率:51%:1H NMR(400 MHz, CDCl3)δ: 8.44(d, J = 8.2 Hz,1H), 7.75(d, J = 8.3 Hz, 1H), 7.68(s, 1H),4.12−3.96(m, 2H), 3.50(dd, J = 33.4, 15.5 Hz,1H) , 2.87−2.70( m, 1H) , 1.71( s, 3H) ,1.65−1.54( m, 2H) , 1.38( dd, J = 13.8, 7.0 Hz,2H) , 0.96( t, J = 7.3 Hz, 3H) .13C NMR( 101MHz, CDCl3)δ: 173.5, 162.3, 141.4, 135.1(q, J =30.3 Hz) , 130.3, 128.6, 127.1, 124.8( q, J = 10.1Hz), 122.9, 119.8−105.4(m), 43.5, 40.9, 40.5(t,J = 20.2 Hz), 31.9, 29.5, 20.1, 13.6; 19F NMR(376MHz, CDCl3)δ: −63.4(s, 3F), −81.2(t, J = 9.8Hz, 3F) , −107.3( d, JF−F = 273.3 Hz, 1F) ,−112.6(d, JF−F = 273.0 Hz, 1F), −124.9(br, 2F),−125.1~ −126.9(m, 2F); HRMS m/z(ESI)calcd for C20H18F12NO2 [M+H]+532.1141, found:532.1144.
产物(3j):淡黄色油状液体,收率:54%:1H NMR( 400 MHz, CDCl3) δ: 8.07( s, 1H) ,7.26(s, 1H), 4.09−3.92(m, 2H), 3.51(dd, J =35.4, 15.7 Hz, 1H), 3.26−3.10(m, 1H), 2.56(d, J =2.2 Hz, 3H), 2.38(d, J = 2.0 Hz, 3H), 1.73(d, J =2.6 Hz, 3H), 1.62−1.54(m, 2H), 1.42−1.32(m,2H) , 0.94( td, J = 7.3, 2.5 Hz, 3H) ;13C NMR( 101 MHz, CDCl3) δ:175.6, 163.9, 139.4, 137.7,135.5, 135.1, 128.5, 125.1, 118.9~ −109.7( m) ,44.3, 40.8(t, J = 19.2 Hz), 37.4, 29.5, 28.2, 22.3,20.7, 20.2, 13.8; HRMS m/z( ESI−TOF) calcd for C21H23F9NO2 [M+H]+492.1580, found: 492.1577.
产物(3k):淡黄色油状液体,收率:63%:1H NMR(400 MHz, CDCl3)δ: 7.50(t, J = 7.7 Hz,1H), 7.31(d, J = 11.0 Hz, 1H), 7.28(s, 1H),4.04−3.96(m, 2H), 3.45(dd, J = 33.6, 15.3 Hz,1H), 2.82(s, 3H), 2.80−2.66(m, 1H), 1.67(s,3H) , 1.64−1.59( m, 2H) , 1.43−1.37( m, 2H) ,0.96( t, J = 7.3 Hz, 3H) ;13C NMR( 101 MHz,CDCl3) δ:173.9, 163.9, 143.1, 132.4, 132.0, 124.1,122.5, 121.4, 118.7−105.9(m), 43.4, 40.5(t, J =19.7 Hz) , 39.4, 32.6, 29.6, 24.2, 20.3, 13.7; 19F NMR(470 MHz, CDCl3)δ: −81.1(t, J = 8.0 Hz,3F) , −109.0( A−B, JF−F = 269 Hz, 1F) , −114.7( A−B, JF−F = 272 Hz, 1F) , −124.6( br, 2F) ,−125.2~ −126.7(m, 2F); HRMS m/z(ESI−TOF)calcd for C20H21F9NO2 [M+H]+478.1424, found:478.1425.
产物(3l):淡黄色油状液体,收率:57%:1H NMR(400 MHz, CDCl3)δ: 7.54(d, J = 2.1 Hz,1H), 7.38(d, J = 6.6 Hz, 1H), 7.26(d, J = 1.9 Hz,1H), 4.06−3.94(m, 2H), 3.46(dd, J = 33.3, 15.5Hz, 1H) , 2.81−2.65( m, 1H) , 1.68( s, 3H) ,1.62−1.57( m, 2H) , 1.38( dd, J = 15.0, 7.6 Hz,2H) , 0.95( t, J = 7.3 Hz, 3H) ;13C NMR( 101MHz, CDCl3) δ:173.0, 161.1, 143.7, 136.8, 133.0,132.2, 124.9, 121.4, 119.1−105.8(m), 43.6, 40.6(t,J = 19.2 Hz) , 32.4, 29.4, 23.4, 20.2, 13.7; 19F NMR(376 MHz, CDCl3)δ: −81.2(t, J = 9.9 Hz,3F), −108.0(d, JF−F = 273.6 Hz, 1F), −112.8(d,JF−F = 274.3 Hz, 1F), −124.9(br, 2F), −125.1~−126.9(m, 2F); HRMS m/z(ESI−TOF)calcd for C19H18F9ClNO2 [M+H]+498.0877, found: 498.0875.
2.2 含氟异喹啉二酮衍生物的抗病毒活性
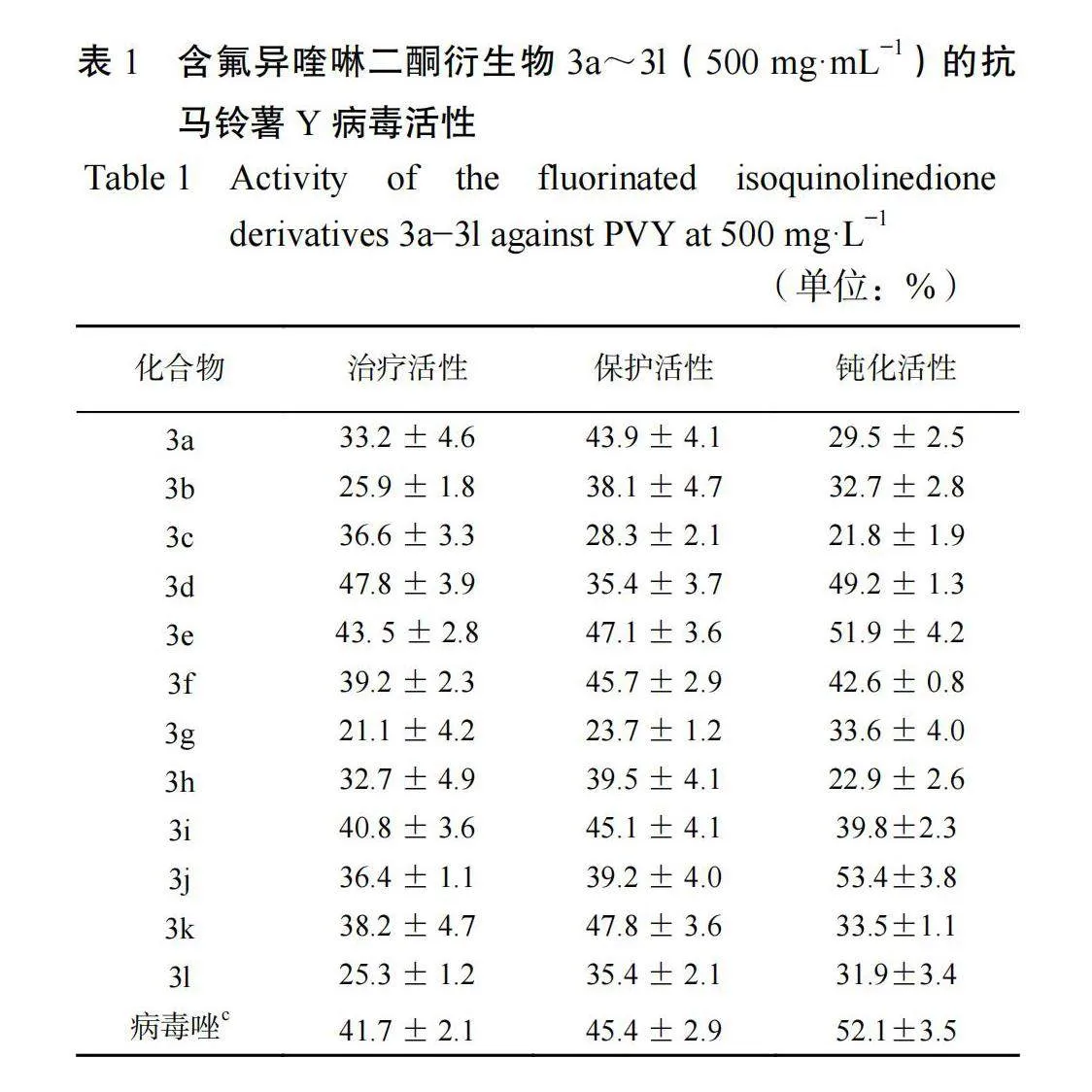
2.2.1含氟异喹啉二酮衍生物的抗 PVY 活性 由表 1 可知,在质量浓度为 500 mg·L−1 时,含氟异喹啉二酮衍生物对 PVY 表现出一定的活性,治疗活性较好的化合物有 3d(47.8%)、3e(43.5%)、3f(39.2%)、3i(40.8%),与阳性对照药剂病毒唑相当(41.7%),其中化合物 3d 和 3e 的治疗活性略高于病毒唑;保护活性较好的化合物有 3e(47.1%)、3f(45.7%)、3i(45.1%)、3k(47.8%),与对照药剂病毒唑相当( 45. 4%);其中化合物3e 和 3k 的保护活性略高于病毒唑;钝化活性较好的化合物有3d(49.2%)、3e(51.9%)、3j(53.4%),与对照药剂病毒唑相当(52. 1%)。由上可知,化合物 3e 的治疗活性、保护活性、钝化活性都与对照药剂病毒唑相当;活体试验见图 2。
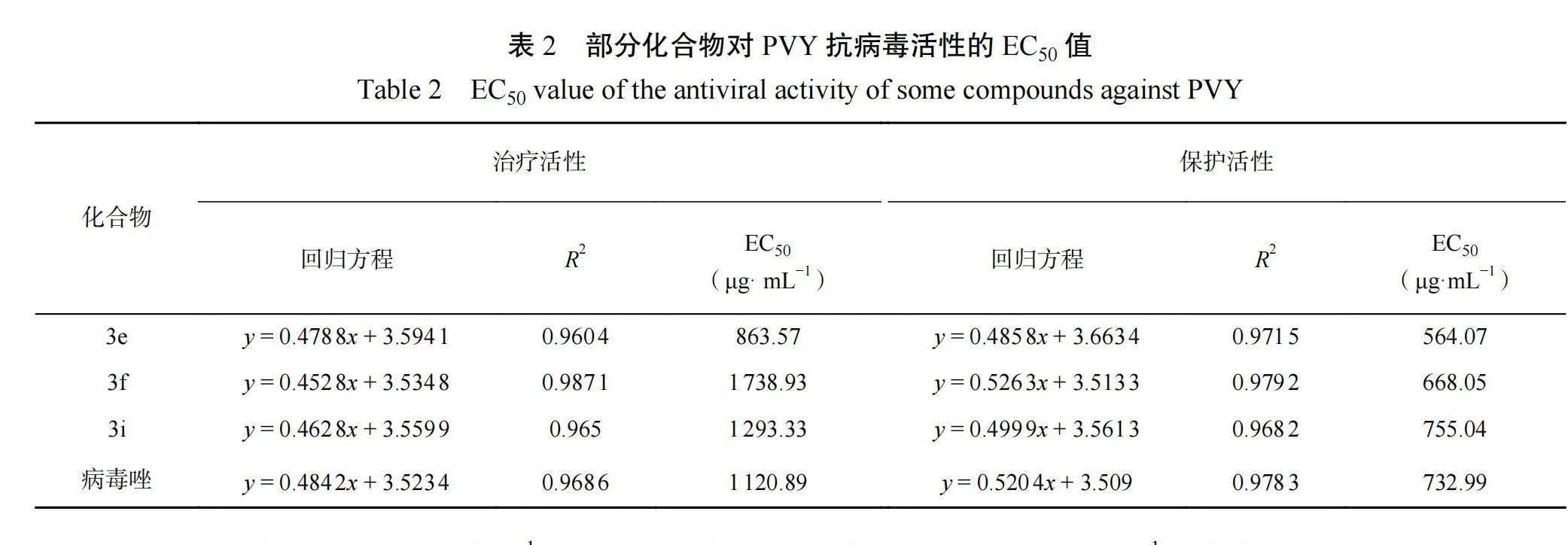
2.2.2含氟异喹啉二酮衍生物抗 PVY 活性的 EC50为了进一步了解目标化合物的抗病毒活性,测试了部分初筛活性较好化合物的 EC50 值,结果见表 2,结果可知化合物 3e 的治疗活性和保护活性的 EC50 值都略优于阳性对照药病毒唑。
初步的构效关系表明,当 R1= 3-OCH3 或 3-F 或 3-CF3 等吸电子基团时,抗 PVY 活性普遍较好,大部分活性都要高于 R1 为甲基和其他卤素(氯和溴)基团,化合物 3e( R1= OCH3,R2=Bu)在保护、治疗和钝化三方面均表现出了较好的抗PVY 活性,与对照药剂病毒唑活性相当或略高。
2.3 目标化合物 3e 与 PVY-CP 的分子对接结果
通过分子对接探究了化合物 3e 与 PVY-CP(PDB 编码:6HXX)的结合模式,其结果见图 3,化合物 3e 对 PVY-CP 有较强的亲和力,结合能为−2.72 kcal·mol−1,病毒唑对 PVY-CP 的结合能为−3.4 kcal·mol−1。化合物 3e 通过氨基酸残基ARG-191 和 ARG-212 插入到 PVY-CP 的活性位点中,这些氨基酸残基在 PVY-CP 的自组装中起着关键作用。其中化合物 3e 的羰基氧原子以及甲氧基氧原子与关键残基(ARG-191 和 ARG-212)之间存在强烈的氢键相互作用,其键长分别为 1.8 Å和2.2 Å。通过对接结果可知化合物 3e 可能和病毒唑一样,破坏了 PVY 外壳蛋白的三维结构使得PVY 粒子无法自组装,从而实现抗病毒效果。
3 结论
本研究以较廉价的成本、较温和的反应条件合成 12 个含氟异喹啉二酮,这类化合物可能具有较好的亲脂性和细胞通透性。采用半叶枯斑法,对目标化合物进行抗 PVY 生物活性测试,根据初筛结果,对部分活性较好化合物抗病毒活性的 EC50 值进行测定,测试结果表明:部分目标化合物对马铃薯 Y 病毒具有较好的抑制活性,其中,化合物3e 的治疗活性(43.5%)、保护活性(47.1%)、钝化活性(51.9%)都表现出较好的效果,与阳性药剂病毒唑活性相当或略高。分子对接结果表明,化合物 3e 可能使得 PVY 外壳蛋白的三维结构被破坏,导致 PVY 颗粒无法自组装,从而产生较强的抗病毒作用。另外在其结构基础上进行更深一步的优化和改进,有望筛选出具有更高抗病毒活性的化合物。
参考文献:
[1]MICHAEL J P.Quinoline,quinazolineandacridonealkaloids[J].,2007,24(1):223−246.
[2]田俊锋,刘军,孙旭,等. 具有生物活性的喹啉类化合物的研究进展[J]. 农药,2011,50(8):552−557.
[3]HOGLUND I P J, SILVER S, ENGSTROM M T, et al.Structure−activityrelationshipof quinolinederivativesaspotentandselectiveα2C-adrenoceptorantagonists[ J] ., 2006,49(2):6351−6363.
[4]KAILA N, JANZ K, DEBERNARDOS,etal.Synthesisandbiological evaluation ofquinoline salicylic Acids as p-selectinantagonists[J]. ,2007,50(1):21−39.
[5]KLINGENSTEIN R,MWLNYK P,LELIVELDSR,et al.Similarstructure−activityrelationshipsofquinolinederivativesforantiprionand antimalarial effects[ J]. , 2006, 49(17):5300−5308.
[6]CAIL, LINC,YFANGJ, etal.PreventingviraldiseasebyZnONPsthroughdirectlydeactivatingTMVandactivatingtheplantimmunity in Nicotianabenthamiana[J].,2019,6(12):3653−3669.
[7]WEI C L, ZHANGJ, SHI J,et al.Synthesis,antiviralactivity,and induction ofplant resistance ofindole analogues bearingdithioacetal moiety[ J]. , 2019, 67( 50):13882−13891.
[8]ZHAOXY, LIAO AC, ZHANG F, etal. Design,synthesis, andbioactivityofnortopsentinanaloguescontaining 1,2,4-triazolemoieties[ J] ., 2019, 57( 2):761−767.
[9]DONGJ, HUANG S S, HAO Y N,et al.Marine-natural-
productsforbiocidesdevelopment:firstdiscoveryofmeridianin alkaloidsasantiviralandantiphytopathogenic-fungusagents[ J] .,2020,76(10):3369−3376.
[10]WANG T N, YANG S, LI H Y, etal.Discovery,structuraloptimization, and mode of action of essramycin alkaloid andits derivativesasanti-tobaccomosaicvirusandantiphytopathogenicfungus agents[J]. ,2020,68(2):471−484.
[11]PRAKASHGS,CHACKOS.Novelnucleophilicandelectrophilicfluoroalkylation methods[J] .,2008,11(6):793−802.
[12]ZHANGB,LICHTENFELD CM, DANILIUC C G, et al. 6-Trifluoromethyl-phenanthridinesthroughradicaltrifluoromethylationofisonitriles[J]. ,2013, 52(41):10792−10795.
[13]王兮,张艳,王剑波. 经由三氟甲基自由基的三氟甲基化反应研 究进展[J].中国科学:化学,2012,42(10):1417−1427.
[14]POSTIGO A, BARATA-VALLEJO S. Metal-mediated radicalperfluoroalkylationoforganiccompounds[J] .,2013,257(21):3051−3069.
[15]DENG Y L,TANGS,DINGGL,etal. ;nediones[J] . , 2016,14(39):9348−9353.
[16]LONGCW,LIP,CHENMH,etal.Synthesis,anti-tobaccomosaicvirus and cucumber mosaic virus activity, and 3D-QSARstudy ofnovel 1, 4-pentadien-3-one derivatives containing 4-thioquinazoline moiety[ J] . ,2015, 102:639−647.
(责任编辑:柯文辉)
