TKI类抗血管药物治疗晚期乳腺癌效果及安全性观察
2024-08-08叶明石王振龙段明月

【摘要】 目的:评估晚期乳腺癌患者使用酪氨酸激酶抑制剂(TKI)类抗血管药物的效果和安全性。方法:回顾性分析2020年6月—2022年7月在吉林省肿瘤医院晚期乳腺癌治疗的102例患者,将接受TKI类抗血管药物患者所接受治疗方案将患者作为观察组(41例),同期接受白蛋白结合型紫杉醇治疗作为对照组(61例)。对比两组客观缓解率(ORR)、临床获益率(CBR)、无进展生存时间(PFS)、总生存时间(OS);检测血清肿瘤标志物[癌胚抗原(CEA)、糖类抗原(CA)153、组织多肽特异抗原(TPS)];按照CTCAE 4.0标准进行分类和记录不良反应。结果:观察组ORR为34.15%,CBR为58.54%,PFS为(11.51±1.64)个月,OS为(28.45±4.84)个月。治疗后,同对照组相比,观察组CEA、CA153、TPS更低,差异均有统计学意义(P<0.05)。观察组1级、2级、3级、4级不良反应与对照组相比,差异均无统计学意义(P>0.05)。结论:TKI类抗血管药物在晚期乳腺癌治疗中显示出一定的效果,具有较高的疾病控制率和可接受的安全性。然而鉴于缺乏完全缓解病例,未来研究需进一步探索与其他治疗方法的联合应用,以提高晚期乳腺癌患者的总体治疗效果。
【关键词】 晚期乳腺癌 酪氨酸激酶抑制剂 抗血管药物 无进展生存时间 不良反应
Observation of the Efficacy and Safety of TKI Class Anti-angiogenic Drugs in the Treatment of Advanced Breast Cancer/YE Mingshi, WANG Zhenlong, DUAN Mingyue. //Medical Innovation of China, 2024, 21(19): -142
[Abstract] Objective: To evaluate the efficacy and safety of tyrosine kinase inhibitors (TKI) anti-angiogenic drugs in patients with advanced breast cancer. Method: A retrospective analysis was conducted on 102 advanced breast cancer patients treated at Jilin Cancer Hospital from June 2020 to July 2022. Patients received TKI anti-angiogenic drugs were designated as the observation group (41 cases), while those received albumin-bound paclitaxel were selected as the control group (61 cases). The objective response rate (ORR), clinical benefit rate (CBR), progression-free survival (PFS), overall survival (OS) were compared; serum tumor markers [carcinoembryonic antigen (CEA), cancer antigen (CA) 153, tissue polypeptide-specific antigen (TPS)] were measured; adverse reactions were classified and recorded according to CTCAE 4.0 criteria. Result: The ORR of the observation group was 34.15%, and the CBR was 58.54%, PFS was (11.51±1.64) months, and OS was (28.45±4.84) months. Post-treatment, the levels of CEA, CA153 and TPS in the observation group were significantly lower than those in the control group, the differences were statistically significant (P<0.05). There were no statistically significant differences in grade 1, 2, 3, and 4 adverse reactions between the observation and control groups (P>0.05). Conclusion: TKI class anti-angiogenic drugs demonstrate certain efficacy in the treatment of advanced breast cancer, with a high disease control rate and acceptable safety profile. However, given the lack of complete remission cases, future research should further explore their combination with other treatment modalities to improve the overall treatment outcomes in advanced breast cancer patients.
[Key words] Advanced breast cancer Tyrosine kinase inhibitors Anti-angiogenic drugs Progression-free survival Adverse reactions
First-author's address: Breast Surgery Department 1, Jilin Cancer Hospital, Changchun 132000, China
doi:10.3969/j.issn.1674-4985.2024.19.032
乳腺癌作为全球范围内妇女最常见的恶性肿瘤之一,其发病率和死亡率始终处于较高水平。乳腺癌的发生和发展是一个复杂的生物学过程,涉及遗传性因素和非遗传性因素的交互作用,目前主要治疗方法通常包括手术治疗、术后化疗和放疗[1-3]。由于易出现耐药、复发和远处转移,晚期乳腺癌的治疗具有特殊的挑战性[4]。酪氨酸激酶抑制剂(tymsine kinase inhibitors,TKI)在其他研究已证明可有效抑制肿瘤生长,增加晚期癌症患者生存率[5]。因此本研究基于吉林省肿瘤医院102例晚期乳腺癌患者的数据,旨在评估TKI类抗血管药物在晚期乳腺癌治疗中的效果和安全性,为未来的临床治疗提供更加丰富的证据支持。
1 资料与方法
1.1 一般资料
回顾性分析2020年6月—2022年7月在本院接受治疗的102例晚期乳腺癌患者资料,选取标准:(1)确诊为晚期乳腺癌(Ⅳ期),符合国家卫生健康委员会医政医管局发表的文献[6]《乳腺癌诊疗指南(2022年版)》标准;(2)观察组治疗方式为TKI类抗血管药物或白蛋白结合型紫杉醇;(3)有可测量或评估的病灶;(4)入院前美国东部肿瘤协作组(ECOG)体能状态评分0~2分;(5)有完整的医疗记录和随访资料。排除标准:(1)有其他活动性恶性肿瘤或过去5年内治愈的第二原发恶性肿瘤(非原位癌,如皮肤基底细胞癌和子宫颈原位癌除外);(2)有严重的肝、肾功能损害;(3)存在其他原发性恶性肿瘤;并发有严重的非肿瘤相关性疾病,包括心血管系统、呼吸系统、神经系统、血液系统、消化系统等严重疾病。将接受TKI类抗血管药物患者所接受治疗方案将患者分为观察组(41例),接受白蛋白结合型紫杉醇治疗对照组(61例)。本研究经吉林省肿瘤医院医学伦理委员会批准。
1.2 方法
(1)收集患者的一般资料(如姓名、年龄、性别、病史、吸烟史、饮酒史、家族史、基础疾病),临床资料(肿瘤分期、病理类型、雌激素受体状态等),治疗方案(包括TKI种类、剂量、治疗周期等),以及随访1年内的资料[不良反应、无进展生存时间(PFS)和总生存时间(OS)]等。(2)效果评估:①根据RECIST 1.1标准评估患者的客观缓解率(ORR)和临床获益率(CBR)。ORR包括完全缓解(CR)和部分缓解(PR);疾病进展(PD)为恶化或肿瘤增大;CBR为ORR加上稳定病情(SD)的比例,CBR=(CR+PR+SD)例数/总例数×100%;ORR=(CR+PR)例数/总例数×100%。PFS指从治疗开始到疾病进展或因任何原因死亡的时间。②肿瘤标志物:使用酶联免疫吸附测定法测定癌胚抗原(CEA)、糖类抗原(CA)153和组织多肽特异抗原(TPS)。(3)安全性评估:根据美国国家癌症研究所共同毒性标准(CTCAE)4.0版本对患者治疗及随访期间的1、2、3、4级不良反应进行分类和评级。
1.3 统计学处理
采用SPSS 26.0软件进行数据分析。对于计量资料,采用(x±s)进行描述,并使用t检验进行组间比较;计数资料采用率(%)描述,组间比较采用字2检验。描述性统计用于基线特征和不良反应的分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较
两组基线资料比较,差异均无统计学意义(P>0.05),见表1。
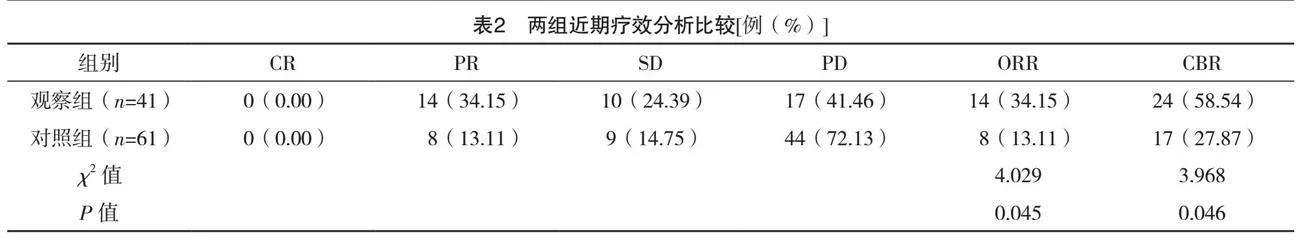
2.2 两组近期疗效分析比较
观察组的ORR和CBR均明显高于对照组,差异均有统计学意义(P<0.05),见表2。
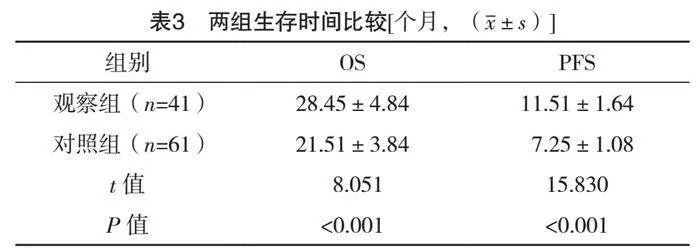
2.3 两组生存时间比较
观察组在OS和PFS方面比对照组更优,差异均有统计学意义(P<0.05),见表3。
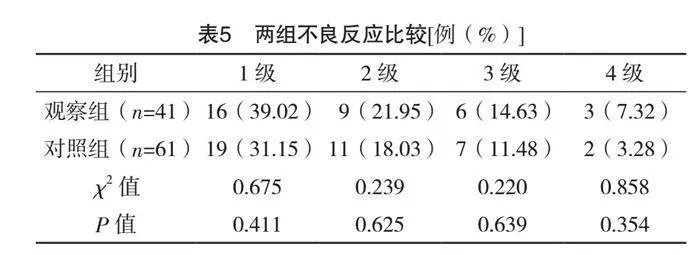
2.4 两组血清肿瘤标志物指比较
治疗前,两组CEA、CA153和TPS比较,差异均无统计学意义(P>0.05);治疗后,观察组CEA、CA153和TPS水平均低于对照组,差异均有统计学意义(P<0.05)。见表4。
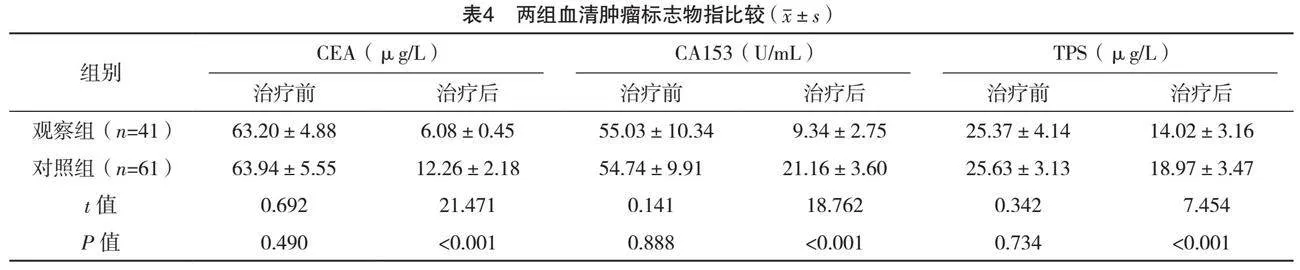
2.5 两组不良反应比较
观察组1级、2级、3级、4级不良反应与对照组比较,差异均无统计学意义(P>0.05),见表5。
3 讨论
乳腺癌是临床常见的女性恶性肿瘤之一,我国发病率呈逐年上升趋势,发病部位主要为乳腺上皮组织[7-8]。晚期乳腺癌,特别是经过常规治疗方法(如内分泌治疗、化疗等)后仍然进展的病例,治疗难度更大,预后较差。因此研究有效的治疗策略对于提高晚期乳腺癌患者的生存质量和延长生存时间具有重要意义。TKI通过针对癌症相关的受体酪氨酸激酶进行靶向作用,通过中断细胞内的信号传导路径来展现其抗癌效果[9]。TKI在晚期乳腺癌的治疗中显示出潜力,但其在实际临床应用中的效果及安全性仍需进一步评估[10]。此外,本研究还将探讨不同亚型的乳腺癌患者对TKI治疗的响应差异,以及TKI联合化疗等综合治疗策略的效果,希望能为个体化治疗提供更多的参考。通过这项研究,我们期望能够更深入地理解TKI在晚期乳腺癌治疗中的作用机制和临床应用价值,为患者带来新的治疗希望。
研究结果显示,在ORR、CBR、PFS、OS及血清肿瘤标志物等方面,接受TKI治疗的患者表现出更佳的效果。在CBR和ORR方面,TKI治疗组表现出显著优于对照组的效果,这与单宏杰等[11]在多线治疗失败的晚期乳腺癌患者中探讨了低剂量阿帕替尼与卡培他滨联合治疗研究结论一致,表明TKI治疗对于晚期多线治疗失败的乳腺癌患者是一种非常有效的治疗选择。在生存时间方面,观察组的PFS和OS均显著长于对照组。这一结果表明TKI类药物可能通过抑制肿瘤生长和扩散,延长患者的生存时间。CEA、CA153和TPS是乳腺恶性肿瘤的重要血清指标,分别用于疾病的敏感性检测、特异性监测和病情进展评估,对于诊断、预测和疗效判断具有显著的临床价值。血清肿瘤标志物的显著下降进一步证实了TKI治疗的有效性[12]。这些生化指标的变化可能反映了肿瘤负担的减少。在1级、2级、3级、4级不良反应方面,两组患者之间没有显著差异两组,说明TKI类药物的安全性概况与白蛋白结合型紫杉醇相似。这一发现对于临床实践具有重要意义,表明在选择治疗方案时,可以根据患者具体情况考虑使用TKI类药物。鉴于晚期乳腺癌患者的治疗选择有限,TKI类药物提供了一种有效的治疗方案。然而选择治疗方案时,还需要考虑患者的个体差异、疾病特征和治疗耐受性。其他研究指出[13-14],TKI类药物会引起慢性粒细胞白血病,在长期用药和随访过程中,未获得缓解的患者未能达到停药标准,停药后无法实现治疗。初期临床试验的结果表明,对于治疗晚期乳腺癌患者,舒尼替尼、索拉非尼和帕挫替尼的疗效受限,同时伴随较多不良反应,因此不被推荐为首选治疗药物,相比之下,阿帕替尼和安罗替尼在早期的临床研究和应用中表现出较好的治疗效果,并且具备可控的安全性[15]。此外,陈丹扬等[16]发现,FOXO3a通过上调HER3表达,促使HER2阳性乳腺癌细胞对TKI治疗产生耐药性,这一发现可能有助于实现更加个体化的乳腺癌治疗及激发更多关于HER2阳性乳腺癌和TKI治疗的研究,以深入了解FOXO3a和HER3在耐药性发展中的确切作用机制。
综上所述,在晚期乳腺癌治疗中,TKI类药物疗效更具优势,且其安全性与白蛋白结合型紫杉醇相当,决策时需考虑个体化治疗和患者的具体情况。
参考文献
[1]翁秀珍,符策岗.有氧糖酵解在乳腺癌中的研究进展[J].中国老年学杂志,2021,41(16):3620-3624.
[2]张玲,逄宗欣,孙萱,等.乳腺癌高危人群BRCA1/2基因突变检测的临床应用价值[J].医学临床研究,2023,40(5):761-764.
[3]沈伟娟,张溢.外周静脉血肿瘤异常蛋白检测对乳腺癌患者的疗效监测及评估价值[J].医学临床研究,2021,38(4):508-511.
[4]刘琳,郑立平,吴柚佼,等.VEGFR-TKIs治疗晚期乳腺癌有效性及安全性的Meta分析[J].海南医学,2023,34(16):2403-2410.
[5] CHENG Y,HE Y,LI W,et al.Osimertinib versus comparator EGFR TKI as first-line treatment for EGFR-mutated advanced NSCLC: FLAURA China, a randomized study[J].Targeted Oncology,2021,16(2):165-176.
[6]国家卫生健康委员会医政医管局.乳腺癌诊疗指南(2022年版)[J].中华肿瘤杂志,2023,45(10):803-833.
[7]王绪麟,刘新梅,王丽华,等.唑来膦酸联合依西美坦治疗激素受体阳性老年乳腺癌的疗效及安全性研究[J].中国现代医学杂志,2023,33(5):23-28.
[8]张云霞,杨波,杨伟强,等.调强放疗下大分割在乳腺癌保乳术后放疗中的疗效观察[J].海军医学杂志,2022,43(10):1132-1135.
[9]刘慧慧,魏静瑶,张丽珍,等.酪氨酸激酶抑制剂引起的肝损伤机制研究进展[J].中国药理学通报,2023,39(9):1613-1617.
[10]陈佳欣,张会强,周金妹,等.晚期乳腺癌新发脑转移患者继续曲妥珠单抗治疗或更换TKI治疗的疗效和安全性比较[J].解放军医学院学报,2023,44(5):475-480.
[11]单宏杰,肖迎利,李红,等.低剂量阿帕替尼联合卡培他滨在多线治疗失败的晚期乳腺癌中的疗效观察[J].重庆医学,2019,48(16):2800-2803.
[12]董南.吡咯替尼治疗老年HER-2阳性晚期乳腺癌的临床效果[J].中国老年学杂志,2021,41(3):497-500.
[13]杨飞.多西紫杉醇联合顺铂治疗晚期乳腺癌的临床效果分析[J].中外医学研究,2017,15(22):133-134.
[14]詹昱,杨志前,曲佳,等.苯所致慢性髓性白血病5例临床分析[J].职业卫生与应急救援,2021,39(3):296-299,355.
[15]李凤娟.应用TKI类抗血管药物治疗晚期乳腺癌的研究[D].长春:吉林大学,2022.
[16]陈丹扬,卢敏莹,曾珊珊,等.FOXO3a反馈上调人表皮生长因子受体3表达介导HER2+乳腺癌细胞酪氨酸激酶抑制剂治疗耐受[J].中国生物化学与分子生物学报,2019,35(8):888-893.
(收稿日期:2024-01-09) (本文编辑:白雅茹)
