基于Kisspeptin/GPR54系统探讨新加二甲地黄汤对PCOS模型大鼠卵泡发育的影响
2024-08-04石明晴王津徐小雨蓝关翠
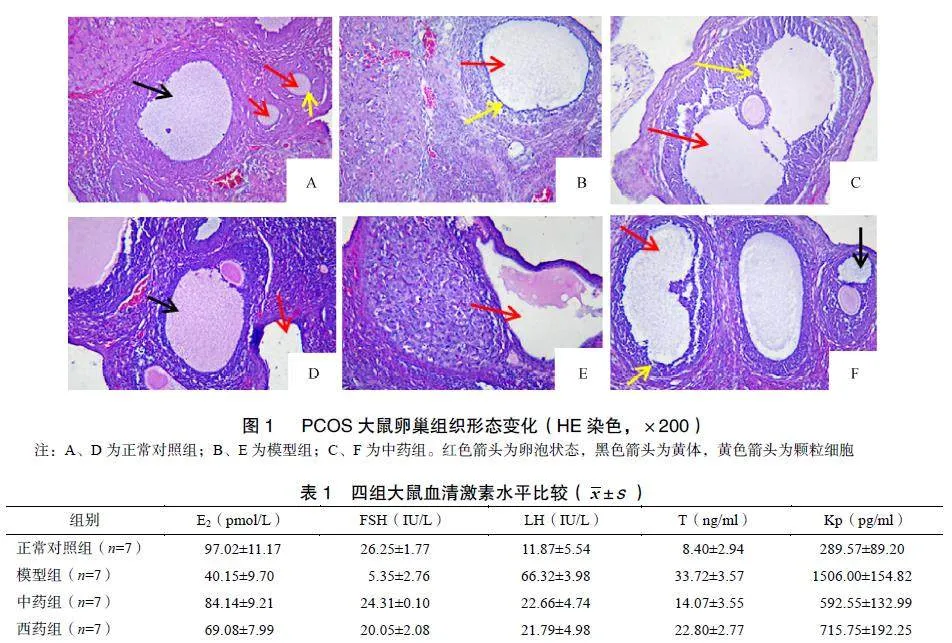
[摘要]目的探讨经新加二甲地黄汤干预后的多囊卵巢综合征(polycysticovarysyndrome,PCOS)模型大鼠的卵泡发育情况及其可能存在的效应机制。方法筛选28只拥有规律动情周期的雌性SD大鼠,随机分为正常对照组、模型组、中药组及西药组,每组7只。除正常对照组外,其余三组均连续予来曲唑-羧甲基纤维素混悬液0.1mg/(kg·d)灌胃,以构建PCOS大鼠模型。自第22天起,中药组以新加二甲地黄汤5.268g/(kg·d)灌胃,西药组以炔雌醇环丙孕酮片0.286mg/(kg·d)灌胃,正常对照组及模型组均以10ml/(kg·d)蒸馏水灌胃。3周后比较各组大鼠卵巢系数,苏木精-伊红染色观察各组大鼠卵巢组织形态学改变,对各组大鼠血清激素均采用酶联免疫吸附试验进行检测,蛋白质印迹法检测卵巢亲吻素(kisspeptin,Kp)、G蛋白偶联受体54(G-protein-coupledreceptor54,GPR54)蛋白表达水平。结果与正常对照组比较,模型组大鼠卵巢内呈现为囊状扩张和闭锁的卵泡增多,其颗粒细胞层数变少,卵巢系数增大;血清睾酮(testosterone,T)、黄体生成素(luteinizinghormone,LH)、Kp水平升高;血清卵泡刺激素(folliclestimulatinghormone,FSH)、雌二醇(estradiol,E2)水平及大鼠卵巢组织中Kp、GPR54蛋白表达均显著降低(P<0.05)。予中药干预后,与模型组比较,中药组大鼠卵巢囊样扩张卵泡数量变少,颗粒细胞的层数增多,存在近成熟的卵泡,并见少量黄体存在;大鼠血清LH、T、Kp水平下降,血清FSH、E2水平及卵巢Kp、GPR54蛋白表达显著升高(P<0.05)。结论PCOS模型大鼠的卵泡发育情况经新加二甲地黄汤干预后得以改善,该治疗机制可能为通过调控Kisspeptin/GPR54系统影响FSH和LH的释放,以此影响激素含量,调整卵巢功能,使卵泡发育和排卵能力得以改善。
[关键词]新加二甲地黄汤;多囊卵巢综合征;G蛋白偶联受体54;Kisspeptin;性激素
[中图分类号]R711[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.18.020
ExploringtheeffectofXinjiaErjiaDihuangTangonfolliculardevelopmentinPCOSmodelratsbasedontheKisspeptin/GPR54system
SHIMingqing1,WANGJin1,XUXiaoyu2,LANGuancui1
1.DepartmentofObstetricsandGynecology,LishuiHospitalofTraditionalChineseMedicine,Lishui323000,Zhejiang,China;2.TheThirdClinicalSchoolofMedicineSchool,ZhejiangChineseMedicineUniversity,Hangzhou310053,Zhejiang,China
[Abstract]ObjectiveToinvestigatethedevelopmentoffolliclesinpolycysticovarysyndrome(PCOS)modelratstreatedwithXinjiaErjiaDihuangTanganditspossiblemechanism.MethodsTwenty-eightfemaleSDratswithregularestrouscyclewereselectedandrandomlydividedintonormalcontrolgroup,modelgroup,ChinesemedicinegroupandWesternmedicinegroup,with7ratsineachgroup.Inadditiontothenormalcontrolgroup,theotherthreegroupswerecontinuouslygiven0.1mg/(kg·d)ofletrozole-carboxymethylcellulosesuspensiontoconstructthePCOSratmodel.Sincethe22ndday,thetraditionalChinesemedicinegroupwasgiven5.268g/(kg·d)ofXinjiaErjiaDihuangTang,thewesternmedicinegroup wasgiven0.286mg/(kg·d)ofethinylestradiolcyproteronetablet,andthenormalcontrolgroupandmodelgroupweregiven10ml/(kg·d)ofdistilledwater.After3weeks,theovariancoefficientsoftheratsinallgroupswerecompared,andthemorphologicalchangesoftheovariantissuesoftheratsinallgroupswereobservedbyhematoxylin-eosinstaining.Theserumhormonesoftheratsinallgroupsweredetectedbyenzyme-linkedimmunosorbentassay,andtheovariankisspeptin(Kp)andG-protein-coupledreceptors(GPR54)proteinexpressionlevelsweredetectedbyWesternblot.ResultsComparedwiththenormalcontrolgroup,thefolliclesintheovaryofthemodelgroupshowedmorecysticdilatationandatresia,andthenumberofgranularcelllayersdecreased,theovariancoefficientofthemodelgroupwasincreased;Serumlevelsoftestosterone(T),luteinizinghormone(LH)andKpwereincreasedinmodelgroup;Serumlevelsoffolliclestimulatinghormone(FSH)andestradiol(E2)andproteinexpressionsofKpandGPR54inovariantissueofratsinthemodelgroupweresignificantlydecreased(P<0.05).AftertreatmentwithChinesemedicine,comparedwiththemodelgroup,thenumberoffolliclesintheChinesemedicinegroupdecreased,thelayernumberofgranulosacellsincreased,therewerenearlymaturefollicles,andasmallamountofcorpusluteumexisted,serumLH,TandKplevelsweredecreased,serumFSHandE2levelsandovarianKpandGPR54proteinexpressionsweresignificantlyincreased(P<0.05).ConclusionThedevelopmentoffolliclesinPCOSmodelratswasimprovedbytheinterventionofXinjiaErjiaDihuangTang.ThetherapeuticmechanismmaybetoaffectthereleaseofFSHandLHbyregulatingKisspeptin/GPR54system,soastoaffecthormonecontent,adjustovarianfunction,andimprovefollicledevelopmentandovulationability.
[Keywords]XinjiaErjiaDihuangTang;Polycysticovarysyndrome;G-protein-coupledreceptor54;Kisspeptin;Sexhormones
多囊卵巢综合征(polycysticovarysyndrome,PCOS)是生殖内分泌缺陷类疾病,常伴有代谢功能失调,发病率5%~20%[1]。PCOS是干扰卵泡发育及排卵而致无排卵性不孕的关键原因之一[2]。PCOS病因复杂,病机尚未完全明确,主要与下丘脑-垂体-性腺轴功能失衡相关[3]。而亲吻素(kisspeptin,Kp)作为该轴上可刺激促性腺激素释放激素(gonadotropin-releasinghormone,GnRH)神经元的因子,通过调控GnRH的分泌,进而引发生殖轴后续的激素变化及反馈[4-5]。针对PCOS的发生、发展,国内外大量的临床研究和相关动物实验证实Kp的异常分泌与其存在密切联系[6-8]。
笔者在长期工作中使用二甲地黄汤治疗PCOS,并通过加减逐渐演变成新加二甲地黄汤,临床发现新加二甲地黄汤可调节PCOS患者的内分泌功能,促卵泡发育和排卵,但并未清楚其中具体的作用机制。本研究选取PCOS大鼠作为研究对象,基于卵巢Kisspeptin/G蛋白偶联受体54(G-protein-coupledreceptor54,GPR54)系统,探讨新加二甲地黄汤改善卵泡发育的可能作用机制。
1实验材料
1.1材料
28只6周龄雌性SD大鼠均购自上海西普必凯实验动物有限公司,本研究动物许可证号为SCXK(沪)2022-0004。本研究经上海市轩祎实验中心伦理委员会审批通过(伦理审批号:RSXY-2022-00327)。
1.2实验药物
新加二甲地黄汤:炙龟板、炙鳖甲、熟地黄、淮山药、山茱萸、菟丝子、茯苓、丹皮、莲子心,以上药材一次性购于丽水市中医院。将以上中草药材放于罐中浸泡,浸泡时间为1h,煎药方法为先用武火将其煮沸,再以文火煎煮20min;过滤,再以相同方法复煮2次,最后混合中药滤液,在55~60℃水浴中浓缩,使1ml的中草药液相当于该生药2.14g。待煎剂冷却后,置于4℃环境中保存。
其他药物:炔雌醇环丙孕酮片(批准文号:国药准字J20100003,生产单位:拜耳医药保健有限公司广州分公司,规格:0.5g/片)、来曲唑片(批准文号:国药准字H19991001,生产单位:江苏恒瑞医药股份有限公司,规格:2.5mg/片)、羧甲基纤维素购自上海源叶生物科技有限公司(批号:M16GS148501)。
1.3实验试剂
大鼠卵泡刺激素(folliclestimulatinghormone,FSH)、大鼠黄体生成素(luteinizing hormone,LH)、大鼠睾酮(testosterone,T)、大鼠雌二醇(estradiol,E2)及大鼠Kp酶联免疫吸附试验(enzymelinkedimmunosorbentassay,ELISA)测定试剂盒购自上海美轩生物有限公司,生产批号:MEXN-R0367、MEXN-R0025、MEXN-R0061、MEXN-R0327、MEXN-R1036;兔抗磷酸甘油醛脱氢酶单克隆抗体(稀释比例1∶5000)、兔抗GPR54单克隆抗体(稀释比例1∶1000)及兔抗Kp单克隆抗体(稀释比例1∶1000)购自美国CST公司,货号:5174、18375-1-ap、15505-1-ap;辣根过氧化物酶标记的羊抗兔免疫球蛋白和二喹啉甲酸(bicinchoninicacidassay,BCA)蛋白定量试剂盒购自上海碧云天生物技术有限公司,生产批号:20221105;预染蛋白分子量标准购自加拿大Fermentas公司,货号:SM0671;丙烯酰胺和N,N'-亚甲基双丙烯酰胺购自美国Amresco公司,生产批号:20220815、20220926。
1.4实验仪器
酶标仪购自北京普朗新技术有限公司,型号:DNM9602;RM2145型冰冻切片机购自德国LEICA公司;JB-P5型包埋机购自武汉俊杰电子有限公司;LW300LFT-LED型生物显微镜购自上海测维光电技术有限公司;MultSkanMK3型酶标仪购自美国Thermo公司;Mini-PROTEANTetreCell小型电泳槽、PowerPaceBasicPowerSupply基础电泳仪、MiniTrans-BlotElectrophoreticTransferCell小型转应槽购自美国BIO-RAD公司,仪器型号:165-8001、164-5050、170-3930。
2实验方法
2.1构建PCOS大鼠模型
将6周龄雌性SD大鼠予来曲唑0.1mg/(kg·d)灌胃,共21d。按文献[9]的方法,通过阴道涂片检测大鼠动情周期,观察卵巢形态及体质量变化,检测血清激素水平等,最终选取符合PCOS标准的大鼠模型。
2.2分组与给药
28只雌性大鼠按随机数字表法分为正常对照组、模型组、西药组、中药组,每组7只。西药组:炔雌醇环丙孕酮0.005mg/(kg·d),相当于成人临床剂量的10倍,将炔雌醇环丙孕酮配制成0.0286mg/ml的溶液,以1ml/100g剂量灌胃[10];中药组:新加二甲地黄汤5.268g/(kg·d),相当于成人剂量的10倍,新加二甲地黄汤浓缩液配成0.526g/ml液体,以1ml/100g灌胃;灌胃频次1次/d,接连灌胃21d;正常对照组与模型组大鼠以等体积量蒸馏水灌胃。
2.3取材
选取经阴道涂片提示处于动情期的大鼠,测量体质量。大鼠腹腔内注射水合三氯乙醛溶液进行麻醉,从心脏取血进行离心,取上清液用于检测血清激素含量。取出大鼠两侧卵巢用0.9%生理盐水洗净,一个用苏木精-伊红染色(ematoxylinandeosinstaining,HE染色),于4%多聚甲醛中固定;另一个保存于有液氮的冷存管内备用。
2.4HE染色
将大鼠卵巢制成石蜡切片,在常规梯度乙醇下脱蜡至水,进行HE染色;再予梯度乙醇脱水,待二甲苯完全透明后,使用中性树胶封堵。最后用显微镜观察四组大鼠卵巢组织的形态变化。
2.5ELISA检测大鼠血清中T、FSH、LH、E2及Kp水平
大鼠血样本静置30min,以3500转/min离心,取上层血清根据ELISA试剂盒说明书检测T、FSH、LH、E2及Kp。将10μm样品及40μm样品稀释液分别加入样本孔,温育洗涤后,加入酶标试剂及显色剂,再加入终止液,静置15min。用波长450nm进行吸光度测量,最终对血清中各激素水平进行计算和分析。
2.6蛋白质印迹法检测大鼠卵巢组织中Kp及GPR54蛋白表达水平
提取大鼠卵巢组织中的蛋白,应用BCA蛋白检测试剂盒,按说明书对各组大鼠的蛋白浓度进行检测。将蛋白样品与缓冲液充分混匀后,取出80mg混合液,采用半湿转法转到0.22pm聚偏二氟乙烯膜上,一抗浓度Kp稀释比例1∶1000,GPR54稀释比例1∶1000,羊抗兔二抗浓度1∶5000。应用增强型化学发光试剂盒进行曝光,ImageJ软件对免疫印迹结果进行分析。
2.7统计学方法
采用SPSS23.0统计学软件对数据进行处理分析。计量资料以均数±标准差(![]() )表示,计数资料以例数(百分率)[n(%)]表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
)表示,计数资料以例数(百分率)[n(%)]表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3结果
3.1各组大鼠卵巢组织的形态学变化
大鼠卵巢组织经HE染色后,正常对照组可见皮质部内存有发育程度不一的卵泡,颗粒细胞布列有序、紧密,结构完备,层数多为6~8;模型组大鼠皮质内未观察到已成熟卵泡,而内见数量较多的闭锁卵泡呈现为囊样扩张,且空囊腔较大、数量较多,该颗粒细胞层稀薄,分布松散、紊乱;中药组大鼠卵巢内呈囊状改变的卵泡数量变少,颗粒细胞层增厚,除出现卵冠丘复合体的近成熟卵泡外,还可看到其内有黄体。见图1。
3.2新加二甲地黄汤对PCOS大鼠卵巢指数的影响
造模21d后,模型组大鼠卵巢指数[(1.22±0.10)mg/g]较正常对照组[(0.82±0.13)mg/g]明显增高,差异有统计学意义(P<0.05);与模型组比较,中药组[(0.78±0.08)mg/g]及西药组[(0.80±0.10)mg/g]大鼠卵巢指数降低,差异有统计学意义(P<0.05)。
3.3新加二甲地黄汤对PCOS大鼠激素水平的影响
造模21d后,与正常对照组比较,模型组大鼠血清LH、T、Kp水平明显升高(P<0.05),E2、FSH水平明显降低(P<0.05);与模型组比较,中药组及西药组大鼠LH、T、Kp水平下降(P<0.05);与模型组比较,中药组及西药组大鼠FSH、E2水平升高(P<0.05)。见表1。
3.4新加二甲地黄汤对PCOS大鼠卵巢中Kp、GPR54蛋白表达的影响
造模21d后,模型组大鼠卵巢中Kp及GPR54蛋白表达灰度值[(0.606±0.131),(0.415±0.106)]较正常对照组[(1.575±0.178),(1.918±0.065)]明显降低,差异有统计学意义(P<0.05);与模型组比较,中药组(1.404±0.094)及西药组(1.086±0.052)大鼠卵巢中Kp蛋白表达灰度值升高,差异有统计学意义(P<0.05);与模型组比较,中药组(1.372±0.177)及西药组(1.060±0.091)大鼠卵巢中GPR54蛋白表达灰度值升高,差异有统计学意义(P<0.05)。
4讨论
中医理论认为PCOS的发病主要在于肾虚,因受先天禀赋不足的影响,使肾阴之濡养、肾阳之温化及肾气之推动功能受损[11-12];加之因乙癸同源,肝肾之精与血皆源于水谷精微,故可互生。肾水为肝木之母,水润则木得涵养以升发,若水乏则木燥使得条达受制;肝体阴而用阳,郁久易化火,火易炼水,使肾水愈亏;精血化生愈难以充满冲任血海,胞络失精血所养,胞宫经血满溢无能,故妇女可出现月水稀发,甚则经闭;肾气鼓动血行失职,肝疏泄气机失司,气血通行受限,气滞血阻,冲任不畅,胞络阻滞,导致排卵障碍。因此中医认为PCOS疾病的发生主要在肾、肝、脾的功能失衡,故治疗上,主要为补益肝肾的阴血。根据调周法理念,主要以月经后期养阴为基础,辅以健脾利湿、化痰散瘀,佐以疏肝理气[13]。新加二甲地黄汤源自《中医临床妇科学》[14],并通过加减化裁而成,方中以炙龟板、炙鳖甲及熟地黄为君药,其中炙龟板、炙鳖甲用以滋阴潜阳兼散结,熟地黄以益精填髓、补肾养肝、滋阴养血为主,淮山药与山茱萸均可益肾。前者兼健脾,后者兼养肝,两者共为臣药,使肾、肝、脾三脏皆得助。予菟丝子佐以调补肾中之阴阳,使滋肾阴又助肾阳。旨在遵循“阳中求阴”之意。茯苓健脾益气兼渗湿,入脾经,丹皮清泄肝火又化瘀,归肝经,加莲子心以安心宁神且清心,归心经,三药共为本方使药。全方共施补肾养阴、疏肝健脾宁心之妙用。且经研究表明补肾之品具有调节和改善女性卵巢功能的作用[15-16]。本课题组临床研究予新加二甲地黄汤治疗PCOS患者,证实该方不仅可调整患者的月经情况,还可调节患者的生殖激素水平及促卵泡发育和排卵[17];但具体作用机制尚未明确。
本研究应用来曲唑灌胃人工诱导建立PCOS大鼠模型,阴道涂片结果提示大鼠丧失动情周期规律;血清LH、T水平升高,经HE染色后发现卵巢组织内呈囊状改变的卵泡数量增多、卵泡颗粒细胞明显稀疏、黄体个数变少。与文献结果一致,且与PCOS的体征及诊断标准相符,说明应用以上建模方法较为成功地复刻了PCOS的相关特征[18-19]。
PCOS的病因复杂且多变,其致病机制目前尚未完全明晰,但经研究证实可能与下丘脑-垂体-卵巢(hypothalamic-pituitaryovary,HPO)轴的功能紊乱及脑内GnRH神经元网络功能障碍有关[20]。PCOS患者LH、FSH值升高是由于GnRH脉冲式传导频次增多和LH对GnRH的高应答,引起HPO轴功能紊乱,从而影响PCOS患者卵泡发育[21]。另外,LH脉冲释放频率可受过度活跃的GnRH神经元的影响而增加,雄激素的分泌则受上游LH的驱动而增多,进而引起PCOS的发生,故此也是导致PCOS发生的重要机制之一[22]。本研究以新加二甲地黄汤干预PCOS大鼠后,结果显示PCOS大鼠血清LH、T水平降低,说明新加二甲地黄汤可改善PCOS大鼠性激素紊乱。
Kp是通过Kiss1基因编码所表达的一类多肽,多与其受体GPR54相结合而发挥生物学作用[23]。Kp作为HPO轴的上游,可作用于GnRH神经元以刺激GnRH的分泌,GnRH进一步调控垂体分泌的LH和FSH以影响卵巢的功能[24]。研究发现PCOS患者血清Kp水平较正常女性偏高,而异常升高的Kp水平可导致LH水平升高,导致高雄激素血症[8,25]。本研究结果显示PCOS大鼠血清LH、T、Kp水平均高于正常对照组,说明Kisspeptin/GPR54系统与PCOS大鼠的LH、T存在关联;而予新加二甲地黄汤干预PCOS大鼠后,PCOS大鼠血清Kp水平有所下降,说明新加二甲地黄可改善PCOS大鼠Kp水平。
研究发现卵巢颗粒细胞因PCOS患者体内异常升高的雄激素而加速凋亡,并引起过早的黄素化,影响体内卵泡发育及排卵功能[26]。另有研究发现Kisspeptin/GPR54系统在PCOS大鼠卵巢组织中呈现低表达,而低表达的Kisspeptin/GPR54系统影响颗粒细胞数量或功能,从而干扰卵泡正常的生长发育[17,27-28]。本研究中模型组大鼠卵巢Kp、GPR54蛋白表达降低,与文献[27]结果一致。其蛋白表达量下降可能与PCOS颗粒细胞减少有关。而经过新加二甲地黄汤干预后,PCOS大鼠卵巢系数降低,其组织形态学观察可见表现为囊样扩张和闭锁的卵泡数量较模型组变少,颗粒细胞的层数增多,且存在近乎成熟的卵泡;并且卵巢内可见少量黄体,表明新加二甲地黄汤可改善卵泡发育及促排卵。PCOS大鼠卵巢内的Kp和GPR54的蛋白水平呈不同幅度的增长,表明新加二甲地黄汤可能是经过调节和控制Kisspeptin/GPR54系统以促卵泡发育及排卵。
综上所述,新加二甲地黄汤具有改善PCOS大鼠卵巢指数大小、调节性激素水平、促进卵泡发育及排卵的功能,可能为通过调控Kisspeptin/GPR54系统来影响FSH和LH的释放,调控PCOS的性腺功能,以此提升卵泡的发育及排卵能力,其具体作用机制有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 柳丽佳,邵铜,方媛,等.1990—2019年中国多囊卵巢综合征发病趋势分析[J].中国预防医学杂志[J].2023,24(3):259–263.
[2] 袁莹莹,赵君利.多囊卵巢综合征流行病学特点[J].中国实用妇科与产科杂志,2019,35(3):261–264.
[3] 张楚,董浩旭,宋玙璠,等. 多囊卵巢综合征相关不孕症发病机制的研究进展[J].现代妇产科进展,2020,29(8):629–631.
[4] TREVISANCM,MONTAGNAE,DEOLIVEIRAR,etal.Kisspeptin/GPR54system:Whatdoweknowaboutitsroleinhumanreproduction?[J].CellPhysiolBiochem,2018,49(4):1259–1276.
[5] MAGGIR,CARIBONIAM,MARELLIMM,etal.GnRHandGnRHreceptorsinthepathophysiologyofthehumanfemalereproductivesystem[J].HumReprodUpdate,2016,22(3):358–381.
[6] YUANC,HUANGWQ,GUOJH,etal.Involvementofkisspeptininandrogen-inducedhypothalamicendoplasmicreticulumstressanditsrescuingeffectinPCOSrats[J].BiochimBiophysActaMolBasisDis,2021,1867(12):166242–166253.
[7] HUKL,ZHAOH,MINZ,etal.IncreasedexpressionofKISS1andKISS1receptorinhumangranulosaluteincells-potentialpathogenesisofpolycysticovarysyndrome[J].ReprodSci,2019,26(11):1429-1438.
[8] TANGR,DINGX,ZHUJ.Kisspeptinandpolycysticovarysyndrome[J].FrontEndocrinol(Lausanne),2019,10:298–303.
[9] KAFALIH,IRIADAMM,OZARDALII,etal.Letrozole-inducedpolycysticovariesintherat:Anewmodelforcysticovariandisease[J].ArchMedRes,2004,35(2):103–108.
[10] 黄晓,吉柳,谢红梅,等.二甲双胍治疗多囊卵巢综合征研究进展[J].中国药房,2014,25(12):1143–1145.
[11] 吴继妹,毋振华,王香桂.王香桂治疗多囊卵巢综合征不孕经验[J].浙江中西医结合杂志,2010,20(2):72–73.
[12] 高悦,王国华.王国华教授治疗非肥胖型多囊卵巢综合征不孕症的经验[J].吉林中医药,2019,39(6):717–721.
[13] 陈婕,谈勇,任青玲,等.国医大师夏桂成调治PCOS的理念与方法[J].南京中医药大学学报,2017,33(6):551–553,69.
[14] 夏桂成.中医临床妇科学[M].北京:人民卫生出版社,2007.
[15] STEINERAZ,PRITCHARDD,STANCZYKFZ,etal.Associationbetweenbiomarkersofovarianreserveandinfertilityamongolderwomenofreproductiveage[J].JAMA,2017,318(14):1367–1376.
[16] MAQW,TANY.Effectivenessofco-treatmentwithtraditionalChinesemedicineandletrozoleforpolycysticovarysyndrome:ameta-analysis[J].JIntegrMed,2017,15(2):95–101.
[17] 石明晴,王津.二甲地黄汤合达英-35治疗肾虚肝郁型PCOS的临床疗效[J].中国现代医生,2023,61(26):108–112.
[18] 骆倩倩,张冬梅,蔺香云,等.Kisspeptin/kiss1r系统在多囊卵巢综合征大鼠卵巢中的表达及其对卵泡发育障碍的可能作用机制[J].解剖学杂志,2016,39(2):156–160.
[19] 宋颖,李蓉.多囊卵巢综合征中国诊疗指南解读[J].实用妇产科杂志,2018,34(10):737–41.
[20] 杜晓琴,刘美玉,尹菊.神经内分泌在多囊卵巢综合征发病机制中的研究进展[J].国际妇产科学杂志,2020,47(5):503–507.
[21] 王凡,张正红,肖开转,等.下丘脑-垂体-肾上腺轴和下丘脑-垂体-卵巢轴在多囊卵巢综合征神经内分泌功能紊乱中的作用[J].中国医学科学院学报,2017,39(5):699–704.
[22] SILVAMSB,DESROZIERSE,HESSLERS,etal.ActivationofarcuatenucleusGABAneuronspromotesluteinizinghormonesecretionandreproductivedysfunction:Implicationsforpolycysticovarysyndrome[J].EBioMedicine,2019,44:582–596.
[23] KOTANIM,DETHEUXM,VANDENBOGAERDEA,etal.ThemetastasissuppressorgeneKiss-1 encodeskisspeptins,thenaturalligandsoftheorphanGprotein-coupledreceptorGPR54[J].JBiolChem,2001,276(37):34631–34636.
[24] SMITHJT,CLAYCM,CARATYA,etal.Kiss-1messengerribonucleicacidexpressioninthehypothalamusoftheeweisregulatedbysexsteroidsandseason[J].Endocrinology,2007,148(3):1150–1157.
[25] FRANKSS,HARDYK.Androgenactionintheovary[J].FrontEndocrinol(Lausanne),2018,9:452–456.
[26] OKUTSUY,ITOHMT,TAKAHASHIN,etal.Exogenousandrostenedioneinducesformationoffollicularcystsandprematureluteinizationofgranulosacellsintheovary[J].Fertilityandsterility,2010,93(3):927–935.
[27] 刘冉冉,骆倩倩,孙晓娟,等.多囊卵巢综合征大鼠卵巢中kisspeptin/kiss1r系统的表达及作用研究[J].中国医药导报,2020,17(19):16–19,198.
[28] LIUH,XUG,YUANZ,etal.Effectofkisspeptinontheproliferationandapoptosisofbovinegranulosacells[J].AnimReprodSci,2017,185:1–7.
(收稿日期:2023–11–07)
(修回日期:2024–06–11)
