生物信息学鉴定青少年特发性脊柱侧凸关键生物标志物
2024-08-04徐海鹏姜雅亨文亚刘晨王恺骐杜红根
[摘要]目的对青少年特发性脊柱侧凸(adolescentidiopathicscoliosis,AIS)患者间质干细胞的基因芯片数据进行生物信息学分析,探究AIS致病机制和治疗靶点。方法从基因表达综合数据库(geneexpressionomnibus,GEO)下载基因芯片GSE110359,获取AIS患者与非AIS患者间质干细胞中的基因表达谱。利用加权基因共表达网络分析(weightedgeneco-expressionnetworkanalysis,WGCNA)识别AIS关键模块,并对其进行基因本体(geneontology,GO)功能分析和京都基因与基因组百科全书(KyotoEncyclopediaofGenesandGenomes,KEGG)富集分析;同时,对其28种不同类型免疫细胞进行免疫细胞浸润分析和蛋白质–蛋白质相互作用(protein-proteininteraction,PPI)分析,并筛选出核心基因。结果确定8个基因共表达模块,GO富集在对氧减少的反应水平、低氧反应、对氧水平的反应、核糖核蛋白复杂组装、胶原蛋白−包含细胞外基质、剪接体snRNP复合物、snRNA结合、细胞外基质结构组成,KEGG信号通路富集在低氧诱导因子-1信号通路、剪接体、细胞铁死亡、脂肪酸降解等通路。此外,免疫浸润结果发现,AIS组单核细胞较非AIS组明显减少(P<0.05);而AIS组的活化树突状细胞浸润程度更高(P<0.05),通过PPI分析,筛选出血管生成素样4(angiopoietin-like4,ANGPTL4)、CXC基序趋化因子配体8(C-X-Cmotifchemokineligand8,CXCL8)、溶质载体家族2成员1(solutecarrierfamily2member1,SLC2A1)、己糖激酶2(hexokinase2,HK2)、转铁蛋白受体蛋白(transferrinreceptorprotein,TFRC)在内的5个核心基因。结论ANGPTL4、CXCL8、SLC2A1、HK2、TFRC是AIS患者的潜在生物标志物与治疗靶点,而单核细胞和活化树突状细胞可能是AIS患者的重要免疫治疗靶点。
[关键词]青少年特发性脊柱侧凸;加权基因共表达网络分析;生物信息学
[中图分类号]R735.3[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.18.001
Identificationofkeybiomarkersinadolescentidiopathicscoliosisbybioinformaticsanalysis
XUHaipeng,JIANGYaheng,WENYa,LIUChen,WANGKaiqi,DUHonggen
DepartmentofTuina,theFirstAffiliatedHospitalofZhejiangChineseMedicalUniversity,ZhejiangProvincialHospitalofTraditionalChineseMedicine,Hangzhou310006,Zhejiang,China
[Abstract]ObjectiveThisstudyaimstoinvestigatethepathogenesisandidentifypotentialtherapeutictargetsforadolescentidiopathicscoliosis(AIS)throughtheutilizationofbioinformaticsanalysisongenechipdataobtainedfrommesenchymalstemcells.MethodsThegenechipGSE110359wasacquiredfromthegeneexpressionomnibus(GEO)databasetoprocurethegeneexpressionprofilesofmesenchymalstemcellsderivedfromAISandnonAISpatients.Weightedgeneco-expressionnetworkanalysis(WGCNA)methodwasemployedtoidentifytheprincipalmodulesassociatedwithadolescentidiopathicscoliosis.Furthermore,geneontology(GO)andKyotoEncyclopediaofGenesandGenomes(KEGG)analyseswereconducted.Additionally,immunecellinfiltrationanalysisandprotein-proteininteraction(PPI)analysiswereperformedon28distinctimmunecelltypes,leadingtotheidentificationofcoregenes.ResultsAtotalofeightgeneco-expressionmodulesweresuccessfullyidentified.GOanalysisrevealedsignificantenrichmentinvariousbiologicalprocesses,includingresponsetodecreasedoxygenlevels,responsetooxygenlevels,ribonucleoproteincomplexsubunitorganization,collagen-containingextracellularmatrix,spliceosomesnRNPcomplex,snRNAbinding,andextracellularmatrixstructuralcomponents.KEGGanalysisdemonstratedenrichmentinseveralpathways,suchashypoxia-induciblefactor-1signalingpathway,spliceosome,ferroptosis,fattyaciddegradation,andotherpathways.Furthermore,thefindingspertainingtoimmuneinfiltrationrevealedanoteworthydecreaseinthequantityofmonocyteswithintheAISgroupcomparedtothenonAISgroup(P<0.05).TherewasaheightenedlevelofinfiltrationbyactivateddendriticcellsintheAISgroup(P<0.05).PPIanalysiswasconducted,resultingintheidentificationofangiopoietin-like4(ANGPTL4),C-X-Cmotifchemokineligand8(CXCL8),solutecarrierfamily2member1(SLC2A1),hexokinase2(HK2),andtransferrinreceptorprotein(TFRC).ConclusionANGPTL4,CXCL8,SLC2A1,HK2andTFRChavebeenidentifiedaspotentialbiomarkersandtherapeutictargetsofAISpatients.MonocytesandactivateddendriticcellshaveemergedassignificanttargetsforimmunotherapyinthecontextofAIS.
[Keywords]Adolescentidiopathicscoliosis;Weightedgeneco-expressionnetworkanalysis;Bioinformatics
青少年特发性脊柱侧凸(adolescentidiopathicscoliosis,AIS)是最常见的脊柱畸形之一,好发于10~16岁的青少年,约占AIS的80%[1]。流行病学显示,中国青少年AIS的发病率为0.6%~2.0%[2]。AIS可引起胸廓、骨盆及下肢结构异常改变、脊柱双侧肌力失衡、疼痛等症状,严重者可影响呼吸和运动功能,甚至累及脊髓,造成永久性瘫痪。AIS发生的确切机制仍不清楚。目前,关于AIS的发病机制主要集中在遗传学、间充质干细胞、脊柱生物力学、神经学、激素、生物化学等方面,其发生可能是以上多种机制共同作用的结果[3]。因此,进一步研究AIS的发病机制对其预防、诊断和治疗等均具有重要意义。
生物信息学是生物学与信息学的交叉科学,在生命科学的研究中发挥着至关重要的作用[4]。其中,加权基因共表达网络分析(weightedgeneco-expressionnetworkanalysis,WGCNA)已广泛应用于多种疾病的研究中,该技术在评估基因模块与不同临床特征的相关性中发挥重要的作用[5-6]。本研究利用WGCNA分析基因表达综合数据库(geneexpressionomnibus,GEO)中AIS患者间质干细胞基因表达芯片,鉴定AIS关键基因模块,进一步探究AIS发生的分子机制,同时探究免疫细胞浸润的组成特点及其在疾病发生、发展过程中扮演的角色,以期为AIS发病机制和临床诊治提供新的理论依据。
1资料与方法
1.1资料来源
登录GEO选择符合条件的基因数据矩阵文件GSE110359,该芯片由17个间质干细胞样本组成,分别取自12例AIS患者和5例非AIS患者。
1.2方法
1.2.1数据的处理使用Perl5.34语言对探针ID数据进行注释;使用R4.2.1软件对从GEO下载的探针表达矩阵文件进行归一化及log2转换,将平台注释文件与每个探针表达矩阵进行筛选和匹配;最后,应用Bioconductor安装的R4.2.1中的sva包消除不同实验批次和平台引起的异质性。
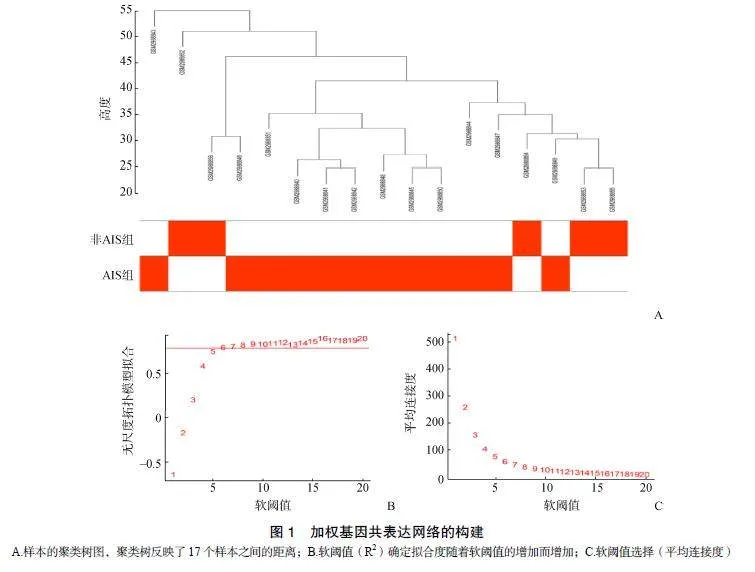
1.2.2WGCNA构建及重要模块识别使用R4.2.1软件中“WGCNA”包中的“goodSamplesGenes”函数构建样本树,检查并去除异常样本后,使用WGCNA中的pickSoftThreshold函数找到合适的软阈值,选择最佳β值,使R2值趋于稳定,说明此网络符合无尺度条件。最后,通过Pearson相关系数计算基因显著性和模块成员资格以将模块与临床特征相关联,当P<0.05时,认为单个模块与表型显著相关。选择与AIS相关系数最高的模块作为关键模块(绿色模块),进行后续分析。
1.2.3功能与通路富集分析使用R4.2.1软件中clusterProfiler包对关键模块基因(绿色模块)进行基因本体(geneontology,GO)和京都基因与基因组百科全书(KyotoEncyclopediaofGenesandGenomes,KEGG)分析。
1.2.4蛋白质-蛋白质相互作用分析与核心基因筛选将关键模块(绿色模块)基因导入STRING11.0数据库,探索不同基因编码的蛋白质之间的相互关系。使用Cytoscape3.7.2软件用于网络的可视化,进行网络分析及可视化操作,建构可视化的分子交互作用网络。利用分子复合体检测(molecularcomplexdetection,MCODE)插件提取关键子网,根据节点得分从大到小的顺序提取出表达较为聚集的子集,将其定义为核心基因[7]。
1.2.5获取免疫细胞矩阵及免疫细胞浸润分析采用R4.2.1软件BioManager中的“limma”包对AIS患者和非AIS患者的间质干细胞中的mRNA表达谱矩阵进行校正。随后,利用CIBERSORT法对人类免疫细胞亚型的表达矩阵进行去卷积分析,计算28种免疫细胞的相对比例,且每个样本获得一个P值;根据P<0.05筛选样本,获得免疫细胞组成矩阵。
1.3统计学方法
差异基因的统计学分析通过R4.2.1软件进行,采用vioplot包绘制小提琴图,采用pheatmap包分析和绘制免疫细胞表达热图。P<0.05为差异有统计学意义。
2结果
2.1WGCNA网络构建及显著性模块确认
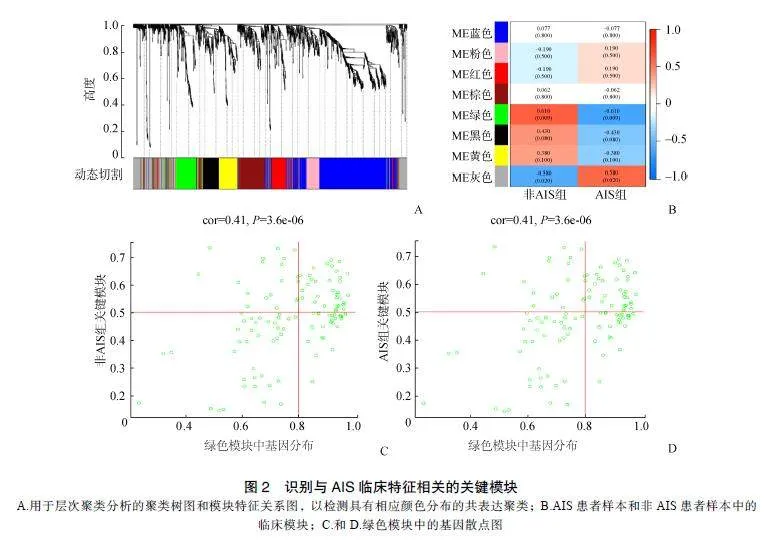
通过R4.2.1软件对GSE110359数据集中所有基因进行WGCNA网络构建。通过计算样本间相关性,绘制样本分层聚类图(图1A),样本聚类树共包括17个样本,无异常样本的剔除;同时,根据无尺度网络拟合指数和平均连接度的要求,计算并确定选取β=6为本数据集的合适软阈值,构建无标度网络(图1B、图1C)。确定软阈值后,采用动态剪切法,获得包含蓝色、粉色、红色、棕色、绿色、黑色、黄色、灰色在内的8个模块(图2A)。通过计算各个基因模块与临床表型之间的关系,绘制共表达模块与临床表型的相关性热图和绿色模块的基因散点图。结果表明,绿色模块(包含120个基因)与ASI的相关性最高(r=0.610,P=0.009),用于后续的分析(图2B)。绿色模块的基因散点图见图2C和图2D。
2.2关键基因模块功能性富集分析
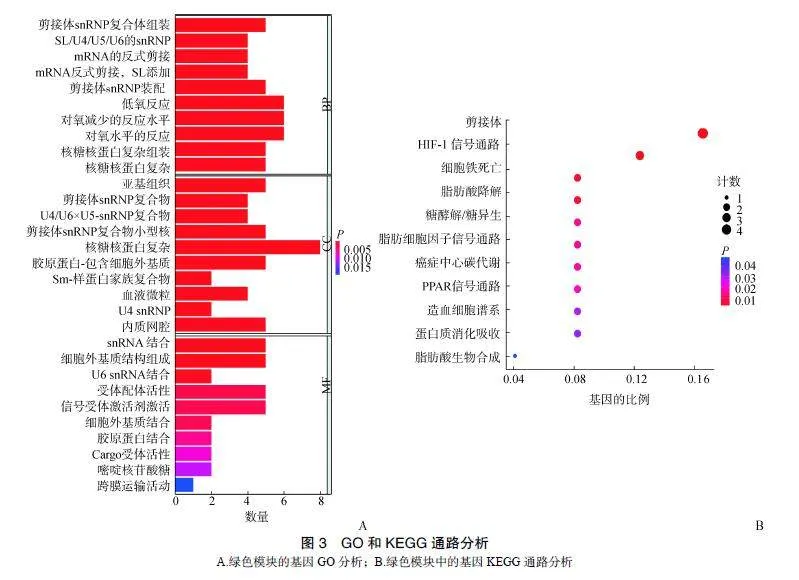
GO富集分析结果表明,绿色模块在生物学过程中主要富集在对氧减少的反应水平、低氧反应、对氧水平的反应、核糖核蛋白复杂组装等方面;在细胞组分中主要富集胶原蛋白-包含细胞外基质、剪接体snRNP复合物、内质网腔等方面;在分子功能中主要富集在snRNA结合、细胞外基质结构组成、受体配体活性、信号受体激活剂的活性等方面(图3A)。KEGG通路富集分析结果表明,绿色模块基因主要富集在低氧诱导因子-1(hypoxia-induciblefactor-1,HIF-1)信号通路、剪接体、细胞铁死亡、脂肪酸降解信号通路(图3B)。
2.3免疫细胞浸润结果
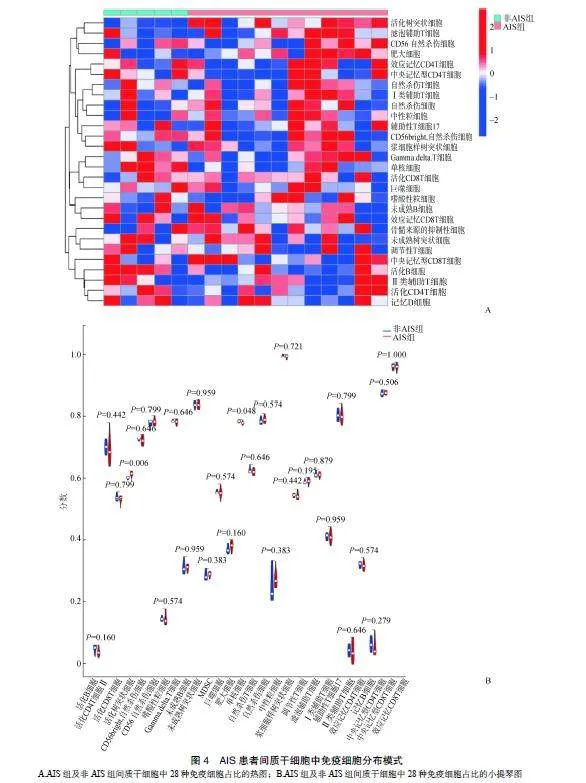
直方图显示每个样本中28种免疫细胞的总体分布,不同的颜色代表不同类型的免疫细胞。每种颜色的高度代表样本中此类细胞的百分比,各种免疫细胞的百分比之和为1(图4A)。通过小提琴图对AIS组与非AIS组间免疫细胞浸润进行差异分析,与非AIS组比较,AIS组单核细胞浸润程度显著降低(P=0.048),而AIS组的活化树突状细胞浸润程度显著提高(P=0.006)(图4B)。
2.4蛋白质-蛋白质相互作用网络构建及核心基因的识别
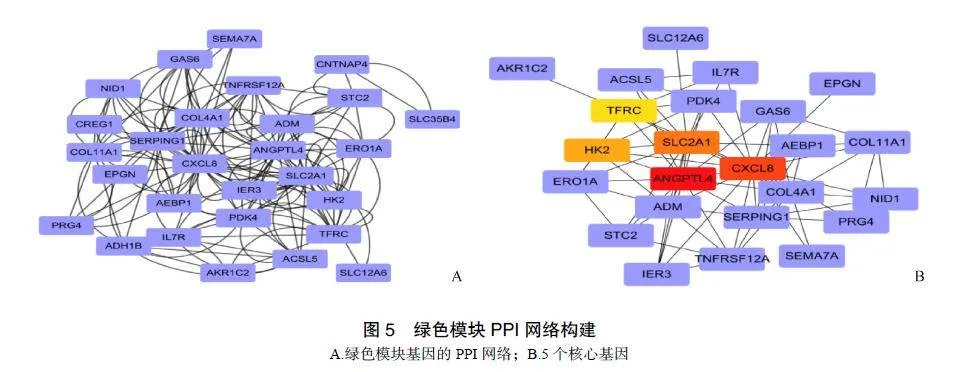
利用STRING11.0数据库进行蛋白质-蛋白质相互作用(protein-proteininteraction,PPI)分析,将所得PPI网络数据导入Cytoscape3.7.2软件,对其进行可视化构建出绿色模块基因的PPI(图5A),利用CytoHubba插件的MCC算法筛选出PPI前5个核心基因(图5B):ANGPTL4、CXCL8、SLC2A1、HK2和TFRC。
3讨论
AIS是引起青少年脊柱畸形最常见的原因,对其一生的健康具有潜在影响,并给家庭带来沉重的负担,引起的并发症尚无有效的治疗手段[8-10]。AIS是由多基因疾病、遗传、神经系统、激素/代谢、生化、肌肉骨骼、环境和可能的生活方式因素共同引起[11]。目前,AIS的主要治疗方法包括全程支具和椎弓根螺钉矫正手术,全程支具可能导致患者背痛和心理障碍,而手术不可避免地导致重大手术创伤,甚至永久性、灾难性神经或血管损伤[10]。新的治疗方法来自于对AIS分子基础的进一步探索[12]。了解AIS发病机制对该病的治疗和预后具有重要的意义。
既往研究发现,AIS患者间质干细胞的异常成骨分化与AIS的发病机制有关[13]。本研究采用WGCNA法对GSE110359基因芯片进行分析,构建8个基因共表达模块,鉴定出与AIS密切相关的基因模块(绿色模块)。通过GO功能富集分析发现绿色模块在生物学过程中主要富集对氧减少的反应水平、低氧反应、对氧水平的反应、核糖核蛋白复杂组装等方面;在细胞组分中,该模块基因主要富集胶原蛋白-包含细胞外基质、剪接体snRNP复合物、内质网腔等方面;在分子功能中与snRNA结合、细胞外基质结构组成、受体配体活性、信号受体激活剂的活性等方面密切相关。KEGG通路富集分析发现,绿色模块基因与HIF-1信号通路、剪接体、细胞铁死亡、脂肪酸降解信号通路相关。此外,AIS患者存在免疫-肌肉串扰的驱动机制,免疫系统可调节参与AIS的肌肉组织重塑过程的炎症反应,从而维持AIS患者的肌肉力量,减轻疼痛并延缓脊柱侧凸的发展[9]。而单核细胞和活化树突状细胞是参与免疫反应的重要细胞[14]。本研究在上述结果的基础上,进一步发现单核细胞和活化树突状细胞可能是治疗AIS的重要免疫靶点。
ANGPTL4是一种功能障碍的蛋白质,参与细胞分化、脂质代谢、肿瘤发生、能量稳态、氧化还原调节、伤口愈合和炎症在内的多种情况的发生与发展[15]。研究发现ANGPTL4在协调破骨细胞和成骨细胞中发挥重要的作用,是溶骨性肌肉骨骼疾病的新治疗靶点[16]。值得注意的是AIS患者的间质干细胞在成骨细胞、软骨细胞和脂肪细胞的发育过程中发生异常分化可能是AIS脊柱畸形的主要原因。然而,目前的研究尚未明确ANGPTL4在AIS中的作用。本研究进一步证实了ANGPTL4可能是调控AIS的重要生物标志物。
CXCL8作为重要的趋化因子之一,在感染和组织损伤的反应中发挥至关重要的作用[17]。本研究的免疫细胞浸润的结果发现,AIS患者单核细胞减少而活化树突状细胞增加,CXCL8在介导的单核细胞和活化树突状细胞迁移过程中发挥协同作用[18]。此外,背痛患者椎间盘组织中CXCL8蛋白表达是脊柱侧凸患者的1.81倍[19];尽管目前仍缺乏相关研究明确CXCL8在AIS中的作用机制,但本研究构建的PPI网络中CXCL8是AIS的核心基因;结合本研究免疫浸润结果,提示CXCL8可能通过调节单核细胞和活化树突状细胞迁移参与AIS的发生与发展。
SLC2A1是一类促进性葡萄糖转运蛋白,负责葡萄糖摄取[20]。Chen等[21]研究表明成骨细胞中,SLC2A1的缺失可阻断体内Wnt7b的骨合成代谢功能,并损害体外成骨细胞的分化。研究发现,SLC2A1是已知的髓核标志物,在人类椎间盘退变的情况下,SLC2A1的表达升高[22]。目前尚无研究报道SLC2A1在AIS中的作用,考虑AIS与椎间盘的退化密切相关;本研究结果提示,SLC2A1可能是参与AIS发病机制的关键基因。
本研究PPI结果表明,HK2和TFRC均是AIS的核心基因,HK2作为外糖磷酸化酶家族中最活跃的成员,促进葡萄糖在细胞内的利用[23]。HK2的过表达导致骨关节炎的滑膜组织中促炎细胞因子水平增加,是骨关节炎的重要治疗靶点[24]。此外,HK2不仅通过参与退变椎间盘中髓核细胞的再生,延缓椎间盘退变,并且在调节急性期神经性疼痛相关免疫细胞反应中发挥重要作用[25-26]。TFRC是一种跨膜蛋白,参与并维持细胞内铁稳态[27]。本研究发现,AIS的发病机制的过程中,细胞铁死亡通路占据重要地位;此外,在既往的研究基础上,笔者发现HK2和TFRC可能是AIS潜在的干预靶点,值得进一步的关注。
综上,本研究首次通过WGCNA和免疫细胞浸润分析AIS的生物学过程,发现ANGPTL4、CXCL8、SLC2A1、HK2、TFRC在内的5个基因均可能是AIS潜在的诊断生物标志物和重要的治疗靶点。此外,单核细胞和活化树突状细胞可能参与AIS的免疫调节的过程,值得进一步探索。然而,目前的研究仍有局限性,研究结果虽然为AIS的发病机制提供了理论依据,但仍需进一步探究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SHAHNV,COSTEM,WOLFERTAJ,etal.Theimpactofprematurityatbirthonshort-termpostoperativeoutcomesfollowingposteriorspinalfusionforadolescentidiopathicscoliosis[J].JClinMed,2023,12(3):1210.
[2] ZHENGY,DANGY,WUX,etal.EpidemiologicalstudyofadolescentidiopathicscoliosisinEasternChina[J].JRehabilMed,2017,49(6):512–519.
[3] PENGY,WANGSR,QIUGX,etal.Researchprogressontheetiologyandpathogenesisofadolescentidiopathicscoliosis[J].ChinMedJ(Engl),2020,133(4):483–493.
[4] MIB,LIUG,ZHOUW,etal.Identificationofgenesandpathwaysinthesynoviaofwomenwithosteoarthritisbybioinformaticsanalysis[J].MolMedRep,2018,17(3):4467–4473.
[5] ZHOUJ,GUOH,LIUL,etal.Constructionofco-expressionmodulesrelatedto survivalbywgcnaandidentificationofpotentialprognosticbiomarkersinglioblastoma[J].JCellMolMed,2021,25(3):1633–1644.
[6] WANQ,TANGJ,HANY,etal.Co-expressionmodulesconstructionbywgcnaandidentifypotentialprognosticmarkersofuvealmelanoma[J].ExpEyeRes,2018,166:13–20.
[7] SZKLARCZYKD,GABLEAL,LYOND,etal.Stringv11:Protein-proteinassociationnetworkswithincreasedcoverage,supportingfunctionaldiscoveryingenome-wideexperimentaldatasets[J].NucleicAcidsRes,2019,47(D1):607–613.
[8] KIMJ,KIMYH,KIMH,etal.Kaposiformhemangioendotheliomainadolescent-onsetscoliosis:Acasereportandreviewofliterature[J].CaseRepOrthop,2020,2020:1839053.
[9] SAMAANMC,MISSIUNAP,PETERSOND,etal.Understandingtheroleoftheimmunesysteminadolescentidiopathicscoliosis:Immunometabolicconnectionstoscoliosis(icons)studyprotocol[J].BMJOpen,2016,6(7):e011812.
[10] BARTLEYCE,YASZAYB,BASTROMTP,etal.Perioperativeanddelayedmajorcomplicationsfollowingsurgicaltreatmentofadolescentidiopathicscoliosis[J].JBoneJointSurgAm,2017,99(14):1206–1212.
[11] BURWELLRG,DANGERFIELDPH,MOULTONA,etal.Adolescentidiopathicscoliosis(AIS),environment,exposomeandepigenetics:Amolecularperspectiveofpostnatalnormalspinalgrowthandtheetiopathogenesisofaiswithconsiderationb6d958860eabaa463ec90aa8ea18171fb5f9bf01510f1d096de21f96f6791462ofanetworkapproachandpossibleimplicationsformedicaltherapy[J].Scoliosis,2011,6(1):26.
[12] LAOLF,SHENJX,CHENZG,etal.Uncoupledneuro-osseousgrowthinadolescentidiopathicscoliosis?Apreliminarystudyof90adolescentswithwhole-spinethree-dimensionalmagneticresonanceimaging[J].EurSpineJ,2011,20(7):1081–1086.
[13] PARKWW,SUHKT,KIMJI,etal.Decreasedosteogenicdifferentiationofmesenchymalstemcellsandreducedbonemineraldensityinpatientswithadolescentidiopathicscoliosis[J].EurSpineJ,2009,18(12):1920–1926.
[14] GUILLIAMSM,GINHOUXF,JAKUBZICKC,etal.Dendriticcells,monocytesandmacrophages:Aunifiednomenclaturebasedonontogeny[J].NatRevImmunol,2014,14(8):571–578.
[15] LAPAGLIAL,LISTÌA,CARUSOS,etal.PotentialroleofANGPTL4inthecrosstalkbetweenmetabolismandcancerthroughPPARsignalingpathway[J].PPARRes,2017,2017:8187235.
[16] KNOWLESHJ.Multiplerolesofangiopoietin-like4inosteolyticdisease[J].FrontEndocrinol(Lausanne),2017,8:80.
