黄芪多糖在Her-2阳性乳腺癌患者化疗中增效减毒的作用及其对血清Her-2-ECD、TAP和疗效的影响
2024-07-30周芹芹林芬钟小娟袁云

【摘要】 目的:探讨黄芪多糖在人表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)阳性乳腺癌患者化疗中增效减毒的作用及其对血清人表皮生长因子受体-2胞外段(human epidermal growth factor receptor-2-extracellular domain,Her-2-ECD)、肿瘤异常糖链糖蛋白(tumor abnormal protein,TAP)和疗效的影响。方法:选择2020年1月—2023年6月新余北湖医院收治的90例Her-2阳性乳腺癌患者作为研究对象,将患者随机分为对照组和观察组,各45例。两组均给予TCbHP(多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗)方案治疗;观察组在此基础上给予注射用黄芪多糖治疗。比较两组治疗前后的中医症候积分、血清Her-2-ECD、TAP水平、免疫功能(CD4+、CD8+)、白细胞(white blood cell,WBC)水平、乳腺癌患者的生活质量量表(functional assessment of cancer therapy-breast,FACT-B)评分、疗效及不良反应发生率。结果:治疗前,两组各项中医症候积分、Her-2-ECD、TAP、CD4+、CD8+、WBC、FACT-B评分比较,差异均无统计学意义(P>0.05)。治疗后,观察组各项中医症候评分、Her-2-ECD、TAP、CD8+、FACT-B各项评分及不良反应发生率均低于对照组,CD4+、WBC、总有效率均高于对照组,差异均有统计学意义(P<0.05)。结论:黄芪多糖能够改善Her-2阳性乳腺癌化疗患者的化疗效果,减轻化疗带来的毒性反应,提高患者的生活质量。
【关键词】 黄芪多糖 人表皮生长因子受体-2阳性乳腺癌 化疗 人表皮生长因子受体-2胞外段 肿瘤异常糖链糖蛋白
Effect of Astragalus Polysaccharide on Enhancing Efficacy and Decreasing Toxicity of Chemotherapy in Patients with Her-2 Positive Breast Cancer and Influence on Serum Her-2-ECD, TAP and Efficacy/ZHOU Qinqin, LIN Fen, ZHONG Xiaojuan, YUAN Yun. //Medical Innovation of China, 2024, 21(20): 0-062
[Abstract] Objective: To investigate the effect of Astragalus Polysaccharide on enhancing efficacy and reducing toxicity during chemotherapy in patients with human epidermal growth factor receptor-2 (Her-2) positive breast cancer and influence on serum human epidermal growth factor receptor-2-extracellular domain (Her-2-ECD), tumor abnormal protein (TAP) and therapeutic efficacy. Method: A total of 90 patients with Her-2 positive breast cancer admitted to Xinyu Beihu Hospital from January 2020 to June 2023 were selected as the study objects, and the patients were randomly divided into control group and observation group, with 45 cases in each group. Both groups were treated with TCbHP (Docetaxel + Carboplatin + Trastuzumab + Pertuzumab) regimen. The observation group was given Astragalus Polysaccharide for Injection treatment on this basis. The traditional Chinese medicine syndrome score, serum Her-2-ECD, TAP levels, immune function (CD4+, CD8+), white blood cell (WBC) levels, functional assessment of cancer therapy-breast (FACT-B) score before and after treatment, efficacy and incidence of adverse reactions between the two groups were compared. Result: Before treatment, there were no significant differences in traditional Chinese medicine syndrome scores, Her-2-ECD, TAP, CD4+, CD8+, WBC and FACT-B scores between the two groups (P>0.05). After treatment, the traditional Chinese medicine symptoms scores,
Her-2-ECD, TAP, CD8+, FACT-B scores and the incidence of adverse reactions in the observation group were lower than those in the control group, and CD4+, WBC and total effective rate were higher than those in the control group, the differences were statistically significant (P<0.05). Conclusion: Astragalus Polysaccharide can improve the chemotherapy effect of Her-2 positive breast cancer patients, reduce the toxic reaction caused by chemotherapy, and improve the quality of life of patients.
[Key words] Astragalus Polysaccharide Human epidermal growth factor receptor-2 positive breast cancer Chemotherapy Human epidermal growth factor receptor-2-extracellular domain Tumor abnormal protein
First-author's address: Department of Oncology, Xinyu Beihu Hospital, Xinyu 338000, China
doi:10.3969/j.issn.1674-4985.2024.20.014
国际癌症研究机构最近在185个国家提供的GLOBOCAN 2020数据报告,乳腺癌新发病例为230万
例(11.7%),已经超过肺癌成为女性最常见的癌症[1]。在我国,乳腺癌的发病率居于女性癌症首位,约占全球乳腺癌病例数的18.4%,且逐渐向年轻化发展[2-3]。重要亚型人表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)阳性乳腺癌是指Her-2表达阳性或基因扩增的乳腺癌,根据统计,其发病率占所有乳腺癌的70%[4]。黄芪为经典补气药物,黄芪多糖(astragalus polysaccharide,APS)是黄芪的大分子多糖类提取物,在黄芪多种化学成分中生物活性最强、占比最高。既往研究表明黄芪多糖具有调节机体免疫功能水平、缓解化疗带来的毒副作用之效[5]。目前针对Her-2阳性乳腺癌患者围化疗期使用黄芪多糖的研究较少。本研究旨在探讨黄芪多糖对Her-2阳性乳腺癌患者在化疗过程中增效减毒的作用及其对患者人表皮生长因子受体-2胞外段(human epidermal growth factor receptor-2-extracellular domain,Her-2-ECD)、肿瘤异常糖链糖蛋白(tumor abnormal protein,TAP)和疗效的影响。
1 资料与方法
1.1 一般资料
选择2020年1月—2023年6月新余北湖医院收治的90例Her-2阳性乳腺癌患者作为研究对象。纳入标准:(1)均为女性,病理学检查和临床影像学检查符合文献[6]《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》中诊断标准,分子分型为Her-2阳性;(2)符合中医正虚毒炽型“乳岩”的诊断标准[7]。排除标准:(1)对本研究中使用药物存在过敏反应、不耐受;(2)合并肝肾功能障碍、循环系统、免疫系统、神经系统疾病;(3)接受其他中医药治疗;(4)中途放弃治疗;(5)生存期不足10个月。将患者随机分为对照组和观察组,各45例。本研究经新余北湖医院医学伦理委员会批准。本研究所纳入的患者已经在知情同意书上签字确认。
1.2 方法
两组均进行TCbHP(多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗)方案治疗;给予多西他赛注射液(生产厂家:扬子江药业集团有限公司,批准文号:国药准字H20093850,规格:0.5 mL︰20 mg)75 mg/m2;注射用卡铂(生产厂家:齐鲁制药有限公司,批准文号:国药准字H10920028,规格:0.1 g)维持血药浓度-曲线下面积=5 mg/(mL·min);注射用曲妥珠单抗[生产厂家:Genentech Inc.,批准文号:国药准字J20180073,规格:440 mg(20 mL)]首次剂量8 mg/kg,后续给予6 mg/kg;帕妥珠单抗注射液[生产厂家:Roche Diagnostics GmbH,批准文号:国药准字SJ20180029,规格:420 mg(14 mL)]首次剂量840 mg/次,后续给予420 mg/次。均为
1次/d。观察组化疗开始后给予注射用黄芪多糖(生产厂家:天津赛诺制药有限公司,批准文号:国药准字Z20040086,规格:250 mg/瓶)250 mg溶于500 mL 5%葡萄糖溶液中,静脉滴注,滴注时间不少于2.5 h,1次/d。21 d为1个疗程,两组均进行6个疗程的治疗。
1.3 观察指标及评价标准
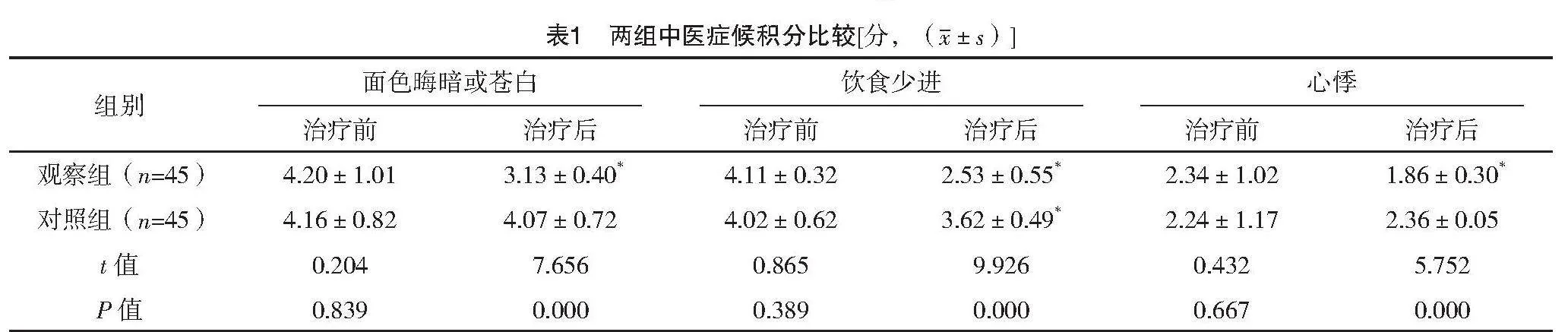
1.3.1 中医症候积分 参考正虚毒炽型“乳岩”的相关症状,对患者治疗前后面色晦暗或苍白、饮食少进、心悸、失眠、舌紫或有瘀斑的表现进行评分,症状表现重记为6分,症状表现中等记为4分,症状表现轻记为2分,无症状记0分,分数越高表示症状越重[7]。
1.3.2 Her-2-ECD和TAP水平 (1)Her-2-ECD检测:治疗前后抽取患者空腹8 h后外周静脉血,根据西门子(中国)有限公司生产的试剂盒说明书,使用凝聚法检测患者血清Her-2-ECD水平。(2)TAP检测:治疗前后采集患者的指端末梢血,根据浙江瑞生医疗科技有限公司生产的试剂盒说明,制备血片,由病理科医师观察和记录斑点聚集物面积大小,记录TAP数值。
1.3.3 免疫功能和白细胞水平 于治疗前后分别抽取患者空腹8 h状态下外周静脉血,检测T淋巴细胞亚群CD4+、CD8+含量、白细胞(white blood cell,WBC)计数水平。
1.3.4 FACT-B量表评分 采用乳腺癌患者的生活质量量表(functional assessment of cancer therapy-breast,FACT-B)对患者治疗前后进行评分,评分内容包括生理方面(7个条目,0~28分)、情感方面(6个条目,0~24分)、功能方面(7个条目,0~28分)、社会/家庭方面(7个条目,0~28分)及乳腺癌附加关注(9个条目,0~36分),评分越高说明生活质量越差[8]。
1.3.5 疗效标准判定 参考文献[9]《中药新药临床研究指导原则(试行)》,依据中医症候积分变化评估疗效;中医症候积分降低≥70%为显效,中医症候积分降低≥30%但<70%为有效,中医症候积分降低<30%为无效,中医症候积分无改善,临床症状加重为恶化;总有效率=(显效+有效)例数/总例数×100%。
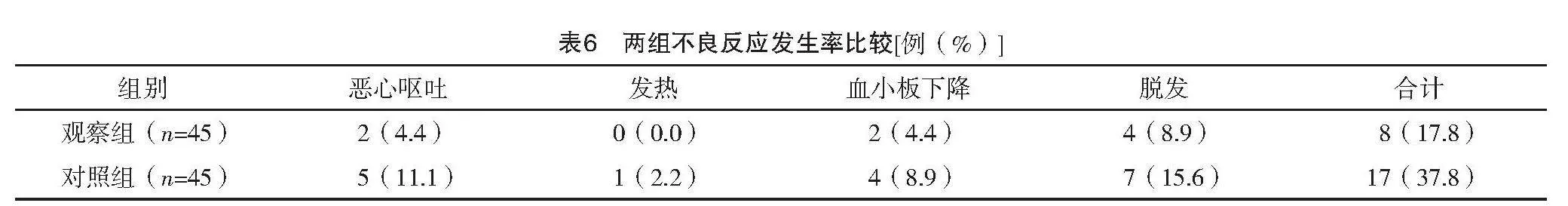
1.3.6 不良反应发生情况 比较两组恶心呕吐、发热、血小板下降、脱发等不良反应的发生情况。
1.4 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较
对照组年龄23~58岁,平均(40.37±8.67)岁;体重指数18.5~26.5 kg/m2,平均(22.19±2.23)kg/m2,绝经状态:已绝经27例,未绝经18例;临床分期:Ⅱ期20例,Ⅲ期25例。观察组年龄26~62岁,平均年龄(41.53±7.69)岁;体重指数18.6~27.2 kg/m2,平均(23.05±1.87)kg/m2;绝经状态:已绝经25例,未绝经20例;临床分期:Ⅱ期24例,Ⅲ期21例。两组基线资料比较,差异均无统计学意义(P>0.05),有可比性。
2.2 两组中医症候积分比较
治疗前,两组面色晦暗或苍白、饮食少进、心悸、失眠、舌紫或有瘀斑评分比较,差异均无统计学意义(P>0.05);治疗后,对照组饮食少进、失眠、舌紫或有瘀斑评分均低于治疗前,观察组面色晦暗或苍白、饮食少进、心悸、失眠、舌紫或有瘀斑评分均低于治疗前及对照组,差异均有统计学意义(P<0.05)。见表1。
2.3 两组血清Her-2-ECD和TAP水平比较
治疗前,两组Her-2-ECD、TAP水平比较,差异均无统计学意义(P>0.05);治疗后,两组Her-2-ECD、TAP水平均低于治疗前,且观察组均低于对照组,差异均有统计学意义(P<0.05)。见表2。
2.4 两组免疫功能水平和WBC计数比较
治疗前,两组CD4+、CD8+、WBC比较,差异均无统计学意义(P>0.05);治疗后,两组CD4+、WBC均高于治疗前,CD8+均低于治疗前,且观察组CD4+、WBC均高于对照组,CD8+低于对照组,差异均有统计学意义(P<0.05)。见表3。
2.5 两组FACT-B评分比较
治疗前,两组FACT-B各项评分比较,差异均无统计学意义(P>0.05);治疗后,两组FACT-B各项评分均低于治疗前,且观察组均低于对照组,差异均有统计学意义(P<0.05)。见表4。
2.6 两组疗效比较
观察组总有效率高于对照组,差异有统计学意义(字2=10.161,P=0.001),见表5。
2.7 两组不良反应发生率比较
观察组不良反应发生率低于对照组,差异有统计学意义(字2=4.486,P=0.034),见表6。
3 讨论
乳腺癌在中医学中属“乳岩”的范畴,在《妇人良方大全》中应用此名记载[10]。中医药在我国恶性肿瘤诊疗中别具特色。临床研究表明,中药治疗在辅助乳腺癌治疗中能起到减轻化疗带来的不良反应、减少肿瘤转移、改善患者生活质量的作用[11-13]。
Her-2-ECD、TAP是本研究评估疗效的重要指标。Her-2是一种络氨酸蛋白,与癌细胞的增殖转化有关,Her-2-ECD是Her-2胞外段,可以从细胞表面切除进入循环,其高表达可以提高肿瘤细胞的DNA增殖活性和肿瘤细胞的变形能力,导致细胞增殖失控和对基底膜组织浸润侵袭增强,提高肿瘤细胞残留和转移的风险[14-17]。TAP是因细胞癌变致使蛋白质糖基化异常生成的蛋白质,能够反映乳腺上皮细胞核分裂情况。有学者指出,乳腺癌患者治疗前后全血TAP水平存在明显差异[18-19]。有研究认为乳腺癌患者可以通过检测TAP表达水平对治疗效果进行评估[20]。本研究结果表明,观察组治疗后Her-2-ECD、TAP水平均明显低于对照组。APS调控免疫细胞抗肿瘤的作用机制多有研究。Yang等[21]发现ASP可以对Wnt/β-catenin信号通路产生抑制作用,减少上皮间质转化介导的癌细胞转移侵袭,抑制乳腺癌细胞增殖。此外,本研究中观察组治疗后CD4+水平高于对照组、CD8+水平低于对照组。CD4+有免疫记忆,在遇到抗原时可以迅速识别和杀死病变细胞,而CD8+则对免疫起到抑制效果,抑制功能失调可能会导致机体免疫系统无法对肿瘤细胞进行及时有效的反应。结果表明注射用黄芪多糖可以辅助化疗,调节乳腺癌患者CD4+、CD8+水平,高效激活患者细胞免疫功能,加强对病变细胞的杀伤作用和抑制转移。该结果与陆婷婷等[22]研究结果一致。
改善恶性肿瘤患者临床症状是中医药治疗的优势之一。化疗是乳腺癌综合治疗中的重要环节,但带来的毒副作用不仅会给患者带来巨大的痛苦和不适,也会降低患者依从性,影响治疗的完整性。中医在治疗乳腺癌方面主张分期而治,在围化疗期主张“补气益阴,健脾止呕”[23]。黄芪是一类补气收涩类药物,在《本草纲目》中被称为“补药之长”,具有健脾补中、益气补肾、扶正祛邪之功效[24]。本研究中,观察组治疗后各项中医症候积分、FACT-B评分均优于对照组,WBC水平高于对照组,不良反应发生率低于对照组,表明加用注射用黄芪多糖在减轻患者化疗毒副作用、改善患者生活质量和气虚血虚症状有良好的表现。
本研究为样本量较小的单中心研究,研究过程中未能做到双盲,对患者的选择和对疗效判定存在偏移。未来可期待扩大样本量,进一步研究黄芪多糖对乳腺癌患者复发转移情况的影响。
综上所述,Her-2阳性乳腺癌患者在化疗过程中使用黄芪多糖,能够有效地辅助改善化疗效果,调节患者免疫功能,降低患者Her-2-ECD、TAP水平,减轻化疗带来的毒性反应,改善患者的生活质量。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al.Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.
[2]崔娟,孙香莲,杨科,等.乳腺癌术后患者身体意象和性调节现状及影响因素分析[J].护理学报,2021,28(6):1-5.
[3]雷少元,郑荣寿,张思维,等.乳腺癌发病率和死亡率的全球模式:一项基于人群的2000-2020年肿瘤登记数据分析研究[J].癌症,2022,41(7):324-335.
[4]王晓稼,王薇.HR阳性/HER2阴性乳腺癌CDK4/6抑制剂联合内分泌治疗——《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2022版)》解读[J].浙江医学,2022,44(24):2595-2599.
[5]王继达,王丽,刘海朝,等.黄芪注射液辅助放化疗对癌症患者疗效和不良反应的系统评价[J].药物评价研究,2022,45(6):1147-1157.
[6]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J].中国癌症杂志,2019,29(8):609-680.
[7]乳岩的诊断依据、证候分类、疗效评定——中华人民共和国中医药行业标准《中医内科病证诊断疗效标准》(ZY/T001.1-94)[J].辽宁中医药大学学报,2018,20(11):12.
[8]万崇华,张冬梅,汤学良,等.乳腺癌患者生命质量测定量表(FACT-B)中文版的修订[J].中国心理卫生杂志,2003,17(5):298-300.
[9]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002.
[10]韩智培,张晓娜,刘继全,等.乳岩宁方对绝经后乳腺癌内分泌治疗患者性激素水平、中医证候及生活质量的影响[J].中华中医药学刊,2022,40(11):65-68.
[11]王荟荟,李惠,张延英,等.中医药辅助癌症免疫治疗的研究进展[J].中国比较医学杂志,2023,33(3):130-135.
[12]耿凤勇,郑颖慧,王永辉,等.中药方剂(乳癌术后方)治疗术后HER-2阳性型乳腺癌90例临床观察[J].现代肿瘤医学,2017,25(6):908-911.
[13]乔丽莉,胡童,吕萍,等.清热解毒消癥汤结合解救治疗对晚期乳腺癌临床疗效、肿瘤标记物、中医证候积分影响研究[J].中华中医药学刊,2023,41(8):214-217.
[14]常庆龙,杨红星,贾国丛,等.血清HER2 ECD+VEGF+HE4对乳腺癌术后复发转移的诊断价值[J].癌症进展,2019,17(3):328-330,334.
[15]吴豪杰,张伟,刘浏,等.超声造影联合HER-2、TPS对乳腺癌新辅助化疗敏感性的预测价值[J].实用癌症杂志,2022,37(7):1211-1214.
[16]张毅敏,王明丽,潘志文,等.血清HER-2neu ECD水平与乳腺癌临床特征及组织中HER-2neu表达的相关性[J].中国现代医学杂志,2017,27(12):84-87.
[17]何永鹏,李丽仙,易琳,等.乳腺癌患者血清HER-2胞外域水平与癌组织HER-2表达的相关性及其临床意义[J/OL].中华乳腺病杂志:电子版,2016,10(1):14-19.https://www.doc88.com/p-90859368007694.html.
[18]多斯波力·扎克汗,木扎帕尔·阿部都克热木,马斌林.肿瘤异常糖链糖蛋白在乳腺癌中的表达及其临床意义[J].世界最新医学信息文摘,2019,19(72):117-118.
[19]李景龙,朱德淼.外周血中TAP含量预测Her-2阳性乳腺癌新辅助化疗疗效价值的研究[J].锦州医科大学学报,2022,43(6):51-55.
[20]包兆康,程家乐,俞士尤.乳腺癌患者中肿瘤异常糖链蛋白的表达情况及与新辅助化疗疗效的关系[J].癌症进展,2020,18(8):835-837.
[21] YANG S,SUN S,XU W,et al.Astragalus polysaccharide inhibits breast cancer cell migration and invasion by regulating epithelial-mesenchymal transition via the Wnt/β-catenin signaling pathway[J].Mol Med Rep,2020,21(4):1819-1832.
[22]陆婷婷,柯玲玲.黄芪多糖靶向肿瘤微环境的抗肿瘤作用机制[J].江西中医药大学学报,2019,31(1):107-111.
[23]李斐斐,史有阳,张洋,等.基于HER-2阳性乳腺癌治疗难点探讨中医药治疗特色及研究进展[J].中国实验方剂学杂志,2023,29(7):237-243.
[24]徐世一,刘秀波,陆佳欣,等.黄芪活性成分抗肿瘤作用机制的研究进展[J].中草药,2022,53(23):7613-7623.
(收稿日期:2024-01-15) (本文编辑:马娇)
