SOX1和PAX1基因甲基化检测对宫颈高级别病变二次分流的价值
2024-07-08郭艳平杨青王诗睿李思敏于博阳杨筱凤
郭艳平 杨青 王诗睿 李思敏 于博阳 杨筱凤
摘要:目的 探讨SOX1和PAX1基因甲基化检测对宫颈高级别病变二次分流的价值。方法 采集122例人乳头瘤病毒(HPV)阳性患者的宫颈脱落细胞,同时行液基薄层细胞学检查(TCT)和SOX1/PAX1基因甲基化检测。结果 HPV联合TCT检测对宫颈上皮内瘤变(CIN)2级及以上(CIN2+)检出灵敏度为95.24%,特异度为23.75%。结合SOX1/PAX1基因甲基化检测二次分流后,对CIN2+检出灵敏度为83.33%,与HPV联合TCT检测差异无统计学意义(P=0.078);特异度为77.50%,明显高于HPV联合TCT检测(P<0.001)。CIN2+组SOX1/PAX1基因甲基化水平高于正常宫颈组织及CIN1组(P<0.001)。SOX1、PAX1基因甲基化对CIN2+诊断的截断值分别为-11.81、-11.98。结论 SOX1/PAX1基因甲基化检测二次分流后,CIN2+检出的效能和准确性明显提升。
关键词:SOX1;PAX1;甲基化;宫颈病变
中图分类号: R711 文献标识码: A 文章编号:1000-503X(2024)03-0329-05
DOI:10.3881/j.issn.1000-503X.15734
Value of SOX1 and PAX1 Gene Methylation Detection in Secondary Triage of High-Grade Cervical Lesions
GUO Yanping,YANG Qing,WANG Shirui,LI Simin,YU Boyang,YANG Xiaofeng
Department of Obstetrics and Gynecology,The First Affiliated Hospital of Xian Jiaotong University,Xian 71006 China
Corresponding author:YANG Xiaofeng Tel:029-85323844,E-mail:yxf73@163.com
ABSTRACT:Objective To evaluate the value of SOX1 and PAX1 gene methylation detection in the secondary triage of high-grade cervical lesions.Methods Exfoliated cervical cells were collected from 122 patients tested positive for human papilloma virus (HPV) and subjected to thin-prep cytologic test (TCT) and SOX1/PAX1 gene methylation tests.Results The HPV test combined with TCT showed the sensitivity of 95.24% and the specificity of 23.75% for detecting cervical intraepithelial neoplasia (CIN) grade 2 and above (CIN2+).After the addition of the SOX1/PAX1 gene methylation detection in secondary triage,the sensitivity for detecting CIN2+ was 83.33%,which had no statistically significant difference from the sensitivity of TCT combined with HPV test (P=0.078).However,the specificity reached 77.50%,which was significantly higher than that of HPV test combined with TCT (P<0.001).The SOX1/PAX1 gene methylation level in the CIN2+ group was higher than those in the normal cervical tissue and the CIN1 group(P<0.001).The cut-off values of SOX1 and PAX1 gene methylation for CIN2+ detection were -11.81 and -11.98,respectively.Conclusion Adding the detection of SOX1/PAX1 gene methylation in secondary triage significantly improves the efficiency and accuracy of CIN2+ detection.
Key words:SOX1;PAX1;methylation;cervical lesion
Acta Acad Med Sin,2024,46(3):329-333
宫颈癌发病率在女性生殖系统恶性肿瘤中居首位,我国宫颈癌每年新发病例11.93万,死亡病例3.72万[1]。高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染是导致宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及宫颈癌的主要因素[2]。目前HPV检测是我国宫颈癌筛查的主要方法,但其存在敏感度高而特异度不足的问题[3],易导致过度的阴道镜检查及不必要的有创检查。因此,探索精细化的危险分层方法是平衡宫颈癌筛查中风险和获益的新目标。表观遗传学在肿瘤的发生发展中发挥着重要作用,其主要通过DNA甲基化、组蛋白修饰、非编码RNA调控和染色质结构重构等方式改变基因功能和表达水平,进而影响肿瘤的进展[4]。研究发现,宫颈癌患者肿瘤抑制因子、转录因子和细胞周期调节因子基因的启动子区发生甲基化,导致抑癌基因功能失活和转录抑制,从而促进宫颈癌的侵袭和转移[5]。SOX1基因是Y染色体性别决定区相关基因家族成员,参与胚胎发育和凋亡过程中转录因子的编码,SOX1基因甲基化水平在宫颈癌组织中显著上调[6]。PAX1基因属于配对盒基因家族,编码重要的转录因子,是细胞谱系特异性调节剂,研究显示PAX1基因甲基化异常与宫颈癌发生相关[7]。因此,本研究通过比较HPV联合宫颈液基薄层细胞学检测(thin-prep cytologic test,TCT)和SOX1/PAX1基因甲基化检测二次分流对宫颈高级别病变的检出效能,旨在探讨SOX1和PAX1基因甲基化检测对宫颈高级别病变的诊断价值。
1 对象和方法
1.1 对象
2020年5至12月西安交通大学第一附属医院行HPV联合TCT检测、HPV DNA分型检测结果阳性且自愿接受阴道镜活检的患者。排除妊娠或可疑妊娠、急性生殖道感染及子宫或子宫颈手术者。共纳入122例患者,采集宫颈脱落细胞同时行SOX1和PAX1基因甲基化检测。本研究通过西安交通大学第一附属医院伦理委员会批准(伦理审批编号:LLSBPJ-2023)。
1.2 宫颈脱落细胞采集
取样前72 h禁盆浴及性生活,无阴道冲洗及用药,非月经期。取样时擦拭宫颈表面过多分泌物,将宫颈细胞刷置于宫颈表面及部分宫颈管内,顺时针旋转5圈,将采集的宫颈脱落细胞保存至细胞保存液中。
1.3 HPV DNA检测
采用潮州凯普生物化学有限公司HPV分型检测试剂盒(PCR+膜杂交法)在HybriMax杂交仪上进行分型检测,包括HPV 16、18、31、33、35、39、42、43、44、45、51、52、53、56、58、59、68、CP8304和81型。
1.4 TCT检测
采用自动液基细胞沉降式制片染色系统(广东安必平医药科技股份有限公司)进行制片,由细胞学病理诊断医师按照2014年美国阴道镜和子宫颈病理协会分类系统[8]进行结果判读。
1.5 SOX1和PAX1基因甲基化检测
对待测样本及空白对照进行DNA提取,采用紫外分光光度计检测样本DNA提取液的浓度与纯度。将合格的样本DNA进行重亚硫酸盐修饰,按照SOX1和PAX1基因甲基化检测试剂盒(PCR-荧光探针法)说明书进行操作。PCR反应条件:预变性95 ℃ 10 min,95 ℃变性20 s,60 ℃变性30 s,共45个循环。以β-actin为内参基因,采用2-ΔΔCt法计算SOX1和PAX1基因的相对表达量。
1.6 阴道镜检查及宫颈组织学判读
对所有患者行阴道镜检查,于可疑病变处取宫颈活检,必要时行宫颈管搔刮。宫颈组织病理结果由两名病理科医生共同判读,根据CIN的评估结果判断宫颈病变的级别。
1.7 统计学处理
采用SPSS 24.0软件,计数资料以例数或百分数表示,组间比较采用卡方检验或秩和检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线描绘SOX1/PAX1基因检测CIN 2级及以上(CIN2+)的诊断效能及截断值,并计算曲线下面积(area under curve,AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 HPV分型及TCT检测结果
122例患者中HPV 16/18阳性66例,其中TCT异常30例,TCT正常36例;HPV其他型阳性56例,其中TCT异常35例,TCT正常21例。
2.2 HPV联合TCT检测对CIN2+的检出能力
宫颈活检病理结果正常58例,CIN1 22例,CIN2 25例,CIN3 10例,宫颈癌7例。HPV联合TCT检测对CIN2+检出灵敏度为95.24%,特异度23.75%,符合率48.36%,约登指数0.19。
2.3 SOX1/PAX1基因甲基化检测二次分流对CIN2+的检出能力
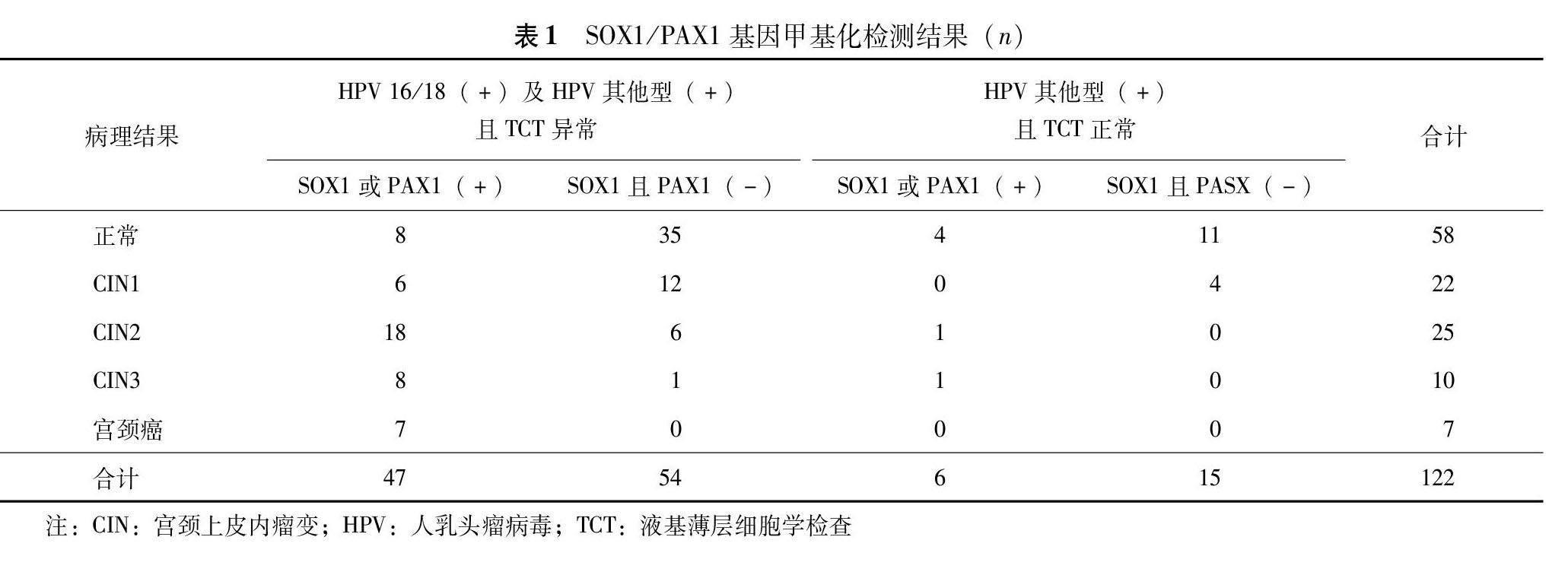
122例患者中SOX1基因甲基化检测阳性37例、阴性85例,PAX1基因甲基化检测阳性52例、阴性70例。HPV16/18阳性及HPV其他型阳性且TCT结果异常的101例患者中,SOX1/PAX1基因阳性47例,SOX1且PAX1基因阴性54例。21例HPV其他型阳性且TCT正常患者中,SOX1/PAX1基因阳性6例,SOX1且PAX1基因阴性15例。SOX1/PAX1基因甲基化检测二次分流对CIN2+检出的灵敏度为83.33%,特异度77.50%,符合率79.51%,约登指数0.61(表1)。
2.4 HPV联合TCT并结合SOX1/PAX1基因甲基化检测二次分流对CIN2+的检出能力
HPV联合TCT并结合SOX1/PAX1基因甲基化检测二次分流后对CIN2+检出的灵敏度为83.33%,与HPV联合TCT检测比较差异无统计学意义(χ2=3.11 P=0.078)。HPV联合TCT并结合SOX1/PAX1基因甲基化检测二次分流后对CIN2+检出的特异度为77.50%,明显高于HPV联合TCT检测(χ2=46.232,P<0.001)。
2.5 SOX1/PAX1基因在正常宫颈组织及不同级别宫颈病变中的甲基化水平
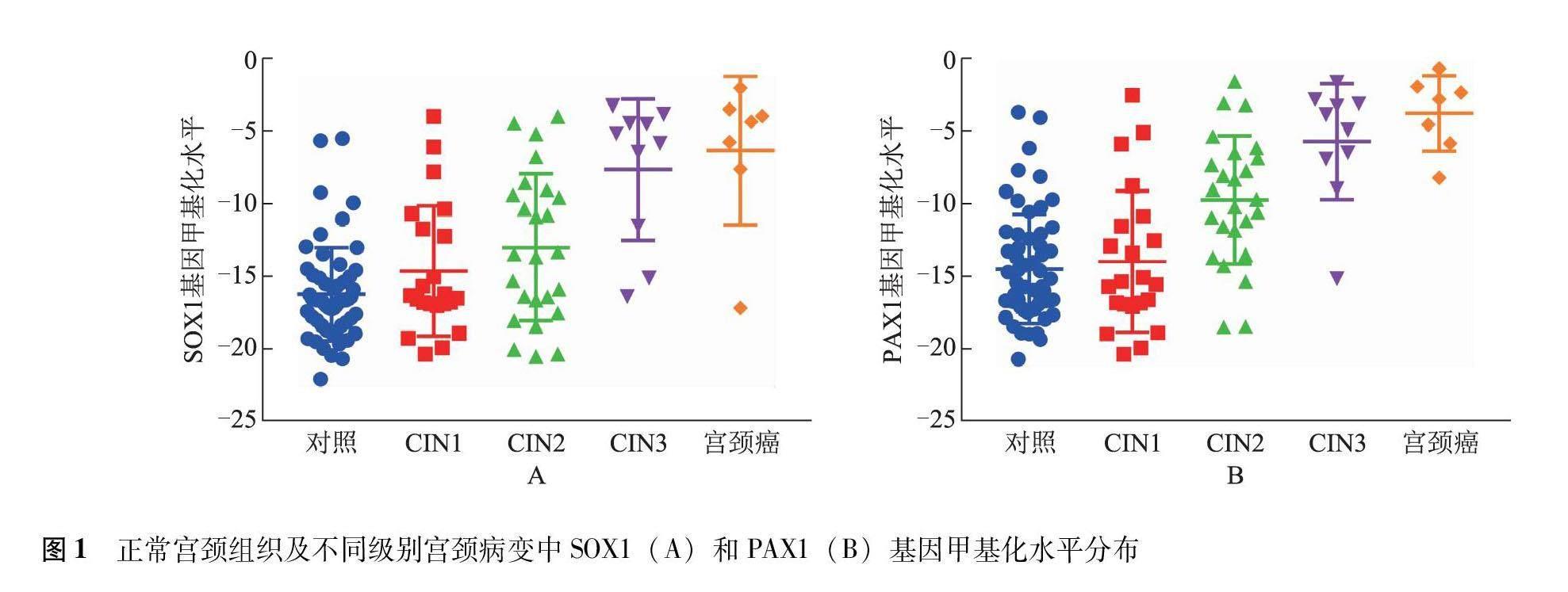
正常宫颈组织、CIN1和CIN2+组中SOX1或PAX1基因甲基化的比例分别为20.69%(12/58)、27.27%(6/22)和83.33%(35/42),正常宫颈组织与CIN1组比较差异无统计学意义(P=0.557),而CIN1与CIN2+组比较差异有统计学意义(P<0.001)。
在正常宫颈组织及不同级别宫颈病变中,SOX1基因甲基化水平随着病变程度加重而逐渐升高,且正常组织与CIN1组(P=0.181)、CIN1与CIN2组(P=0.258)、CIN3与宫颈癌组(P=0.475)比较差异无统计学意义,而CIN2与CIN3组比较差异有统计学意义(P=0.007);PAX1基因甲基化水平随着病变程度加重而逐渐升高,且正常组织与CIN1组(P=0.838)、CIN3与宫颈癌组(P=0.230)比较差异无统计学意义,而CIN1与CIN2组(P=0.003)、CIN2与CIN3组(P=0.013)比较差异有统计学意义(图1)。
2.6 SOX1和PAX1基因甲基化对CIN2+的诊断效能
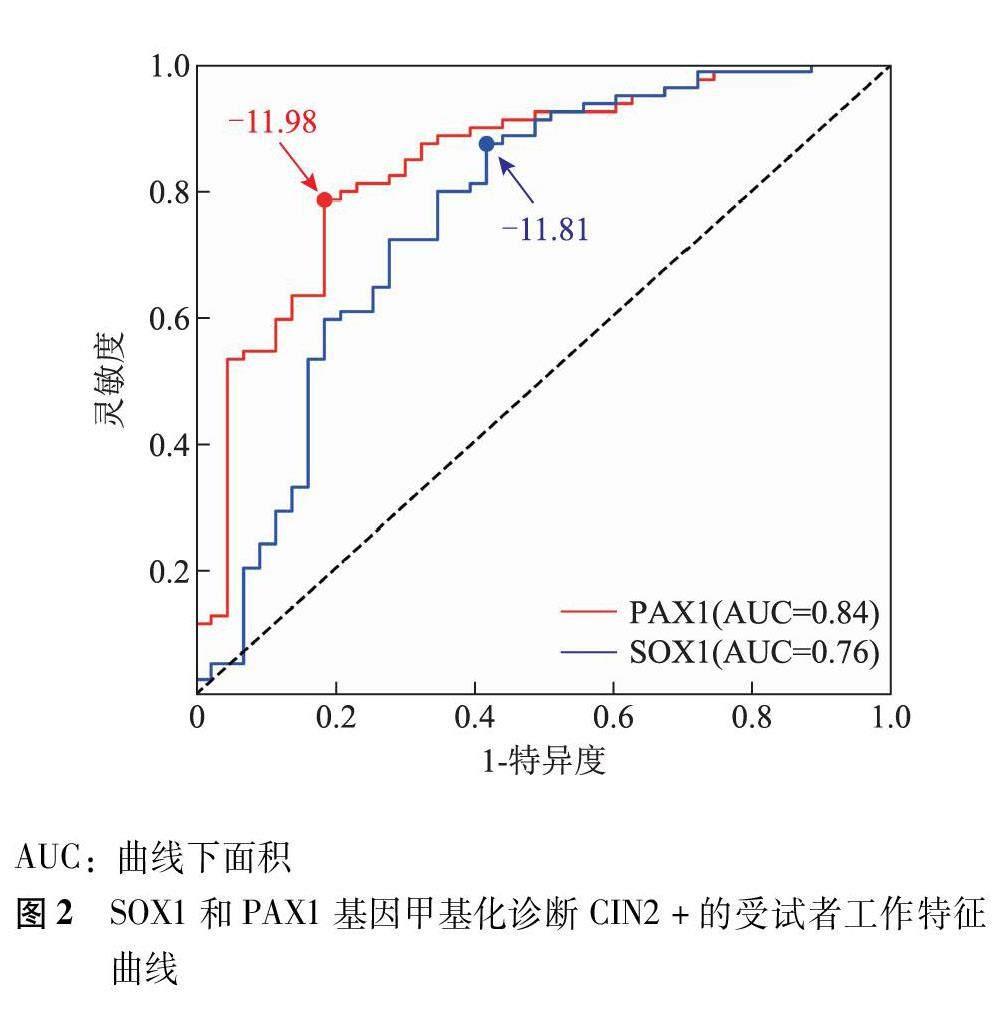
ROC曲线分析结果显示,SOX1基因甲基化诊断CIN2+的AUC为0.76 当截断值为-11.81时,灵敏度为87.3%,特异度为58.1%;PAX1基因甲基化诊断CIN2+的AUC为0.840,当截断值为-11.98时,灵敏度为78.5%,特异度为81.4%(图2)。
3 讨论
宫颈癌是目前唯一病因明确的癌症,早期发现宫颈高级别病变是预防宫颈癌的关键[9]。现有筛查手段主要包括宫颈脱落细胞检查及高危型HPV检测。然而,宫颈脱落细胞检查易受主观因素影响,敏感度较差[10]。高危型HPV DNA检测灵敏度优于传统细胞学筛查,但由于存在HPV一过性感染,其特异度较低,增加受检者的经济及心理负担[3]。因此,寻找高敏感度和特异度的筛查手段是宫颈癌诊治工作的重要方向。
恶性肿瘤的发生通常是一个涉及遗传和表观遗传改变的多步骤过程,最新研究发现,某些特定基因的表观遗传变化可能介导或预测癌症进展[11]。甲基化作为表观遗传学中重要的一种方式,在肿瘤发生发展中起着重要作用[12]。PAX1是一种重要的转录调控因子,可通过调控细胞增殖,诱导细胞定向迁移,参与胚胎发育过程中重要器官的形成[13]。SOX1是编码SOX家族转录因子中的一个成员,具有参与胚胎发育的调节以及决定细胞存亡的功能。研究表明,SOX1和PAX1基因启动子区域甲基化普遍存在于宫颈癌组织中,且明显高于正常组织,被认为是宫颈癌发生的早期事件[14-15]。本研究中,HPV联合TCT检测对CIN2+病变检出的灵敏度高,但特异度低,与Wei等[16]研究结果一致。结合SOX1/PAX1基因甲基化检测二次分流后,CIN2+病变检出的特异度明显提高,达到77.50%。因此,对于HPV联合TCT检测结果阳性者进行SOX1/PAX1基因甲基化检测二次分流后,CIN2+检出的灵敏度和特异度均较高,解决了传统HPV联合TCT进行宫颈癌筛查特异度较低的问题,对宫颈癌筛查策略的优化具有重要意义。
符合率是指诊断试验中真阳性和真阴性之和占总受检人数的比例,反映了正确诊断患者与排除非患者的能力。本研究传统HPV联合TCT检测CIN2+符合率为48.36%,结合SOX1/PAX1基因甲基化检测二次分流后,CIN2+符合率提升至79.51%,表明结合SOX1/PAX1基因甲基化检测对于CIN2+的诊断和CIN1及一过性HPV感染的排除能力均提高。同时,HPV联合TCT检测对CIN2+检出的约登指数为0.19,结合SOX1/PAX1基因甲基化检测二次分流后CIN2+筛查结果约登指数为0.6 结合SOX1/PAX1基因甲基化检测二次分流后对CIN2+检出准确度得到明显提高。
本研究对SOX1/PAX1基因甲基化定量检测与宫颈病变程度之间的关系进行分析,结果显示CIN2+组SOX1/PAX1基因甲基化水平高于正常宫颈组织及CIN1组。谌媛媛等[17]研究也证实宫颈脱落细胞中PAX1和SOX1基因甲基化水平对宫颈癌具有较高的诊断价值。此外,PAX1基因甲基化水平在正常宫颈组织、CIN1和CIN2+的变化趋势与Li等[18-19]的研究结果一致。
综上,本研究结果表明,采用SOX1/PAX1基因甲基化检测进行二次分流可显著提高CIN2+检出的效率和准确性,这对于宫颈癌筛查策略的优化具有重要意义。
利益冲突 所有作者声明无利益冲突
作者贡献声明 郭艳平:研究设计、论文撰写与修改、数据分析、按编辑部的修改意见进行核修;杨青:数据收集、数据分析、按编辑部的修改意见进行核修;王诗睿、李思敏、于博阳:数据分析,按编辑部的修改意见进行论文核修;杨筱凤:主导研究工作、提供基金支持、指导学术问题解答
参 考 文 献
[1]郑荣寿,张思维,孙可欣,等.2016年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2023,45(3):212-220.DOI:10.3760/cma.j.cn112152-20220922-00647.
[2]Gao G,Smith DI.Human papillomavirus and the development of different cancers[J].Cytogenet Genome Res,2016,150(3-4):185-193.DOI:10.1159/000458166.
[3]Koliopoulos G,Nyaga VN,Santesso N,et al.Cytology versus HPV testing for cervical cancer screening in the general population[J].Cochrane Database Syst Rev,2017,8(8):CD008587.DOI:10.1002/14651858.CD008587.pub2.
[4]王攀,赵洪林,任凡,等.表观遗传学在恶性肿瘤发生发展和治疗中的新进展[J].中国肺癌杂志,2020,23(2):91-100.DOI:10.3779/j.issn.1009-3419.2020.02.04.
[5]刘贽,席金瓯,夏剑波.抑癌基因DNA异常甲基化与宫颈癌研究进展[J].微循环学杂志,2019,29(3):75-78.DOI:10.3969/j.issn.1005-1740.2019.03.017.
[6]Chen Y,Cui Z,Xiao Z,et al.PAX1 and SOX1 methylation as an initial screening method for cervical cancer:a meta-analysis of individual studies in Asians[J].Ann Transl Med,2016,4(19):365.DOI:10.21037/atm.2016.09.30.
[7]Lai HC,Lin YW,Huang TH,et al.Identification of novel DNA methylation markers in cervical cancer[J].Int J Cancer,2008,123(1):161-167.DOI:10.1002/ijc.23519.
[8]Nayar R,Wilbur DC.The Pap test and Bethesda 2014[J].Cancer Cytopathol,2015,123 (5):121-132.DOI:10.1002/cncy.21521.
[9]余艳琴,郝金奇,徐慧芳,等.宫颈癌综合预防和控制的应用和前景[J].中国医学科学院学报,2020,42(4):535-539.DOI:10.3881/j.issn.1000-503X.11370.
[10]Bruhn LV,Andersen SJ,Hariri J.HPV-testing versus HPV-cytology co-testing to predict the outcome after conization[J].Acta Obstet Gynecol Scand,2018,97(6):758-765.DOI:10.1111/aogs.13325.
[11]陈丛,赵敏.DNA甲基化预测宫颈病变研究进展[J].国际妇产科学杂志,202 48(5):535-538.DOI:10.12280/gjfckx.20201124.
[12]Lorincz AT.Virtues and weaknesses of DNA methylation as a test for cervical cancer prevention[J].Acta Cytol,2016,60(6):501-512.DOI:10.1159/000450595.
[13]程媛,魏丽惠,王建六.PAX1基因及其甲基化在宫颈癌作用的分子机制研究进展[J].实用妇产科杂志,2016,32(11):823-825.
[14]Lai HC,Ou YC,Chen TC,et al.PAX1/SOX1 DNA methylation and cervical neoplasia detection:a Taiwanese Gynecologic Oncology Group (TGOG) study[J].Cancer Med,2014,3(4):1062-1074.DOI:10.1002/cam4.253.
[15]Huang J,Tan ZR,Yu J,et al.DNA hypermethylated status and gene expression of PAX1/SOX1 in patients with colorectal carcinoma[J].Onco Targets Ther,2017,10:4739-4751.DOI:10.2147/OTT.S143389.
[16]Wei Y,Wang W,Cheng M,et al.Clinical evaluation of a real-time optoelectronic device in cervical cancer screening[J].Eur J Obstet Gynecol Reprod Biol,202 266:182-186.DOI:10.1016/j.ejogrb.2021.09.027.
[17]谌媛媛,李静.宫颈脱落细胞中PAX1和SOX1基因甲基化对宫颈癌实验诊断的临床研究[J].现代检验医学杂志,2022,37(6):46-51.DOI:10.3969/j.issn.1671-7414.2022.06.009.
[18]Li M,Zhao C,Zhao Y,et al.Association and effectiveness of PAX1 methylation and HPV viral load for the detection of cervical high-grade squamous intraepithelial lesion[J].Pathogens,2023,12(1):63.DOI:10.3390/pathogens12010063.
[19]Li M,Zhao C,Zhao Y,et al.The role of PAX1 methylation in predicting the pathological upgrade of cervical intraepithelial neoplasia before cold knife conization[J].Front Oncol,2023,12:1064722.DOI:10.3389/fonc.2022.1064722.
(收稿日期:2023-06-19)
