化学反应速率和化学平衡图像综合问题解题策略研究
2024-07-03郭晨辉
郭晨辉

摘 要:化学反应速率和化学平衡图像是两个紧密相关的知识点,这类问题在高考出题中灵活度高、分值大,要求学生具备很高的分析问题、挖掘信息的能力.本文对化学反应速率和化学平衡图像综合问题解题策略进行研究,并例举了高考真题详解指导,以期望帮助学生更好地掌握化学反应速率和化学平衡的概念,提高解题效率和准确性.
关键词:高中化学;化学平衡;图像
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2024)15-0121-03
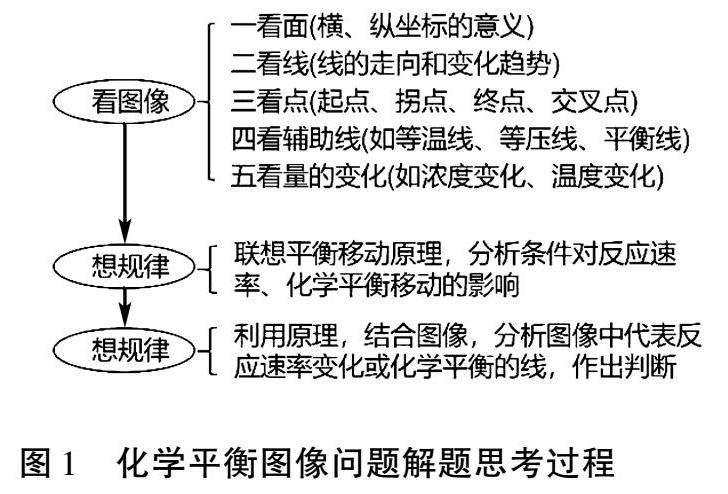
化学平衡图像类试题经常涉及的图像类型有含量—时间—温度(压强)、恒温、恒压曲线等.图像中蕴含着丰富的信息,具有简明、直观、形象的特点,命题形式灵活,解题的关键是根据反应特点,明确反应条件,认真分析图像,充分挖掘蕴含的信息,紧扣化学原理,找准切入点解决问题[1-2].具体思考过程如图1所示:
1 常规图像
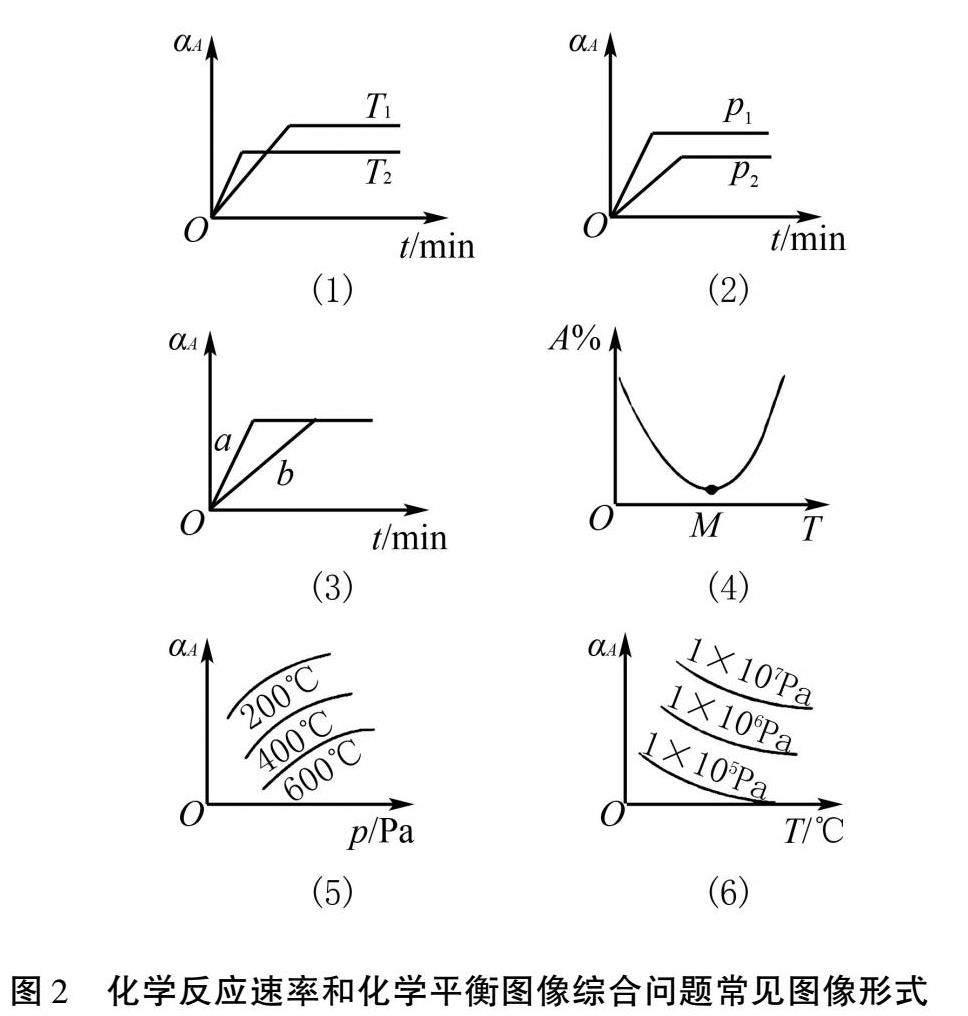
化学反应速率和化学平衡图像综合问题的常见图像形式通常有6种,如图2所示.
其核心解题技巧为:①先拐先平:在转化率(或百分含量)—时间曲线中,先出现拐点的先达到平衡,说明该曲线反应速率大,表示温度较高、有催化剂、压强较大等;②定一议二:当图像中有三个量时(如恒温线或恒压线),先确定一个量不变,再讨论另外两个量的关系[3-4].下面以一道例题为例进行讲解.
例1 (湖南卷)实验台上有甲、乙两个恒容容器,向两容器中分别充入X和Y,二者的反应如下:
2X(g)+Y(g)Z(g)
图3为两反应体系的压强随时间变化的曲线.已知甲、乙两个容器的体积均为1 L,X和Y的量分别为2 mol和1 mol,甲容器中的反应为绝热过程,乙容器中的反应为恒温过程,求:
(1)证明ΔH<0;
(2)气体的总物质的量na和nc的关系;
(3)证明a点平衡常数K<12;
(4)反应速率va正和vb的关系.
解 本题考查化学平衡、化学反应速率等.
(1)题给反应正向是气体分子数减小的反应,在恒容容器中绝热过程进行反应时,起始阶段体系压强增大,是由体系内温度升高引起的,因此正反应为放热反应,即ΔH<0;
(1)略.
(2)由于反应放热,而甲容器中的反应为绝热过程,则温度a>c,a、c两点的压强相同,则气体的总物质的量na (3)因为乙容器中的反应为恒温过程,c点时体系压强为p,而起始压强为2p,则c点气体的总物质的量nc=12×(2 mol+1 mol)=1.2 mol,设从开始到c点,Y反应了x mol,结合X和Y的化学方程式有 (2-2x)mol+(1-x)mol+x mol=1.5 mol 解得x=0.75,则c点n(X)=0.5 mol,n(Y)=0.25 mol,n(Z)=0.75 mol,c点浓度商Qc=0.75/1(0.5/1)2×0.25/1=12,而a点平衡实际上是绝热条件下达到的平衡,a点温度大于c点,平衡逆向移动,故a点平衡常数K<12; (4)a、b时反应均已达平衡,温度:a>b,且对该反应升温平衡逆向移动,则a点反应物浓度大于b点,所以反应速率va正>vb正. 2 新型图像 化学反应速率和化学平衡问题的知识点博杂,出题角度很多,在高考中常会出现一些异于常规图像的新型图像.这类新型图像最明显的特点是并未对图中的曲线直接定义,而是要求解题者能够根据题目给出的反应方程进行推理,挖掘图像包含的信息,分析出图中曲线所代表的变量,然后以此为切入点解答问题[5].以下题为例. 例2 (江苏卷)催化重整乙醇和水是制备氢气的常用方法之一,其主要反应过程为: C2H5OH(g)+3H2O(g)2CO2(g)+6H2(g) ΔH=+173.3 kJ/mol① CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2 kJ/mol.② 某科学兴趣小组的同学在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3条件下利用乙醇和水制备氢气,反应平衡时二氧化碳和一氧化碳的选择性以及氢气的产率随温度变化的情况如图4所示(只考虑上述两个主要反应),CO=n生成(CO)n生成(CO2)+n生成(CO)×100%.请问下列哪项说法正确的. A.图中曲线①表示平衡时H2产率随温度的变化 B.升高温度,平衡时CO的选择性增大 C.一定温度下,增大n(C2H5OH)/n(H2O)可提高乙醇平衡转化率 D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率 解 由分析可知图4中曲线②代表H2的产率,故A错误;由分析可知升高温度,平衡时CO的选择性减小,故B错误;一定温度下增大n(C2H5OH)/n(H2O),可以认为开始时水蒸气物质的量不变,增大乙醇物质的量,乙醇的平衡转化率降低,故C错误;加入CaO(s)与水反应放热,且CaO吸收CO2,促进反应①向正反应方向进行,反应②向逆反应方向进行,对反应①影响较大,可以增大H2产率,或者选用对反应①影响较大的高效催化剂,增加反应①的反应,减少反应②的发生,也可以增大H2产率,故D正确.因此答案为D. 3 巩固训练 例3 (江苏卷)工业上常通过催化氧化反应将尾气中的NH3与O2反应转化为N2进行去除,以达到排放标准.现向装有催化剂的容器中通入未知比例的NH3、O2和N2进行反应,NH3的转化率、N2择性=2n生成(N2)n总转化(NH3)×100%与温度的关系如图5所示.已知NH3与O2反应分别生成N2、NO、NO2的反应均为放热反应.请问下列哪项说法正确的. A.保持其他条件不变,升高温度,NH3的平衡转化率增大 B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大 C.催化氧化除去尾气中的NH3应选择反应温度高于250 ℃ D.高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂 解 图5所示中NH3的转化率并不是平衡转化率,由“NH3与O2反应分别生成N2、NO、NO2的反应均为放热反应”知,升高温度,平衡逆向移动,NH3的平衡转化率减小,A项错误;随着温度的升高,N2的选择性减小,说明生成N2的量不断减小,B项错误;温度高于250 ℃时,N2的选择性减小较快,NH3更易转化成NO或NO2,仍会污染环境,C项错误;N2对环境无污染,由图5知,低温下N2的选择性高,但低温下反应速率慢,所以单位时间内NH3的转化率不高,故需要研发低温下NH3转化率高且N2选择性高的催化剂,D项正确. 4 结束语 化学反应速率和化学平衡图像是化学学科中重要的内容之一,本研究旨在探讨化学反应速率和化学平衡图像综合问题的解题策略,帮助学生更好地理解和应用这些知识点.本文通过对不同类型的化学平衡图像进行分析总结,并以高考真题为例详细讲解,向学生介绍这类问题的解题技巧和策略,以帮助学生更好地理解问题的本质,准确把握解题思路,助利其在化学学科中取得更好的成绩. 参考文献: [1]黄春德,辛静玲.化学反应速率与化学平衡图像解题研究[J].数理化解题研究,2021(13):92-94. [2] 冯正清.化学反应速率与化学平衡图像的解题技巧[J].试题与研究,2019(34):30. [3] 穆玉鹏.化学反应速率和化学平衡图像分类突破[J].数理化解题研究,2020(04):82-85. [4] 郭樱滨.基于平衡图像认知模型解决平衡图像多元变化问题[J].化学教与学,2018(10):48-51,67. [5] 张林.“化学反应速率和化学平衡图像”考点点击[J].理科考试研究,2019,26(15):49-51. [责任编辑:季春阳]
