低盐条件下副溶血弧菌侵染对菲律宾蛤仔存活、消化腺组织及免疫基因表达的影响
2024-07-03陈俊影王宇航李双李云志刘莉君李东东张贺霍忠明闫喜武
陈俊影 王宇航 李双 李云志 刘莉君 李东东 张贺 霍忠明 闫喜武

摘要:为探究低盐条件下副溶血弧菌胁迫对蛤仔存活、消化腺组织及基因表达的影响,开展了不同盐度和副溶血弧菌(Vibrio parahaemolyticus)双因素互作胁迫对菲律宾蛤仔的影响研究。结果表明,在盐度和副溶血弧菌浓度分别为16‰-108 CFU/mL、16‰-107 CFU/mL和16‰-106 CFU/mL条件下处理蛤仔48 h的死亡率为100%。对蛤仔消化腺组织的切片观察发现,低盐条件下,相对于对照组(0 h),弧菌感染组中消化腺组织随时间的增加内腺管结构开始逐渐排列松散,大量的腺管出现上皮细胞脱落,管腔内可见脱落的上皮细胞,炎症细胞浸润面积逐渐增多。利用荧光定量PCR检测蛤仔消化腺中免疫基因时序表达发现基因在低盐和弧菌双重胁迫下Rho GTP、CD-MPR、Big Defensin、CfC1qDC、RpLysBp和PGRPs基因被显著诱导表达,表明低盐条件下这些免疫基因响应了副溶血弧菌的侵染。
关键词:菲律宾蛤仔;副溶血弧菌;盐度;消化腺组织切片;免疫基因
中图分类号:S966.2 Q178.1 文献标识码:A
基金项目:辽宁省自然科学基金联合基金“博士科研启动项目”(2023-BSBA-013)
作者简介:陈俊影(1999—),女,硕士研究生,主要从事贝类遗传育种与繁殖研究。E-mail:2298631811@qq.com
通讯作者:李东东(1994—),男,博士,讲师,主要从事滩涂贝类先天免疫与病害防控研究。E-mail:lidongdong@dlou.edu.cn
弧菌属(Vibrio)隶属于弧菌科(Vibrionaceae)[1],研究表明常见的弧菌属会引起水产动物疾病的发生[2]。水体环境因子的变化对贝类的健康养殖具有重要意义[3],作为条件致病菌,环境因子的变化会直接成为弧菌病害爆发的关键因素。相关研究表明,水体中的盐度变化也可直接对贝类的生长发育、生理代谢、渗透调节和免疫防御等产生影响,进而对贝类的存活率造成影响[4]。菲律宾蛤仔(Ruditapes philippinarum),在我国海水养殖贝类中占据重要地位,其健康状态及免疫能力与环境因子之间存在密切关联[5]。
本文探究了不同盐度及弧菌胁迫双因素互作下对蛤仔存活的影响,通过消化腺组织切片观察低盐弧菌下对该组织的影响,进而探讨蛤仔消化腺组织的免疫基因,对其表达情况进行分析,旨在为蛤仔养殖中预防弧菌病害发生及其健康养殖提供参考。
1 材料与方法
1.1 样品采集与处理
在大连市金州市七顶山海购买到实验用野生菲律宾蛤仔(下称蛤仔),平均壳长3.87±0.2 cm,平均总重10.20±0.5 g。实验开始前,将蛤仔暂养于水温22 ℃,盐度30的实验室水槽中七天,连续充气,每日更换沙滤海水,投喂小球藻一次。每日挑出死亡蛤仔,待蛤仔稳定后,开始实验。
实验所用的副溶血弧菌(V.parahaemolyticus),来自大连海洋大学病害实验室。菌种置于冰上解冻,用无菌接种环蘸取上层菌液,在TCBS固体平板培养基上划线培养,28 ℃控温培养24 h,直至单个菌落清晰可见,重复划线培养一次。在清晰观察到单个菌落的重复培养后,挑取单一菌落然后在200 mL的2216E液体培养基进行28 ℃下孵育并在以180 r/min的转速的摇床上连续培养24 h,于无菌海水中进行重悬,血细胞计数器计数重复3次并取平均值,每个瓶子中的细菌密度约为2.8×109 CFU/mL,于4 ℃保存备用。
1.2 实验方法
1.2.1 感染实验
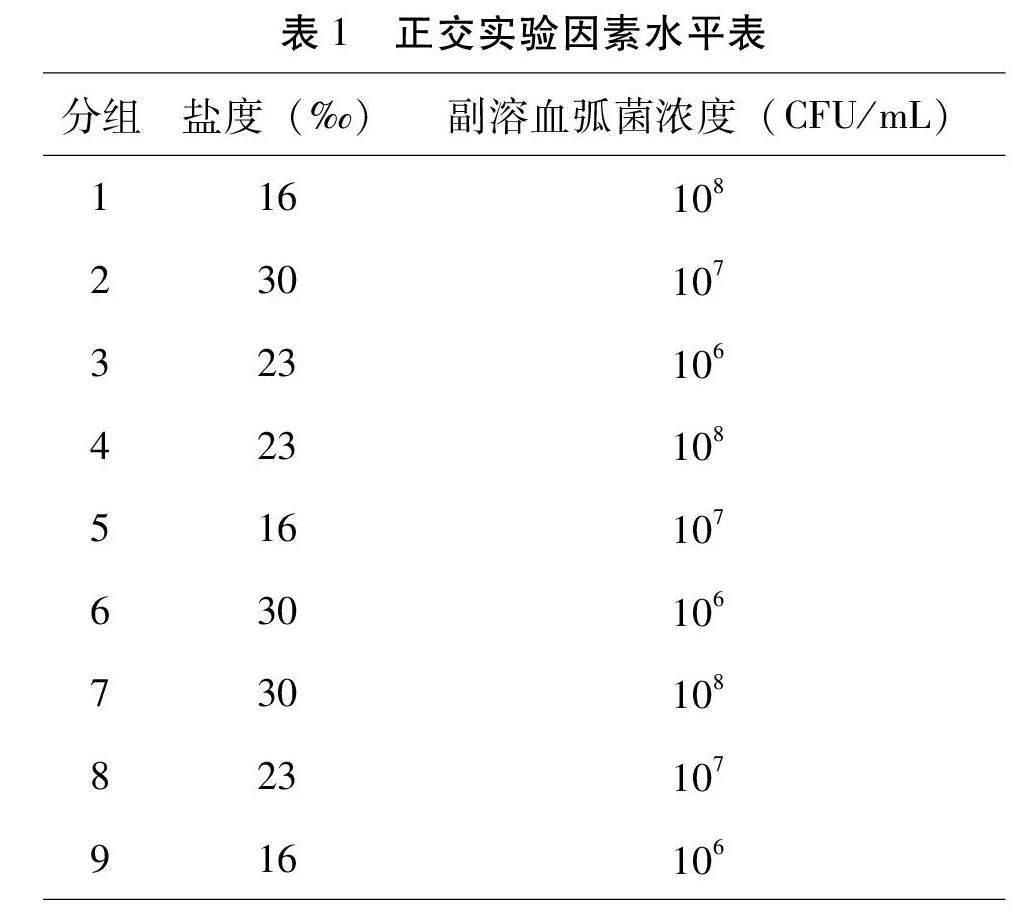
采用正交实验法,设计双因素双水平胁迫实验,因素水平:盐度(30‰、23‰、16‰)和副溶血弧菌浓度(106 CFU/mL、107 CFU/mL、108 CFU/mL),见表1。加热棒控制实验温度为22 ℃,利用曝气淡水进行不同盐度梯度设置。采用浸泡法对蛤仔进行副溶血弧菌感染。将蛤仔分为9组,饲养在5 L水体的长方形水槽中,每组50只蛤仔,各组设置三个平行,根据实验设计在各组中加入不同剂量的副溶血弧菌,使水体中的弧菌达到对应的浓度。实验开始后0 h、24 h、48 h、72 h和96 h统计各平行组死亡个数,累计死亡率用各平行组平均死亡率表示。采用SPSS 25.0单因素方差分析(One-Way ANOVA),P<0.05表示具有显著差异,使用Excel处理数据并绘图。
1.2.2 组织切片观察
实验组蛤仔在温度22 ℃、盐度23‰、水体弧菌浓度为108 CFU/mL条件下进行低盐副溶血弧菌攻毒实验,并取0 h对照组与24 h、48 h、72 h下实验组的蛤仔的消化腺组织,制作成石蜡切片后进行HE染色,观察感染后蛤仔消化腺组织器官的病理变化情况。
1.2.3 免疫基因表达分析
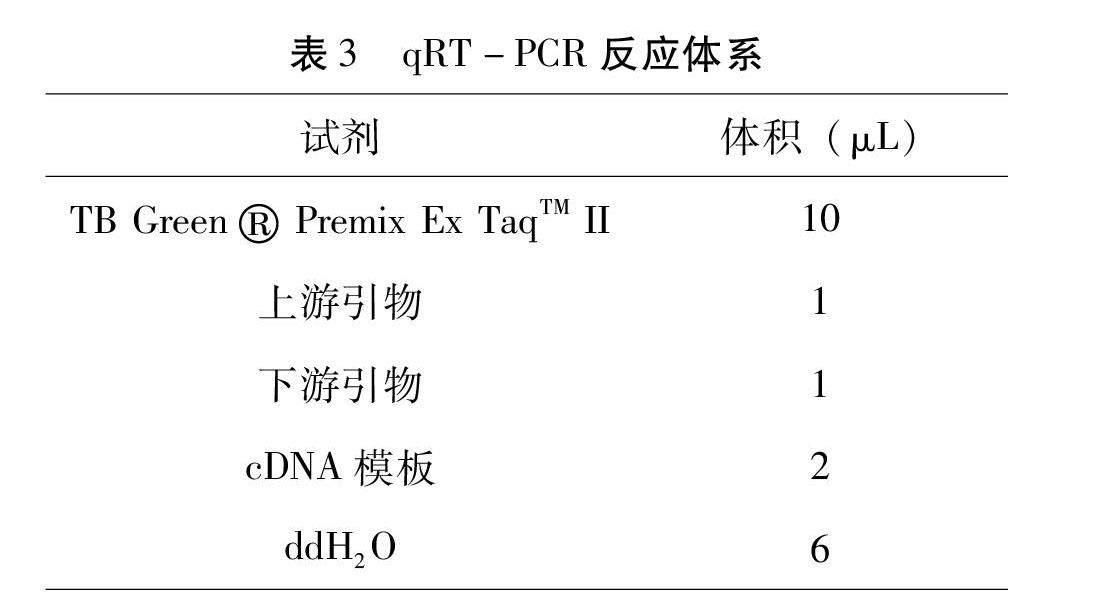
设置同1.2.2相同实验条件的低盐弧菌胁迫感染实验,每组放入70个蛤仔,并设3个平行。分别在0 h对照组与24 h、48 h和72 h下实验组随机挑取3只蛤仔。使用Trizol法提取蛤仔消化腺总RNA。质量检测合格后使用反转录试剂盒(TianGen)合成cDNA。反转录程序为37 ℃15 min,85 ℃5 s,反应体系见表2。根据相关研究对蛤仔消化腺组织内免疫相关基因表达情况进行分析,并在NCBI网站上设计特异性引物(表4),以β-actin作为内部参考基因。利用罗氏荧光定量PCR仪(Roche)进行反应,反应体系见表3。荧光定量反应程序为95 ℃30 s,95 ℃5 s,60 ℃30 s,40个循环,重复三次。qRT-PCR定量验证结果使用2-△△Ct法计算基因相对表达量。使用SPSS 25.0处理数据并进行单因素方差分析(One-way ANOVA),P<0.05为差异显著。
2 结果与分析
2.1 蛤仔低盐条件下副溶血弧菌胁迫后死亡率分析
通过表型性状观察发现,未受胁迫的蛤仔解剖后各组织完整、鳃组织结构清晰可见,整体软体部组织新鲜,并对外部刺激反应敏感。而受胁迫感染的死亡个体的外套膜无光泽发生萎缩易剥离,鳃组织发生萎缩,鳃丝出现严重糜烂,水管、足和闭壳肌软弱无力。在对不同处理组蛤仔96 h内累计死亡率统计(图1)中发现,16‰-106 CFU/mL、16‰-107 CFU/mL、16‰-108 CFU/mL处理组在48 h死亡率达到100%,与30‰-106 CFU/mL、23‰-108 CFU/mL、30‰-108 CFU/mL和23‰-106 CFU/mL处理组相比差异显著(P<0.05)。通过对不同条件下蛤仔死亡率进行方差分析的结果可以看出,盐度对蛤仔死亡率的影响具有显著意义(P<0.05)。
2.2 蛤仔在副溶血弧菌胁迫后消化腺组织病理分析
如图2所示,0 h为健康蛤仔消化腺组织,可见消化腺基本结构清楚,排列整齐,消化腺为复管状腺,腺管上皮细胞多呈柱状,细胞核大,核仁明显,间质内结缔组织未见明显的增生。然而,低盐条件下,副溶血弧菌感染组中的蛤仔消化腺组织随感染时间的增加可观察到内腺管结构开始逐渐排列松散,大量的腺管出现上皮细胞脱落,管腔内可见脱落的上皮细胞(红色箭头),间质内可见结缔组织轻度增生,可见炎性细胞浸润(红色*表示)。
2.3 低盐条件下副溶血弧菌处理后蛤仔免疫相关基因表达分析
通过qRT-PCR对低盐条件下副溶血弧菌处理后的蛤仔消化腺内免疫相关基因表达模式进行分析(图3)。结果发现,低盐条件下,副溶血弧菌侵染后蛤仔消化腺内Rho GTP基因表达与0 h相比在48 h时表现出显著上调,甚至表达量达到峰值(P<0.05),在72 h时出现下降(图3 A);CD-MPR基因在副溶血弧菌胁迫下表达呈现低-高-低的变化趋势,在24 h表达量显著升高并达到最大值(P<0.05)(图3 B);此外,与0 h相比Big Defensin基因表达量在12 h升高后在24 h时出现下降,48 h再次出现升高并达到最大值,随后达到72 h再次出现下降,但整个过程中除24 h外其他时间点与0 h均表现出显著差异(P<0.05)(图3 C);图3 D所示,CfC1qDC基因表达量总体呈上升趋势,并与0 h均表现出显著差异(P<0.05),表达水平在48 h达到最大值,但在72 h出现明显下降。图3 E所示,与0 h相比在12 h时RpLysBp基因表现出下调趋势,在48 h时表达量最高(P<0.05)。PGLYRPs基因表达量与0 h相比在胁迫24 h后表达量开始升高,并在72 h达到最高(P<0.05)(图3 F)。
3 讨论
采用正交实验设计不同盐度和不同浓度副溶血弧菌胁迫证实盐度对蛤仔的死亡率产生显著影响,发现在盐度16‰的条件下胁迫48 h时蛤仔死亡率达到100%。表明盐度的改变与致病性弧菌会对贝类养殖业产生严重的危害[6]。通过组织学切片观察23‰-108 CFU/mL条件下蛤仔的消化腺组织病变程度随时间增加而不断加深。其实此前Joshy等[7]研究表明,根据对贝类的消化腺和鳃组织的形态结构变化及损伤程度的评分,进而可以对水体环境质量进行评估。在研究发现随着感染时间的推移,蛤仔消化腺在感染72 h后可明显观察到消化腺组织的结构排列极为松散,同时伴有大量的腺管上皮细胞脱落,以及出现多处炎性细胞浸润等病理现象。
蛤仔在低盐条件下受副溶血弧菌感染时,机体大部分能量会被用于体内渗透压的调节,使免疫力下降更容易被弧菌所感染。本试验中通过对消化腺中的免疫相关基因的验证,表明6种与免疫相关的基因在蛤仔免疫应答过程中发挥了一定的作用。Rho族蛋白是重要的分子开关,Yin等[8]人在进行鳗弧菌(Vibrio anguillarum)胁迫蛤仔实验中发现,作为免疫因子的Rho GTP基因出现显著表达,这与本实验中蛤仔受到副溶血弧菌胁迫下的显著表达结果一致。阳离子依赖性甘露糖6-磷酸受体(CD-MPR)在贝类先天免疫过程中,可以介导吞噬作用,抵御病原菌的感染,将细菌引导到溶酶体进行降解[9],本研究发现蛤仔在应对副溶血弧菌侵染时,CD-MPR是蛤仔识别副溶血弧菌入侵细胞的受体。同样,在本研究验证了大防御素基因(Big Defensin)在蛤仔消化腺中的表达量随着胁迫时间的延长逐渐达到峰值。Big Defensin可以响应贝类免疫因子的储存以及应激反应机制,使机体在受到病原菌的感染时,可以使免疫系统能及时发挥作用,抵制病原体的侵害[10]。Big Defensin在多数双壳纲贝类中均被发现,其表达量均会随着病原菌刺激时间的推进而逐渐增加[11-13]。肽聚糖识别蛋白(PGRPs)作为一种模式识别受体,在机体先天免疫系统中占据重要地位[14]。Su等[15]通过对栉孔扇贝(Chlamys farreri)的CfPGRP-S1基因的研究发现,在鳗弧菌(V.anguillarum)刺激24 h时其表达水平显著增加,与本研究PGRPs基因的表达水平在低盐条件下副溶血弧菌刺激后的24 h到48 h显著升高的结果相似。本研究中C1q相关的CfC1qDC基因表达上调,总体趋势与隋立军等对文蛤(Meretrix meretrix)受鳗弧菌侵染研究中发现C1q的表达水平显著上调的实验结果类似[16]。差异之处是由于随着副溶血弧菌在体内侵害时间的延长,其体内营养代谢,有机质的利用受阻,免疫活性开始受到抑制,导致其表达水平降低。溶菌酶(Lysozyme,LSZ)广泛存在于软体动物的许多组织器官中,溶酶体酶是软体动物中研究最多的,在本研究中,与LSZ相关的RpLysBp基因在48 h时的表达量达到峰值,与王锐等[17]的研究表明PGN处理组在3 h时蛤仔RpLysBp基因表达量达到最高存在差异,这可能是由于胁迫方式的不同所导致。
参考文献
[1]张晓华,林禾雨,孙浩.弧菌科分类学研究进展[J].中国海洋大学学报(自然科学版),2018,48(8):43-56.
[2]李梦飞,明红霞,樊景凤,等.近岸及河口环境中副溶血弧菌的生态适应性及其主要毒力基因分布特征[J].生命科学,2019,31(2):209-215.
[3]Han J E,Mohney L L,Tang K F J,et al.Plasmid mediated tetracycline resistance of Vibrio parahaemolyticus associated with acute hepatopancreatic necrosis disease(AHPND)in shrimps[J].Aquaculture Reports,2015,2:17-21.
[4]单筱涵,冯延凯,李雪,等.山东养马岛贝类养殖海域细菌及相关因素的研究[J].水产养殖,2021,42(2):24-29+36.
[5]王凤青,孙玉增,任利华,等.海水养殖中水产动物主要致病弧菌研究进展[J].中国渔业质量与标准,2018,8(2):49-56.
[6]桑士田,闫喜武,杨鹏,等.菲律宾蛤仔稚贝最适生长环境条件的响应面法分析[J].水产学报,2012,36(9):1410-1417.
[7]Joshy A,Sharma S R K,Mini K G,et al.Histopathological evaluation of bivalves from the southwest coast of India as an indicator of environmental quality[J].Aquatic Toxicology,2022,243:106076.
[8]Yin Z,Nie H,Jiang K,et al.Molecular mechanisms underlying Vibrio tolerance in Ruditapes philippinarum revealed by comparative transcriptome profiling[J].Frontiers in Immunology,2022,13:879337.
[9]李园园,谢敏,刘先胜.甘露糖受体生物学功能的新进展[J].国际呼吸杂志,2011,31(8):616-619.
[10]Oyanedel D,Gonzalez R,Flores-Herrera P,et al.Molecular characterization of an inhibitor of NF-κB in the scallop Argopecten purpuratus:first insights into its role on antimicrobial peptide regulation in a mollusk[J].Fish & Shellfish Immunology,2016,52:85-93.
[11]Li Y,Sun J,Zhang Y,et al.CgRel involved in antibacterial immunity by regulating the production of CgIL17s and CgBigDef1 in the Pacific oyster Crassostrea gigas[J].Fish & Shellfish Immunology,2020,97:474-482.
[12]赵建民.扇贝大防御素和G型溶菌酶的基因克隆与重组表达[D].青岛:中国科学院研究生院(海洋研究所),2006.
[13]González R,Brokordt K,Cárcamo C B,et al.Molecular characterization and protein localization of the antimicrobial peptide big defensin from the scallop Argopecten purpuratus after Vibrio splendidus challenge[J].Fish & Shellfish Immunology,2017,68:173-179.
[14]杨子彦.三角帆蚌肽聚糖识别蛋白和谷胱甘肽硫转移酶的基因克隆和功能分析[D].武汉:华中科技大学,2013.
[15]Su J,Ni D,Song L,et al.Molecular cloning and characterization of a short type peptidoglycan recognition protein(CfPGRP-S1)cDNA from Zhikong scallop Chlamys farreri[J].Fish & Shellfish Immunology,2007,23(3):646-656.
[16]隋立军,刘卫东,李云峰,等.文蛤C1q基因的克隆与表达及其重组蛋白活性的研究[J].水产科学,2012,31(6):321-328.
[17]王锐.蛤仔(Ruditapes philippinarum)噬菌体型溶菌酶基因的克隆及表达分析[D].大连:大连海洋大学,2014.
