重症肌无力合并炎症性肌病2例报道
2024-06-24李冠肸畅雪丽郭军红张炜
李冠肸 畅雪丽 郭军红 张炜
摘要 报道我院收治的2例重症肌无力(MG)合并炎症性肌病(IM)病人,并结合文献进行回顾分析。探讨MG合并IM病人的临床表现、血清免疫学特点及肌肉病理,以期提高临床医生对本病的认识,对MG合并IM病人做到早诊早治。
关键词 重症肌无力;炎症性肌病;胸腺瘤
doi: 10.12102/j.issn.1672.1349.2024.09.040
重症肌无力(myasthenia gravis,MG)是由自身抗体介导的获得性自身免疫性神经.肌肉接头(neuromuscular junction,NMJ)传递障碍的疾病,临床特征为以波动性及易疲劳性为特点的骨骼肌无力。抗乙酰胆碱受体(acetylcholine receptor,AChR)抗体是MG常见的致病性抗体 [1] 。炎症性肌病(inflammatory myopathies,IM)统称肌炎,是以肌无力和肌肉炎症为特征的自身免疫性异质性疾病,以骨骼肌炎性细胞浸润和肌纤维坏死为主要病理特征,还可累及皮肤、肺和肌肉等不同靶器官,临床表现复杂 [2] 。关于MG合并IM的相关报道较少。本研究报道我院收治的2例MG合并IM病人,并结合文献进行回顾分析,旨在提高临床医生对该病的认识和早期诊断水平。
1 病 例
病例[1]。男性,46岁,因“进行性四肢无力2周”于2022年3月23日就诊我院。既往“银屑病”病史10年余。病人入院前2周出现双手无力,表现为提重物费力,需反复休息;伴双手伸展不能,晨起时明显,活动后略好转;伴饮水呛咳、吞咽困难。症状进行性加重,入院前4 d出现端水杯不能,蹲起动作费力,活动耐力下降,平路走1 000 m左右即需休息。入院体格检查:全身皮肤可见多处大小不等暗红色鳞屑性斑疹。右侧眼睑下垂(2~4点位),双眼球各向活动无受限,无复视,上视疲劳试验阳性;双侧闭目力弱,双侧额纹、鼻唇沟对称,鼓腮漏气;饮水呛咳,咽反射减弱;伸舌居中,未见舌肌萎缩及束颤。颈屈肌肌力Ⅲ级,左 侧三角肌肌力Ⅴ级,右侧三角肌肌力Ⅳ级,肱二头肌 肌力Ⅴ级,拇短展肌肌力Ⅲ级,小指展肌肌力Ⅲ级,双手握力Ⅳ级,指屈肌肌力Ⅲ级,指伸肌肌力Ⅱ级;髂腰肌肌力Ⅲ级,股二头肌肌力Ⅳ级,股四头肌肌力Ⅴ级,足背屈及足跖屈肌肌力Ⅴ级,双足足趾背屈、跖屈肌肌力Ⅳ级;四肢肌张力适中。深浅感觉查体正常。双上肢腱反射(++),双下肢腱反射(+++),双侧巴宾斯基征(-)。辅助检查:D.二聚体7.91 mg/L,肌酸激酶3 009 U/L,乳酸脱氢酶466 U/L。肌炎特异性抗体(-),肌炎 相关性抗体(-),抗AChR抗体110.1 nmol/L(正常值< 0.5 nmol/L),抗肌肉特异性酪氨酸激酶抗体(MuSK)抗体(未送检),抗低密度脂蛋白受体相关蛋白(LRP4)抗体(未送检),抗兰尼碱受体钙释放通道抗体(RYR)抗体(未送检),抗连接素抗体(Titin)抗体(未送检)。运动神经传导四肢复合肌肉动作电位(compound muscle action potential,CMAP)波幅显著降低,感觉神经传导正常,针极肌电图提示肌源性损害可能,重复神经电刺激(repetitive nerve stimulation,RNS)可见低频、高频刺激波幅递减现象。新斯的明实验阳性。胸部增强CT提示胸腺瘤。大腿肌肉核磁共振成像(MRI)提示炎症性改变。取左股外侧肌肉行病理活检,病理符合IM病理学表现(见图1)。诊断胸腺瘤型MG合并IM。给予溴吡斯的明、糖皮质激素联合免疫抑制剂(应用免疫抑制剂为他克莫司)、静脉注射人免疫球蛋白及补钾、补钙等综合治疗,治疗3个月后病人症状较前明显改善,MG定量评分体系(quantitative myasthenia gravis scoring system,QMG)较前改善3分,MG复合量表(myasthenia gravis composite,MGC)评分较前改善10分,MG生命质量15项量表(MG.QOL15)评分较前改善3分,MG日常生活质量量表(myasthenia gravis.activities of daily living profile,MG.ADL)评分较前改善4分,肌酸激酶逐渐降至正常。激素缓慢减量,病人拒绝行胸腺瘤切除术。
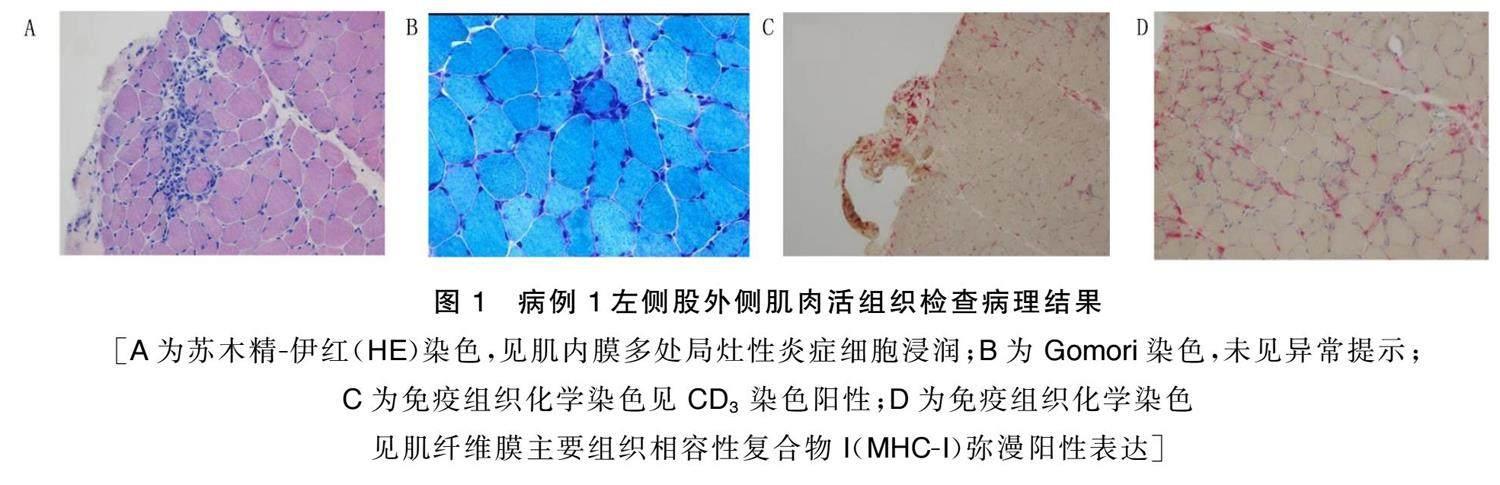
[A为苏木精.伊红(HE)染色,见肌内膜多处局灶性炎症细胞浸润;B为Gomori染色,未见异常提示;C为免疫组织化学染色见CD 3染色阳性;D为免疫组织化学染色见肌纤维膜主要组织相容性复合物I(MHC.I)弥漫阳性表达] 病例[2]。女性,76岁,因“确诊胸腺瘤型MG 4年,四肢无力伴吞咽困难10 d”于2022年9月7日入院。既往有冠状动脉粥样硬化性心脏病病史。病人4年前出现波动性双眼睑下垂、吞咽困难,外院就诊完善新斯的明实验阳性,胸部CT提示胸腺瘤,诊断胸腺瘤型MG,并予以溴吡斯的明片治疗,每次60 mg,每日2次,口服,症状较前好转。10 d前病人自行调整溴吡斯的明片为1周口服2~3次后出现吞咽困难、四肢无力加重,表现出不能行走伴四肢肌肉疼痛,外院化验肌酸激酶1 455 U/L。入院体格检查:意识清楚,构音障碍,吞咽困难,饮水呛咳,双眼球活动无受限,双侧眼睑下垂,遮角膜3~9点位。双侧闭目有力,双侧额纹及鼻唇沟对称,鼓腮力弱,伸舌居中,舌肌无萎缩。颈屈肌肌力Ⅲ级,双侧三角肌肌力Ⅳ级,双侧肘关节屈曲肌肌力Ⅳ级,左侧肘关节伸展肌肌力Ⅳ级,右侧肘关节伸展肌肌力Ⅲ级,双侧拇短展肌肌力Ⅳ级,双侧小指展肌肌力Ⅲ级,双下肢髂腰肌肌力0级,双侧膝关节屈曲肌肌力Ⅱ级,双侧足背屈肌肌力Ⅲ级,双侧足趾屈肌肌力Ⅲ级。四肢肌张力正常。四肢腱反射(++)。无肌肉萎缩,手足水肿。辅助检查:肌酸激酶1 801 U/L。肌炎特异性抗体(-),肌炎相关性抗体(未送检),抗AChR抗体13.254 nmol/L,抗MuSK抗体(-),LRP4 抗体(-),抗RYR抗体(1∶100),抗Titin抗体(1∶320)。 血气分析提示:pH 7.45,二氧化碳分压(PaCO 2)为41.2 mmHg,血氧分压(PaO 2)为70 mmHg。肌电图提示:肌源性损害;RNS可见低频、高频刺激波幅递减现象。胸部CT提示胸腺区软组织结节,胸腺瘤待除外。大腿肌肉MRI提示炎症性改变。左股外侧肌肌肉活检病理改变符合IM,诊断为胸腺瘤型MG合并IM。给予静注人免疫球蛋白输注治疗预防肌无力危象,给予他克莫司免疫调节治疗。入院第4天,病人出现端坐呼吸,血气分析提示:氧流量5 L/min,PaCO 2为36.3 mmHg,PaO 2为69 mmHg,血氧饱和度(SaO 2)为92.7%。 病人出现呼吸衰竭,复查化验肌酸激酶242 U/L,肌钙蛋白I 2.139 ng/mL(正常界值<0.04 ng/mL),肌钙蛋白T 931.78 ng/mL(正常界值<0.13 ng/mL),N端.B型钠尿肽前体32 895 pg/mL,心脏彩色多普勒超声提示心功能不全,结合病人既往陈旧性心肌梗死病史,考虑心功能衰竭,转入重症监护病房,并给予气管插管及呼吸机辅助通气、利尿、抗血小板聚集、抗凝、降压等治疗。入院第6天病人家属要求转至当地医院继续治疗。转入当地医院后,继续行他克莫司、溴吡斯的明治疗,病人呼吸困难、吞咽困难、饮水呛咳等症状较前逐渐好转,2个月后自行停用他克莫司,目前病人病情尚平稳,吞咽正常,肢体力弱,不能爬楼,平路仅能行走20 m。
2 肌肉活检病理
对2例病人均取材左侧股外侧肌行肌肉活检。病例[1]HE染色显示,肌内膜可见多处局灶性炎细胞浸润;免疫组织化学染色示:炎细胞浸润以CD 4、CD 68 染色阳性T淋巴细胞浸润为主,未见CD 20 染色阳性B淋巴细胞浸润;肌纤维膜MHC.I呈弥漫阳性表达。病例[2]HE染色示肌束膜、肌内膜、血管周围可见多处血管周围炎细胞浸润;免疫组织化学染色示以CD 3、CD 4及CD 8染色阳性T淋巴细胞浸润为主,未见CD 20 、CD 68 、C5b.9染色阳性B淋巴细胞浸润;免疫组织化学染色示:肌纤维膜MHC.I染色呈弥漫阳性表达。
3 肌肉影像
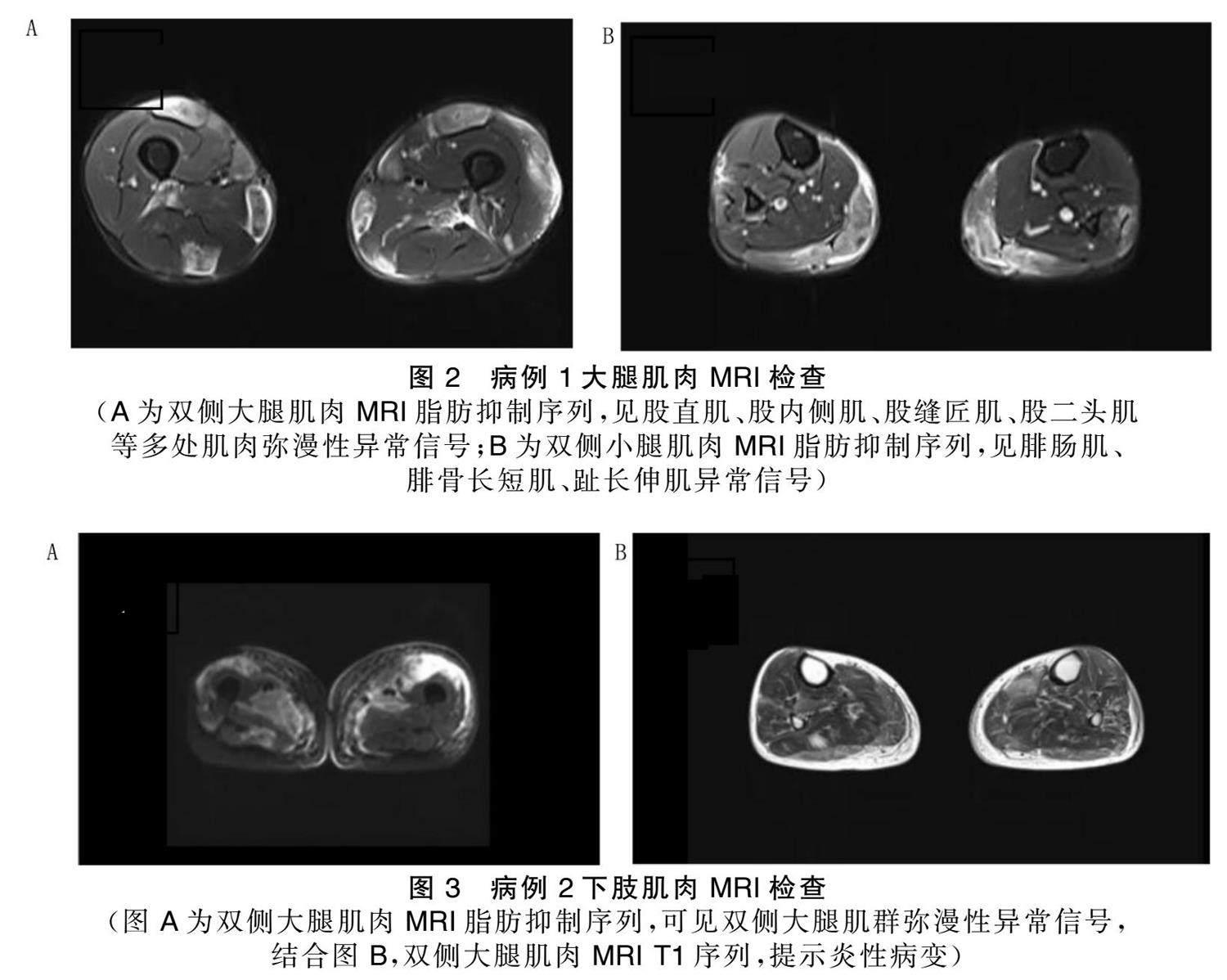
2例病人均完善双下肢肌肉MRI检查。病例[1]双侧大腿肌群弥漫性异常信号、双侧小腿腓肠肌、腓骨长短肌、趾长伸肌异常信号,考虑炎性改变,双侧小腿皮下软组织水肿,符合IM表现。病例[2]双侧大腿肌群弥漫斑片状异常信号,考虑炎性改变,双下肢皮下、肌间隙内水肿,双下肢肌群可见肌肉萎缩及脂肪浸润,符合IM改变。详见图2、图3。
4 文献回顾
检索国内外文献,整理目前较为详细报道MG合并IM病人106例 [3.27] ,病例以女性受累多见(68/106,64.15%),IM与MG同时起病多见(57/106,53.77%),以MG起病其次(34/106,32.08%),以IM起病少见(15/106,14.15%);其中,>50%的病人合并胸腺瘤 (66/106,62.26%),多数病人表现出肢体无力(100/106, 94.34%)、吞咽困难或饮水呛咳等球部症状(76/106,71.70%)、呼吸困难(38/106,35.85%)等临床症状,也有部分表现出眼外肌无力(56/106,52.83%);肌酸激酶为67~40 000 U/L,仅极少数病人肌酸激酶无升 高;大多数病人抗AChR抗体呈阳性(75/106,70.75%), 几乎所有病例肌炎相关抗体及肌炎特异抗体阴性(102/106,96.23%);大多数病人治疗方案选择激素联合免疫抑制剂、丙种球蛋白或血浆置换,多数病例治疗后病情好转(90/106,84.91%)。
5 讨 论
MG临床特征性表现为波动性无力和易疲劳性,症状呈“晨轻暮重”特点,活动后加重、休息后减轻;全身骨骼肌均可受累,以眼外肌最易受累,80%以上的MG病人以此为首发症状,部分病人短期内病情可迅速进展,发生肌无力危象,胸腺瘤相关MG占MG病人的10%~15%,属于副肿瘤综合征 [1] 。MG诊断在具有典型MG临床特征的基础上,需满足药理学检查、电生理学特征以及血清抗AChR抗体等相关抗体检测中的任意一点即可做出诊断,同时需排除其他疾病 [1] 。
IM为系统性自身免疫性风湿病,临床症状以肌肉炎症表现合并多种肌外表现为特征,亚急性或慢性发作;肌肉受累以肢体近端及颈屈肌为主,极少涉及面部肌肉。IM诊断除需具备炎症导致肌肉损伤相关证据,包括肌酸激酶升高,针极肌电图肌源性损害提示,肌肉MRI提示肌肉伴或不伴皮肤、皮下软组织炎症、水肿、钙化、脂肪浸润等相关表现外,还需免疫学相关证据,包括肌炎特异性或肌炎相关性抗体阳性;其诊断金标准为肌肉病理中发现CD 4阳性T细胞或B淋巴细胞为主束周浸润、肌纤维表达MHC.I类分子明显上调、束周萎缩等特征性表现 [28] 。
本研究报道的2例病人均以吞咽困难、饮水呛咳伴肢体无力起病。2例病人入院后抗AChR抗体检测均为阳性,RNS提示低频刺激波幅递减;肌酸激酶升高、肌肉MRI提示炎症性改变且肌电图呈肌源性损害表现,肌肉病理符合IM表现,综合诊断为MG合并IM。病例2为既往确诊MG病人,本次病情急性加重,肌无力危象,合并心功能不全、肺部感染和呼吸衰竭,给予较强的免疫抑制治疗,病人呼吸功能、吞咽功能于免疫抑制剂起效后逐渐改善,后自行调整药物治疗,依靠胆碱酯酶抑制剂行症状性治疗。病例1以球麻痹症状及肢体无力起病,肢体无力疲劳性特点明确,但“晨轻暮重”特点表现不明确,入院后RNS、新斯的明试验、血清抗体均支持MG诊断,结合其肌肉MRI和病理表现,考虑诊断MG合并IM。
回顾既往病例报道过程中,关注到MG合并IM病人肢体无力模式包括全身肌无力合并双上肢对称的局灶性远端肌肉受累、肌痛伴轻微的近端肌无力或无症状血清肌酸激酶升高 [16] ;也有少数MG合并IM表现为侧边肌无力的病例报道 [19] 。本研究中病例1以无力分布呈双重对称上肢远端无力伴四肢近端无力;病例2表现为全身性肌无力伴四肢双侧对称性肌肉无力;2病例肌无力分布未见明显规律,这可能与合并IM类型不同相关。目前,MG合并IM肌无力的分布尚未得到详细的研究,依据肌无力临床分布识别较为困难,诊断仍需关注病例其他临床特征。
MG与IM在罹患其他自身免疫性疾病病人中发生的概率较高,而两种疾病合并情况临床较为罕见。Kufukihara等 [29] 研究表明,2.8%的MG病人患有IM或心肌炎。国内外文献报道中 [3.27] ,MG合并IM病例年龄14~82岁,既往病例有以下临床特征:1)女性多于男性;2)多数病例合并胸腺瘤;3)IM与MG同时起病多见,以IM起病少见;4)抗AChR抗体多阳性;5)肌炎特异性抗体几乎为阴性;6)部分病例抗Titin抗体阳性;7)病人死亡多与感染相关;8)肌电图多同时呈现出肌源性损害特点及RNS低频刺激波幅递减表现;9)血清肌酸激酶多升高。国内外文献目前报道的有较为详细临床资料的MG合并IM病人中,多数合并胸腺瘤,表明这两种疾病的关联不是巧合,而是由胸腺瘤相关的免疫致病机制引起的 [30] ;部分病人肌酸激酶急性升高至极高水平,呈横纹肌溶解样特征 [30] 。在临床诊疗过程中,对于肌肉无力(尤其颈屈肌无力、呼吸肌无力)伴有肌肉痛、合并胸腺异常、肌酸激酶升高病人,需警惕是否为MG合并原发性IM。对于MG病人,尤其是MG全身型病人,若合并肌肉痛,或出现CK升高,需警惕是否合并原发性IM;对于罹患IM的病人,若有眼外肌无力、疲劳性肌无力等症状,需评估是否合并 MG。MG合并IM治疗需选择激素治疗,必要时联合免疫抑制剂治疗,治疗过程中,需严格控制感染,避免引起病情进展,甚至死亡。
近年来,关于免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)引起的MG与IM以及心肌炎的重叠综合征报道逐年增加,研究显示,ICIs诱导的IM合并MG和原发性IM合并MG具有相似的临床特征 [31.39] 。随着肿瘤治疗领域靶向药物的研究进展,肿瘤病人应用靶向药物诊疗的比例也在逐年增加,医生需提高对肿瘤靶向药物相关不良反应的警惕性。目前,关于ICIs诱导MG合并IM的相关报道中,病人多数合并黑色素瘤、肺癌等肿瘤疾病,但尚未检索到胸腺肿瘤相关报道,提示ICIs触发MG合并IM的致病机制与胸腺瘤触发MG合并IM的致病机制存在相似性,但其具体机制尚需进一步研究证实。一般认为,其机制涉及:1)肿瘤和健康组织之间的抗原交叉反应;2)肿瘤破坏后肿瘤和健康组织抗原的释放;3)ICIs的直接毒性。既往研究表明,心肌毒性与心肌细胞程序性死亡受体1(programmed cell death protein 1,PD.1)和细胞程序性死亡.配体1(programmed cell death 1 ligand 1,PD.L1)的表达有关,在小鼠实验中,PD.1表达的敲除与心肌肌钙蛋白.1自身抗体的产生和自身免疫性扩张型心肌病的发生有关;毒性可能是由T细胞介导的,由于肿瘤和心肌细胞之间共享T细胞抗原,CD 8 +T细胞的活化水平较高 [40.41] 。因此,ICIs相关重叠综合征可能是一个类似的过程,涉及共享肿瘤抗原或针对心脏、骨骼以及神经肌肉连接处自身抗体可能 导致该综合征的发展,但尚需生物学水平的进一步研究。
综上所述,对于MG病人,尤其是以肢体、吞咽、呼吸表现为主,合并胸腺异常的病人,若合并肌肉痛或出现肌酸激酶升高,需警惕是否合并原发性IM;对于有IM典型症状的病人,若有复视、斜视、疲劳性肌无力等症状,需评估是否合并MG。ICIs诱导的IM合并MG和原发性IM合并MG有相似的临床特征,其发生机制可能与胸腺瘤诱发原发性IM合并MG机制类似。随着近年来肿瘤治疗中靶向药物使用的增加,医生需提高对于相关不良反应的警惕性。
参考文献:
[1] 常婷. 中国重症肌无力诊断和治疗指南(2020版)[J].中国神经免疫学和神经病学杂志,2021,28(1):1.12.
[2] BOTTAI M, TJRNLUND A,SANTONI G, et al. EULAR/ACR classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups:a methodology report[J].RMD Open,2017,3(2):e000507.
[3] 郭庆合, 杨明山.重症肌无力伴多发性肌炎(附7例报告)[J].卒中与神经疾病,2000,7(3):166.
[4] 毕建忠, 朱正禹,来超,等.结节性肌炎并重症肌无力1例[J].山东大学学报(医学版),2002,40(5):480.481.
[5] 郝风玲, 赵辉,邓本强.重症肌无力并多发性肌炎1例[J].神经疾病与精神卫生,2003,3(6):492.
[6] 周爱红 ,毕建忠,袁云.重症肌无力并发多发性肌炎二例报告[J].中国神经免疫学和神经病学杂志,2004,11(1):59.
[7] 刘暘, 徐瑞香.皮肌炎合并重症肌无力一例[J].中华临床医师杂志(电子版),2013,7(14):6757.
[8] 李延红 ,薛孟周,陈文武.以垂头征为首发症状的成人多发性肌炎并重症肌无力病例报道[C].成都:中华医学会第十八次全国神经病学学术会议论文汇编(下),2015:1.5.
[9] 胡安全, 赵振强,王埮.重症肌无力合并多发性肌炎1例及文献复习[C].成都:中华医学会第十八次全国神经病学学术会议论文汇编(下),2015:1.5.
[10] 赵玉月, 彭琳一,费允云,等.多发性肌炎合并重症肌无力三例报告并文献复习[J].中华全科医师杂志,2016,15(5):387.390.
[11] 宇佳利, 王磊,冯枫,等.多发性肌炎合并重症肌无力1例报告[C].北京:中华医学会第十八次全国神经病学学术会议论文汇编(下),2015:1.5.
[12] 操亚云, 桂梦翠,季苏琼,等.重症肌无力合并多发性肌炎两例临床分析并文献复习[J].中国神经免疫学和神经病学杂志,2017,24(3):193.196.
[13] 许云云, 何宏军,黄玉娟,等.多发性肌炎合并重症肌无力1例并文献复习[J].风湿病与关节炎,2021,10(11):43.46..
[14] HUANG G, ZHOU X H,YAO D Y.Report of a case of necrotizing autoimmune myopathy with thymoma.associated myasthenia gravis[J].The International Journal of Neuroscience,2020,130(11):1178.1181.
[15] NATERA .VILLALBA E,CORRAL.CORRAL I,CABAES L, et al. Acute concomitant presentation of polymyositis and atypical myasthenia gravis:a diagnostic challenge[J].European Journal of Neurology,2020,27(11):e77.e78.
[16] GARIBALDI M ,FIONDA L,VANOLI F, et al. Muscle involvement in myasthenia gravis:expanding the clinical spectrum of Myasthenia.Myositis association from a large cohort of patients[J].Autoimmunity Reviews,2020,19(4):102498.
[17] WANG Y L, ZHAO N,YANG J, et al. Case report:orbital Myositis and myasthenia gravis as symptoms of immune reconstitution inflammatory syndrome in a patient with human immunodeficiency virus infection[J].Frontiers in Immunology,2020,11:595068.
[18] 赵冰 ,岳耀先,张永庆,等.重症肌无力合并炎症性肌病二例报道并文献复习[J].中华神经科杂志,2021,54(2):99.105.
[19] KANBAYASHI T, TANAKA S,HATANAKA Y, et al. Myasthenia gravis with inflammatory myopathy without elevation of creatine kinase[J].Neuromuscular Disorders,2021,31(6):570.573.
[20] FRASSON E, SIMONETTO M,BERTOLASI L, et al. Statin.associated necrotizing autoimmune myopathy with concurrent myasthenia gravis[J].Clinical Case Reports,2021,9(5):e03925.
[21] MAAROUFI A, ASSOUFI N,ESSAOUDI M A, et al. Thymoma may explain the confusion:a case report[J].Journal of Medical Case Reports,2021,15(1):616.
[22] SCANGARELLO F A, ANGEL.BUITRAGO L,LANG.ORSINI M, et al. Giant cell myositis associated with concurrent myasthenia gravis:a case.based review of the literature[J].Clinical Rheumatology,2021,40(9):3841.3851.
[23] 李芷仪, 范学军.重症肌无力合并抗NXP2抗体阳性皮肌炎一例报道并文献复习[J].中国神经免疫学和神经病学杂志,2022,29(3):220.225.
[24] GARCEZ D, CLARA A I,MORAES.FONTES M F, et al. A challenging case of eyelid ptosis and diplopia induced by pembrolizumab[J].Cureus,2022,14(8):e28330.
[25] YU H ,MA X Y,TONG N T, et al. Acute exudative paraneoplastic polymorphous vitelliform maculopathy in a patient with thymoma,myasthenia gravis,and polymyositis[J].European Journal of Ophthalmology,2022,32(3):NP56.NP61.
[26] ZEB S, SAGDEO A,AMARASENA R.Rare case of overlap of myositis and myasthenia gravis[J].Clinical Medicine,2022,22(Suppl 4):47.
[27] TERAYAMA A, YOSHIKAWA K,MICHIURA T, et al. A case of thymoma.associated myasthenia gravis accompanied with myositis showing the clusters of histiocyte along the fascicles in perimysium[J].Clinical Neurology and Neurosurgery,2023,229:107715.
[28] 孙磊, 唐雪梅.特发性炎性肌病分类及诊断标准的变迁[J].国际免疫学杂志,2021,44(5):580.584.
[29] KUFUKIHARA K, WATANABE Y,INAGAKI T, et al. Cytometric cell.based assays for anti.striational antibodies in myasthenia gravis with myositis and/or myocarditis[J].Scientific Reports,2019,9:5284.
[30] BERNARD C, FRIH H,PASQUET F, et al. Thymoma associated with autoimmune diseases:85 cases and literature review[J].Autoimmunity Reviews,2016,15(1):82.92.
[31] BOUTROS A ,BOTTINI A,ROSSI G, et al. Neuromuscular and cardiac adverse events associated with immune checkpoint inhibitors:pooled analysis of individual cases from multiple institutions and literature[J].ESMO Open,2023,8(1):100791.
[32] CUENCA J A ,HANMANDLU A,WEGNER R, et al. Management of respiratory failure in immune checkpoint inhibitors.induced overlap syndrome:a case series and review of the literature[J].BMC Anesthesiology,2023,23(1):310.
[33] LIU H, LI Y M,LI J, et al. Musculoskeletal adverse events induced by immune checkpoint inhibitors:a large.scale pharmacovigilance study[J].Frontiers in Pharmacology,2023,14:1199031.
[34] ROSSI S, GELSOMINO F,RINALDI R, et al. Peripheral nervous system adverse events associated with immune checkpoint inhibitors[J].Journal of Neurology,2023,270(6):2975.2986.
[35] YILDIRIM F, MUTLU M Y,AAN O C, et al. Dermatomyositis associated with thymoma:a case report and literature review[J].La Clinica Terapeutica,2023,174(2):115.120.
[36] 范南南, 张子瑾,王晖.抗PD.1治疗引起无症状心肌炎合并重症肌无力、肝损伤及肌炎1例报道[J].胃肠病学和肝病学杂志,2021,30(7):835.838.
[37] 徐博, 贾童舒,巫昊,等.程序性死亡受体.1抑制剂治疗肾癌致免疫 性肌炎伴重症肌无力1例[J].河南医学研究,2021,30(30):5760.5762.
[38] 郭凯, 朱斌,汪丰.PD.1抑制剂致肌炎伴重症肌无力1例分析[J].上海医药,2020,41(3):56.59.
[39] AHDI H S, ABDULMUJEEB S,NABRINSKY E.Multiple autoimmune complications after a single dose of pembrolizumab[J].Cureus,2023,15(3):e35871.
[40] MICHEL L, HELFRICH I,HENDGEN.COTTA U B, et al. Targeting early stages of cardiotoxicity from anti.PD1 immune checkpoint inhibitor therapy[J].European Heart Journal,2022,43(4):316.329.
[41] SOLIMANDO A G, CRUDELE L,LEONE P, et al. Immune checkpoint inhibitor.related Myositis:from biology to bedside[J].International Journal of Molecular Sciences,2020,21(9):3054.
(收稿日期:2024.01.07)
(本文编辑 邹丽)
