胸腔镜下手术治疗胸腺瘤合并重症肌无力疗效
2017-01-12高鲲梁华刚张舸薛雷赵晓龙贾瑞
高鲲 梁华刚 张舸 薛雷 赵晓龙 贾瑞 李健
[摘 要] 目的:分析胸腔镜下手术治疗胸腺瘤合并重症肌无力(Myasthenia gravis,MG)的疗效。方法:选取我院2013年7月—2015年7月收治的192例胸腺瘤合并MG患者,按照随机数字表法分为胸腔镜组、开胸组,各96例,分别实施电视胸腔镜微创手术及传统胸骨正中劈开手术治疗,比较两组患者围术期指标、并发症发生情况,并实施6个月随访,观察其治疗结局。结果:胸腔镜组手术时间、术中出血量、切口长度、术后引流量、住院时间均低于开胸组,差异有统计学意义(P<0.05);胸腔镜组术后并发症发生率为4.16%,低于开胸组的16.67%,差异有统计学意义(P<0.05);随访期间胸腔镜组失访3例,开胸组失访5例。胸腔镜组、开胸组临床总有效率分别为82.80%、86.81%,组间比较差异无统计学意义(P<0.05)。结论:胸腔镜下手术治疗胸腔镜合并MG有着良好的临床疗效与安全性,且具有创伤小、恢复快等明显围手术期优势。
[关键词] 胸腔镜;手术;胸腺瘤;重症肌无力;疗效
中图分类号:R734 文献标识码:A 文章编号:2095-5200(2016)06-027-03
DOI:10.11876/mimt201606010
胸腺瘤是一种常见的前纵膈肿瘤,约占纵膈肿瘤发病率的20%以上,可导致以器官功能障碍为主的类癌综合征,部分患者可伴有免疫系统或非免疫系统表现,其中约有15%的患者合并重症肌无力(Myasthenia gravis,MG)[1]。研究表明,有效切除胸腺瘤并清扫前纵膈脂肪可使70%~90%的MG患者波动性眼睑下垂、延髓及肢体无力等症状得到明显缓解,降低肌无力危象(Myasthenia crisis,MC)发生风险[2]。但目前临床治疗胸腺瘤合并MG仍以传统开胸手术为主,该方案创伤大、恢复慢且并发症发生风险较高,随着微创技术的发展,胸腔镜下可以完成胸腺瘤合并MG 手术治疗[3]。本文就传统与微创方案的临床疗效与安全性进行了对比观察。
1 资料与方法
1.1 一般资料
2013年7月—2015年7月收治192例胸腺瘤合并MG患者,均经胸部影像学检查、病理组织学检查确诊胸腺瘤,并经肌电图、新斯的明试验或氯化腾喜龙试验确诊MG[4],排除合并手术禁忌证或拒绝参与此次研究者。按照随机数字表法将其分为胸腔镜组、开胸组,各96例。两组患者年龄、病程、胸腺瘤直径、性别、MG Osserman分型[5]、胸腺瘤世界卫生组织(WHO)病理分型等一般临床资料比较,差异无统计学意义(P>0.05),具有可比性。本临床研究已征得我院医学伦理委员会批准,患者均知情同意并签署知情同意书。
1.2 治疗方法
术前处理:按照患者病情状态给予溴吡啶斯的明口服,轻症给予120~240 mg/d,重症者给予240~480 mg/d,若病情仍无明显缓解则加用泼尼松口服,每日3~4次,共计60 mg,而后根据患者病情稳定度逐渐减量,每周减量约5~10 mg,直至维持较低剂量[6]。治疗期间不应用任何多粘菌素类、四环素类、氨基糖苷类抗菌药物,避免对神经肌接头造成影响。
手术方法:开胸组患者接受传统胸骨正中劈开手术治疗,方法参照文献[7]。胸腔镜组参照文献[8]采用电视胸腔镜微创手术治疗切除胸腺及前纵膈脂肪组织。术后处理:两组患者均接受术后辅助放疗,给予抗感染、维持水电解质平衡、止咳祛痰药物,并继续术前用药方案,可维持术前剂量或酌情减量。
1.3 观察指标
记录两组手术时间、术中出血量、切口长度、术后引流量、住院时间等围术期指标及并发症发生情况。
随访及疗效评价:采用电话随访、门诊随诊等形式,对两组患者进行为期6个月的随访,观察疗效,疗效评价采用MGFA标准[9]:(1)完全稳定缓解:MG临床症状及不良体征完全消失,或仅存在单纯眼睑闭合无力症状,且无需药物治疗;(2)药物缓解:MG临床症状及不良体征完全消失,或仅存在单纯眼睑闭合无力症状,但需要药物治疗;(3)轻微症状:肌力正常但仍存在部分MG临床症状及不良体征;(4)无效:MG临床症状及不良体征未见明显好转或恶化;(5)复发:已达到完全稳定缓解、药物缓解或轻微症状,但MG症状再次出现。总有效率=(完全稳定缓解例数+药物缓解例数+轻微症状例数)/总例数×100%。
1.4 统计学分析
SPSS20.0进行分析,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术情况比较
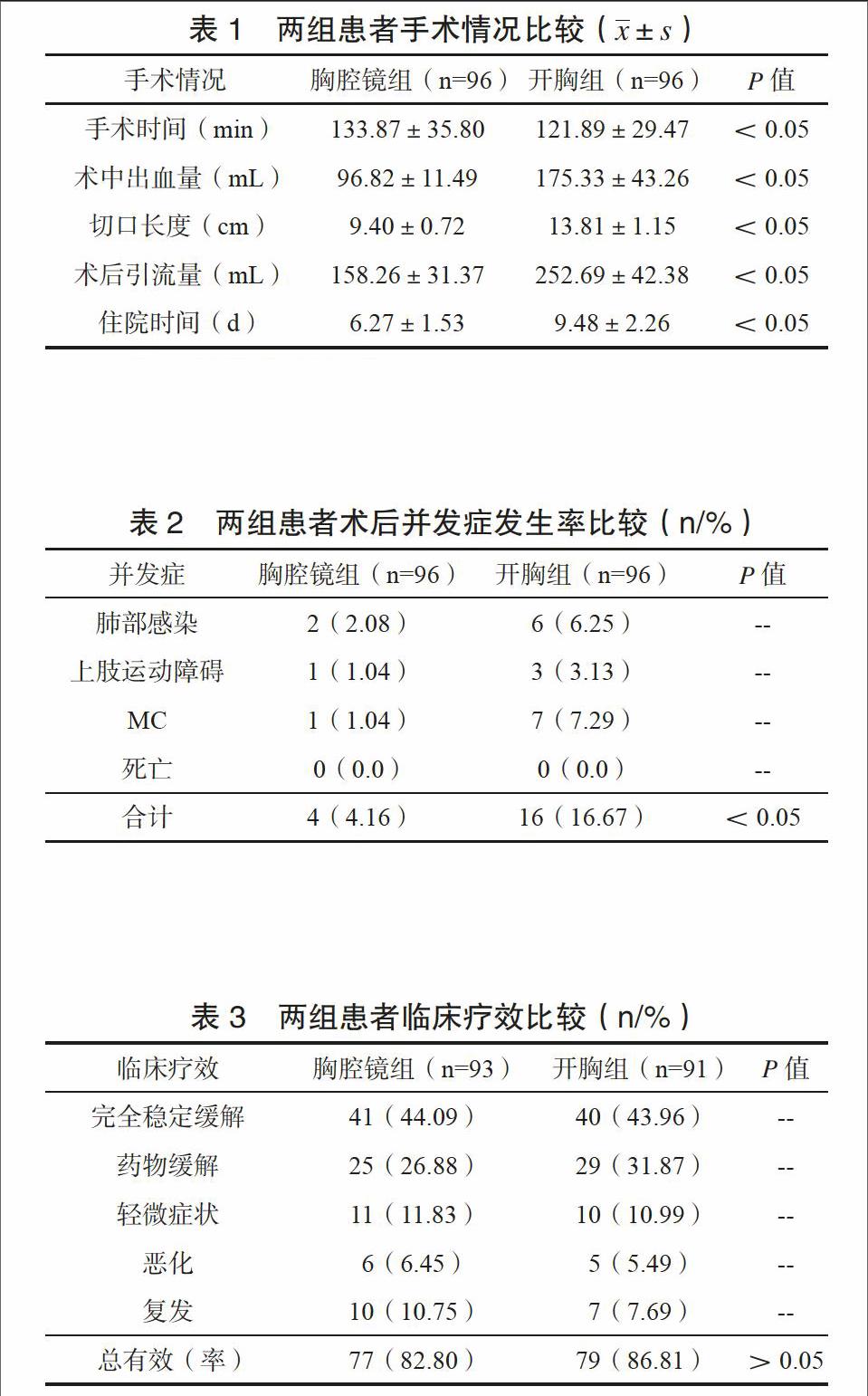
胸腔镜组手术时间、术中出血量、切口长度、术后引流量、住院时间均低于开胸组,差异有统计学意义(P<0.05),见表1。
2.2 术后并发症及疗效
胸腔镜组术后并发症发生率为4.16%,低于开胸组的16.67%,差异有统计学意义(P<0.05),见表2。
随访期间胸腔镜组失访3例,开胸组失访5例。胸腔镜组、开胸组临床总有效率分别为82.80%、86.81%,组间比较差异无统计学意义(P<0.05),见表3。
3 讨论
MG是补体依赖的、乙酰胆碱受体抗体介导的自身免疫性疾病 [10]。约有50%以上MG患者可见胸腺异常,约有30%以上MG患者合并胸腺瘤,及时切除包括胸腺瘤在内的胸腺与前纵膈脂肪组织是治疗MG的重要手段[11]。
过往胸腺瘤的治疗方案以胸骨正中劈开手术为主,其术野暴露清晰、操作便利、胸腺与前纵膈脂肪组织清除彻底的优势已得到广泛认可,但亦存在创伤明显、术后恢复慢、并发症发生风险较高等弊端,难以满足当今医学治疗的微创要求[12]。本研究证实胸腔镜下手术治疗胸腺瘤合并MG有着良好的临床疗效与安全性,且对患者术后的早期恢复具有积极意义。传统手术方案需自胸骨正中劈开并将胸部肌肉切断,术中撑开肋间、撑断肋骨甚至劈开胸骨操作大大增加了切口长度与出血量,且患者术后痛感十分明显[13]。胸腔镜手术仅需于胸壁上开1~3个小孔,大大降低了术中出血量及术后痛感,可明显提高患者恢复质量。传统方案切口大、耗时较长,增加了术中不良事件发生风险,相较而言,胸腔镜手术可在短时间内完成开放切口、置入胸腔镜探测、切开胸膜、游离胸腺等一系列操作,从而明显缩短手术时间、降低术后痛苦,并避免长时间麻醉引发的并发症[14]。唐勇等[15]发现,传统手术在对患者造成较大创伤的同时,对其术后免疫功能的恢复亦存在明显不良影响,而胸腔镜手术术中刺激较小,不易引发严重应激反应,对患者术后免疫功能的迅速恢复亦具有积极意义。此外,随着患者对治疗要求的不断提高,胸腔镜手术切口窄小、美观度高、术后无明显瘢痕遗留等优势更利于被医生、患者接受。
一般认为,胸腺瘤合并MG的手术治疗应符合两项原则,即完整切除胸腺瘤、胸腺组织,在减少肿瘤复发风险的同时缓解MG临床症状,以及尽量实施前纵膈脂肪组织的完整清除[16]。为满足这一原则,传统手术中往往需辅以胸腺扩大切除,进一步增加了手术、疼痛、恐惧、感染等因素诱发的严重并发症风险[17]。本研究中开胸组患者术后MC发生率高达7.29%,也证明了这个结论。与之相比,胸腔镜手术存在的各项优势能够有效避免患者因营养状态较差、免疫功能下降及术后辅助呼吸时间过长等因素诱发的MC加重,对进一步提高治疗的安全性具有积极意义[18]。本研究的局限性在于随访时间有限,未能明确胸腔镜手术对胸腺瘤合并MG患者远期预后的影响。
总体而言,胸腔镜下手术治疗胸腺瘤合并MG可达到与传统开胸手术相近的临床效果,且创伤小、恢复快、安全性高。
参 考 文 献
[1] Koezuka S, Sato F, Hata Y, et al. Video-assisted thoracoscopic surgery for ectopic middle mediastinal thymoma in a patient with myasthenia gravis[J]. Ann Thorac Surg, 2013, 95(3): e67-e68.
[2] He Z, Zhu Q, Wen W, et al. Surgical approaches for stage I and II thymoma-associated myasthenia gravis: feasibility of complete video-assisted thoracoscopic surgery (VATS) thymectomy in comparison with trans-sternal resection[J]. J Biomed Res, 2013, 27(1): 62.
[3] 蒋雷. 胸腺切除术治疗非胸腺瘤重症肌无力的研究进展[J]. 中国胸心血管外科临床杂志, 2013, 20(4): 463-466.
[4] Liu T J, Lin M W, Hsieh M S, et al. Video-assisted thoracoscopic surgical thymectomy to treat early thymoma: a comparison with the conventional transsternal approach[J]. Ann Surg Oncol, 2014, 21(1): 322-328.
[5] Lo C M, Lu H I, Hsieh M J, et al. Thymectomy for myasthenia gravis: Video-assisted versus transsternal[J]. J Formods Med Assoc, 2014, 113(10): 722-726.
[6] 张国飞. 电视胸腔镜下行胸腺切除治疗重症肌无力[D]. 杭州:浙江大学, 2006.
[7] Nakagiri T, Inoue M, Shintani Y, et al. Improved procedures and comparative results for video-assisted thoracoscopic extended thymectomy for myasthenia gravis[J]. Surg Endosc, 2015, 29(9): 2859-2865.
[8] Ye B, Tantai J C, Li W, et al. Video-assisted thoracoscopic surgery versus robotic-assisted thoracoscopic surgery in the surgical treatment of Masaoka stage I thymoma[J]. J Surg Oncol, 2013, 11(1): 1.
[9] 李运涛. 胸腺瘤伴重症肌无力外科治疗与预后分析[D]. 济南:山东大学, 2009.
[10] 景少巍. 重症肌无力患者抗乙酰胆碱受体抗体的测定及意义[D]. 延吉:延边大学, 2007.
[11] Manoly I, Whistance R N, Sreekumar R, et al. Early and mid-term outcomes of trans-sternal and video-assisted thoracoscopic surgery for thymoma[J]. Eur J Cardiothorac Surg, 2014, 45(6): e187-e193.
[12] Kimura T, Inoue M, Kadota Y, et al. The oncological feasibility and limitations of video-assisted thoracoscopic thymectomy for early-stage thymomas[J]. Eur J Cardiothorac Surg, 2013, 44(3): e214-e218.
[13] 孟祥一. 胸腔镜与传统胸骨正中劈开治疗胸腺瘤合并重症肌无力的临床疗效分析[D]. 长春:吉林大学, 2014.
[14] Hess N R, Sarkaria I S, Pennathur A, et al. Minimally invasive versus open thymectomy: a systematic review of surgical techniques, patient demographics, and perioperative outcomes[J]. Ann Cardiothoracic Surg, 2016, 5(1): 1.
[15] 唐勇, 徐恩五, 廖明, 等. 电视胸腔镜手术与胸骨劈开扩大胸腺切除术治疗重症肌无力的临床对比研究[J]. 中国微创外科杂志, 2014, 14(12):1077-1080.
[16] Ismail M, Swierzy M, Rückert R I, et al. Robotic thymectomy for myasthenia gravis[J]. Thorac Surg Clin, 2014, 24(2): 189-195.
[17] Gu Z, Mao T, Chen W, et al. Comparison of Video-assisted Thoracoscopic Surgery and Median Sternotomy Approaches for Thymic Tumor Resections at a Single Institution[J]. Surg Laparosc Endosc Percutan Tech, 2015, 25(1): 47-51.
[18] Lo C M, Lu H I, Hsieh M J, et al. Thymectomy for myasthenia gravis: Video-assisted versus transsternal[J]. J Formods Med Assoc, 2014, 113(10): 722-726.