马钱苷调节AKT/AMPK/Nrf2通路改善氧葡萄糖剥夺/复氧诱导的神经元铁死亡的机制研究
2024-06-24杨祎贾健魏小利苟平平袁媛高李
杨祎 贾健 魏小利 苟平平 袁媛 高李

摘要 目的: 探讨马钱苷通过调节蛋白激酶B(AKT)/腺苷酸活化蛋白激酶(AMPK)/核因子.E2相关因子2(Nrf2)通路改善氧葡萄糖剥夺/复氧(OGD/R)诱导的神经元铁死亡的机制。 方法: 将神经元分为对照组、OGD/R组、OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组、OGD/R+H.马钱苷+ML385组。透射电子显微镜观察神经元线粒体形态;检测铁含量、谷胱甘肽过氧化物酶4(GPX4)活性、4.羟基壬烯醛(4.HNE)、超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)/氧化型谷胱甘肽(GSSG),还原型辅酶Ⅱ(NADPH)/辅脱氢酶Ⅱ(NADP +)及乳酸脱氢酶(LDH)含量;使用CM.H2DCFDA、C11.BODIPY581/591分别检测细胞内和脂质活性氧(ROS)水平;四唑盐(MTT)试剂盒检测细胞活性;蛋白免疫印迹法(Western Blot)检测B细胞淋巴瘤2(Bcl.2)、Bcl相关X蛋白(Bax)、剪切的半胱天冬氨酸蛋白酶3(cleaved Caspase.3)、磷酸化的蛋白激酶B(p.AKT)/AKT、磷酸化的腺苷酸活化蛋白激酶(p.AMPK)/AMPK、Nrf2蛋白表达。 结果: OGD/R组神经元线粒体出现碎片化现象,嵴减少,线粒体膜密度有所增 加。与对照组比较,OGD/R组GSH/GSSG、NADPH/NADP +、SOD、GPX4相对活性、 细胞活力以及Bcl.2水平、p.AKT/AKT、p.AMPK/AMPK、 Nrf2水平下降( P <0.05),Fe 2+ 含量、细胞内ROS水平、脂质ROS水平以及4.HNE、MDA水平、LDH释放量、Bax以及cleaved Caspase.3 水平上升( P <0.05);马钱苷处理后神经元线粒体中的线粒体嵴变得较为完整,碎片化现象消失,OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组较OGD/R组GSH/GSSG、NADPH/NADP +、SOD、GPX4相对活性、细胞活力以及Bcl.2水平、p.AKT/AKT、p.AMPK/AMPK、Nrf2水平上升( P <0.05),Fe 2+ 含量、 细胞内ROS水平、脂质ROS水平以及4.HNE、MDA水平、LDH释放量、Bax 以及cleaved Caspase.3水平下降( P <0.05),且随着马钱苷剂量的增加,改善效果更显著;OGD/R+H.马 钱苷+ML385组以上指标与OGD/R组趋势一致。 结论: 马钱苷可能通过调节AKT/AMPK/Nrf2通路改善OGD/R诱导的神经元铁死亡。
关键词 氧葡萄糖剥夺/复氧;铁死亡;马钱苷;蛋白激酶B/腺苷酸活化蛋白激酶/核因子.E2相关因子2通路;神经元
doi: 10.12102/j.issn.1672.1349.2024.09.010
Mechanism of AKT/AMPK/Nrf2 Regulated by Loganin to Improve Ferroptosis Induced by Oxygen Glucose Deprivation/Reoxygenation
YANG Yi, JIA Jian, WEI Xiaoli, GOU Pingping, YUAN Yuan, GAO Li
Baoji Central Hospital, Baoji 721000, Shaanxi, China
Corresponding Author GAO Li, E.mail: gaoli1980g@163.com
Abstract Objective: To investigate the mechanism of loganin improves the ferroptosis induced by oxygen glucose deprivation/reoxygenation(OGD/R) by regulating protein kinase B(AKT)/adenylate activated protein kinase(AMPK)/nuclear factor E2 associated factor 2(Nrf2) pathway. Methods: The neurons were divided into control group,OGD/R group,OGD/R+L.loganin group,OGD/R+M.loganin group,OGD/R+H.loganin group,OGD/R+H.loganin+ML385 group.The morphology of neuron mitochondria was observed by transmission electron microscope.Iron content,glutathione peroxidase 4(GPX4) activity,4.hydroxynonenal(4.HNE),superoxide dismutase(SOD),malondialdehyde(MDA),reduced glutathione(GSH)/oxidized glutathione(GSSG),reduced Coenzyme Ⅱ(NADPH)/Codehydrogenase Ⅱ(NADP +),and Lactate dehydrogenase(LDH) content were determined.Intracellular and lipid reactive oxygen species(ROS) levels were detected by CM.H2DCFDA and C11.BODIPY581/591,respectively.MTT assay was used to detect cell activity.B.cell lymphoma 2(Bcl.2),Bcl.associated X protein(Bax),cleaved Caspase.3,phosphorylated protein kinase B(p.AKT)/AKT,phosphorylated adenylate activated protein kinase(p.AMPK)/AMPK,Nrf2 protein expression were detected by Western Blot. Results: In OGD/R group,mitochondrial fragmentation occurred,ridge decreased,and mitochondrial membrane density increased.Compared with the control group,the relative activities of GSH/GSSG,NADPH/NADP +,SOD,GPX4,and the levels of Bcl.2,p.AKT/AKT,p.AMPK/AMPK and Nrf2 in OGD/R group decreased( P <0.05),Fe 2+ content,intracellular ROS levels,lipid ROS levels,4.HNE,MDA levels,LDH release,Bax,and cleaved Caspase.3 levels increased( P <0.05).After treatment with loganin,the mitochondrial ridge in neuronal mitochondria became more complete and the fragmentation disappeared.The relative activity of GSH/GSSG,NADPH/NADP +,SOD,GPX4,Bcl.2 level,p.AKT/AKT,p.AMPK/AMPK,and Nrf2 in OGD/R+L.loganin group,OGD/R+M.loganin group and OGD/R+H.loganin group were higher than those in OGD/R group,Fe 2+ content,intracellular ROS levels,lipid ROS levels,4.HNE,MDA levels,LDH release,Bax,and cleaved Caspase.3 levels were lower than those in OGD/R group( P <0.05).With the increase of the dose of loganin,the improvement effects were more significant.The above indexes of OGD/R+H.loganin+ML385 group were consistent with the trend of OGD/R group. Conclusion: loganin may ameliorate OGD/R.induced neuronal ferroptosis by regulating the AKT/AMPK/Nrf2 pathway.
Keywords oxyglucose deprivation/reoxygenation; ferroptosis; loganin; protein kinase B/adenylate.activated protein kinase/nuclear factor.E2.related factor 2 pathway; neurons
脑梗死是一种常见的缺血性脑血管病,是由于各种原因造成脑动脉闭塞,引起相应供血区域脑细胞缺血、缺氧、坏死,出现相应功能障碍;临床上通常通过恢复血流来治疗,但恢复血流可能导致缺血区域的继发性损伤,简称为缺血再灌注损伤(ischemia reperfusion injury,IRI) [1] 。IRI会诱发线粒体氧化代谢受损及神经元能量消耗,进而导致细胞程序性死亡 [2] 。铁死亡是一种铁依赖的细胞死亡形式,由脂质过氧化物的过量积累介导,其对脑梗死等多种神经系统疾病具有重要意义 [3] 。寻找适当的药物来保护神经元免受IRI的影响是目前急需解决的难题之一。
马钱苷(loganin,log)是一种从山茱萸中提取的环烯醚萜苷,具有神经保护 [4] 、抗氧化 [5] 、抗炎 [6] 等特性。有研究发现,马钱苷可减轻脂多糖刺激的BV2小胶质细胞对原代神经元的损伤,对大脑中动脉闭塞小鼠发挥抗炎和神经保护作用 [7] 。据报道,调节腺苷酸活化蛋白激酶(AMP.activated protein kinase,AMPK)/核因子.E2相关因子2(nuclear factor erythroid 2.related factor 2,Nrf2)信号通路可以对IRI中的神经元起到保护作用 [8] 。蛋白激酶B(protein kinase B,AKT)参与细胞生长、增殖、凋亡和蛋白质合成等生物过程 [9] 。AKT也与Nrf2介导的抗氧化反应有关 [10] 。研究发现,激活AMPK/Nrf2信号通路可减轻氧葡萄糖剥夺/复 氧(oxygen.glucose deprivation/reoxygenation,OGD/R) 诱导的神经元损伤 [11] 。本研究探讨马钱苷通过激活AKT/AMPK/Nrf2通路减轻OGD/R诱导的神经元铁死亡的机制。
1 材料与方法
1.1 材料
3只妊娠C57BL/6j小鼠购自广东省医学实验动物 中心[许可证号SCXK(粤)2022.0002];饲养于昼夜12 h 交替、湿度45%、室温(23±1)℃环境中,自由进食。马钱苷(货号:YT62708)购自北京伊塔生物科技有限公司;ML385(货号:S86700)购自上海源叶生物科技有 限公司;4.羟基壬烯醛(4.hydroxynonenal,4.HNE) 试剂盒(货号:EK.M25633)、超氧化物歧化酶 (superoxide dismutase,SOD)试剂盒(货号:EK.M29371)、 丙二醛(malondialdehyde,MDA)试剂盒(货号:EK.M29370) 购自上海酶研生物科技有限公司;还原型谷胱甘肽(GSH)/氧化型谷胱甘肽(GSSG)(货号:AAT.10056)和还原型辅酶Ⅱ(nicotinamide adenine nucleoside phosphorylase b,NADPH)/辅脱氢酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADP +)试剂盒(货号:K347.100)购自上海研卉生物科技有限公司;谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)(货号:ybC994Hu)试剂盒购自上海钰博生物科技有限公司;四唑盐(MTT)试剂盒(货号:FT.P9S1344X)购自上海梵态生物科技有限公司;总活性氧(reactive oxygen species,ROS)荧光探针CM.H2DCFDA(货号:HY.D1713)及脂质ROS荧光探针C11.BODIPY581/591 (货号:HY.D1301)购自美国MCE公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(货号:Dojindo) 购自上海觅拓生物科技有限公司;磷酸化的蛋白激酶B (p.AKT)抗体(货号:4060)、AKT(货号:9272)、磷酸化的腺苷酸活化蛋白激酶(p.AMPK)抗体(货号:4185)购自Cell Signaling Technology公司;铁含量检测试剂 盒(货号:ab83366)、B细胞淋巴瘤2(B.cell lymphoma 2, Bcl.2)(货号:ab32124)、Bcl相关X蛋白(Bcl.associated X protein,Bax)抗体(货号:ab32503)、剪切的半胱天冬氨酸蛋白酶3(cleaved Caspase.3)抗体(货号:ab2302)、AMPK抗体(货号:ab3760)购自Abcam公司;Nrf2抗体(货号:bs.2013)购自RBioss公司;电泳仪(货号:1645050.OG)购自北京智杰方远科技有限公司;离心机(货号:D1524R)购自大龙兴创实验仪器(北京)有限公司。
1.2 方法
1.2.1 原代皮层神经元的培养
参考文献[12]将妊娠的C57BL/6j小鼠处死,从胎鼠中分离原代皮质神经元。首先分离小鼠大脑皮层,大脑皮层经胰酶消化后,分离神经元置于含有2% B27和2 mmol/L谷氨酰胺的神经基础培养基中,在37 ℃、5%CO 2 的条件下培养10 d后开始进行实验。
1.2.2 OGD/R模型的构建及分组
将原代神经元用不含葡萄糖的杜尔伯科改良伊格尔(DMEM)培养基培养,然后将培养基置于1%O 2、5%CO 2和94%N 2的缺氧37 ℃培养箱培养2 h,诱导OGD损伤。在OGD之后,将培养基更换为新鲜的基础培养基,然后将培养基置于37 ℃、5%CO 2培养箱培养24 h构建OGD/R模型 [13] 。
将神经元分为对照组、OGD/R组、OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组、OGD/R+H.马钱苷+ML385组。对照组神经元未做任何处理,OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组分别 用10、30、50 μmol/L马钱苷预处理1 h [14] ,然后暴露于 OGD/R;OGD/R+H.马钱苷+ML385组用马钱苷 (50 μmol/L)加ML385(1 μmol/L)预处理1 h后暴露于OGD/R [12] 。
1.2.3 观察神经元线粒体形态
收集各组神经元,用2%戊二醛固定2 h,然后用1%四氧化锇固定1 h,经过乙醇脱水,包埋剂包埋后,用乙酸双氧铀和柠檬酸铅进行染色,在透射电子显微镜下观察神经元线粒体形态。
1.2.4 比色法检测细胞内铁含量
按照铁含量检测试剂盒检测神经元内铁浓度。Fe 2+ 相对含量=[Fe 2+ (实验组)-Fe 2+ (空白组)]/[Fe 2+ (对照组)-Fe 2+ (空白组)]×100%。
1.2.5 比色法检测神经元细胞的GPX4、4.HNE、SOD、MDA、GSH/GSSG、NADPH/NADP +、LDH水平
用裂解缓冲液裂解神经元细胞,采用GPX4、 4.HNE、SOD、MDA、GSH/GSSG、NADPH/NADP +、LDH试剂盒检测神经元细胞的GPX4、4.HNE、SOD、MDA、GSH/GSSG、NADPH/NADP +、LDH水平。
1.2.6 CM.H2DCFDA及C11.BODIPY581/591检测ROS水平
使用CM.H2DCFDA检测细胞内ROS水平。在各组神经元中加入10 μmol/L CM.H2DCFDA 37 ℃避光孵育30 min,在酶标仪中检测荧光强度。使用C11.BODIPY581/591测量脂质ROS水平。在各组神经元中加入2.5 μmol/L C11.BODIPY581/591并在37 ℃避光孵育30 min,用酶标仪检测荧光强度。
1.2.7 MTT检测细胞活性
药物处理结束后收集各组细胞,弃去培养基,然后加入0.5 mg/mL MTT试剂37 ℃孵育4 h,弃去MTT溶液后,加入100 μL 二甲基亚砜(DMSO)溶解甲瓒,最后上机检测吸光度。
1.2.8 蛋白免疫印迹(Western Blot)法检测凋亡相关蛋白以及通路相关蛋白表达
收集经裂解液处理的各组神经元细胞,提取各组神经元的总蛋白,电泳分离后转到聚偏二氟乙烯 (PVDF)膜上,之后用脱脂牛奶封闭,加入一抗Bcl.2 (1∶2 000)、Bax(1∶2 000)、cleaved Caspase.3(1∶2 000)、 AKT(1∶1 000)、 p.AKT(1∶1 000)、AMPK(1∶1 000)、 p.AMPK(1∶2 000)、Nrf2(1∶2 000)和GAPDH抗体(1∶1 000),在4 ℃下过夜,加入二抗,加入显色剂使目的条带显色,使用Image Lab TM 软件分析目标蛋白的灰度值。
1.3 统计学处理
采用Graphpad Prism 8.0软件进行数据分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,多组间比较采用单因素方差分析(ANOVA),两组间比较采用SNK. q 检验。 P <0.05为差异有统计学意义。
2 结 果
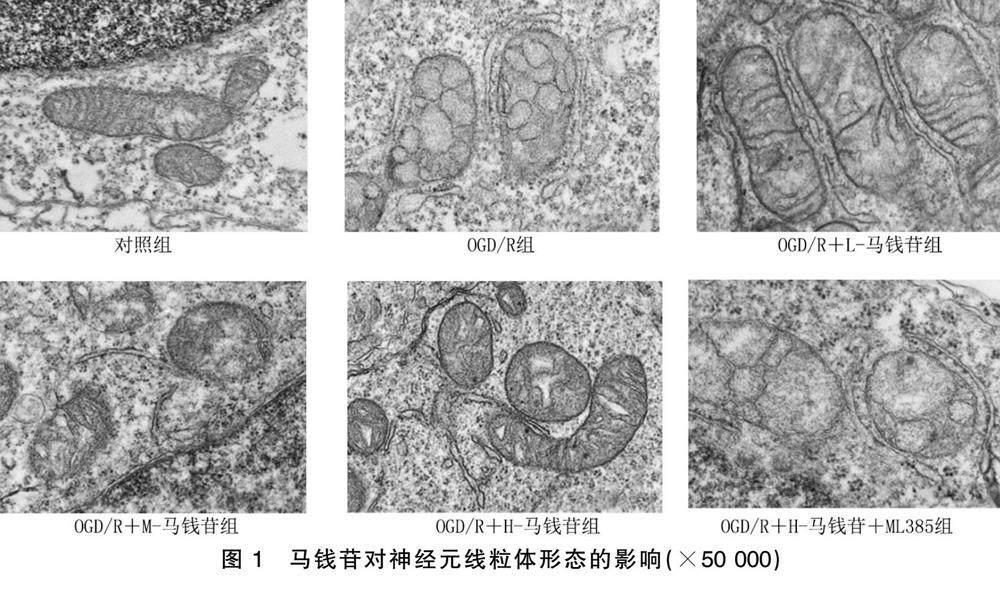
2.1 马钱苷对OGD/R诱导的神经元线粒体形态的影响
对照组线粒体形态结构正常,无异常现象;OGD/R组神经元线粒体出现碎片现象,嵴减少,线粒体膜密度有所增加;马钱苷处理后神经元线粒体中的线粒体嵴 变得较为完整,碎片化现象消失;OGD/R+H.马钱 苷+ML385组现象与OGD/R组现象相似。详见图1。
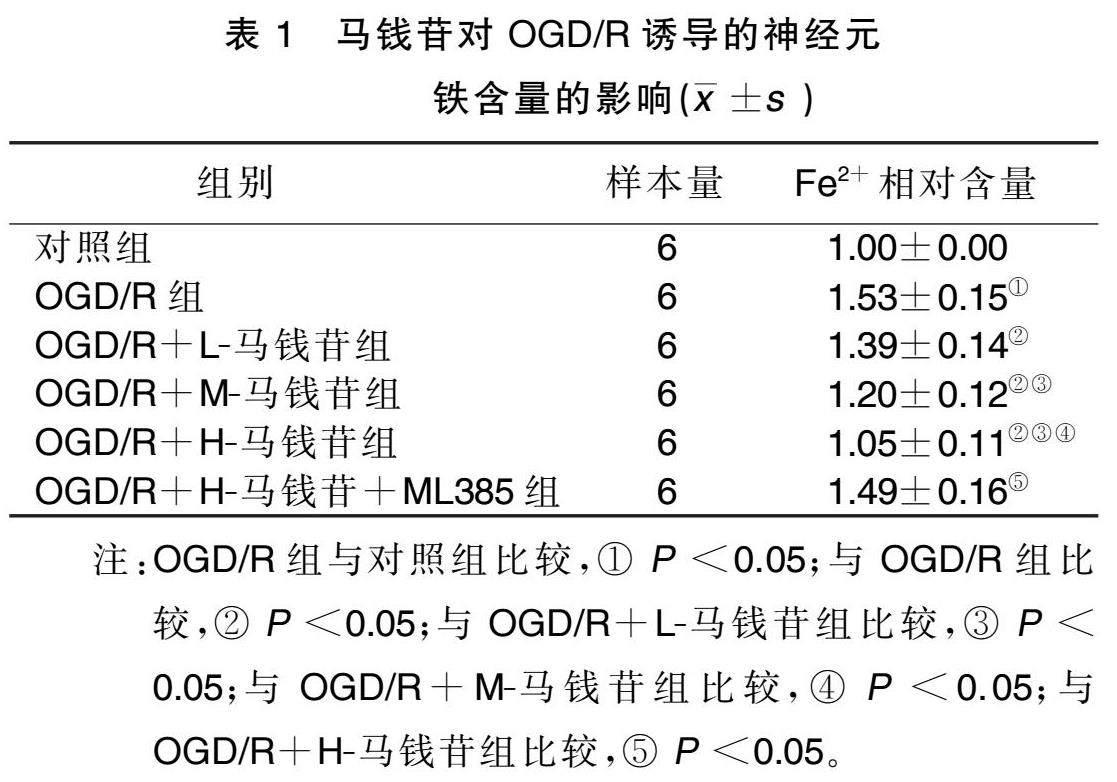
2.2 马钱苷对OGD/R诱导的神经元铁含量的影响
与对照组比较,OGD/R组Fe 2+ 相对含量提高 ( P <0.05);与OGD/R组比较,OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组Fe 2+ 相对含量下降( P <0.05),且随着马钱苷剂量的增加, Fe 2+ 相对含量变化更明显,呈现剂量相关性;与OGD/R+ H.马钱苷组比较,OGD/R+H.马钱苷+ML385组Fe 2+ 相对含量升高( P <0.05)。详见表1。
2.3 马钱苷对OGD/R诱导的神经元抗氧化指标的影响
与对照组比较,OGD/R组GSH/GSSG、NADPH/NADP +、SOD、GPX4相对活性下调( P <0.05);与OGD/R组比较,OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组GSH/GSSG、NADPH/NADP +、SOD、GPX4相对活性上调( P <0.05);与OGD/R+H.马钱苷组比较,OGD/R+H.马钱苷+ML385组GSH/GSSG、NADPH/NADP +、SOD、GPX4相对活性下调( P <0.05)。详见表2。
2.4 马钱苷对OGD/R诱导的神经元脂质过氧化的影响
OGD/R组较对照组细胞内ROS水平、脂质ROS 水平以及4.HNE、MDA水平上升( P <0.05);与OGD/R 组比较,OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组细胞内ROS水平、脂质ROS 水平以及4.HNE、MDA水平下降( P <0.05);OGD/R+ H.马钱苷+ML385组较OGD/R+H.马钱苷组细胞内ROS水平、脂质ROS水平以及4.HNE、MDA水平上升( P <0.05)。详见表3。
2.5 马钱苷对OGD/R诱导的神经元细胞活力和细胞死亡的影响
OGD/R组较对照组细胞活力以及Bcl.2水平显著降低,LDH释放量、Bax以及cleaved Caspase.3水平升高( P <0.05);与OGD/R组比较,OGD/R+L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱苷组细胞活力以及Bcl.2水平升高,LDH释放量、Bax以及 cleaved Caspase.3水平降低( P <0.05);OGD/R+ H.马钱苷+ML385组较OGD/R+H.马钱苷组细胞活力以及Bcl.2水平下降,LDH释放量、Bax以及cleaved Caspase.3水平上升( P <0.05)。详见图2、表4。
2.6 马钱苷对OGD/R诱导的神经元中AKT/AMPK/Nrf2通路蛋白表达的影响
OGD/R组较对照组p.AKT/AKT、p.AMPK/AMPK、 Nrf2下降( P <0.05);与OGD/R组比较,OGD/R+ L.马钱苷组、OGD/R+M.马钱苷组、OGD/R+H.马钱 苷组p.AKT/AKT、p.AMPK/AMPK、Nrf2升高( P <0.05); OGD/R+H.马钱苷+ML385组较OGD/R+H.马钱苷组p.AKT/AKT、p.AMPK/AMPK、Nrf2下降( P <0.05)。详见图3、表5。
3 讨 论
据统计,脑卒中每年导致全球数百万人脑损伤,尽管已知缺血会导致细胞损伤,但其潜在机制尚未明确,且目前还没有确切的治疗方法可以减少梗死面积或神经功能障碍 [15.16] 。研究发现,马钱苷可能是治疗缺血性脑卒中的潜在神经保护剂 [17.18] 。铁死亡与脑卒中的发病机制密切相关 [19] 。在本研究中,OGD/R处理后神经元线粒体出现碎片现象,嵴减少,线粒体膜密度有所增加(铁死亡的主要特征),且神经元的细胞活力降低,细胞死亡增加,表明OGD/R促进了神经元损伤。马钱苷处理后神经元线粒体中的线粒体嵴变得较为完整,碎片化现象消失,神经元的细胞活力增加,细胞死亡降低,提示马钱苷可能对OGD/R神经元损伤起到了改善作用。
铁死亡是一种细胞死亡形式,其特征在于脂质过氧化的铁依赖性积累 [20] 。4.HNE是脂质过氧化的最终产物,已被确定为参与调节细胞增殖、铁死亡和细胞凋亡的关键第二信使 [21] 。脂质ROS的积累是铁死亡的一个重要指标 [22] 。而GPX4是一种抗氧化防御酶,有研究发现,GXP4的消融会诱导铁死亡并引发前脑神经元的神经变性 [23] 。GPX4可使用GSH作为共底物减少脂质氢过氧化物,抑制铁死亡 [24] 。而NADPH可以诱导GSSG转化为GSH [25] 。NADPH和GSH的还原形式以及SOD是最重要的内源性抗氧化剂 [26] 。 因此,本研究检测以上指标观察马钱苷是否对铁死亡 产生影响。结果发现,OGD/R处理后神经元中GSH/GSSG、 NADPH/NADP +、SOD、GPX4水平均下降,Fe 2+ 含量、神经元中的细胞内和脂质ROS以及4.HNE、MDA水平增加,提示OGD/R可能降低了神经元的抗氧化能 力,诱导了铁死亡。而马钱苷处理后神经元中 GSH/GSSG、NADPH/NADP +、SOD、GPX4水平均升 高,Fe 2+ 含量、神经元中的细胞内和脂质ROS以及 4.HNE、MDA水平降低,证实马钱苷有抗氧化作用,可减轻铁死亡。
AKT和AMPK的磷酸化诱导Nrf2通路的活化,已有大量研究表明激活AKT/AMPK/Nrf2通路可以减轻炎症和氧化应激损伤 [11] ,研究发现,激活AMPK/Nrf2信号通路可能减轻IRI,发挥神经保护作用 [9] 。本研究 结果发现,OGD/R处理后神经元中p.AKT/AKT、 p.AMPK/AMPK、Nrf2水平均下降,而马钱苷使p.AKT/AKT、p.AMPK/AMPK、Nrf2升高,提示马钱苷可能通过激活AKT/AMPK/Nrf2信号通路改善OGD/R诱导的神经元铁死亡。为了进一步验证马钱苷的作用机制,本研究在使用马钱苷处理的基础上,加入AKT/AMPK/Nrf2通路抑制剂ML385,结果发现,ML385可减弱马钱苷对OGD/R诱导的神经元铁死亡的抑制作用,表明 马钱苷可能通过激活AKT/AMPK/Nrf2通路改善OGD/R 诱导的神经元铁死亡。
综上所述,马钱苷可能通过激活AKT/AMPK/Nrf2通路改善OGD/R诱导的神经元铁死亡。然而,马钱苷是否可以通过调节其他通路改善OGD/R诱导的铁死亡,需要进一步深入探究。
参考文献:
[1] YE M, WU H,LI S G.Resveratrol alleviates oxygen/glucose deprivation/reoxygenation.induced neuronal damage through induction of mitophagy[J].Molecular Medicine Reports,2021,23(1):73.
[2] SHE R N, LIU D H,LIAO J, et al. Mitochondrial dysfunctions induce Panoptosis and ferroptosis in cerebral ischemia/reperfusion injury:from pathology to therapeutic potential[J].Frontiers in Cellular Neuroscience,2023,17:1191629.
[3] WEILAND A ,WANG Y M,WU W H, et al. Ferroptosis and its role in diverse brain diseases[J].Molecular Neurobiology,2019,56(7):4880.4893.
[4] XU Y D, CUI C,SUN M F, et al. Neuroprotective effects of loganin on MPTP.induced Parkinson′s disease mice:neurochemistry,glial reaction and autophagy studies[J].Journal of Cellular Biochemistry,2017,118(10):3495.3510.
[5] ZHANG F, YAN Y,ZHANG J, et al. Phytochemistry,synthesis, analytical methods,pharmacological activity,and pharmacokinetics of loganin:a comprehensive review[J].Phytotherapy Research,2022,36(6):2272.2299.
[6] WANG J W, PAN Y B,CAO Y Q, et al. Loganin alleviates LPS.activated intestinal epithelial inflammation by regulating TLR4/NF.κB and JAK/STAT3 signaling pathways[J].The Kaohsiung Journal of Medical Sciences,2020,36(4):257.264.
[7] HUO K, XU J,MA K G, et al. Loganin attenuates neuroinflammation after ischemic stroke and fracture by regulating α7nAChR.mediated microglial polarization[J].Environmental Toxicology,2023,38(4):926.940.
[8] ZHOU F, WANG M D,JU J, et al. Schizandrin A protects against cerebral ischemia.reperfusion injury by suppressing inflammation and oxidative stress and regulating the AMPK/Nrf2 pathway regulation[J].American Journal of Translational Research,2019,11(1):199.209.
[9] WEI L J, ZHOU Q Q,TIAN H, et al. Integrin β3 promotes cardiomyocyte proliferation and attenuates hypoxia.induced apoptosis via regulating the PTEN/Akt/mTOR and ERK1/2 pathways[J].International Journal of Biological Sciences,2020,16(4):644.654.
[10] LI Y, WANG X M.Chrysin attenuates high glucose.induced BMSC dysfunction via the activation of the PI3K/AKT/Nrf2 signaling pathway[J].Drug Design,Development and Therapy,2022,16: 165.182.
[11] PARK S Y ,CHO M H,LI M, et al. Petatewalide B alleviates oxygen.glucose deprivation/reoxygenation.induced neuronal injury via activation of the AMPK/Nrf2 signaling pathway[J].Molecular Medicine Reports,2020,22(1):239.246.
[12] YUAN Y, ZHAI Y Y,CHEN J J, et al. Kaempferol ameliorates oxygen.glucose deprivation/reoxygenation.induced neuronal ferroptosis by activating Nrf2/SLC7A11/GPX4 axis[J].Biomolecules,2021,11(7):923.
[13] ZHI S M, FANG G X,XIE X M, et al. Melatonin reduces OGD/R.induced neuron injury by regulating redox/inflammation/apoptosis signaling[J].European Review for Medical and Pharmacological Sciences,2020,24(3):1524.1536.
[14] CHENG Y C, CHU L W,CHEN J Y, et al. Loganin attenuates high glucose.induced schwann cells pyroptosis by inhibiting ROS generation and NLRP3 inflammasome activation[J].Cells,2020,9(9):1948.
[15] KHOSHNAM S E ,WINLOW W,FARZANEH M, et al. Pathogenic mechanisms following ischemic stroke[J].Neurological Sciences,2017,38(7):1167.1186.
[16] KURIAKOSE D, XIAO Z C.Pathophysiology and treatment of stroke:present status and future perspectives[J].International Journal of Molecular Sciences,2020,21(20):7609.
[17] 徐小雯, 李哲明,应夏丽.马钱苷在脑缺血再灌注损伤中的作用及机制[J].浙江医学,2022,44(23):2490.2498.
[18] 王璐, 付蓉,巫玉娟.马钱苷对大鼠局灶性脑缺血再灌注损伤神经保护作用及Wnt/β.catenin通路的影响[J].中国老年学杂志,2022,42(18):4531.4535.
[19] XU S L, LI X W,WANG Y Q.Regulation of the p53.mediated ferroptosis signaling pathway in cerebral ischemia stroke (review)[J].Experimental and Therapeutic Medicine,2023,25(3):113.
[20] LI D S, LI Y S.The interaction between ferroptosis and lipid metabolism in cancer[J].Signal Transduction and Targeted Therapy,2020,5:108.
[21] WANG F X, LI H Y,LI Y Q, et al. Can medicinal plants and bioactive compounds combat lipid peroxidation product 4.HNE.induced deleterious effects?[J].Biomolecules,2020,10(1):146.
[22] XIE Z X ,HOU H D,LUO D, et al. ROS.dependent lipid peroxidation and reliant antioxidant ferroptosis.suppressor.protein 1 in rheumatoid arthritis:a covert clue for potential therapy[J].Inflammation,2021,44(1):35.47.
[23] HAMBRIGHT W S ,FONSECA R S,CHEN L J, et al. Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration[J].Redox Biology,2017,12:8.17.
[24] ZHANG Y L, SWANDA R V,NIE L T, et al. mTORC1 couples cyst(e)ine availability with GPX4 protein synthesis and ferroptosis regulation[J].Nature Communications,2021,12:1589.
[25] MORENO. SNCHEZ R,MARN.HERNNDEZ ,GALLARDO.PREZ J C, et al. Control of the NADPH supply and GSH recycling for oxidative stress management in hepatoma and liver mitochondria[J].Biochimica et Biophysica Acta Bioenergetics,2018,1859(10):1138.1150.
[26] SOURI Z, KARIMI N,AHMAD P.The effect of NADPH oxidase inhibitor diphenyleneiodonium (DPI) and glutathione (GSH) on Isatis cappadocica,under Arsenic (As) toxicity[J].International Journal of Phytoremediation,2021,23(9):945.957.
(收稿日期:2022.10.10)
(本文编辑 邹丽)
